Резюме
Запаморочення, що трапляються достатньо часто в населення, відносять до присінкових розладів. Окрім запаморочення, в МКХ-10 виділяють головокружіння, порушення сприйняття простору: акро-, агора-, клаустро- та ряд неспецифічних фобій, а також пов’язані симптоми: нудоту, заніміння, болі голови, вушні шуми. Серед найчастіших проблем здоров’я називають артеріальну гіпертензію (у 31,5 % дорослого населення України). Тому завданням цієї роботи була ідентифікація взаємодії запаморочень з артеріальною гіпертензією.
Обстежені 123 хворі зі скаргами на запаморочення. Артеріальний тиск у контрольній групі (72 особи, 56,91 %) був 118,38 ± 12,14/76,19 ± 8,53 мм рт.ст., у групі з АГ (51 особа, 43,09 %) АТ становив 148,98 ± 19,76/94,44 ± 7,83 мм рт.ст. (вірогідність різниці систолічного тиску за Ф-тестом р = 0,00039, за Т-тестом р = 2,56Е-15 та діастолічного тиску за Ф-тестом р = 0,53, за Т-тестом р = 1,05Е-21, коефіцієнти зміни відповідно 25,85 та 23,95 %). Різниця між групами в кількості хворих: із запамороченнями — 46,05 та 76,92 %, псевдоголовокружінням — 22,37 та 34,62 %, кінетозом — 26,32 та 34,62 %, ніктофобією — 19,74 та 28,95 % та оптокінезом — 18,42 та 25,00 %. При виконанні проби Ромберга з заплющеними очима збільшилася площа хитання у групі з АГ — з 0,08 ± 0,05 до 0,34 ± 1,00 м2; Кв = 325,00 %, вірогідність різниці за Ф-тестом р = 1,89Е-24, за Т-тестом р = 0,18, що вказує на важливість вивчення площі хитання при заплющених очах у хворих на АГ. Дуже великі коефіцієнти відмінності багатьох присінкових проб (більше ніж у 100 разів для АТ) можливі за умови первинного ураження вестибулярних ядер. А чутливість саме якісного Ф-тесту при порівнянні груп вказує на появу нової якості захворювання АГ, викликаної присінковим порушенням. Обговорене питання, що присінкове порушення може призводити до підвищень артеріального тиску та формування патологічного стану АГ.
Головокружения, которые встречаются достаточно часто у населения, относят к расстройствам преддверия уха. Кроме неясного головокружения в МКБ-10 выделяют иллюзии движения, нарушения восприятия пространства: акро-, агора-, клаустро- и ряд неспецифических фобий, а также сопутствующие симптомы: тошноту, онемение, головные боли, ушные шумы. Среди самых частых проблем здоровья называют артериальную гипертензию (31,5 % взрослого населения Украины). Поэтому задачей данной работы была идентификация взаимодействия головокружений с артериальной гипертензией.
Обследовано 123 больных с жалобами на головокружения. Артериальное давление в контрольной группе (72 человека; 56,91 %) было 118,38 ± 12,14/76,19 ± 8,53 мм рт.ст., в группе с АГ (51 человек; 43,09 %) оно составило 148,98 ± 19,76/94,44 ± 7,83 мм рт.ст. (достоверность различия систолического давления составила по Ф-тесту р = 0,00039, по Т-тесту
р = 2,56Е-15 и диастолического давления по Ф-тесту р = 0,53 и Т-тесту р = 1,05Е-21; коэффициенты изменения 25,85 и 23,95 % соответственно). Различия между группами в количестве больных: с неясными головокружениями — 46,05 и 76,92 %, псевдоголовокружениями — 22,37 и 34,62 %, кинетозами — 26,32 и 34,62 %, никтофобиями — 19,74 и 28,95 % и оптокинезами — 18,42 и 25,00 %. При выполнении пробы Ромберга с закрытыми глазами увеличивалась площадь расшатывания в группе больных АГ с 0,08 ± 0,05 до 0,34 ± 1,00 м2; Кв = 325,00 %; достоверность различия по Ф-тесту р = 1,89Е-24, по Т-тесту р = 0,18, что указывает на важность изучения площади раскачиваний у больных АГ. Очень большие коэффициенты отличия многих вестибулярных проб (больше чем в 100 раз для артериального давления) возможны при условии первичного поражения вестибулярных ядер. А чувствительность именно качественного Ф-теста при сравнении групп указывает на появление нового качества — заболевания АГ, вызванного вестибулярным нарушением. Обсужден вопрос о том, что вестибулярное нарушение может приводить к повышениям артериального давления и формированию патологического состояния АГ.
Dizziness occurs frequently of population. It are related to vestibular dysfunctions. Besides dizziness in ICD-10 there are vertigo, space orientation disturbances: acro, agora, claustro and some other unspecific phobias, as well as related symptoms: nausea, numbness, headache, tinnitus. Among most frequent health problems they name arterial hypertension in 31.5 % of adult population in Ukraine. That is why the identification of dizziness and arterial hypertension correlations is the main problem of this presentation.
One hundred and twenty three patients complaining of dizziness have been examined. Blood pressure in control group (n = 72; 56.91 %) was 118.38 ± 12.14/76.19 ± 8.53 mm Hg and in a hypertensive one (n = 51; 43.09 %) was 148.98 ± 19.76/94.44 ± 7.83 mm Hg (diffe-rence significance for systolic pressure according to F-test р = 0.00039, Т-test р = 2.56Е-15 and diastolic pressure F-test р = 0.53, and Т-test р = 1.05Е-21, coefficients of difference were 25.85 and 23.95 %, respectively). Difference between groups in amount of patients was: dizziness 46.05 and 76.92 %, giddiness 22.37 and 34.62 %, kinetosis 26.32 and 34.62 %, nyctophobia 19.74 and 28.95 % and optokinesis 18.42 and 25.00 %. Romberg test performance with closed eyes demonstrated increased the sway square in the hypertensive group from 0.08 ± 0.05 to 0.34 ± 1,00 m2; Кd = 325,00 % with difference significance according to F-test р = 1,89Е-24, and Т-test р = 0,18; thus indicating the importance of sway square studies in the hypertensive patients. Great levels of coefficients of difference for vestibular dysfunctions parameters (more than 100 times in comparison to hypertension data) are possible if primary lesion is localized in vestibular nuclei. The sensitivity of qualitative F-test indicates the appearance of a new qua-lity — hypertension initiated by vestibular dysfunction. The possibility of vestibular trigger of blood pressure increasing and development of hypertension as a pathological condition is being discussed.
Статтю опубліковано на с. 13-19
Вступ
Артеріальна гіпертензія (АГ) в Україні уражає 31,5 % дорослого населення [2]. Серед її причин називають стреси, але патогенетичні механізми формування АГ під дією стресу не з’ясовані [29]. В Україні внаслідок складної екологічної обстановки частими проблемами називають запаморочення (39 %), які пов’язують з АГ [8]. Запаморочення виявляється третьою за частотою причиною звернень до лікаря в США [17]. За даними Кокранівських звітів, у Німеччині від нього страждає 22,9 % від загальної кількості населення, причому в цих осіб якість життя знижена. Лікарі надавали допомогу всього 1,8 % хворих [26], ігноруючи 20 % населення земної кулі, що страждає від даної патології. У –МКХ-10 розрізняють дві одиниці: запаморочення (Dizziness R 42) — це порушення сприйняття простору та руху та головокружіння (Vertigo H81) — це ілюзія неіснуючого руху, частіше обертального, рідше коливального чи лінійного [22]. Дискутують про питання щодо затьмарення, заніміння, конфузії [12], а також головних болів [16] та вушних шумів [28]. Висловлена думка, що акрофобія та ортостатичні порушення також виявляються ознаками присінкової дисфункції [15]. Механізми формування названих симптомів виглядають фрагментарними, а можливості індивідуальної розробки лікування не мають доказової основи. Ідеї про судинну етіологію запаморочень виглядають сумнівними, оскільки показано, що судинні препарати неефективні при вестибулярних розладах [11], а стенози та оклюзії вертебробазилярного басейну не корелюють із запамороченням [9]. Наведена дискусія показує актуальність проблеми, з одного боку, та брак об’єктивних підходів — з іншого. Тому завданням цієї роботи була ідентифікація взаємодії запаморочень з артеріальною гіпертензією.
Об’єкт дослідження
Обстежені 123 хворі зі скаргами на запаморочення: середній вік 52,34 ± 14,82 року; чоловічої статі — 42, жіночої — 81 особа; середній зріст — 168,25 ± 8,46 см; вага — 76,24 ± 16,09 кг, зміни ваги за останній час — 0,197 ± 6,550 кг. Стрес був основною причиною в 35,77 % осіб, видимих причин не спостерігали в 17,89 %, в інших хворих були різноманітні причини, частота яких не досягала 10 %. У 51 особи (43,09 %, основна група) артеріальний тиск (АТ) був підвищений. Хворі з нормальним АТ становили контрольну групу (72 особи, 56,91 %).
Методи дослідження
Методи розглядали з точки зору концепції присінка, одним із положень якої є чотири проекції цього аналізатора: вестибулосенсорна, моторна, вегетативна та лімбічна [5]. Виходячи з цього, вестибулокіркову проекцію досліджували за даними анамнезу та питальника «Типи запаморочень» [3]. Методи обстеження вестибуломоторної проекції поділяють на дві групи: дослідження вестибулоспінальних та вестибулоокуломоторних реакцій. Перші ґрунтуються на результатах проби Ромберга, крокового тесту Унтербергера — Фукуди та Уемури. Серед першої групи методів найбільш популярною стала постурографія, яка полягає в реєстрації руху центру гравітації в позі Ромберга [27] за допомогою тензодатчиків. Обстежуваному пропонують постояти на спеціальній платформі, а три тензодатчики показують перерозподіл ваги між ними [25]. Проводять 6 тестових процедур по 20 с кожна: 1) стояння з розплющеними очима на нерухомій платформі; 2) стояння з заплющеними очима на нерухомій платформі; 3) стояння з розплющеними очима на нерухомій платформі, хворому пред’являють рухливу картинку. Далі платформу опускають і підвішують на пружинах, повторюють названі тести. Аналіз співвідношень площ та швидкостей хитання дозволяє оцінити соматосенсорну, зорову та вестибулярну функції та їх внесок у підтримання рівноваги. Відсоток збільшення площі відповідає зниженню функції ураженої системи. Збільшення площі хитання при заплющенні очей вказує на порушення присінкової функції, при розплющених очах — зорової, при підвішуванні платформи — соматосенсорної, а при демонстрації рухливої картинки — залежність від зору [17]. Постурографія не враховує стратегії рухів тіла пацієнтів: нахили в поперековій ділянці, згинання колін та рухи кінцівок, при спробах зберегти рівновагу. Оцінюють єдиний показник, обсяг інформації виявляється обмеженим, що знижує її діагностичне значення. Чутливість методу становила від 35 до 54 % при специфічності, що доходила до 90 % [18]. Водночас метод краніокорпографії дає можливість отримати більше інформації за допомогою дешевих технічних засобів. Він полягає в тому, що на голову та плечі хворого фіксують маркери та проводять проби Ромберга та Унтербергера [13]. Проба Унтербергера означає марширування з заплющеними очима на місці та вимірювання амплітуд хитання голови та плечей, зміщень лінійного, кутового та ротації [32]. Чутливість методу становить 82,89 %, а специфічність — 99,78 % (n = 912) [6]. Уемура запропонував пробу стояння на одній нозі із заплющеними очима як експрес-тест [31]. Чутливість її виявилась 91,67 % при специфічності 98,90 % (n = 912). Недоліком проби Уемури є те, що при захворюваннях нижніх кінцівок вона стає недостатньо інформативною. Для виправлення ситуації використали батарею тестів еспрес-діагностики стану координації рухів [7].
Застосовували стандартний пакет електронних таблиць Excel: описову, порівняльну, варіаційну статистику.
Результати дослідження
Артеріальний тиск хворих, у яких АТ на момент обстеження був нижчим за 140/90 мм рт.ст., становив 118,38 ± 12,14/76,19 ± 8,53 мм рт.ст., у групі з підвищеним тиском — 148,98 ± 19,76/94,44 ± 7,83 мм рт.ст. (вірогідність різниці систолічного тиску за Ф-тестом р = 0,00039, за Т-тестом р = 2,56Е-15 та діастолічного тиску за Ф-тестом р = 0,53, за Т-тестом р = 1,05Е-21, коефіцієнти зміни становили 25,85 та 23,95 % відповідно).
Типи запаморочень та поєднані симптоми (вестибулосенсорні розлади). Частота скарг понад 10 %: запаморочення, об’єктивне головокружіння, суб’єктивне головокружіння, псевдоголовокружіння, порушення координації, ортостатика, кінетози, акрофобія, агорафобія, ніктофобія, клаустрофобія, асцендофобія, десцендофобія, оптокінез, нудота, блювота, болі голови, затьмарення, шуми вушні, заніміння.
Профіль скарг у загальній групі: запаморочення — 58,92 %, об’єктивне головокружіння — 23,26 %, суб’єктивне головокружіння — 17,05 %, псевдоголовокружіння — 27,13 %, порушення координації — 57,36 %, ортостатика — 54,26 %, кінетози — 30,23 %, акрофобія — 50,39 %, агорафобія — 51,94 %, ніктофобія — 27,91 %, клаустрофобія — 21,71 %, асцендофобія — 14,73 %, десцендофобія — 20,16 %, оптокінез — 20,93 %, нудота — 41,86 %, блювота — 12,40 %, болі голови — 34,11 %, затьмарення — 42,64 %, вушні шуми — 59,69 %, заніміння — 66,67 %.
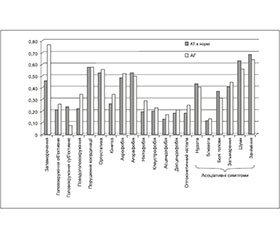
Профіль скарг на запаморочення різнився між групами (рис. 1).
Найбільша різниця між групами в кількості хворих із запамороченнями: 46,05 та 76,92 %, менша — при псевдоголовокружінні (22,37 та 34,62 %), кінетозі (26,32 та 34,62 %), ніктофобії (19,74 та 28,95 %) та оптокінезі (18,42 та 25,00 %). З іншого боку, суб’єктивне головокружіння (23,68 та 7,69 %), болі голови (36,84 та 30,77 %), вушні шуми (63,16 та 55,77 %) та заніміння (68,42 та 63,46 %) частіше зустрічаються у хворих із нормальним тиском.
Патогенез розвитку АГ
Координацію рухів вивчали за допомогою 20-бальної шкали. Загальний бал становив 8,87 ± 1,96 бала, скарги — 2,14 ± 0,94; проба Уемури — 2,37 ± 0,81; письмова проба Фукуди — 1,89 ± 0,79; крокова проба Фукуди — 1,64 ± 0,81; стеження — 0,90 ± 0,73 бала; вказівне — 0,48 ± 0,64.
Для хворих із нормальним АТ (n = 36) отримали такі дані: скарги — 2,09 ± 1,01, проби Уемури — 2,16 ± 0,78, Фукуди крокова — 1,65 ± 0,65, Фукуди письмова — 1,24 ± 0,80, вказівна — 0,49 ± 0,69, стеження — 0,95 ± 0,72, загалом — 8,56 ± 2,10 бала. Для хворих з АГ отримали такі результати: скарги — 2,21 ± 0,86 (вірогідність різниці за Ф-тестом р = 0,34, за Т-тестом р = 0,58), проби Уемури — 2,61 ± 0,79 (вірогідність різниці за Ф-тестом р = 0,91, за Т-тестом р = 0,01), Фукуди крокова — 1,76 ± 0,59 (вірогідність різниці за Ф-тестом р = 0,55, за Т-тестом р = 0,42), Фукуди письмова — 1,25 ± 0,80 (вірогідність різниці за Ф-тестом р = 0,95, за Т-тестом р = 0,97), вказівна — 0,63 ± 0,61 (вірогідність різниці за Ф-тестом р = 0,47, за Т-тестом р = 0,38), стеження — 0,85 ± 0,76 (вірогідність різниці за Ф-тестом р = 0,80, за Т-тестом р = 0,57), загалом — 9,22 ± 1,75 бала (вірогідність різниці за Ф-тестом р = 0,31, за Т-тестом р = 0,16). Отриманий результат показує значимість проби Уемури та її кількісний характер, тобто її виконання не залежить від якісної різниці в групах, а саме від наявності АГ, що може свідчити про первинний характер присінкового розладу та вторинний АГ.
Оскільки попередній результат виявив порушення вестибулоспінальних реакцій, їх деталізацію проведено методом постурографії. Вивчали відсоток виконання кожного тесту щодо ідеальної вікової норми, площу хитання та пікову швидкість хитання. У зв’язку з тим що коефіцієнти відмінності АТ становили приблизно 25 %, звертали увагу на параметри, коефіцієнти відмінності яких перевищували 25 %. Група хворих із нормальним АТ включала 25 осіб, а з АГ — 30. Нормативні дані для здорових взяті з літературних джерел.
Відсоток виконання проби Ромберга на стабільній платформі з розплющеними очима становив для осіб із нормальним АТ 97,92 ± 1,02 %, а для хворих з АГ — 97,67 ± 1,12 %; коефіцієнт відмінності (Кв) = 0,26 %; вірогідність різниці за Ф-тестом р = 0,63, за Т-тестом р = 0,40, що вказує на відсутність різниці за цим параметром. Площі хитання становили в групі з нормальним АТ 0,06 ± 0,02 м2, з АГ — 0,07 ± 0,05 м2; Кв = 16,67 %; вірогідність різниці за Ф-тестом р = 0,001, за Т-тестом р = 0,46, що вказує на наявність якісної різниці в групах та важливість вивчення площі хитання у подальшому у хворих на АГ. Пікові швидкості хитання в осіб із нормальним АТ були 0,04 ± 0,05 м/с, а у хворих з АГ 0,06 ± ± 0,07 м/с, Кв = 50,00 %; вірогідність різниці за Ф-тестом р = 0,56, за Т-тестом р = 0,31, що вказує на наявність відмінності та велику вихідну дисперсію, що зробило дані невірогідними.
Заплющення очей призвело до незначного за абсолютними числами зниження відсотка якості виконання тесту Ромберга з 96,96 ± 1,20 % у хворих із нормальним АТ до 95,23 ± 4,15 % у хворих з АГ, Кв = 1,78 %, вірогідність різниці за Ф-тестом р = 5,68Е-08, за Т-тестом р = 0,037, що вказує на наявність якісної та кількісної різниці в групах. Цей результат також указує на незалежність параметрів варіаційної та порівняльної статистики. Збільшення площі у групі з АГ було найбільшим — з 0,08 ± 0,05 м2 до 0,34 ± 1,00 м2, Кв = 325,00 %, вірогідність різниці за Ф-тестом р = 1,89Е-24, за Т-тестом р = 0,18, що вказує на наявність вираженої якісної, пов’язаної з АГ різниці в групах та важливість вивчення площі хитання при заплющених очах у хворих на АГ. Значно більший коефіцієнт відмінності для площі хитання, ніж АТ, вказує на те, що вестибулярна дисфункція є провідним параметром, який призвів до зміни якості. Тобто порушення стану присінка викликає зміну якості — АГ. Пікова швидкість хитання також суттєво збільшилась при заплющенні очей — від 0,08 ± 0,04 м/с до 0,12 ± 0,11 м/с, Кв = 50,0 %, вірогідність різниці за Ф-тестом р = 4,47Е-06, за Т-тестом р = 0,12, що вказує на наявність якісної та відсутність кількісної різниці між групами.
Перешкода зору у вигляді картинки, що обертається, дозволила виявити незначне за абсолютними числами погіршення виконання проби Ромберга у хворих з АГ: 96,50 ± 1,18 % та 95,30 ± 3,37 % відповідно, Кв = 1,00 %; вірогідність різниці за Ф-тестом р = 2,38Е-06, за Т-тестом р = 0,078, що вказує на наявність якісної, пов’язаної з АГ різниці в групах та важливість вивчення оптокінетичних явищ у хворих на АГ. Площа хитання при цьому збільшилась з 0,10 ± 0,05 м2 до 0,19 ± 0,42 м2, Кв = 90 %, вірогідність різниці за Ф-тестом р = –2,10Е-15, за Т-тестом р = 0,23, що вказує на наявність якісної різниці в групах та важливість вивчення площі хитання у подальшому у хворих на АГ. Пікова швидкість хитання збільшилась на 10 %: 0,10 ± 0,04 м/с та 0,11 ± 0,08 м/с відповідно, Кв = 10,00 %; вірогідність різниці за Ф-тестом р = 0,00046, за Т-тестом р = 0,37, що вказує на наявність якісної різниці в групах та важливість вивчення оптокінезу у хворих на АГ. Кореляційний аналіз показав, що саме оптокінез корелює з АГ.
Надалі ті ж самі тести повторені за умови підвішеної на пружинах платформи. При розплющених очах виконання проби Ромберга гірше у хворих на АГ: 95,71 ± 1,78 % та 94,45 ± 1,73 %, Кв = 1,32 %; вірогідність різниці за Ф-тестом р = 0,00052, за Т-тестом р = 0,11, що вказує на наявність якісної різниці в групах. Площа хитання у хворих на АГ виявилась значно більшою: 0,18 ± 0,17 м2 та 0,38 ± 0,66 м2, Кв = 111,11 %; вірогідність різниці за Ф-тестом р = 8,18Е-09, за Т-тестом р = 0,11, що вказує на наявність якісної різниці в групах. АГ залежить від площі хитання. Пікова швидкість хитання також виявилась значно більшою у хворих на АГ: 0,11 ± 0,05 м/с та 0,14 ± 0,09 м/с, Кв = 27,27 %; вірогідність різниці за Ф-тестом р = 0,0039, за Т-тестом р = 0,09, що вказує на вірогідну різницю в групах.
При заплющенні очей не виявлено зниження якості виконання проби Ромберга у хворих на АГ: 90,13 ± 7,31 % та 85,61 ± 10,23 %, Кв = 5,01 %, вірогідність різниці за Ф-тестом р = 0,10, за Т-тестом р = 0,06, що вказує на відсутність різниці між групами. Дослідження площ хитання в групах виявило значне її збільшення у хворих на АГ: 1,32 ± 1,89 м2 та 2,96 ± 3,63 м2, Кв = 124,24 %; вірогідність різниці за Ф-тестом р = 4,03Е-05, за Т-тестом р = 0,08, що вказує на наявність якісної різниці в групах. Пікова швидкість хитання виявилась меншою у хворих на АГ: 1,24 ± 0,17 м/с та 0,36 ± 0,26 м/с, Кв = 70,97 %; вірогідність різниці за Ф-тестом р = 0,035, за Т-тестом р = 0,043, що вказує на вірогідну різницю в групах.
При застосуванні перешкоди зору не виявлено зниження якості виконання проби Ромберга у хворих на АГ: 93,00 ± 5,58 % та 90,61 ± 2,36 %, Кв = 2,57 %; вірогідність різниці за Ф-тестом р = 0,21, за Т-тестом р = 0,09, що вказує на відсутність різниці між групами. Дослідження площ хитання в групах виявило незначне її збільшення у хворих на АГ: 0,73 ± 1,63 м2 та 0,81 ± 0,66 м2, Кв = 10,96 %; вірогідність різниці за Ф-тестом –р = 1,02Е-05, за Т-тестом р = 0,82, що вказує на наявність якісної різниці в групах. Пікова швидкість хитання виявилась більшою у хворих на АГ: 0,17 ± 0,14 м/с та 0,22 ± 0,11 м/с, Кв = 29,41 %; вірогідність різниці за Ф-тестом р = 0,11, за Т-тестом р = 0,12, що вказує на невірогідну різницю в групах.
Аналіз результатів показав відсутність різниць соматосенсорної функції та залежності від зору. З іншого боку, виявлена вірогідна різниця між групами щодо зниження зорової функції у хворих на АГ: 99,79 ± 1,02 % та 95,55 ± 9,44 %, Кв = 4,25 %; вірогідність різниці за Ф-тестом р = 2,98Е-17, за Т-тестом р = 0,019. Важливою знахідкою було зниження вестибулярної функції у хворих на АГ: 88,92 ± 24,91 % та 68,29 ± 33,01 %, Кв = = 23,20 % (за абсолютною величиною дорівнює такому для АТ); вірогідність різниці за Ф-тестом р = 0,17, за Т-тестом р = 0,01. Причому це зниження вестибулярної функції було єдиним параметром, що вийшов за межі нормативних значень.
Узагальнюючи отримані дані, можна відзначити таке. Вестибулярна функція у хворих обох груп порушена. Параметри, які описують стан вестибулоспінальних провідних шляхів, указують, що у хворих з АГ присінкова патологія більше виражена, ніж у хворих зі скаргами на запаморочення без АГ. Найбільшими виявились збільшення площ хитання, зокрема на стабільній платформі із заплющеними очима. Пікові швидкості хитання мали менші за площу хитання коефіцієнти змін у відповідних тестах, за винятком проби Ромберга, яку виконували на нестабільній платформі з перешкодою зору. Показники варіаційної та порівняльної статистики, зокрема коефіцієнти змін, параметри якісного Ф-тесту та кількісного Т-тесту, виявились невзаємозалежними, тому для опису АГ потрібно використовувати всі три параметри, найбільш чутливий Ф-тест.
Вестибулоспінальні реакції, які ми вивчали, забезпечують латеральний (неперехрещений) та медіальні (іпсі- та контралатеральний, частково перехрещений) низхідні вестибулоспінальні провідні шляхи. Вони починаються від нейронів латерального, медіального та низхідного вестибулярних ядер ромбоподібної ямки. Ці нейрони мають значні олігосинаптичні входи зорові, слухові та соматосенсорні, що вказує на інтегративну функцію присінка та його ключову роль у формуванні сприйняття простору та взаємодії з ним. У цій взаємодії важливу роль відіграє перерозподіл крові між головою та кінцівками, особливо значимий у біпедальних створінь. В отриманих результатах вражають дуже великі коефіцієнти відмінності площі хитання при заплющених очах на стабільній платформі, величина яких перевищує такі для АТ більше ніж у 100 разів (Кв = 25,85 % для систолічного тиску та Кв = 325,00 % для діастолічного). Такі дані можливі лише за умови первинного ураження вестибулярних ядер. З іншого боку, чутливість саме якісного Ф-тесту при порівнянні даних описаних нами груп вказує на те, що поява нової якості захворювання АГ викликана присінковим порушенням.
Обговорення результатів
Отримані результати підтверджують гіпотезу про первинну роль порушення присінкового стану в патогенезі АГ. Вони також указують на бульбарну топографію взаємодії вестибулярних та судинних центрів. Анатомічно це можуть бути зв’язки низхідного вестибулярного ядра з первинними судинорухаючими центрами.
Наші дані збігаються з результатами, отриманими при інших вестибулярних ураженнях: вібраційній хворобі [1], травмі голови [14]. Електрофізіологічні дослідження показали значний вплив вестибулярної стимуляції на імпульсацію симпатичних ядер стовбура мозку [10]. Виявлено, що присінкові ядра ромбоподібної ямки утворюють на стику латерального, медіального та низхідного ядер асоціативний центр, що координує локомоцію та вегетативні функції вже у рептилій [19]. Присінку відводять роль сервосистеми, що узгоджує взаємодію органів чуття та детермінує функцію внутрішніх органів, зокрема серцеві скорочення та судинні реакції [24].
Присінкові ядра стовбура та середнього мозку отримують олігосинаптичні входи від органів зору, слуху, пропріорецепції [21], з приводу чого було висловлене припущення, що вже в ядрах ромбоподібної ямки відбувається формування сприйняття простору та взаємодії з ним [30]. У клінічних дослідженнях на 530 хворих показано, що вестибулярні розлади виникали на 3–5 років раніше за ймовірні підвищення тиску [4]. При присінковому навантаженні відзначали зміни частоти серцевих скорочень, складу ферментів крові та артеріального тиску [20, 23]. Цей механізм виглядає детермінованим, подібно до інших життєво важливих рефлексів [24]. Його біологічний сенс полягає в постійному перерозподілі крові в організмі залежно від положення тіла в довкіллі. Препарати, призначені для корекції присінка, стабілізують АТ у хворих на артеріальну гіпертензію [8]. Буде логічним припустити, що стреси у формі надлишкової інформації, діючи на органи чуття через присінкові ядра, призводять до перезбудження симпатичних центрів стовбура мозку і таким чином сприяють підвищенню артеріального тиску. Для забезпечення доказового рівня потрібне подальше вивчення питання про зв’язок присінкових уражень з артеріальною гіпертензією.
Висновки
1. Присінкові порушення можуть бути причиною розвитку АГ.
2. У профілі захворювання в пацієнтів з АГ домінують скарги на запаморочення, псевдоголовокружіння, кінетози, оптокінези, ніктофобії.
3. Присінкове порушення може призводити до підвищень артеріального тиску та формування патологічного стану АГ.
Список литературы
1. Ніколенко В.Ю. Хвороби нервової системи в гірників і імунопатологія. — Донецьк: Донеччина, 1999. — 266 с.
2. Сиренко Ю.Н. Гипертоническая болезнь и артериальная гипертензия. — Донецк: Издатель Заславский А.Ю., 2011. — 352 с.
3. Трінус К.Ф. Типи запаморочень, доказовий підхід // Укр. мед. альманах. — 2010. — Т. 13, № 4 (додаток). — С. 143-145.
4. Трінус К.Ф. Віддалені неврологічні наслідки катастрофи на ЧАЕС // Мат-ли Всеукраїнської науково-практичної конференції з міжнародною участю «Актуальні питання поліклінічної неврології», Київ, 18–19 травня 2011. — С. 149-163.
5. Тринус К.Ф. Концепция вестибулярного анализатора. Обзор // Неврология, нейропсихиатрия, психосоматика. — 2011. — № 2. — С. 66-72.
6. Тринус К.Ф. Сравнительная характеристика методов исследования головокружений. Обзор // Неврология, нейропсихиатрия, психосоматика. — 2012. — № 3. — С. 85-92.
7. Тринус К.Ф., Поскрипко Ю.А. Роль вестибулярного анализатора в эргономическом обеспечении безопасности полетов // Сб. научн. трудов. — К.: КИИГА, 1987. — С. 92-97.
8. Хомазюк Т.А., Егоров К.Ю. Общая врачебная практика: головокружение у женщин с артериальной гипертензией // Здоров’я України. — 2010. — № 3. — С. 1-3.
9. Bertora G., Bergmann J. Doppler sonography in vertigo patients // Vertigo, nausea, tinnitus and hearing loss in cardio-vascular diseases / Ed. by Claussen C.-F., Kirtane M.V. — Amsterdam; New York; Oxford: Excerpta Medica, 1986. — P. 25-30.
10. Bolton P.S., Kerman I.A., Woodring S.F., Yates B.J. Influences of neck afferents on sympathetic and respiratory nerve activity // Brain Res. Bull. — 1998. — Vol. 47, № 413. — 19 p.
11. Boniver R. The physiology of the microcirculation of the inner ear. Reflections about the use of vasodilatators. Vertigo, nausea, tinnitus and hearing loss in cardio-vascular diseases. Excerpta Medica. — Amsterdam; New York; Oxford: Excerpta Medica. — 1986. — P. 15-18.
12. Claussen C.-F. Schwindel, symptomatik, diagnostik, therapie. — Hamburg: Edition m+p. Dr. Werner Rudat und Co, 1983. — 225 p.
13. Claussen C.-F. Cranio-Corpo-Graphy (CCG) — 30 years of equilibriometric measurements of spatial and temporal head, neck and trunk movements // Equilibrium Research, Clinical Equilibrio-metry and Modern Treatment / Ed. by Claussen C.-F., Haid C.T, Hofferberth B.
International Congress Series 1201. — Amsterdam: Elsevier Science B.V., 2000. — P. 245-259
14. Claussen C.-F., Constantinescu L. Late whiplash Injury Syndrome. Claussen C.-F., Constantinescu, L. Equilibriometric Invesstigations // Modern Concepts of Neurootology / Ed. by DeSa-Souza S., Claussen C.-F. — Bombay: PRAJAKTA, 1997. — P. 351 -360.
15. Claussen CF., Franz B. Contemporary & practical neurooto-logy. Solvay. — Hannover, 2006. — 410p.
16. DeLucchi E. Vertigo equivalent migraine. Giddiness & vestibulo-spinal investigations. Combined audio-vestibular investigations // Experimental neurootology / Ed. by Claussen C.F., Kirtane M.V., Constantinescu L., Schneider D. — 1996. — P. 401-406.
17. Desmond A.L. Vestibular function: evaluation and treatment. — New York; Stuttgart: Thieme, 2004. — 228p.
18. Di Fabio R.P. Sensitivity and specificity of platform posturography for identifying patients with vestibular dysfunction // Phys. Ther. — 1995. — Vol. 75, № 4. — Р. 290-305.
19. Gacek R.R. Anatomy of the central vestibular system // Neurotology / Ed. by Jackler R.K., Brackmann D.E. — Baltimore; Boston: Mosby, St.Luis, 1994. — P. 41-58.
20. Haralanov H., Sachanska Th., Haralanov S., Popova N. Vegetative dysfunction, vertigo and orthostatic collapse in sea sickness // Vertigo, nausea, tinnitus and hearing loss in cardio-vascular diseases / Ed. by Claussen C.-F., Kirtane M.V. — New York; Oxford: Elsevier Science, Publishers B.V., Excerpta Medica, 1986. — P. 207-213.
21. Honrubia V., Sitko S., Lee R., Kuruvilla A., Schwartz I.R. Anatomical characteristics of the anterior vestibular nerve of the bullfrog // Laryngoscope. — 1984. — Vol. 94, № 4. — P. 464-474.
22. International Statistical Classification of Diseases and Related Health Problems. Tenth Revision. — Vol. 1-2. World Health Organization. — Geneva, 1992.
23. Kehaiov A. Changes of the serum parameters under vestibular effect // Vertigo, nausea, tinnitus and hearing loss in cardio-vascular diseases / Ed. by Claussen C.-F., Kirtane M.V. — New York; Oxford: Excerpta Medica, 1986. — P. 221-226.
24. Mackert A., Kasper J., Thoden U. Responses to corneal stimulation in vestibulospinal units of nucleus Deiters // Exp. Neurol. — 1984. — Vol. 83. — P. 24-32.
25. Nashner LM., Black F.O., Wall C. 3rd. Adaptation to altered support and visual conditions during stance: patients with vestibular deficits // J. Neurosci. — 1982. — № 2. — Р. 536-544.
26. Neuhauser H.K., Radtke A., von Brevern M., Lezius F., Feldmann M., Lempert T. Burden of dizziness and vertigo in the community // Arch. Intern. Med. — 2008. — Vol. 168, № 19. — Р. 2118-24.
27. Romberg H. Lehrbuch der Nervenkrankheiten. — Berlin: Springer-Verlag, 1848. — S. 184-191.
28. Schneider D., Shulman A., Claussen C.-F., Just E., Schneider L., Koltchev Ch., Kersebaum M., Dehler R., Goldstein B., Claussen E. Recent findings about measurable interactions between tinnitus and vestibular disturbances // Clinical Equilibriometry and Modern Treatment / Claussen C.-F., Haid C.T, Hofferberth B. — Equilibrium Research, Exerpta Medica, International Congress Series 1201. — Elsevier Science B.V., Amsterdam, Netherland, 2000. — Р. 629-634.
29. The Merck manual of diagnostics and therapy / Ed. by Berkow R. — Merck & Co Inc., Rahway, 1992. — 2844 p.
30. Trinus K. Vestibular system: morpho-physiology and patho-logy. — Lambert Academic Publishing, 2012. — 544 p.
31. Uemura T., Suzuki J.-I., Hozawa J., Highstein S.M. Neurootological examination with special reference to equilibrium function tests. — Tokyo: Igaku Shoin Ltd., 1977. — 178 p.
32. Unterberger S. Neue objektive registrierbare Vestibularis-körperdrehreaktionen, erhalten durch Treten auf der Stelle // Der Tretversuch. Arch. Ohr. Nas. Kehlk. Heilk. — 1938. — 145. — P. 273-282.

/15.jpg)