Статтю опубліковано на с. 59-64
Деменція є актуальною медичною та соціальною проблемою, оскільки поширеність захворювання, обумовлена постарінням населення, постійно зростає. За оцінками епідеміологічних досліджень, у світі у 2010 році від деменції страждали 35,6 млн осіб, кожні 20 років це число буде подвоюватися і становитиме у 2030 році 65,7 млн, а у 2050 році — 115,4 млн.
Щорічно у світі реєструється майже 7,7 млн нових випадків, що відповідає одному новому випадку кожні чотири секунди [1].
Загальносвітові розрахункові витрати, пов’язані з деменцією, у 2010 році становили 604 млн доларів США. У країнах з високим рівнем доходу більша частина витрат припадає на неофіційний догляд (45 %) та офіційну соціальну допомогу (40 %), а відповідна частка прямих медичних витрат (15 %) значно нижча. У країнах з низьким рівнем доходу і в країнах з рівнем доходу, нижчим за середній, прямі витрати на соціальну допомогу невеликі, а переважають витрати на неофіційний догляд (тобто неоплачуваний догляд, що забезпечується сім’єю) [1, 2].
Глобальна проблема полягає в тому, що деменція є причиною втрати функціональної самостійності, інвалідизації та стану залежності людей похилого віку в усьому світі, вагомим фактором значних економічних, соціальних та психологічних затрат сім’ї хворого та суспільства.
У структурі деменцій хвороба Альцгеймера (ХА) становить 60 %, судинна деменція (СД) — 10 %, їх поєднання — 10–25 % [3–6]. В основі розвитку ХА лежить нейродегенеративний процес, який включає накопичення тау-протеїну в нейронах, гіпепродукцію β-амілоїду з формуванням амілоїдних бляшок, що викликає дегенеративні зміни в нейронах та холінергічний дефіцит [6–8]. Патогенез судинної деменції обумовлений цереброваскулярною патологією: перенесеними інсультами, лакунарними інфарктами, лейкоареозом, ішемічною лейкоенцефалопатією [9, 10]. Їх поєднання включає поняття «змішана деменція», розвиток якої полягає в перебігу паралельних патологічних процесів у хворого, який має фактори ризику, спільні для ХА і СД [11, 12].
Факторами ризику деменції є природне старіння, нейродегенеративні, запальні та неопластичні процеси, метаболічні, гормональні, психічні розлади, а також серцево-судинні та судинно-мозкові захворювання, серед яких пріоритетне місце посідає артеріальна гіпертензія (АГ).
Наявність АГ значно підвищує ризик розвитку інсульту. У масштабних популяційних дослідженнях виявлено, що частота розвитку деменції в ранньому періоді інсульту становила 30 %, частота нових випадків зростала після першого року з моменту захворювання на 7 %, а через 25 років — на 48 %. У цілому перенесений інсульт підвищує ризик деменції у 2 рази [13–15].
Взаємозв’язок між високим АТ і розладами когнітивних функцій у літніх пацієнтів встановлений у великих епідеміологічних дослідженнях: Framingham, EVA, Gothenburg, Honolulu-Asia Aging Study [16–19].
Когнітивні порушення виявлялися в 73 % пацієнтів як середнього, так і літнього віку з тривалістю АГ понад 5 років, причому у вигляді помірних когнітивних розладів — у 26,5 %, легких когнітивних порушень — у 46,5 %. Чим більше ускладнювався перебіг АГ, тим значнішими ставали когнітивні порушення.
Існує прямий зв’язок між рівнем АТ у 50 років і когнітивними функціями в 70 років. У дослідженні Honolulu-Asia Aging Study, що тривало близько 30 років і в якому взяли участь 3735 осіб віком від 45 до 50 років, було показано, що високий систолічний АТ у середині життя прямо корелював з ризиком деменції в літньому віці [19].
Отже, АГ розглядається як фактор ризику деменції будь-якої етіології.
Деменція є драматичним етапом довготривалого прогресуючого процесу, якому передують легкі та помірні когнітивні розлади (ПКР).
У 1997 році експертами клініки Мейо був запропонований термін «синдром помірних когнітивних розладів» та були розроблені його діагностичні критерії [20]. ПКР — синдром, що зустрічається переважно в літніх людей, виходить за рамки вікової норми, але не досягає ступеня деменції. Діагноз ПКР правомірний у разі відповідності таким діагностичним критеріям (MCI-revised; Petersen R., Touchon J., 2005):
— скарги на когнітивні порушення, що висловлюються пацієнтом або його близьким оточенням;
— зниження когнітивних функцій порівняно з попереднім більш високим рівнем;
— об’єктивне підтвердження когнітивних порушень шляхом нейропсихологічного тестування;
— прогресуюче зниження когнітивних функцій протягом останнього року;
— відсутність порушень при звичайних, повсякденних формах діяльності, але їх поява при складних, неординарних видах діяльності;
— відсутність деменції.
Крім порушень пам’яті, швидкого психологічного виснаження, зниження темпу розумової діяльності, для таких пацієнтів характерні емоційні розлади: апатія, депресія, порушення ритму сну.
У переважній більшості випадків ПКР поступово прогресують: у 10–15 % вони протягом року трансформуються в деменцію, за 5 років ризик розвитку становить 55–70 %. Ризик прогресування дисмнестичних порушень зростає в старших вікових групах, за наявності атрофії гіпокампа, а також в осіб з деменцією в сімейному анамнезі [21–25].
У деяких випадках ПКР залишаються стаціонарними, навіть можливий регрес патологічних проявів. Саме тому своєчасне виявлення помірних когнітивних порушень до розвитку деменції сприяє призначенню патогенетичної терапії, що може уповільнити або навіть призупинити патологічний процес.
Лікування когнітивних порушень полягає в призначенні етіопатогенетичної терапії, при цьому нейропротекція розглядається як пріоритетний напрямок у лікуванні ПКР.
До групи нейропротекторів належить холіну альфо–сцерат (Гліатилін). Гліатилін є попередником ацетилхоліну та фосфатидилхоліну. В організмі холіну альфосцерат розщеплюється на холін, що є складовою біосинтезу ацетилхоліну (один з основних нейромедіаторів), та гліцерофосфат, що, будучи попередником фосфатидилхоліну мембран нейронів, справляє мембраностабілізуючу та нейропротекторну дію.
Ефективність Гліатиліну при когнітивних дисфункціях доведена результатами багатьох міжнародних клінічних досліджень. Так, у метааналізі 13 досліджень, проведеному L. Parnetti et al. (2001), що включив 4054 пацієнтів з когнітивними розладами різноманітної етіології, показано, що на тлі терапії Гліатиліном відзначалося вірогідне покращення когнітивних функцій (пам’яті, уваги) та емоційного фону порівняно зі стандартною терапією або плацебо; також відмічена позитивна динаміка поведінкових розладів та зростання повсякденної активності [26].
Дослідження, проведене F. Amenta et al. (2010), показало, що застосування Гліатиліну сприяло значному покращенню когнітивних функцій у пацієнтів з легкою та середньою формою тяжкості ХА, а побічні ефекти були мінімальними порівняно з антихолінестеразними препаратами. У даний час у Європі проходить подвійне сліпе багатоцентрове клінічне дослідження ASCOMALVA, у якому оцінюється ефективність комбінованого застосування інгібітору холінестерази донепезилу й холінергічного попередника холіну альфосцерату (Гліатилін) у пацієнтів, які страждають від хвороби Альцгеймера, при наявності ішемічних вогнищ ураження в головному мозку за даними МРТ. Після двох років успішної терапії в дослідженні ASCOMALVA авторами було зроблено висновок, що терапія на основі холіну альфосцерату (Гліатиліну), максимально повно усуваючи холінергічний дефіцит, має виражений клінічний ефект у відновленні когнітивних і рухових функцій, здатності до самообслуговування в пацієнтів з перенесеним ішемічним ураженням головного мозку. Отже, клінічне дослідження ASCOMALVA показало, що запропонована холінергічна терапія може розглядатися як можливий метод лікування нейродегенеративних захворювань у поєднанні з ішемічним ураженням головного мозку [27–30].
Таким чином, вищезазначене дозволяє використовувати Гліатилін як ефективний препарат патогенетичної терапії когнітивних порушень різноманітного генезу.
Мета дослідження: вивчити ефективність використання холіну альфосцерату (Гліатилін) у хворих з артеріальною гіпертензією та синдромом помірних когнітивних розладів.
Матеріали та методи
У групу спостереження увійшли 28 пацієнтів віком від 52 до 70 років, серед них 12 жінок та 16 чоловіків зі встановленим діагнозом гіпертонічної хвороби II стадії, 2-го ступеня, високого ризику, які перебували на стаціонарному або амбулаторному лікуванні відділень: некоронарогенних захворювань, фармакотерапії, поліклініки Національного наукового центру «Інститут кардіології імені акад. М.Д. Стражеска НАМН України».
Усім пацієнтам проведено 24-годинне моніторування артеріального тиску (АТ), виконано ехокардіографію. Середній рівень систолічного тиску до лікування становив 166 ± 14 мм рт.ст., діастолічного — 93 ± 8 мм рт.ст. Гіпотензивні препарати приймали регулярно 28,5 % пацієнтів, нерегулярно — 60,7 % (17), не приймали взагалі — 10,7 %. Тривалість захворювання становила в середньому 7,64 ± 2,02 року.
Клініко-неврологічні методи дослідження включили вивчення скарг, анамнезу, оцінку неврологічного та ней–ропсихологічного статусу хворого.
Оцінка когнітивного дефіциту проводилась за допомогою шкали MMSE (Mini Mental State Examination), що включає 30 питань, які дозволяють оцінити орієнтування в часі та місці, сприйняття, концентрацію уваги, короткотривалу та тривалу пам’ять, мову, письмо, читання, конструювання та праксис. Сума балів від 30 до 28 означає норму, 27–24 — помірні когнітивні порушення, нижче ніж 24 — деменцію.
Психоемоційний стан оцінювався з використанням госпітальної шкали тривоги та депресії (HADS-A, HADS-D), де за норму прийняті показники ≤ 7 балів, 8–10 балів — субклінічна тривога/депресія, 11 та вище — клінічно виражена тривога/депресія.
Клініко-лабораторні методи — загальний аналіз крові, дослідження біохімічних показників сироватки крові, гормонів щитоподібної залози.
Пацієнтам проводили магнітно-резонансну томографію (МРТ) головного мозку на магнітно-резонансному томографі Toshiba Vantage HSP з індукцією магнітного поля 1,5 тесла.
Діагноз «помірні когнітивні розлади» встановлений згідно з діагностичними критеріями MCI-revised (Petersen R., Touchon J., 2005).
Дослідження тривало протягом 2 місяців. У рамках дослідження всі хворі отримували комбіновану гіпотензивну терапію з використанням препаратів першої лінії (діуретики, бета-блокатори, антагоністи кальцію, інгібітори ангіотензинперетворюючого ферменту, антагоністи рецепторів ангіотензину ІІ). Метою призначення гіпотензивних препаратів було досягнення цільового рівня АТ < 140/90 мм рт.ст.
Додатково до гіпотензивної терапії пацієнтам призначений Гліатилін у дозі 1000 мг парентерально протягом дев’яти днів з подальшим застосуванням препарату перорально в дозі 400 мг 2 рази на день.
Результати та їх обговорення
При первинному обстеженні основними скаргами пацієнтів були: порушення пам’яті на перебіг подій (89,2 %), зниження концентрації уваги (85,7 %); утруднення запам’ятовування нової інформації (82,1 %); головний біль (92,9 %); запаморочення (85,7 %); шум у голові та вухах (75,0 %); тривога (67,8 %), підвищена втомлюваність та швидке виснаження (78,5 %), знижений фон настрою (60,7 %), роздратованість (67,8 %), апатія (46,4 %), порушення ритму сну (78,5 %).
При неврологічному огляді переважали слабкість конвергенції очних яблук, недостатність VII та XII пар черепних нервів, підвищення пластичного тонусу; тремор голови та/або кінцівок, пірамідний синдром у вигляді анізорефлексії, підвищення сухожильних та періостальних рефлексів, патологічних пірамідних рефлексів; помірні координаторні та сенсорні порушення. Неврологічна симптоматика мала розсіяний характер.
Аналіз результатів МРТ продемонстрував, що в більшості хворих виявлено від одного до декількох гіперінтенсивних на Т2- та гіпоінтенсивних на Т1-зображеннях вогнищ діаметром 0,1–1,5 см у білій речовині лобної, скроневої та тім’яної ділянок, субкортикально в проекції базальних гангліїв; ділянки лейкоареозу перивентрикулярно в ділянці передніх рогів бокових шлуночків; помірне розширення субарахноїдальних просторів та шлуночків головного мозку. У двох хворих виявлені німі інфаркти в скроневій та потиличній ділянках без неврологічних проявів.
У всіх пацієнтів протягом 8–14 днів був досягнутий цільовий рівень тиску.
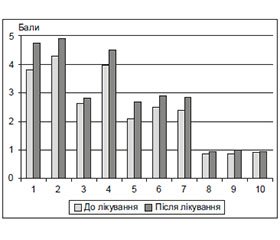
На початку дослідження середній бал за шкалою MMSE становив 24,53 ± 0,59. Обстеження пацієнтів на 20-ту добу лікування виявило тенденцію до зростання показника. У подальшому когнітивний статус обстежуваних покращувався залежно від досягнення цільового рівня АТ та тривалості лікування. Середній бал тесту MMSE після закінчення дослідження становив 28,47 ± 0,37. Аналіз результатів продемонстрував приріст показників за всіма субтестами, особливо за такими: «Орієнтування в часі», «Концентрація уваги та рахунок», «Пам’ять», «Написання речення» (рис. 1).
Результатом лікування стало покращення самопочуття та зменшення соматичних скарг у переважної більшості пацієнтів (рис. 2).
При оцінці рівня тривоги та депресії за госпітальною шкалою HADS на початку лікування у більшості пацієнтів (82,1 %) була виявлена тривога, середній рівень якої становив 11,28 ± 1,72 бала, що відповідає клінічно вираженій тривозі. Після стабілізації АТ та двомісячного лікування препаратом Гліатилін спостерігалось зменшення таких симптомів у підшкалі тривоги, як: напруження (2,00 ± 0,51 бала до лікування та 1,5 ± 0,2 бала після нього); наявність неспокійних думок (до лікування — 1,85 ± 0,43; після нього — 1,40 ± 0,74); внутрішнє напруження та тремтіння (до лікування — 1,60 ± 0,77; після — 1,32 ± 0,73), непосидючість, необхідність постійно рухатися (до лікування — 1,64 ± 0,91; після — 1,20 ± 0,68), нав’язливі думки (до лікування — 1,43 ± 0,77; після — 1,14 ± 0,52); відчуття паніки (до лікування — 1,32 ± 0,69, після нього — 1,14 ± 0,75). Середній бал у підшкалі тривоги після завершення дослідження становив 7,07 ± 1,60 (рис. 3).
Депресивні розлади визначались у 46,4 % пацієнтів, і середній бал становив 8,20 ± 1,43 (субклінічно виражена депресія). Після проведення дослідження знизились рівні таких депресивних показників, як: неможливість отримувати задоволення (до лікування — 1,53 ± 0,96; після — 0,92 ± 0,81); низький рівень бадьорості (до лікування — 1,39 ± 0,54; після — 0,96 ± 0,51); уповільнення повсякденної діяльності (до лікування — 1,30 ± 0,96; після — 0,90 ± 0,70), зниження відчуття задоволення від виконання власних справ, захоплень (до лікування — 1,07 ± 0,35; після — 0,98 ± 0,91). Результатом лікування стало зниження середнього бала в підшкалі депресії до 6,40 ± 1,83 (рис. 4).
Отже, у пацієнтів з гіпертонічною хворобою стабілізація АТ у поєднанні з терапією препаратом Гліатилін призвела до покращення самопочуття, когнітивних функцій, стабілізації психоемоційного стану.
Висновки
1. Дані літературних джерел, результати масштабних клінічних досліджень свідчать про те, що артеріальна гіпертензія є самостійним та вагомим фактором ризику розвитку деменції.
2. Стабілізація АТ та лікування препаратом Гліатилін покращують стан когнітивних функцій у пацієнтів з гіпертонічною хворобою.
3. Комплексне застосування гіпотензивних препаратів у поєднанні з Гліатиліном призводить до стабілізації психоемоційного стану, зменшує рівень тривоги та депресії, покращує загальний соматичний стан хворих.
Список литературы
1. Деменция: приоритет общественного здравоохранения (2012); ВООЗ и международная организация по проблемам болезни Альцгеймера. — http://www.who.int/mental_health/publications/dementia_report_2012
2. Бачинська Н.Ю., Рожелюк І.Ф., Політаєва К.М., Холін В.О. Застосування мемантину гідрохлориду у хворих похилого віку на початкових стадіях судинної деменції і хвороби Альцгеймера // Лікарська справа. — 2013. — № 7. — С. 3-18.
3. Gearing M., Mirra S.S., Hedreen J. et al. The consortium to establish a registry for Alzheimer’s disease (CERAD). Part X. Neuropathology confirmation ofthe clinical diagnosis of Alzheimer’s disease // Neurology. — 1995. — Vol. 45, № 3. — P. 461- 466.
4. Nagy Z., Esiri M.M., Jobst K.A. et al. The effects of additional pathology on the cognitive deficit in Alzheimer disease // J. Neuropathol. Exp. Neurol. — 1997. — Vol. 56, № 2. — P. 165-170.
5. Гехт А.Б. Болезнь Альцгеймера и другие деменции // Журнал неврологии и психиатрии. — 2009. — Спецвып. — С. 17-20.
6. Anderson A.J., Pike C.J., Cotman C.W. Differential induction of immediate early gene proteins in cultured neurons by betaamyloid (A beta): association of cJun with A betainduced apoptosis // J. Neurochem. — 1995. — Vol. 65, № 4. — P. 1487-1498.
7. Banati R.B., Gehrmann J., Lannes-Vieira J. Inflammatory reaction in experimental autoimmune encephalomyelitis (EAE) is accompanied by a microglial expression of the beta A4-amyloid precursor protein (APP) // Glia. — 1995. — Vol. 14, № 3. — P. 209-215.
8. Moran M.A., Mufson E.J., Gomez-Ramos P. Cholinesterases colocalize with sites of neurofibrillary degeneration in aged and Alzheimers brains // Acta Neuropathol. Berl. — 1994. — Vol. 87, № 3. — P. 284-292.
9. Roman G.C. Vascular dementia: distinguishing characteristics, treatment, and prevention // J. Am. Geriatr. Soc. — 2003. — Vol. 51, № 5, suppl. 2. (Dementia). — P. S296-S304.
10. Iemolo F., Duro G., Rizzo C. Pathophysiology of vascular dementia // Immun. Ageing. — 2009. — Vol. 6. — 13.
11. Langa K.M., Foster N.L., Larson E.B. Mixed dementia: emerging concepts and therapeutic implications // JAMA. — 2004. — Vol. 292, № 23. — P. 2901-2908.
12. Schneider J.A., Wilson R.S., Bienias J.L. Cerebral infarctions and the likelihood of dementia from Alzheimer disease pathology // Neurology. — 2004. — Vol. 62, № 7. — P. 1148-1155.
13. Gorelick P.B. Risk factors for vascular dementia and Alzheimer disease // Stroke. — 2004. — Vol. 35, № 11. — P. 2620-2622.
14. Gorelick P.B., Scuteri A., Black S.E. et al.; American Heart Association Stroke Council, Council on Epidemiology and Prevention, Council on Cardiovascular Nursing, Council on Cardiovascular Radiology and Intervention, and Council on Cardiovascular Surgery and Anesthesia Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association // Stroke. — 2011. — Vol. 42, № 9. — P. 2672-2713.
15. Мищенко Л.А. Антигипертензивная терапия и риск развития деменции // Терапия. — 2013. — № 9. — С. 61-62.
16. Elias M.F., Wolf P.A., D’Agostino et al. Untreated blood pressure level is inversely reated to cognitive functioning: the Fra–mingham Study // Am. J. Epidemiol. — 1993. — Vol. 138, № 6. — P. 353-364.
17. Tzourio C., Dufouil C., Ducimetiere P. Cognitive decline in individuals with high blood pressure: a longitudinal study in the elderly. EVA Study Group. Epidemiology of Vascular Aging // Neuro–logy. — 1999. — Vol. 53, № 9. — P. 1948-1952.
18. Ruitenberg A., Skoog I., Ott A. et al. Blood pressure and risk of dementia: results from the Rotterdam study and the Gothenburg H-70 Study // Dement. Geriatr. Cogn. Disord. — 2001. — Vol. 12, № 1. — P. 33-39.
19. Launer L.J., Masaki K., Petrovitch H. The association between midlife blood pressure level and late-life cognitive function. The Honolulu-Asia Aging Study // JAMA. — 1995. — Vol. 274, № 23. — P. 1846-1851.
20. Petersen R.S, Smith G.E., Warning S.C. Aging, memory and mild cognitive impairment // Int. Psychogeriatr. — 1997. — Vol. 9. — P. 24-32.
21. Захаров В.В. Диагностика и лечение умеренных когнитивных нарушений // Неврология, нейропсихиатрия, психосоматика. — 2009. — № 2. — С. 14-19.
22. Яхно Н.Н., Захаров В.В. Легкие когнитивные нарушения в пожилом возрасте // Неврологический журнал. — 2004. — № 1. — С. 4-8.
23. Petersen R.S., Smith G.E., Waring S.C. et al Mild cognitive impairment: clinical characterization and outcome // Arch. Neurol. — 1999. — Vol. 56. — P. 303-308.
24. Petersen R.C., Stevens J.C., Ganguli M. et al. Practice parameter. Early detection of dementia: mild cognitive impairment (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology // Neurology. — 2001. — Vol. 56. — P. 1133-1142.
25. Ritchie K., Artero S., Touchon J. Classification criteria for mild cognitive impairment: a population-based validation study // Neurology. — 2001. — Vol. 56. — P. 37- 42.
26. Lucilla Parnetti, Francesco Amenta, Virgilio Galla. Choline alphoscerate in cognitive decline and in acute cerebrovascular disease: an analysis of published clinical data // Mechanisms of Ageing and Development. — 2001. — Vol. 122, Issue 16. — P. 2041-2055.
27. Кадыков А.С., Шахпаронова Н.В., Кашина Е.М. Возможности холинергической терапии больных с хроническими прогрессирующими сосудистыми заболеваниями головного мозга // Атмосфера. Нервные болезни. — 2006. — № 2. — С. 25-26 .
28. Di Perri R. et al. A multicentre trial to evaluate the efficacy and tolerability of alpha-glycerylphosphorylcholine versus cytosine diphosphocholine in patients with vascular dementia // J. Int. Med. Res. — 1991. — № 19 (4). — P. 330-341.
29. Moreno M. Cognitive improvement in mild to moderate Alzheimer dementia after treatment with the acetylcholine precursor choline alfoscerate: a multi-center, double-blind, randomized, placebo-controlled trial // Clin. Ther. — 2003. — Vol. 25, № 1. — P. 178-193.
30. Amenta F., Carotenuto A., Fasanaro A.M., Lanari A., Previdi P., Rea R. Analisi comparativa della sicurezza/efficacia degli inibitori delle colinesterasi e del precursore colinergico colina alfoscerato nelle demenze ad esordio nell’eta adulta // G. Gerontol. — 2010. — Vol. 58. — P. 64-68.

/62.jpg)