Статья опубликована на с. 65-69
Электроэнцефалографический (ЭЭГ) метод регистрации и анализа биопотенциалов является одним из наиболее эффективных инструментов для неинвазивного анализа деятельности головного мозга, применяемым для диагностики болезни Паркинсона (БП) [7, 10–12]. Множественные публикации связывают активность определенных диапазонов ЭЭГ с функционированием различных медиаторных систем ЦНС. В экспериментальных исследованиях показана зависимость возникновения: тета-активности 4–5 Гц — от адренергической активации, 5–6 Гц — серотонинергической, 6–7,5 Гц — холинергической (Р.М. Багирова, 2006). У человека отмечена связь поведения альфа-составляющих ЭЭГ частотой 11–12 Гц с изменениями уровня активации в дофаминергической системе, бета 24–25 Гц — в серотонинергической (С.В. Панюшкина, 2000) [3]. По данным литературы, изменения электроэнцефалографических показателей у пациентов с болезнью Паркинсона обнаруживаются в 30–40 % случаев. Их характер во многом зависит от тяжести заболевания [8] и его формы. Выявлена их взаимосвязь с постуральными нарушениями, когнитивными расстройствами, терапией препаратами, содержащими леводопу [3, 7, 11]. Изменения биоэлектрической активности мозга носят преимущественно диффузный характер и, по-видимому, обусловлены нарушением множества нейротрансмиттерных систем: дофаминергической, холинергической (особенно при БП с деменцией), серотонинергической, норадренергической и др.
В целом ЭЭГ-картина у больных паркинсонизмом характеризуется снижением реактивности, межполушарной асимметрии амплитуд, быстрых составляющих спектра ЭЭГ, замедлением основного ритма и склонностью к медленным ритмам [9]; реже отмечается тенденция к десинхронизации фоновой ЭЭГ с очень частой биоэлектрической активностью [1, 2].
Мощность α-ритма в основном снижается [5], реже возрастает до 100 мкВ и более. Иногда α-ритм может отсутствовать, что особенно характерно для пациентов с большой длительностью болезни. Среди медленных ритмов особенно увеличивается представленность θ-ритма [1], наиболее характерного для акинетических форм заболевания. Α-ритм обнаруживается в виде отдельных волн. Медленные ритмы больше регистрируются в переднецентральных отведениях.
C нарастанием тяжести клинических проявлений заболевания повышается влияние деактивирующих мозговых систем, нарастает представленность медленных ритмов и снижается — быстрых [1, 2, 9]. А. Morita и соавт. показали, что спектральный индекс (сумма абсолютных мощностей α- и β-ритмов, разделенная на сумму мощностей медленных ритмов) по всем отведениям ЭЭГ достоверно уменьшается по мере прогрессирования заболевания (увеличения стадии по Хен и Яру) [8]. Замедление фоновой активности особенно часто встречается у пациентов с постуральной неустойчивостью [7].
Цель исследования: изучить клинико-неврологические и нейрофизиологические особенности болезни Паркинсона (БП) и дисциркуляторной энцефалопатии (I, II ст.) с паркинсоническим синдромом, возникшим в результате хронического нарушения мозгового кровообращения атеросклеротического и гипертонического генеза.
Материалы и методы
Были проанализированы амбулаторные карты 22 пациентов (данные промежуточного этапа работы) в возрасте от 43 до 78 лет, среди них 9 мужчин и 13 женщин, получавших консультативную помощь в ДОКТМО в 2013–2014 гг.
1-я группа состояла из 7 пациентов с диагнозом «болезнь Паркинсона». 2-я группа включала 15 больных с диагнозом «дисциркуляторная энцефалопатия атеросклеротического и гипертонического генеза с паркинсоническим синдромом». В клинико-неврологическом обследовании использовались: оценочная шкала cтадий заболевания по Хен — Яру, унифицированная оценочная шкала болезни Паркинсона, MMSE, шкала Шваба и Ингланда, BDI, PDQ-39 [1, 2]. В целях подтверждения этиологии сосудистого паркинсонизма проводилось исследование липидограммы, дуплексное сканирование прецеребральных и интракраниальных сосудов, МРТ-ангиография, тщательное соматическое обследование, включая ЭКГ, в ряде случаев холтер-ЭКГ + АД, УЗИ сердца.
Регистрацию биопотенциалов мозга осуществляли с помощью нейрофизиологического комплекса DX-NT32. Использовали чашечковые хлорсеребряные электроды, которые накладывались в соответствии с международной системой «10–20» [5] в положения Fp1, Fp2, C3, C4, O1, O2, T3, T4. Применялось монополярное отведение биопотенциалов с референтным электродом на мочке ипсилатерального уха [5]. Протокол записи ЭЭГ включал спокойное бодрствование, затем ахроматическую ритмическую фотостимуляцию (ФТС) на частотах 2, 5, 10 Гц. Вычисляли абсолютную спектральную мощность (АМ) усредненно для следующих частотных диапазонов ЭЭГ: ∆ — delta (0–4 Гц), θ — teta (5–7 Гц), α-alfa (8–12 Гц), α1 — alfa-1 (9–11 Гц), β1 — beta-1 (13–20 Гц), β2 — beta-2 (20–30 Гц). Для оценки уровня активности холинергической системы (ХС) головного мозга определяли показатели АМ в диапазоне 6–7,5 Гц, дофаминергической (ДофС) — 11–12 Гц [3, 5].
Для объективизации оценки ЭЭГ использован метод интегрального количественного анализа ЭЭГ-паттерна (Деклараційний патент на корисну модель «Спосіб інтегрального кількісного аналізу електричної активності головного мозку». Затверджено 26 липня 2005 року. — 9648. — А61В5/0476. — Бюл. № 10). Реактивность ЦНС оценивали по изменению (%) показателей абсолютной спектр-мощности (АМС) и интегральных коэффициентов (ИК) в ответ на введение нейротропных препаратов на основании классификации типов реакции ЦНС [6]. Статистический анализ данных проводили с помощью программы MedStat [4].
Результаты исследования
Для определения степени выраженности расстройства движений была использована классификация по Хен — Яру: в 1-й группе отмечалось 14,3 % пациентов с I стадией, 57,1 % — со II и 28,6 % — с III стадией. Во 2-й группе у всех пациентов расстройства движений соответствовали II стадии. Значимых различий по гендерному распределению в группах не выявлено. Возрастные показатели групп достоверно различались (W-критерий Вилкоксона). В 1-й группе пациенты были моложе (Ме (± 95 %) = 59 (47–69)), чем во 2-й (Ме (± 95 %) = 72 (61–75)).
Исходные значения абсолютной спектральной мощности (АСМ) в диапазоне 6–8 Гц, характеризующие активность холинергической системы в ЦНС, у пациентов 1-й группы были достоверно ниже (W-критерий Вилкоксона, p ≤ 0,05), чем у пациентов 2-й группы, в левом лобном и билатерально в окципитальных отделах коры больших полушарий. Исходные уровни АСМ в диапазоне 11–12 Гц, который характеризует дофаминергическую систему, во всех исследуемых отведениях у пациентов обеих групп не имели значимых различий и были снижены (W-критерий Вилкоксона, p ≤ 0,05) относительно показателей в контрольной группе здоровых добровольцев.
В комплексе назначаемого лечения пациенты обеих групп получали следующие препараты: оригинальный амантадина сульфат, генерический амантадина сульфат, агонист дофаминовых рецепторов. В 1-й группе оригинальный амантадина сульфат — 85,7 %, генерический амантадина сульфат — 42,9 %, агонист дофаминовых рецепторов — 85,7 %. Во 2-й группе оригинальный амантадина сульфат получали 53,3 %, генерический амантадина сульфат — 26,67 %, агонист дофаминовых рецепторов — 73,3 % пациентов.
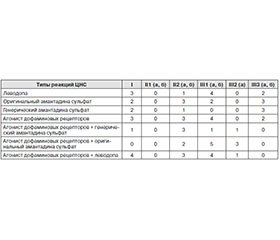
Изучение типов реакции ЦНС в ответ на фармакологическое воздействие дало возможность количественно оценить увеличение или уменьшение дезорганизации ЭЭГ-паттерна и определить уровень нейрофизиологического воздействия препарата на мозг (кора-подкорка, кора-кора). Была разработана классификация типов реакций ЦНС, где I тип — отсутствие достоверных изменений показателей абсолютной спектральной мощности (АСМ) и интегральных коэффициентов — относился к прогностически неблагоприятным [6]. Реакции II типа отражают изменения корково-подкорковых взаимодействий в ответ на фармакологическое воздействие. Реакции ЦНС типа II 1а и II 1б ПГ отнесены к прогностически неблагоприятным, так как они характеризуются нарастанием дезорганизации ЭЭГ-паттерна за счет недостаточности стволовых активирующих влияний с увеличением спектр-мощности патологической, преимущественно δ-волновой активности. Тип 1в ПГ реакций ЦНС с увеличением суммарной мощности (СМ) ЭЭГ-паттерна, преимущественно за счет повышения АСМ альфа-активности, — прогностически благоприятный.
Реакции II типа, подгруппы 2а и 2б — уменьшение СМ ЭЭГ-паттерна, преимущественно за счет угнетения δ- и θ-ритмов — прогностически благоприятные. Из реакций II типа наиболее благоприятной следует считать 2а ПГ изменений, во-первых, отражающих рост активирующих влияний на кору со стороны ретикулярной формации и, во-вторых, характеризующихся угнетением патологической активности δ- и θ-диапазонов.
Реакции III типа — изменение взаимодействий на уровне коры мозга в ответ на фармакологическое воздействие. Это реакции перераспределения мощности ЭЭГ-паттерна при стабильности СМ. Реакции III 1а и III 1б подгрупп можно назвать относительно неблагоприятными, так как они свидетельствуют об относительном восстановлении функции нейронов в условиях обширных морфоструктурных постишемических повреждений клеток мозга различного генеза (в данном случае на фоне ДЭП), но отражают умеренные дезорганизационные ЭЭГ-процессы. Из реакций перераспределения мощности (III тип) прогностически благоприятными можно считать III 2а подгруппу изменений, для которой типична активация α- и β2-ритмов за счет угнетения дельта-активности. Такие реакции, особенно на стороне поражения, отражают корковые процессы восстановления обратимо поврежденных клеток мозговой ткани, их постсинаптической пропускной способности для высокочастотной стимуляции.
III тип 3а подгруппа, 3б подгруппа — перераспределение ЭЭГ-активности с увеличением β2-мощности за счет редукции δ-ритма — прогностически благоприятные. Интересны реакции III 3а ПГ, для которых характерно замещение альфа-ритма высокочастотной β2-активностью, что считается ЭЭГ-коррелятом перехода от состояния покоя к напряжению при умственной деятельности у взрослых.
У пациентов 1-й и 2-й групп были выявлены следующие типы реакций ЦНС в ответ на применение патогенетической паркинсонической терапии [1, 2, 9] (табл. 1–4).
/67.jpg)
Для этой категории больных недостаточно просто включения в терапию отдельных препаратов: более 80 % благоприятных реакций ЦНС зафиксированы при включении в терапию оригинального амантадина сульфата. Также необходимо отметить, что благоприятной биоэлектрической активности ЦНС не отмечалось у пациентов с дисциркуляторной энцефалопатией с паркинсоническим синдромом, которые получали генерический амантадина сульфат (табл. 3). Это, скорее всего, связано с селективной способностью рецепторов оригинального вещества амантадина сульфата снижать патологическое преобладание глутаматергической системы, а значит, снижать уровень ацетилхолина в полосатом теле (уменьшение тремора, ригидности, акинезии), уменьшать концентрацию ионов Са++ в нигростриарных нейронах, снижая, таким образом, потенциал дегенеративного процесса и оказывая мощный нейропротективный эффект.
/68.jpg)
Более эффективно, по данным нейрофизиологического мониторинга, использование сочетаний: совместное применение агониста дофаминовых рецепторов + оригинальный амантадина сульфат повышает долю благоприятных реакций ЦНС до 72 %, агониста дофаминовых рецепторов с леводопой — до 34 %.
Для данной категории пациентов максимальная доля благоприятных реакций ЦНС — около 80 % — выявлена при включении в комплекс оригинального амантадина сульфата или при использовании агониста дофаминовых рецепторов + оригинальный амантадина сульфат, около 20 % благоприятных реакций ЦНС выявлены при включении в терапию агониста дофаминовых рецепторов в сочетании с леводопой.
Выводы
1. В группе с диагнозом «болезнь Паркинсона» пациенты были моложе, чем в группе с ДЭП.
2. Более выраженная недостаточность холинергической системы ЦНС была зафиксирована в группе пациентов с БП.
3. ЭЭГ-показатели, которые характеризуют активность дофаминергической системы, были снижены в обеих группах.
4. Особенности нейромедиаторной недостаточности предопределили назначение комплексов патогенетической терапии.
5. При БП необходимым и эффективным является назначение блокаторов глутаматных рецепторов (оригинальный амантадина сульфат).
6. Пациентам обеих групп показано применение селективных агонистов дофаминовых рецепторов и препаратов леводопы.
7. Включение в терапию болезни Паркинсона (1-я группа) и дисциркуляторной энцефалопатии с паркинсоническим синдромом (2-я группа) комплексов препаратов «агонист дофаминовых рецепторов + оригинальный амантадина сульфат» и «агонист дофаминовых рецепторов + леводопа» повышает долю благоприятных реакций ЦНС.
Список литературы
1. Болезнь Паркинсона и расстройства движений: Руководство для врачей / Под ред. С.Н. Иллариошкина, Н.Н. Яхно. — М., 2008. — 405 с.
2. Голубев В.Л., Левин Я.И., Вейн А.М. Болезнь Паркинсона и синдром паркинсонизма. — М.: МЕДпресс, 1999.
3. Шарова Е.В. Современные возможности ЭЭГ в анализе функциональных нарушений при тяжелых повреждениях головного мозга // Нейронауки: теоретичні та клінічні аспекти. — 2009. — Т. 5, № 1–2. — С. 49-58.
4. Лях Ю.Е., Гурьянов В.Г., Хоменко В.Н., Панченко О.А. Основы компьютерной биостатистики: анализ информации в биологии, медицине и фармации статистическим пакетом MedStаt. — Донецк: Папакица Е.К., 2006. — 214 с.
5. Острова Т.В., Черній В.І., Шевченко А.І. Алгоритм діагностики реактивності ЦНС методами штучного інтелекту. — Донецьк: Наука і освіта, 2004. — 180 с.
6. Островая Т.В. Исследование реактивности ЦНС в ответ на фармакологическое воздействие (Тиоцетам) / Т.В. Островая, В.И. Черний, И.А. Андронова // Междунар. неврол. журн. — 2007. — № 2 (12). — С. 53-62.
7. Babiloni C., De Pandis M., Vecchio F. et al. Cortical sources of resting state electroencephalographic rhythms in Parkinson’s disease related dementia and Alzheimer's disease // Clin. Neurophysiol. — 2011. — 122 (12). — 2355-2364.
8. Desplats P., Lee H.J. Inclusion formation and neuronal cell death through neuron-to-neuron transmission of alpha-synuclein // Proc. Nalt. Acad. Sci USA. — 2009. — Vol. 106. — P. 13010-13015.
9. Parnetti L. Choline alphoscerate in cognitive decline and in acute cerebrovascular disease: an analysis of published clinical data // Mechanisms of Ageing and Development. — 2001. — 122. — P. 2041-2055.
10. Morita A., Kamei S., Mizutani T. Relationship between slowing of the EEG and cognitive impairment in Parkinson disease // J. Clin. Neurophysiol. — 2011. — 28 (4). — 384-387.
11. Serizawa K., Kamei S., Morita A. et al. Comparison of quantitative EEGs between Parkinson disease and age-adjusted normal controls // J. Clin. Neurophysiol. — 2008. — 25 (6). — 361-366.
12. Tanaka H., Koenig T., Pascual-Marqui R. Event-related potential and EEG measures in Parkinson's disease without and with dementia // Dement Geriatr. Cogn. Disord. — 2000. — 11. — 39-45.

/67.jpg)
/68.jpg)