Статья опубликована на с. 70-81
Введение
Травматическое повреждение головного мозга (ТПГМ) является значимой медико-социальной проблемой современного общества. Так, в США каждый год более 1,7 млн человек получают ТПГМ, причем в 1/4 случаев травма носит умеренный или тяжелый характер. По сути, ТПГМ является лидирующей причиной инвалидизации, особенно у молодежи, и сегодня приблизительно 5,3 млн американцев живут с хроническими последствиями перенесенного ТПГМ [1].
В Украине ежегодно около 200 тыс. человек переносят ТПГМ. Около 1 млн украинцев имеют ту или иную группу инвалидности вследствие перенесенного ТПГМ. В связи с вооруженным противостоянием на юго-востоке Украины ожидается существенное увеличение этих цифр [2].
В связи с актуальностью данной патологии в настоящем обзоре внимание было уделено хроническому последствию ранее перенесенного ТПГМ — посттравматической деменции.
Виды посттравматической деменции
Посттравматическая деменция после однократного умеренного или тяжелого травматического повреждения головного мозга
Относительно недавно была установлена связь между перенесенным ТПГМ и развитием деменции в отдаленном периоде (табл. 1).
Видно, что эта зависимость имеет дозозависимый характер: однократное воздействие умеренного или тяжелого ТПГМ увеличивает вероятность последующего развития деменции соответственно в 2–4 раза, в то время как однократное легкое ТПГМ не влечет за собой подобных последствий.
На основании данных исследований, представленных в табл. 1, а также ряда других работ комитет Института медицины (США) пришел к следующему выводу: «Накоплено достаточно доказательств связи между умеренным и тяжелым ТПГМ и развитием деменции… имеются ограниченные доказательства связи между легким ТПГМ (с потерей сознания) и развитием деменции… собрано недостаточно доказательств связи между легким ТПГМ (без потери сознания) и развитием деменции» [7].
Были сделаны предположения о том, что носительство ε4-аллели гена аполипопротеина-Е (APOE-ε4) увеличивает риск развития деменции после ТПГМ. Однако полученные данные весьма противоречивы: в одних исследованиях было получено подтверждение этого факта, в других — нет [3].
Среди форм деменции, которые могут развиться после ТПГМ, отмечают болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз. Среди них наиболее подтверждена связь ТПГМ с болезнью Альцгеймера [8]. Интересно, что когда исследователи выполнили обратную оценку — сколько же пациентов, страдающих деменцией, обязаны своей болезнью ранее перенесенному ТПГМ, то были получены цифры на уровне 5–15 % (математическое моделирование) [9].
По состоянию на сегодняшний день не обнаружено различий между болезнью Альцгеймера, развившейся вследствие ТПГМ, и обычной формой болезни Альцгеймера [1]. Клиническая картина данного заболевания хорошо известна, ниже мы коротко напомним ее.
Посттравматическая деменция после многократного легкого травматического повреждения головного мозга
Наука иногда обнаруживает удивительные факты там, где их меньше всего ожидают. Оказалось, что легкое ТПГМ (такое как сотрясение с потерей сознания или без него) при его многократном воздействии приводит к развитию особой формы деменции, которая получила название «хроническая травматическая энцефалопатия» [10]. Группой риска в плане возникновения данной патологии являются боксеры, футболисты, хоккеисты и военные. При этом у непрофессиональных спортсменов (спортсменов-любителей) риск развития деменции практически отсутствует [3].
Для хронической травматической энцефалопатии также характерна дозозависимость: чем больше легких ТПГМ было перенесено, тем выше вероятность возникновения данного типа деменции. Вместе с тем связь с носительством APOE-ε4-аллели была противоречивой [10].
Особо хотелось бы отметить, что спортивные ТПГМ существенно завышают те статистические данные, которые были приведены в начале данной статьи. Проведенные оценки свидетельствуют о том, что в США ежегодно наблюдается 1,6–3,8 млн связанных со спортом ТПГМ, включая те, по поводу которых не было обращений за медицинской помощью. В связи с этим ТПГМ, связанные со спортом, было предложено называть «молчаливой эпидемией» [10].
Некоторые клинические симптомы хронической травматической энцефалопатии и ряд критериев для ее диагностики представлены в табл. 2 и 3 соответственно.
Различия и сходство между травматической болезнью головного мозга как фактором риска развития болезни Альцгеймера и хронической травматической энцефалопатией
Между болезнью Альцгеймера, развившейся после однократного умеренного или тяжелого ТПГМ, и хронической травматической энцефалопатией, развившейся вследствие многократного легкого ТПГМ, имеется ряд клинических, патоморфологических и патофизиологических различий (табл. 4).
Клинической особенностью травматической болезни головного мозга как фактора риска развития болезни Альцгеймера является раннее появление нарушений кратковременной памяти. При хронической травматической энцефалопатии на ранних стадиях болезни возникает депрессия, на поздних стадиях — паркинсонический синдром. Больные с этой патологией склонны к резким перепадам настроения со вспышками гнева, к злоупотреблению различными веществами. Также у них отмечено суицидальное поведение [3].
В экспериментальных исследованиях на животных, посмертных исследованиях на людях и отдельных клинических исследованиях были обнаружены различия в патоморфологической картине обеих патологий. Если для травматической болезни головного мозга как фактора риска развития болезни Альцгеймера было характерно накопление компактных (нейритических, т.е. типичных) β-амилоидных бляшек, то при хронической травматической энцефалопатии они встречаются редко и даже если имеются, чаще носят диффузный характер. Накопление гиперфосфорилированного tau-белка было одинаковым при обеих патологиях, в то время как накопление гиперфосфорилированного TDP-43 было более выражено при хронической травматической энцефалопатии [1, 3].
К примеру, в 2014 г. удалось выполнить визуализационное исследование головного мозга у бывшего игрока Национальной футбольной лиги в возрасте 71 года с нарушениями памяти и клиническим профилем, близким к болезни Альцгеймера. При выполнении позитронно-эмиссионной томографии с [(18)F]-флорбетапиром (связывается с β-амилоидом) был получен отрицательный результат, что позволило исключить наличие у данного пациента болезни Альцгеймера. То же самое исследование с [(18)F]-Т807 (связывается с гиперфосфорилированным tau-белком) выявило задержку данного зонда в стриарной (полосатое тело) и нигральной (черная субстанция) областях, указывая на наличие таупатии. Больному был выставлен диагноз хронической травматической энцефалопатии [11].
При посмертном исследовании головного мозга людей (n = 39), перенесших при жизни однократное умеренное или тяжелое ТПГМ и живших после него 1–47 лет, было выявлено наличие нейрофибриллярных клубков (накопление гиперфосфорилированного tau-белка) и β-амилоидных бляшек у 1/3 больных [12].
Данные процитированных [11, 12] и многих других исследований подтверждают тот факт, что хроническая травматическая энцефалопатия является таупатией, в то время как при травматической болезни головного мозга как факторе риска развития болезни Альцгеймера накапливается как гиперфосфорилированный tau-белок, так и β-амилоид.
Как после однократного умеренного или тяжелого ТПГМ, так и после многократного легкого ТПГМ развивается персистирующее воспаление, часто называемое иммуноэксайтотоксичностью, которое длится многие годы и, как считается, ответственно за развитие наблюдаемой при этих заболеваниях нейродегенерации. Иными словами, исследователи полагают, что травматическая болезнь головного мозга как фактор развития болезни Альцгеймера и хроническая травматическая энцефалопатия обязаны своим возникновением не столько травме, сколько последующим патофизиологическим нарушениям — длительно поддерживаемому воспалению [1, 13, 14].
Считается, что в ответ на травму происходит активация микроглии и астроцитов, которые запускают последующий процесс воспаления, высвобождая провоспалительные цитокины (TNF-α, IL-1β, IL-6 и др.), хемокины (MAP-1, MCP-1 и др.) и эксайтотоксины (глутамат, аспартат, хинолиновая кислота и др.) (рис. 1).
Хроническое воспаление длится много лет и в конечном итоге приводит к развитию посттравматической деменции (травматическая болезнь головного мозга как фактор развития болезни Альцгеймера, хроническая травматическая энцефалопатия и др.) с соответствующими патоморфологическими и клиническими признаками [1, 14].
Лекарственная коррекция посттравматической деменции
Общие подходы к терапии
В 2012 г. Ассоциация по вопросам лечения болезни Альцгеймера (Alzheimer’s Association) выпустила релиз, в котором сформулировала основной подход к лечению посттравматической деменции любого типа: «Стратегии для лечения болезни Альцгеймера или деменций другого типа являются одинаковыми у лиц, переносивших и не переносивших травматическое повреждение головного мозга».
Иными словами, посттравматические деменции клиницистам рекомендуется вести так же, как и аналогичные деменции без травмы [15].
Роль Церебролизина в лечении дементных расстройств
Препарат с плейотропным и мультимодальным действием
Церебролизин является пептидным препаратом, получаемым с помощью стандартизированного ферментативного расщепления обезжиренных белков головного мозга свиней, и состоит из низкомолекулярных пептидов и свободных аминокислот. Пептиды, содержащиеся в Церебролизине, представляют собой фрагменты ряда нейротрофических факторов головного мозга (цилиарного нейротрофического фактора (CNTF), глиального нейротрофического фактора (GDNF), инсулинового фактора роста 1 (IGF-1) и инсулинового фактора роста 2 (IGF-2). Было показано, что после внутривенного введения пептиды проникают через гематоэнцефалический барьер и действуют аналогично нейротрофическим факторам [16, 17].
Нейротрофическое действие (т.е. действие, подобное нейротрофическим факторам) Церебролизина включает в себя нейропротекцию и нейрорегенерацию (рис. 2) [18, 19].
Нейропротекция включает в себя защиту нейронов от разнообразных повреждений. Из рис. 2 видно, что Церебролизин проявляет антиоксидантное, противовоспалительное, антиапоптотическое действие, препятствует накоплению патологических белков (β-амилоида, гиперфосфорилированного tau-белка). Кроме того, Церебролизин усиливает высвобождение нейротрофических факторов, метаболизм головного мозга, нейротрансмиссию, когнитивные функции (обучение и память). Поскольку Церебролизин проявляет не какой-то один, а все перечисленные эффекты, говорят о плейотропном действии данного препарата.
Нейрорегенерация включает в себя нейрогенез — усиление образования новых нейронов, ангиогенез — усиление образования новых сосудов, нейропластичность — стимуляцию образования аксонов, дендритов и синаптических контактов, функциональное нейровосстановление — частичное или полное восстановление нарушенных функций головного мозга (когнитивных, поведенческих и пр.).
Поскольку Церебролизин проявляет не какой-то один, а все компоненты нейротрофического действия — нейропротекцию и нейрорегенерацию, то говорят о мультимодальном действии данного препарата.
Новые данные о механизме действия
Длительное время в науке существовало мнение, что нервные клетки у взрослого человека не восстанавливаются. Предполагалось, что полное их количество закладывается на этапе созревания, включая юношеский возраст, и далее их число может только уменьшаться под воздействием различных повреждающих факторов или старения.
Поэтому настоящим прорывом в физиологии стало открытие того факта, что в головном мозге взрослых людей протекает нейрогенез — образование новых нейронов — под влиянием умственных и физических нагрузок, а также при введении ряда лекарственных средств, включая Церебролизин. Основными нейрогенными областями оказались субгранулярная зона (SGZ) зубчатой извилины гиппокампа и субвентрикулярная зона (SVZ) (выстилает боковые желудочки). После открытия нейрогенеза спектр исследований в данной сфере медицины стал интенсивно расти.
В более ранних работах было продемонстрировано, что Церебролизин усиливает нейрогенез опосредованно, за счет уменьшения апоптоза нервных клеток-предшественников (нервных стволовых клеток) в нейрогенных областях [20, 21].
Чуть позднее было выяснено, что Церебролизин способен прямо усиливать нейрогенез путем стимуляции нервных клеток-предшественников посредством PI3K/Akt пути сигнализации [22].
Сегодня стал известен еще один способ прямой стимуляции нейрогенеза Церебролизином — посредством активации Sonic hedgehog пути сигнализации (рис. 3).
Данный путь известен тем, что он отвечает за многие аспекты нормального эмбрионального развития, включая формирование и паттернирование (клеточный состав) нервной трубки. Например, при его избыточном функционировании возникает экзэнцефалия и спинальный дизрафизм (spina bifida), а при недостаточном — голопрозэнцефалия. У взрослых людей этот путь способствует стимуляции нервных клеток-предшественников [23].
Было показано, что активация Церебролизином этого пути приводит к стимуляции нервных клеток-предшественников и усилению нейрогенеза. Приятной неожиданностью стал также факт усиления олигодендрогенеза, поскольку образование олигодендроцитов способствует восстановлению белого вещества головного мозга (аксональное ремоделирование) [24].
Возможности применения Церебролизина при травматической болезни головного мозга как факторе риска развития болезни Альцгеймера
В связи с «молодостью» данной патологии практически нет исследований, в которых была бы специально оценена эффективность тех или иных лекарственных средств. По всей видимости, до сих пор эти больные просто оказывались в тех же группах, что и пациенты с обычной формой болезни Альцгеймера.
Выше, однако, уже было отмечено, что Ассоциация по вопросам лечения болезни Альцгеймера рекомендует использовать для лечения травматической болезни головного мозга как фактора риска развития болезни Альцгеймера те же подходы, что и при лечении обычной формы данного заболевания.
Эффективность Церебролизина при лечении болезни Альцгеймера была подтверждена во многих экспериментальных и клинических исследованиях. В частности, у трансгенных мышей (Thy1-APP-tg-мыши) было продемонстрировано, что Церебролизин уменьшает высвобождение β-амилоида во внеклеточный матрикс [17, 26]. В другой трансгенной модели (Thy1-APP-tg-мыши, которым инъецировали аденоассоциированный вирус AAV2, несущий мутантный tau-белок) была подтверждена способность препарата уменьшать внутриклеточное накопление гиперфосфорилированного tau-белка [27].
Очень важными оказались экспериментальные наблюдения, в которых Церебролизин уменьшает активацию микроглии, высвобождение провоспалительных цитокинов и эксайтотоксинов. Следовательно, Церебролизин уменьшает выраженность иммуноэксайтотоксичности, которая, как считают, лежит в основе многолетнего формирования травматической болезни головного мозга как фактора риска развития болезни Альцгеймера [18].
По состоянию на сегодняшний день клиническая эффективность Церебролизина при болезни Альцгеймера была оценена примерно в 10 рандомизированных контролируемых исследованиях; результаты 6 из них были обобщены в метаанализе 2014 г. [28, 29]. В 4 исследованиях, включенных в метаанализ, Церебролизин назначали в течение 1 месяца, в 1 исследовании — в течение 2 месяцев (1 месяц лечения, затем перерыв 2 месяца, затем снова 1 месяц лечения), в 1 исследовании — в течение 3 месяцев подряд. Таким образом, во всех исследованиях, включенных в метаанализ, длительность лечения составляла не менее 1 месяца. Препарат вводили в дозе 30 мл в течение 5 дней в неделю, 2 дня — перерыв. В метаанализ в общей сложности было включено 784 пациента.
Как известно, клинически у больных с болезнью Альцгеймера наблюдаются когнитивные нарушения, нарушения общеклинического функционирования, нарушения повседневной активности и поведенческие нарушения.
Когнитивные нарушения сводятся в основном к снижению памяти и исполнительных функций (внимательность, планирование, гибкость мышления, абстрактное мышление). Клинически их оценивают по таким шкалам, как ADAS-cog, ADAS-cog+, MMSE, ZVT. В ходе метаанализа, включавшего совокупную оценку по всем этим шкалам, было продемонстрировано, что лечение Церебролизином улучшало когнитивные функции спустя 1 месяц терапии (рис. 4) [28, 29].
При оценке нарушений общеклинического функционирования учитывают, как специфические домены (когнитивная сфера, речь, повседневная активность, бдительность, соматические функции и др.) влияют друг на друга и на функционирование пациентов в целом. С этой целью используют такие шкалы, как CIBIC+ и CGI. Как и в предыдущем случае, в метаанализе, включавшем совокупную оценку по всем этим шкалам, было показано, что лечение Церебролизином улучшало общеклиническое функционирование спустя 1 месяц терапии и спустя 6 месяцев последующего наблюдения (рис. 5) [28, 29].
/77.jpg)
В ходе выполнения метаанализа была подтверждена безопасность Церебролизина. Такие параметры, как «преждевременное прекращение терапии вследствие развития побочных эффектов», «пациенты по крайней мере с одним побочным эффектом», «пациенты по крайней мере с одним тяжелым побочным эффектом», практически не отличались от плацебо. Показатель «преждевременное прекращение терапии по любым причинам» был лишь немного выше в группе с Церебролизином по сравнению с плацебо [28, 29].
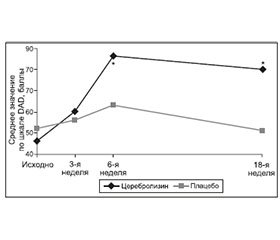
Нарушения повседневной активности заключаются в снижении способности самостоятельно выполнять обычные рутинные действия, такие как уход за собой (прием пищи, личная гигиена, одевание, уход за внешностью), работа, домашние дела, отдых. X.A. Álvarez и соавт. в обзоре 2011 г. [30] цитируют 11 исследований разного дизайна (некоторые из них являются частью или продолжением других), в 6 из которых было обнаружено положительное влияние Церебролизина на повседневную активность у пациентов с болезнью Альцгеймера, в 5 — нет. Таким образом, данные эффекты Церебролизина требуют дальнейшего подтверждения. Результаты одного из исследований, в котором было обнаружено положительное влияние Церебролизина на повседневную активность, представлены на рис. 6.
/78.jpg)
Поведенческие нарушения могут проявляться депрессией, апатией, раздражительностью, тревожным возбуждением, бредом. В том же обзоре 2011 г. [30] X.A. Álvarez и соавт. цитируют 5 исследований, в которых было обнаружено положительное влияние Церебролизина на поведенческие нарушения. Таким образом, данные эффекты препарата следует считать подтвержденными. Результаты одного из этих исследований представлены на рис. 7.
Сегодня исследователи выделяют два принципиально разных подхода к лечению таких хронических нейродегенеративных заболеваний, как болезнь Альцгеймера: симптоматическую терапию и болезнь-модифицирующую терапию (рис. 8). Симптоматическая терапия, как следует из названия, призвана устранить исключительно имеющиеся симптомы заболевания. При этом она лишь немного задерживает развитие болезни: вскоре больной достигает выраженных стадий инвалидизации, после чего наступает смерть. Болезнь-модифицирующая терапия направлена на улучшение долговременного прогноза при нейродегенеративных заболеваниях. Для нее характерны следующие признаки: уменьшение накапливаемых повреждений внутри головного мозга, снижение частоты и тяжести клинических рецидивов заболевания, замедление нарастания инвалидизации на длительное время. Выполненные к сегодняшнему дню исследования свидетельствуют о том, что назначение Церебролизина носит болезнь-модифицирующий характер при лечении болезни Альцгеймера [19, 25].
Таким образом, в клинических исследованиях, выполненных к сегодняшнему дню, было установлено, что Церебролизин уменьшает выраженность всех четырех вышеупомянутых групп нарушений при болезни Альцгеймера: когнитивных, общеклинического функционирования, повседневной активности и поведенческих (рис. 9). При этом данные, касающиеся влияния Церебролизина на повседневную активность, требуют дальнейшего подтверждения [17, 28].
Положительный опыт применения Церебролизина для лечения болезни Альцгеймера был отмечен также и в работах отечественных исследователей [34, 35].
Возможности применения Церебролизина при хронической травматической энцефалопатии
Поскольку и эта патология также относительно молода, нет специальных исследований, в которых была бы изучена клиническая эффективность лекарственных средств при данном виде деменции. С учетом близости клинической картины хронической травматической энцефалопатии и болезни Альцгеймера и вышеприведенных рекомендаций Ассоциации по вопросам лечения болезни Альцгеймера терапия этих двух заболеваний должна быть одинаковой.
О возможностях применения Церебролизина для лечения хронической травматической энцефалопатии было заявлено, в частности, в ходе 2-го Европейского конгресса по нейрореабилитации, проходившего вместе с 3-м Европейским тренингом по нейрореабилитации (26–28 июня 2013 г.). Профессор Rudi J. Castellani в докладе, посвященном современному пониманию хронической травматической энцефалопатии, отметил: «Одной из таких терапевтических возможностей может быть Церебролизин. Учитывая его плейотропные и, что особенно важно, нейротрофические эффекты, а также большое количество специальных исследований, в которых были продемонстрированы клинические преимущества данного препарата при нейродегенеративных заболеваниях, инсульте и нейротравме, Церебролизин может модулировать повреждающие эффекты прогрессирующей таупатии при хронической травматической энцефалопатии…» [36].
Эффективность Церебролизина при таупатиях (накопление гиперфосфорилированного tau-белка преимущественно без накопления β-амилоида) была подтверждена, например, в экспериментальном исследовании у дважды трансгенных мышей (Thy1-Tau/GSK3β дважды tg-мыши) с моделью фронтотемпоральной лобарной дегенерации. В этой работе была подтверждена способность препарата уменьшать внутриклеточное накопление гиперфосфорилированного tau-белка [37].
Большое значение имеют экспериментальные исследования, в которых была продемонстрирована способность Церебролизина уменьшать выраженность иммуноэксайтотоксичности при хроническом травматическом повреждении головного мозга. В частности, этот эффект опосредуется за счет уменьшения активации астроцитов [38]. Таким образом, Церебролизин ослабляет воспаление, многолетнее течение которого, как полагают, приводит к развитию данной формы деменции.
Ожидается, что клиническая эффективность Церебролизина при хронической травматической энцефалопатии будет сравнима с таковой при болезни Альцгеймера (см. выше).
Схема назначения Церебролизина
По состоянию на сегодняшний день схема лечения травматической болезни головного мозга как фактора риска развития болезни Альцгеймера должна быть такой же, как и обычной болезни Альцгеймера. Препарат назначают 5 дней в неделю в течение 4 недель (1 цикл). Таких циклов в течение года должно быть 2–4. Доза препарата составляет от 10 (при наличии только когнитивных расстройств) до 30 мл (при наличии поведенческих расстройств) в день [17].
Хроническая травматическая энцефалопатия должна лечиться, по-видимому, таким же образом.
Заключение
В новых исследованиях было продемонстрировано, что однократное умеренное или тяжелое ТПГМ может приводить к развитию посттравматической деменции, обычно по типу болезни Альцгеймера, в то время как многократное легкое ТПГМ способно вызывать развитие хронической травматической энцефалопатии. С учетом того, что эти клинические диагнозы были верифицированы относительно недавно, по состоянию на сегодняшний день практически нет специальных исследований, в которых была бы изучена эффективность тех или иных лекарственных средств. Однако, исходя из опыта лечения обычной формы болезни Альцгеймера и учитывая современные рекомендации по ведению посттравматических деменций, представляется целесообразным назначать таким больным Церебролизин — препарат, содержащий фрагменты нейротрофических факторов с доказанным нейропротективным и нейрорегенераторным действием. Как следствие, ожидаются высокие клинические результаты с уменьшением выраженности когнитивных и поведенческих нарушений, улучшением повседневной активности и общеклинического функционирования.
Список литературы
1. Smith D.H., Johnson V.E., Stewart W. Chronic neuropathologies of single and repetitive TBI: substrates of dementia? / Nat. Rev. Neurol. — 2013. — V. 9, № 4. — P. 211-221.
2. Шевага В.Н. Ранние и отдаленные последствия черепно-мозговой травмы: медико-социальные аспекты и возможности нейропротекции / Здоров’я України. — 2009. — № 5/1. — С. 45.
3. Dementia resulting from traumatic brain injury: what is the pathology? / Shively S., Scher A.I., Perl D.P., Diaz-Arrastia R. // Arch. Neurol. — 2012. — V. 69, № 10. — P. 1245-1251.
4. Head injury as a risk factor for Alzheimer’s disease: the evidence 10 years on a partial replication / Fleminger S., Oliver D.L., Lovestone S. et al. // J. Neurol. Neurosurg. Psychiatry. — 2003. — V. 74, № 7. — P. 857-862.
5. Head injury and the risk of AD in the MIRAGE study / Guo Z., Cupples L.A., Kurz A. et al. // Neurology. — 2000. — V. 54, № 6. — P. 1316-1323.
6. Documented head injury in early adulthood and risk of Alzheimer’s disease and other dementias / Plassman B.L., Havlik R.J., Steffens D.C. et al. // Neurology. — 2000. — V. 55, № 8. — P. 1158-1166.
7. Institute of Medicine Committee on Gulf War and Health. Volume 7: Long-Term Consequences of Traumatic Brain Injury. — Washington, DC: National Academies Press, 2009. — P. 214.
8. Faden A.I., Loane D.J. Chronic Neurodegeneration After Traumatic Brain Injury: Alzheimer Disease, Chronic Traumatic Encephalopathy, or Persistent Neuroinflammation? // Neurotherapeutics. — 2014. — Nov 25 [Epub ahead of print].
9. Kahn H.A., Sempos C.T. Attributable Risk: Statistical Methods in Epidemiology. — New York: Oxford University Press, 1989. — P. 72-84.
10. Jordan B.D. The clinical spectrum of sport-related traumatic brain injury // Nat. Rev. Neurol. — 2013. — V. 9, № 4. — P. 222-230.
11. Tauopathy PET and amyloid PET in the diagnosis of chronic traumatic encephalopathies: studies of a retired NFL player and of a man with FTD and a severe head injury / Mitsis E.M., Riggio S., Kostakoglu L. et al. // Transl. Psychiatry. — 2014. — V. 16, № 4. — e441.
12. Johnson V.E., Stewart W., Smith D.H. Widespread τ and amyloid-β pathology many years after a single traumatic brain injury in humans // Brain Pathol. — 2012. — V. 22, № 2. — P. 142-149.
13. Patterson Z.R., Holahan M.R. Understanding the neuroinflammatory response following concussion to develop treatment strategies // Front Cell Neurosci. — 2012. — V. 6, № 58. — doi: 10.3389/fncel.2012.00058.
14. Blaylock R.L., Maroon J. Immunoexcitotoxicity as a central mechanism in chronic traumatic encephalopathy-A unifying hypothesis // Surg. Neurol. Int. — 2011. — V. 2, № 107. — doi: 10.4103/2152-7806.83391.
15. Traumatic Brain Injury (TBI) Topic Sheet — Alzheimer's Association. — 2012. www.alz.org.
16. Bornstein N., Poon W.S. Accelerated recovery from acute brain injuries: clinical efficacy of neurotrophic treatment in stroke and traumatic brain injuries // Drugs Today (Barc). — 2012. — V. 48 (Suppl. A). — P. 43-61.
17. Cerebrolysin — product monograph // EVER Neuro Pharma. — 2010. — 84 p.
18. Álvarez X.A., Figueroa J., Muresanu D. Peptidergic Drugs for the Treatment of Traumatic Brain Injury // Future Neurology. — 2013. — V. 8, № 2. — P. 175-192.
19. Савустьяненко А.В. Эффекты Церебролизина и их значение // Международный неврологический журнал. — 2013. — Т. 2, № 56. — http://www.mif-ua.com/archive/article/35694.
20. The dentate gyrus neurogenesis: a therapeutic target for Alzheimer’s disease / Tatebayashi Y., Lee M.H., Li L. et al. // Acta Neuropathol. — 2003. — V. 105, № 3. — P. 225-232.
21. Effects of Cerebrolysin on neurogenesis in an APP transgenic model of Alzheimer’s disease / Rockenstein E., Mante M., Adame A. et al. // Acta Neuropathol. — 2007. — V. 113, № 3. — P. 265-275.
22. Cerebrolysin enhances neurogenesis in the ischemic brain and improves functional outcome after stroke / Zhang C., Chopp M., Cui Y. et al. // J. Neurosci. Res. — 2010. — V. 88, № 15. — P. 3275-3281.
23. Murdoch J.N., Copp A.J. The relationship between sonic Hedgehog signaling, cilia, and neural tube defects // Birth Defects Res. A. Clin. Mol. Teratol. — 2010. — V. 88, № 8. — P. 633-652.
24. Sonic hedgehog signaling pathway mediates cerebrolysin-improved neurological function after stroke / Zhang L., Chopp M., Meier D.H. et al. // Stroke. — 2013. — V. 44, № 7. — P. 1965-1972.
25. Церебролизин: клиническое применение при травматическом повреждении головного мозга // EVER Neuro Pharma. — 2014. — 24 с.
26. Cerebrolysin decreases amyloid-beta production by regulating amyloid protein precursor maturation in a transgenic model of Alzheimer's disease / Rockenstein E., Torrance M., Mante M. et al. // J. Neurosci. Res. — 2006. — V. 83, № 7. — P. 1252-1261.
27. Neurofibrillary and neurodegenerative pathology in APP-transgenic mice injected with AAV2-mutant TAU: neuroprotective effects of Cerebrolysin / Ubhi K., Rockenstein E., Doppler E. et al. // Acta Neuropathol. — 2009. — V. 117, № 6. — P. 699-712.
28. Cerebrolysin in mild to moderate Alzheimer's disease: a meta-analysis of randomized controlled clinical trials / Gauthier S., Proano J.V., Jia J. et al. // Journal of Dementia and Geriatric Cognitive Disorders. — 2014 (accepted for publication).
29. Cerebrolysin: treatment of cognitive impairment and dementia // EVER Neuro Pharma. — 2014. — 84 p.
30. Álvarez X.A., Fuentes P. Cerebrolysin in Alzheimer's disease // Drugs Today (Barc). — 2011. — V. 47, № 7. — P. 487-513.
31. Muresanu D.F., Rainer M., Moessler H. Improved global function and activities of daily living in patients with AD: a placebo-controlled clinical study with the neurotrophic agent Cerebrolysin // J. Neural Transm. Suppl. — 2002. — V. 62. — P. 277-285.
32. Allegri R.F., Guekht A. Cerebrolysin improves symptoms and delays progression in patients with Alzheimer’s disease and vascular dementia // Drugs Today (Barc). — 2012. — V. 48, Suppl. A. — P. 25-41.
33. A 28-week, double-blind, placebo-controlled study with Cerebrolysin in patients with mild to moderate Alzheimer’s disease / Ruether, E., Husmann, R., Kinzler, E. et al. // Int. Clin. Psychopharmacol. — 2001. — V. 16, № 5. — P. 253-263.
34. Бачинская Н.Ю. Болезнь Альцгеймера // Доктор. — 2002. — № 5. — С. 27-30.
35. Полетаева К.Н., Холин В.А., Бачинская Н.Ю. Опыт применения Церебролизина у больных болезнью Альцгеймера и сосудистой деменцией // Международный неврологический журнал. — 2009. — Т. 6, № 28. — http://www.mif-ua.com/archive/article/11427
36. Castellani R.J. Chronic traumatic encephalopathy: a case series with review of current understanding // 2nd European Neurorehabilitation Congress in conjunction with the 3rd European Teaching Course on Neurorehabilitation. — Bucharest, 2013. June 26-28. — P. 27.
37. Cerebrolysin™ efficacy in a transgenic model of tauopathy: role in regulation of mitochondrial structure / Rockenstein E., Ubhi K., Trejo M. et al. // BMC Neuroscience. — 2014. — V. 15, № 90. — doi:10.1186/1471-2202-15-90.
38. Cerebrolysin attenuates astrocyte activation following repetitive mild traumatic brain injury: implications for chronic traumatic encephalopathy / Kang H.B., Kim G., Kim H. et al. // Journal of Life Science. — 2013. — V. 23, № 9. — P. 1096-1103.
/74.jpg)
/76.jpg)
/78.jpg)

/71.jpg)
/72.jpg)
/73.jpg)
/75.jpg)
/76_2.jpg)
/77.jpg)
/78_2.jpg)