Международный неврологический журнал 4 (82) 2016
Вернуться к номеру
Клініко-нейрофізіологічні особливості у хворих на міастенію залежно від структурних змін тимуса
Авторы: Товажнянська О.Л., Самойлова Г.П. - Харківський національний медичний університет, м. Харків, Україна; ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України», м. Харків, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
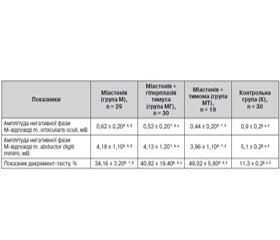
Для вивчення особливостей клінічного перебігу й порушення нервово-м’язової передачі в пацієнтів з міастенією залежно від структурних змін тимуса були проаналізовані результати клініко-нейрофізіологічного обстеження 78 хворих. Матеріали та методи. Залежно від структурних змін тимуса всі хворі були поділені на 3 групи. Перша група — 29 пацієнтів з міастенією без змін структури тимуса. Друга група — 30 пацієнтів, у яких міастенія супроводжувалася гіперплазією тимуса. Третя група — 19 хворих з міастенією на фоні тимоми. Ступінь тяжкості захворювання оцінювався за допомогою кількісної шкали тяжкості клінічних проявів міастенії (QMGS) та клінічної класифікації Myathenia Gravis Foundation of America (MGFA), 2001. Оцінка нервово-м’язової передачі проводилася на підставі аналізу результатів декремент-тесту та амплітуди негативної фази М-відповіді при низькочастотній непрямій супрамаксимальній стимуляції m. abductor digiti minimi та m. orbicularis oculi. Результати та висновки. Зміни структури тимуса негативно впливають на перебіг міастенії, про що свідчать показники за шкалою QMGS та класифікацією MGFA. Найбільша тяжкість захворювання (з переважанням ураження бульбарної групи м’язів) поєднувалася із наявністю у хворих тимоми, а найменша відзначалась у хворих з нормальною структурою тимуса. Переважання пацієнтів жіночої статі в групі хворих з міастенією на тлі гіперплазії тимуса може свідчити про вплив гормонального статусу як на структуру вилочкової залози з розвитком її гіперплазії, так і на перебіг міастенії, що потребує подальшого вивчення. Простежена пряма залежність між структурними змінами в тимусі та зниженням амплітуди негативної фази М-відповіді, що свідчить про негативний вплив морфологічних порушень тимуса на нервово-м’язову передачу імпульсів. Значне зниження амплітуди негативної фази М-відповіді на фоні високих показників декремент-тесту можна вважати маркером тяжкого перебігу захворювання.
Для изучения особенностей клинического течения и нарушения нервно-мышечной передачи у пациентов с миастенией в зависимости от структурных изменений тимуса были проанализированы результаты клинико-нейрофизиологического обследования 78 больных. Материалы и методы. В зависимости от структурных изменений тимуса все больные были разделены на 3 группы. Первая группа — 29 пациентов с миастенией без изменений структуры тимуса. Вторая группа — 30 пациентов, у которых миастения сопровождалась гиперплазией тимуса. Третья группа — 19 больных с миастенией на фоне тимомы. Степень тяжести заболевания оценивалась с помощью количественной шкалы тяжести клинических проявлений миастении (QMGS) и клинической классификации Myathenia Gravis Foundation of America (MGFA), 2001. Оценка нервно-мышечной передачи проводилась на основании анализа результатов декремент-теста и амплитуды негативной фазы М-ответа при низкочастотной косвенной супрамаксимальной стимуляции m. аbductor digiti minimi и m. оrbicularis oculi. Результаты и выводы. Изменения структуры тимуса негативно влияют на ход миастении, о чем свидетельствуют показатели по шкале QMGS и классификации MGFA. Наибольшая тяжесть заболевания (с преобладанием поражения бульбарной группы мышц) сочеталась с наличием у больных тимомы, а наименьшая отмечалась у больных с нормальной структурой тимуса. Преобладание пациентов женского пола в группе больных с миастенией на фоне гиперплазии тимуса может свидетельствовать о влиянии гормонального статуса как на структуру вилочковой железы с развитием ее гиперплазии, так и на ход миастении, что требует дальнейшего изучения. Прослежена прямая зависимость между структурными изменениями в тимусе и снижением амплитуды негативной фазы М-ответа, что свидетельствует о негативном влиянии морфологических нарушений тимуса на нервно-мышечную передачу импульсов. Значительное снижение амплитуды негативной фазы М-ответа на фоне высоких показателей декремент-теста можно считать маркером тяжелого течения заболевания.
To study the features of clinical course and disorders of neuromuscular transmission in patients with myasthenia gravis depending on the structural changes in the thymus, we have analyzed the results of clinical and neurophysiological examination of 78 patients. Materials and methods. Depending on the structural changes in the thymus, all patients were divided into 3 groups. The first group — 29 patients with myasthenia gravis and no changes in the structure of the thymus. The second group — 30 patients, in whom myasthenia gravis was associated with thymic hyperplasia. The third group — 19 patients with myasthenia gravis against the background of thymoma. The severity of the disease was assessed using quantitative myasthenia gravis score (QMGS) and clinical classification of Myathenia Gravis Foundation of America (MGFA), 2001. Evaluation of neuromuscular transmission was conducted based on the analysis of decrement test results and amplitude of negative phase of M-response at low-frequency indirect supramaximal stimulation of m.abductor digiti minimi and m.orbicularis oculi. Results and conclusions. Changes in the structure of the thymus have a negative impact on the course of myasthenia gravis, as evidenced by indicators of QMGS and MGFA classification. The greatest disease severity (with the prevalence of lesions of bulbar muscles) was associated with the presence of thymoma in patients, and the lowest one was noted in patients with normal thymic structure. The predominance of females in the group of patients with myasthenia gravis against the background of thymic hyperplasia may indicate the influence of hormonal state both on the structure of the thymus gland with the development of hyperplasia, and on the course of myasthenia gravis, which requires further study. We have noted a direct correlation between structural changes in the thymus and reduced amplitude of the negative phase of M-response, indicating a negative effect of morphological disorders of the thymus on neuromuscular transmission of impulses. A significant reduction in the amplitude of the negative phase of M-response on the background of high performance of decrement test may be considered as a marker of a severe course of the disease.
міастенія, гіперплазія тимуса, тимома, електроміографія, декремент-тест.
миастения, гиперплазия тимуса, тимома, электромиография, декремент-тест.
myasthenia gravis, thymic hyperplasia, thymoma, electromyography, decrement test.
Статтю опубліковано на с. 49-53
Вступ
Матеріали та методи
Результати дослідження та їх обговорення
Висновки
1. Касаткина Л.Ф. Электромиографические методы исследования в диагностике нервно-мышечных заболеваний. Игольчатая электромиография / Л.Ф. Касаткина, О.В. Гильванова. — СПб.: Медика, 2010. — 416 с.
2. Клинико-иммунологические особенности у пациентов в зависимости от структуры тимуса / [Е.Л. Товажнянская, E.М. Климова, А.П. Самойлова и др.] // Неврология и нейрохирургия. Восточная Европа. — 2015. — № 4 (28). — С. 15-23.
3. Кузьмина Л.Н. Диагностические возможности электронейромиографии при миастении / Л.Н. Кузьмина, В.Н. Василенко // Український медичний альманах. — 2009. — Т. 12, № 1. — С. 107-109.
4. Кузьмина Л.Н. Клинико-иммунологическая характеристика разных форм миастении в сочетании с нейросоматическими расстройствами: Автореф. дис… канд. мед. наук: спец. 14.01.15 «нервные болезни» / Кузьмина Л.Н. — Харьков, 2010. — 21 с.
5. Николаев С.Г. Практикум по клинической электромиографии / С.Г. Николаев. — Иваново: Ивановская государственная медицинская академия, 2003. — 264 с.
6. Оржешковський В.В. Сучасні підходи до діагностики та лікування міастенії гравіс / В.В. Оржешковський // Ліки України. — 2011. — № 9 (155). — С. 81-83.
7. Романова Т.В. Диагностическая и прогностическая значимость исследования надежности нервно-мышечной передачи при миастении [Електронний ресурс] / Т.В. Романова // Практическая медицина. — 2013. — Режим доступу до ресурсу: http://pmarchive.ru/diagnosticheskaya-i-prognosticheskaya-znachimost-issledovaniya-nadezhnosti-nervno-myshechnoj-peredachi-pri-miastenii
8. Школьник В.М. Миастения: что нам известно сегодня? [Електронний ресурс] / В.М. Школьник, А.И. Кальбус, О.Д. Шульга // Здоров’я України. — 2010. — Режим доступу до ресурсу: http://health-ua.com/pics/pdf/ZU_2010_Nevro_3/10-11.pdf
9. EFNS/ENS Guidelines for the treatment of ocular myasthenia / E. Kertya, A. Elsaisa, Z. Argovc [et al.] // European Journal of Neurology. — 2014. — № 2. — Р. 687-693. doi: 10.1111/ene.12359.
10. Masaharu T. Structure of the neuromuscular junction: functionand cooperative mechanisms in the synapse / Takamori Masaharu // Ann. NY Acad. Sci. — 2012. — Vol. 1274. — P. 14-23.

/51.jpg)