Вступ
Гетеротопічна осифікація (ГО) — це формування пластинчастої кісткової тканини за межами скелета, в м’яких тканинах, які в нормі не мають остеогенних властивостей. ГО розташована навколо великих суглобів і не з’єднана з окістям [8]. У літературі ХХ століття ГО часто зустрічається за назвою «осифікуючий міозит». Проте на сьогодні значення цього терміну переглянуто, що обумовлено, в першу чергу, розумінням патогенетичних процесів розвитку ГО. Термін «осифікуючий міозит» застосовується тільки у випадку розвитку кісткової тканини в травмованих м’язах із наявністю чіткого зв’язку між травмою м’язів і формуванням ектопічної кісткової тканини. В інших випадках первинне ушкодження м’язів не є обов’язковим попередником для розвитку осифікату, крім того, ГО виникає не тільки в м’язовій тканині, часто залучаються фасції, сухожилки та інші мезенхімальні м’які тканини, тому узагальнюючим терміном є «гетеротопічна осифікація».
Сьогодні не існує універсальної єдиної класифікації ГО, проте в більшості робіт виділяють три типи ГО залежно від походження:
1. Генетично обумовлена ГО — прогресуюча фіброзна дисплазія (Fibrodysplasia ossificans progressive).
2. Травматичний осифікуючий міозит (розвиток ектопічної кісткової тканини в ушкоджених м’язах).
3. Гетеротопічна осифікація, причина якої натепер не відома.
Утворення ектопічної кісткової тканини може виникати при різних захворюваннях, не пов’язаних спільною етіологією чи відомими патогенетичними механізмами, що й обумовлює складності в діагностиці цієї патології. Провідні чинники ризику виникнення ГО наведені в табл. 1.
У пацієнтів з ушкодженням центральної нервової системи (ЦНС) формування ектопічної кісткової тканини зараховують до нейрогенної ГО. Виділення таких випадків в окрему групу обумовлено особливостями хворих. Порушення рухової та чутливої функцій внаслідок травми ЦНС призводить до пізньої діагностики ГО й частих діагностичних помилок. Частота нейрогенної ГО в пацієнтів з ушкодженням спинного мозку варіює від 10 до 78 % за даними різних літературних джерел, що обумовлено різними методами виявлення осифікатів і різними критеріями діагностики [9].
Діагностика ГО базується переважно на клінічній картині. Початок розвитку ГО в пацієнтів із травмою хребта та спинного мозку (ТХСМ) може не супроводжуватися суб’єктивними відчуттями або проявлятися як підвищення температури тіла та спастичності. При огляді в зоні росту осифікату відзначається щільний, часто гіперемований набряк. Локалізація ГО залежить від рівня ушкодження спинного мозку. ГО завжди локалізуються нижче від зони ураження навколо великих суглобів, але без залучення окістя. Переважною локалізацією є кульшові та колінні суглоби в пацієнтів з ушкодженням спинного мозку на рівні шийного та грудного відділів хребта, ліктьові суглоби при ураженні на шийному рівні, інші локалізації зустрічаються значно рідше. Набряк розташовується навколо суглобів із залученням прилеглих ділянок кінцівок (частіше стегна, гомілки) й суттєво обмежує рухи в суглобах. Набряк кінцівки та підвищення спастичності не дає можливості акцентувати увагу на зменшенні амплітуди пасивних рухів у суглобах. Загалом клінічна картина нагадує клініку тромбозу вен нижніх кінцівок, що призводить до частих діагностичних помилок, особливо за умови неможливості проведення ультразвукової діагностики судин і відсутності інформованості лікарів про інші можливі причини виникнення вказаної симптоматики. Терміни виникнення ГО — 3–12 тижнів після ТХСМ — також не сприяють вчасній діагностиці захворювання, тому що в цей період пацієнт переважно знаходиться вдома, лікування в нейрохірургічному відділенні вже завершене й ще не розпочаті реабілітаційні заходи [2, 4, 5, 9, 10].
Виділені деякі додаткові чинники ризику розвитку ГО в пацієнтів із ТХСМ, а саме повне ушкодження спинного мозку, високий рівень спастичності, інфекційні захворювання дихальних і сечовивідних шляхів [9]. Але питання, чи це додаткові фактори чи тільки прояви тяжкості ушкодження спинного мозку як єдиного предиктора розвитку ГО, залишається дискутабельним.
Є ще одне дискутабельне питання: чи необхідне ушкодження тканин саме в ділянці розвитку осифікату в ролі провокуючого фактора? Тісного зв’язку між ГО та попередньою травмою м’яких тканин не знайдено ні в літературі, ні при опитуванні обстежених пацієнтів, проте виражений руховий дефіцит, спастичність та відсутність чутливості можуть приховати незначні травми, а порушення іннервації тканин — скласти сприятливі умови для формування ГО. З іншого боку, типова локалізація та терміни початку розвитку ГО вказують на системні процеси в організмі, обумовлені ТХСМ, і не враховують додаткового провокуючого фактора.
Як і більшість ускладнень ТХСМ, ГО не викликає специфічних скарг і не має чітких клінічних ознак. При осифікатах невеликих розмірів може бути відсутнім гіперемований набряк і підвищення температури тіла, проте такі осифікати не викликають суттєвого зменшення обсягу рухів у суглобах і не змінюють якості життя у пацієнтів із ТХСМ. Тому особливу увагу слід приділити діагностиці великих, клінічно значущих осифікатів на ранньому етапі, що дало б можливість попередити мінералізацію матриксу осифікату й зберегти обсяг рухів у суглобах і відновний потенціал пацієнта.
Сьогодні основним методом діагностики ГО будь-якого походження є рентгенографія, що візуалізує сформований осифікат. На дорентгеноконтрастній стадії ГО діагностичні можливості обмежені. Зростання інтересу до діагностики ГО пов’язане з поширенням відновних оперативних втручань на опорно-руховому апараті, зокрема ендопротезувань, та, відповідно, збільшенням числа їхніх ускладнень.
Під час формування осифікату зафіксовано підвищення показників запалення та зміни маркерів ремоделювання кісткової тканини, як формування, так і резорбції. Згідно з німецьким дослідженням, опублікованим у 2016 році, в якому були проаналізовані випадки ГО в пацієнтів із ТХСМ за період 2004–2013 рр., підвищення температури тіла в поєднанні зі збільшеними рівнями С-реактивного білка та креатинкінази розцінювалось як ознаки розвитку ГО [11]. Вказані пацієнти перебували в умовах стаціонару, й їм було проведене комплексне інструментальне дослідження, що виключало будь-які інші причини запальної реакції [11].
Маркери метаболізму кісткової тканини змінюються під впливом багатьох факторів: і самої ТХСМ, і оперативного втручання (у випадку ендопротезування), та змінюються з тривалістю посттравматичного чи пост–операційного періоду, що й обумовлює, на нашу думку, суттєві відмінності літературних даних. У дослідженні О.А. Trentz et al. (2005), де було обстежено 80 пацієнтів із черепно-мозковою травмою та ГО, отримано протилежні результати. Маркери формування кісткової тканини були значно збільшені, а маркери резорбції знижені порівняно з пацієнтами без ГО [6]. Отримані дані підтверджували одну з провідних теорій формування осифікатів — теорію дисбалансу між проостеоіндуктивними та антиостеоіндуктивними факторами [7]. Змін маркерів метаболізму кісткової тканини, що були б характерними для пацієнтів із ГО на фоні ТХСМ, у літературі не знайдено. ГО в пацієнтів із ТХСМ на етапі формування осифікату діагностується досить рідко, що обумовлено неспецифічністю клінічної картини та коротким періодом (від 3 тижнів до 2 місяців). Як приклад, можна навести дослідження, проведене у відділенні спинного мозку відділу загальної й травматологічної хірургії університетської лікарні Рурського університету міста Бергманшейль у Німеччині, де за 10 років спостереження для вивчення гострофазових показників запалення було виділено всього 15 пацієнтів із ТХСМ та ГО [11].
Метою нашого дослідження стало визначення особливостей ремоделювання кісткової тканини в пацієнтів із ТХСМ і виділення показників, специфічних для розвитку ГО.
Матеріали та методи
У результаті співпраці Української асоціації остеопорозу та Асоціації інвалідів-спінальників України було оглянуто 106 пацієнтів із травмою хребта та спинного мозку. Ступінь ушкодження спинного мозку визначали згідно з AIS (ASIA Impairment Scale — шкала ушкодження Американської асоціації травми спинного мозку). Серед обстежених пацієнтів було 87 осіб із повним поперечним ураженням спинного мозку (AIS A) і 19 — із частковим ураженням спинного мозку (AIS B, C), з давністю травми від 3 місяців до 7 років. Після клінічного обстеження ознаки ГО були виявлені в 19 (18 %) пацієнтів. При проведенні рентгенографії ГО підтверджена в усіх 19 хворих.
Серед пацієнтів із ГО у 18 — повне поперечне ушкодження спинного мозку (11 пацієнтів — травма на рівні шийного відділу, 7 — на рівні грудного відділу хребта), в 1 пацієнтки часткове ушкодження спинного мозку на рівні шийного відділу хребта з тяжким правобічним і легким лівобічним геміпарезом (АІS С).
Пацієнти відрізнялись також за кількістю осифікатів. У 5 пацієнтів діагностовано множинні осифікати різного розміру на рівні паравертебральних м’язів, кульшових і колінних суглобів; у 4 пацієнтів — симетричні осифікати на рівні кульшових або колінних суглобів; у 6 пацієнтів — один осифікат на рівні кульшових суглобів; у 3 пацієнтів — один осифікат на рівні колінного суглоба; в 1 пацієнтки (АІS С) — осифікат на рівні ліктьового суглоба в паретичній кінцівці. Масивні множинні осифікати не були діагностовані в пацієнтів із тривалістю посттравматичного періоду понад 3 роки. Серед пацієнтів із ГО були виділені хворі з ознаками росту осифікатів: наявність твердого набряку та/або гіперемія в навколосуглобових ділянках. Тривалість посттравматичного періоду в цієї когорти хворих становила не більше 12 місяців.
У відділі клінічної фізіології та патології опорно-рухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» проведено дослідження особливостей ремоделювання кісткової тканини в пацієнтів із ТХСМ і ГО.
Критерії включення:
1. Наявність клінічних ознак розвитку ГО.
2. Тривалість посттравматичного періоду до 12 місяців.
Критерії виключення:
1. Пацієнти з інфекційними ускладненнями хребетно-спинномозкової травми в гострій стадії.
2. Пацієнти із супутніми масивними травмами кістково-м’язової системи.
3. Пацієнти з ендокринними розладами, що могли би впливати на кальцієвий обмін або потребували б спеціальної терапії (цукровий діабет, гіпотиреоз), прийом глюкокортикостероїдів та антиконвульсантів.
Серед обстежених пацієнтів критеріям включення/виключення відповідали 11 хворих.
Було обстежено 11 пацієнтів із ТХСМ (AIS A, B) та ГО з ознаками росту осифікату й тривалістю посттравматичного періоду від 3 до 12 місяців — група І (n = 11, середній вік — 25,5 ± 1,3 року, тривалість посттравматичного періоду — 6,4 ± 1,3), 12 пацієнтів із ТХСМ без ГО (середній вік — 27,2 ± 1,4 року, тривалість посттравматичного періоду — 6,0 ± 0,8) — група ІІ. Пацієнти в обох групах були порівнянні за віком, тривалістю посттравматичного періоду, ступенем неврологічних проявів. Також було обстежено 23 практично здорові особи відповідного віку та статі (середній вік — 29,4 ± 1,4) — група ІІІ.
Визначення маркерів ремоделювання кісткової тканини в периферичній крові (остеокальцину, пропептидів проколагену І типу (P1NP), С-телопептиду зшивок колагену І типу (β-CTx)) проводилося електрохемілюмінесцентним методом на аналізаторі Eleсsys 2010 (Roche Diagnostics, Німеччина) за допомогою тест-систем Cobas.
Статистичний аналіз проводили із застосуванням програм Statistica 10 і SPSS Statistics 17. Результати подані як середні величини (M ± m). Різницю показників між групами встановлювали за допомогою однофакторного дисперсійного аналізу ANOVA. Міжгрупові відмінності оцінювали за допомогою тесту Шеффе. Різницю показників вважали вірогідною при р < 0,05.
З метою визначення порогових значень маркерів метаболізму кісткової тканини, що могли б стати критерієм формування та продовження росту ГО, було застосовано ROC-аналіз із визначенням індексу Йодена.
Результати та обговорення
Виражений руховий дефіцит внаслідок ТХСМ викликає зміни в кістковій тканині, обумовлені багатьма факторами, зокрема відсутністю гравітаційного навантаження, порушенням вегетативної іннервації та гормональними змінами в гострому періоді травми. Зміни маркерів ремоделювання кісткової тканини в пацієнтів із ТХСМ подані в табл. 2.
У пацієнтів із ТХСМ без ГО процеси резорбції та формування рівномірно прискорені, зокрема значення показника β-CTх збільшені в 2,8 раза відносно значень у групі практично здорових осіб і в 2,3 раза щодо нормативних значень; маркер формування кісткової тканини (P1NP) збільшений у 2,7 раза щодо практично здорових осіб та перевищує нормативні значення в 2,3 раза. Рівень остеокальцину в пацієнтів із ТХСМ без ГО не відрізняється від такого у практично здорових осіб та знаходиться в рамках нормативних значень.
У пацієнтів з осифікатами переважають процеси формування кісткової тканини. Рівень маркерів ремоделювання кісткової тканини вірогідно перевищує значення в практично здорових осіб і пацієнтів із ТХСМ без ГО (табл. 2). Так, у хворих із ГО рівень P1NP вищий у 8,2, β-CTх — у 3,9, а остеокальцину — у 3,5 раза порівняно з пацієнтами з ТХСМ без ГО.
Отже, ТХСМ характеризується як підвищенням процесів резорбції, так і формуванням кісткової тканини з переважанням процесів резорбції, тоді як ТХСМ із ГО супроводжується значним переважанням процесів формування кісткової тканини над резорбцією. Відмінністю метаболізму кісткової тканини, характерною для ГО в пацієнтів із ТХСМ, є значне підвищення, що перевищує в декілька разів (три й більше) нормативні значення, рівня маркеру формування (P1NP) і збільшення нормативних значень сироваткового рівня остеокальцину. Проведене дослідження дало можливість виділити зміни маркерів ремоделювання кісткової тканини, що свідчать про розвиток ГО та можуть використовуватись як рання діагностика ГО.
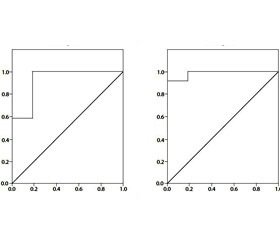
На наступному етапі дослідження були визначені відрізні точки маркерів формування кісткової тканини як предикторів формування ГО. За результатами проведеного аналізу, індекс Йодена для P1NP становить 187,3 нг/мл, чутливість — 94 %, специфічність — 90 %, площа під кривою (AUROC) — 0,97; 95% довірчій інтервал (ДІ) — 0,867–0,981, p < 0,0001 (рис. 1). Індекс Йодена для остеокальцину — 49,6 нг/мл (чутливість — 97,1 %, специфічність — 90,1 %, площа під кривою (AUROC) — 0,99; 95% ДІ = 0,965–1,000, p < 0,0001) (рис. 2).
Згідно з отриманими даними, рівень P1NP ≥
≥ 187,3 нг/мл і остеокальцину ≥ 49,6 нг/мл можна розглядати як вірогідний предиктор розвитку ГО в пацієнтів із ТХСМ.
За результатами дослідження був створений алгоритм ранньої діагностики ГО у пацієнтів із ТХСМ (рис. 3).
/92-1.jpg )
Підвищення сироваткових рівнів маркерів формування кісткової тканини при формуванні осифікатів є закономірним, проте лише поодинокі дослідження пропонують використовувати ці показники для діагностики ГО. В дослідженні J.M. Wilkinson et al. (2003) підвищення β-CTх більш як на 42 %, рівня P1NP більше ніж на 57 % і остекальцину більше ніж на 13 % через тиждень після ендопротезування кульшового суглоба розцінюється як предиктор формування ГО [12]. Проте для встановлення діагнозу за цією методикою необхідні вихідні дані маркерів ремоделювання кісткової тканини, що неможливо для пацієнтів із ТХСМ. На відміну від теорії дисбалансу формування та резорбції кісткової тканини як причини розвитку ГО в нашому дослідженні отримані високі рівні як маркерів формування, так і маркерів резорбції. Проте як предиктори формування ГО використані маркери формування, оскільки високий маркер резорбції є характерним для пацієнтів із ТХСМ незалежно від наявності ГО.
Висновки
1. Розвиток ГО в пацієнтів із ТХСМ характеризується значним підвищенням формування кісткової тканини порівняно з практично здоровими особами та пацієнтами із ТХСМ без ГО.
2. Показники маркера формування кісткової тканини P1NP ≥ 187,3 нг/мл та рівень остеокальцину ≥ 49,6 нг/мл можна розглядати як вірогідний пре–диктор розвитку ГО в пацієнтів із ТХСМ.
3. Запропонований алгоритм ранньої діагностики ГО в пацієнтів із ТХСМ дасть можливість попередити мінералізацію м’якотканинної основи осифікату та розвиток контрактур суглобів, що збереже можливість адаптації пацієнта до інвалідного візка.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Banovac K., Williams J.M., Patrick L.D., Haniff Y.M. Prevention of heterotopic ossification after spinal cord injury with indomethacin // Spinal. Cord. — 2001. — Vol. 39(7). — Р. 370-374.
2. Banovac K., Gonzalez F., Wade N. et al. Intravenous disodium etidronate therapy in spinal cord injury patients with heterotopic ossification // Paraplegia. — 1993. — Vol. 31, № 10. — P. 660-666.
3. Citak M., Grasmücke D., Salber J. et al. Heterotopic ossification mimicking infection in patients with traumatic spinal cord injury // Technol. Health Care. — 2016. — № 24(1). — P. 87-91.
4. Kim E., Maher B., 2012, http://www.authorstream.com/Presentation/edwardhanbongkim-1559197-heterotopic-ossification/
5. Ploumis A., Donovan J., Olurinde M. et al. Association between alendronate, serum alkaline phosphatase level, and heterotopic ossification in individuals with spinal cord injury // J. Spinal. Cord. Med. March. — 2015. — Vol. 38(2). — P. 193-198.
6. Sakellariou V.I., Grigoriou E., Mavrogenis A.F. et al. Heterotopic ossification following traumatic brain injury and spinal cord injury: insight into the etiology and pathophysiology // J. Musculoskelet Neuronal. Interact. — 2012. — Vol. 12(4). — Р. 230-240.
7. Skehad D., Elgazzar A.H., Collier B.D. Heterotopic ossification // J. Nucl. Med. — 2002. — Vol. 43, № 3. — P. 346-353.
8. Trentz O.A., Handschin A.E., Bestmann L. et al. Influence of brain injury on early posttraumatic bone metabolism // Crit. Care Med. — 2005. — Vol. 33(2). — Р. 399-406.
9. van Kuijk A.A, Geurts A.C., van Kuppevelt H.J. Neurogenic heterotopic ossification in spinal cord injury // Spinal. Cord. — 2002. — Vol. 40, № 7. — P 313-326.
10. Vanden Bossche L., Vanderstraeten G. Heterotopic ossification: a review // J Rehabil. Med. — 2005. — Vol. 37, № 3. — P. 129-136.
11. Wilkinson J.M., Stockley I., Hamer A.J. et al. Biochemical markers of bone turnover and development of heterotopic ossification after total hip arthroplasty // J. Orthop. Res. — 2003. — № 21(3). — P. 529-534.

/90-1.jpg )
/93-1.jpg )
/92-1.jpg )