Введение
Современные достижения фундаментальной и клинической неврологии позволяют рассматривать эндотелий как высокоспециализированную, метаболически активную систему, продуцирующую значительное число биологически активных веществ, являющихся конечным звеном нейрогенной и гуморальной регуляции сосудистого тонуса, его антитромботической, противовоспалительной и антипролиферативной функции. В настоящее время нормальная работа эндотелия рассматривается как ключевая в поддержании сосудистого гомеостаза, а эндотелиальная дисфункция считается неблагоприятным прогностическим фактором развития сердечно-сосудистых и неврологических заболеваний [2, 4, 5, 17].
Более того, эндотелий сосудистого русла, осуществляя локальный синтез медиаторов, участвует в регуляции сосудистого тонуса, гемостаза, иммунных реакций, миграции клеток крови в сосудистую стенку, синтезе факторов воспаления и их ингибиторов, осуществляет барьерные функции [1, 7].
Отмечают различия в структуре эндотелиоцитов в зависимости от расположения, что особенно касается эндотелия мозговых сосудов, выполняющих функцию гематоэнцефалического барьера (ГЭБ), регулирующего интрацеребральный транспорт лекарственных препаратов [6–8].
Эндотелиальные клетки ГЭБ отличаются большим количеством митохондрий и значительной концентрацией окислительных ферментов, обеспечивающих активный двусторонний транспорт веществ между нейрональной тканью и кровью. Поскольку ГЭБ при болезни Паркинсона (БП) является преградой для транспорта противопаркинсонических препаратов, можно полагать, что улучшение функции эндотелия мозговых сосудов будет оказывать существенное влияние на эффективность, чувствительность и переносимость базисной терапии заболевания.
Понимание молекулярных механизмов регуляции функциональной активности компонентов ГЭБ должно стать обязательным условием для разработки новых эффективных методов фармакотерапии, в том числе с применением средств доставки или препаратов, направленно изменяющих проницаемость ГЭБ [8], что в совокупности с другими нейробиологическими и нейрохимическими данными обеспечит прорыв в терапии заболеваний, связанных с нейродегенерацией.
Эти положения в большой мере могут рассматриваться как концептуальная позиция, оценивающая эндотелий как самостоятельную мишень терапевтического воздействия с целью профилактики, лечения и снижения риска прогредиентности течения неврологических заболеваний, в частности болезни Паркинсона.
В последние годы все большее внимание обращает на себя инновационная группа препаратов — цитопротекторы, в частности, хорошо известный препарат мельдоний, который имеет мультимодальное цитопротекторное действие. Показано, что комбинация 180 мг мельдония и 60 мг γ-бутиробетаина под названием Капикор способствует в большей степени физиологическому образованию эфиров γ-бутиробетаина и в результате более активному синтезу оксида азота [3, 5].
Так, установлена ключевая роль эндотелиопротекторных препаратов, в частности Капикора, как оптимизаторов выработки NO и восстановления функции эндотелия при сосудистых и нейродегенеративных заболеваниях ЦНС [5].
В связи с этим представляет значительный интерес применение комбинированного препарата Капикор в комплексной патогенетической терапии болезни Паркинсона с целью уменьшения проявлений окислительного стресса и улучшения функции эндотелия, а также транспорта противопаркинсонических препаратов через гематоэнцефалический барьер к мозгу.
Есть веские основания полагать, что исследование механизма действия Капикора на сосудистый эндотелий будет иметь глубокое фундаментальное значение в условиях экспериментального моделирования дисфункции эндотелия и последующего морфологического анализа его ультраструктуры непосредственно в тканях лабораторных животных (крыс), находящихся в ротеноновой модели паркинсонизма.
Эта идея стала основой для определения целей настоящего исследования — изучить и оценить эффективность и переносимость препарата Капикор (комбинация γ-бутиробетаина 60 мг и мельдония дигидрата 180 мг), капсулы, производства АО «Олайнфарм» (Латвия) в комплексном лечении пациентов с болезнью Паркинсона; исследовать механизм действия Капикора на ротеноновой модели паркинсоноподобного синдрома с целью выявления влияния препарата на осложнения многолетнего лечения в виде феномена истощения эффекта разовой дозы (т.н. wearingoff), флуктуаций и дискинезий.
Материалы и методы
Комплексные клинико-нейрофизиологические исследования проведены среди 22 больных БП в возрасте 60,4 ± 6,4 года с началом заболевания в 50,10 ± 8,57 года и его длительностью 10,40 ± 4,55 года, продолжительностью лечения 9,20 ± 3,43 года со стадией болезни 2.0–3.0 по Hoenh-Yahr. Все пациенты находились на терапии леводопа/ИДК при средней дозе препарата 521,4 ± 52,5 мг/сутки, имели осложнения многолетнего лечения в виде феномена истощения эффекта разовой дозы (wearingoff), флуктуаций и дискинезии. Для объек–тивизации выраженности клинических симптомов БП применялась Унифицированная рейтинговая шкала оценки проявлений паркинсонизма (UPDRS). До и после лечения Капикором проводились нейропсихологическое обследование по шкалам MMSE, MoCА, FAB, Спилбергера — Ханина, депрессии Бека, исследование когнитивных вызванных потенциалов Р300, постуральный контроль методом стабилографии, регистрация биоэлектрической активности мышц (ЭМГ) и сенсомоторной реакции. Назначение препарата Капикор проводилось на фоне базисной противопаркинсонической терапии препаратами леводопа/ИДК, которая оставалась стабильной в течение 28–30 дней до начала приема Капикора и в течение всего исследуемого периода. Схема приема препарата — по 2 капсулы утром и днем в течение 2 месяцев. Контрольную группу составили 10 пациентов, находящихся на традиционной базисной терапии БП.
Экспериментальные исследования проведены на 20 половозрелых крысах-самцах линии Вистар, у которых с помощью ротенона (п/к, ежедневно в течение 2 недель в дозе 0,3 мг/100 г массы тела) моделировали паркинсоноподобный синдром. Контрольная группа включала 10 животных.
Митохондриальную дисфункцию оценивали при электронно-микроскопическом исследовании тромбоцитов в крови больных БП. Морфологические подсчеты выполняли с помощью компьютерной программы Image Tool Version 3 (США). Содержание продуктов перекисного окисления липидов определяли спектрофотометрически с использованием реактивов Sigma Alddrich, США.
Результаты и обсуждение
Контингент пациентов представлен в табл 1. После курса лечения препаратом Капикор отмечена положительная динамика клинических симптомов БП, измеряемых с помощью шкалы UPDRS. Так, значительно снижались баллы оценки моторной активности (UPDRS III) — с 35,4 ± 7,7 до 30,6 ± 8,3 (P < 0,05) и общей оценки симптомов БП (UPDRS total) с 51,5 ± 9,4 балла до 46,2 ± 10,5 балла (p < 0,05), в основном за счет улучшения постуральной активности, уменьшения выраженности ригидности и моторных флуктуаций.
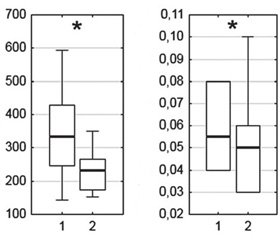
Когнитивные вызванные потенциалы. В результате курсового приема препарата Капикор происходило достоверное улучшение функциональной активности головного мозга, связанной с протеканием когнитивных процессов. Так, исходные значения латентного периода вызванного потенциала Р300 составляли 469,2 ± 90,1 мс (отведение Fp2), в то время как после курса лечения выявлено достоверное его уменьшение до 391,00 ± 47,35 мс, отведение Fp2 и приближение средних значений к уровню нормы в переднефронтальных и левом теменном отведениях (рис. 1).
В то же время выраженность компонентной структуры вызванного потенциала Р300 в большинстве отведений оставалась без изменений, однако межпиковая амплитуда потенциалов N200–P300 изменялась с 9,9 ± 4,7 мс до 7,1 ± 2,9 мс в отведении Pz и с 8,8 ± 3,8 мс до 6,6 ± 2,7 мс в отведении Oz.
Согласно современным представлениям время формирования потенциала Р300 рассматривается в качестве характеристики скорости обработки информации в рамках решения когнитивных задач. В свою очередь, амплитуда вызванных потенциалов отражает объем мозговых ресурсов, вовлеченных в реализацию того или иного процесса [9, 10]. Развивающееся с возрастом или вследствие нейродегенеративных заболеваний снижение эффективности мозговых функций требует подключения дополнительных нейрональных ресурсов для достижения адекватной результативности деятельности [11].
Такие компенсаторные механизмы могут быть связаны с дополнительной активацией структур префронтальной коры, что подтверждается как изменениями топографии распределения потенциала Р300 по конвекситальной поверхности [12], так и нейровизуализационными исследованиями [13].
Таким образом, развивающееся в результате курсового применения препарата Капикор снижение амплитуды вызванного потенциала Р300 в теменно-затылочных областях и уменьшение его латентного периода в лобных отделах коры может указывать на возрастание роли переднефронтальных нейрональных генераторов в организации когнитивных процессов, направленное на повышение их функциональной активности.
Стабилографическое исследование. Для контроля стабильности позы у пациентов с болезнью Паркинсона использовался метод компьютерной стабилографии с использованием стабилографического теста и теста Ромберга до и после курсового приема Капикора.
Получены достоверные данные об уменьшении разброса колебаний ЦД по сагиттали с 5,04 ± 1,76 мм до 4,14 ± 1,14 мм (р < 0,05), что может свидетельствовать об уменьшении колебания тела в основной стойке в сагиттальном направлении и улучшении функции равновесия после курсового приема Капикора (рис. 2).
Анализ показателя LFS — длины статокинезиограммы в зависимости от площади — выявил увеличение этого показателя с 1,46 ± 0,73 до 2,03 ± 0,66 (р < 0,05), что свидетельствовало о повышении плотности статокинезиограммы, возможном увеличении энергозатрат пациентами для удержания тела в вертикальном положении и стало результатом позитивного действия Капикора на процесс регуляции постуральной стабильности.
Биоэлектрическая активность мышц. Для исследования влияния препарата Капикор на состояние центрального супраспинального контроля движений использовали методику регистрации биоэлектрической активности мышц (ЭМГ). Установлено выраженное улучшение показателей электрогенеза мышц, связанное с приемом Капикора, что зафиксировано при записи фонового электрогенеза m.bicepsbrachii и при функциональных пробах на синергии по показателям средней амплитуды (мкВ), частоты «залповой активности» (1/с) и коэффициента соотношения амплитуда/частота (мкВ/с) (рис. 3).
При электронно-микроскопическом исследовании клеток крови у пациентов с БП до и после лечения Капикором установлено несомненное положительное влияние препарата.
При развитии паркинсоноподобного состояния нарушение ультраструктуры тканей, развитие митохондриальной и эндотелиальной дисфункции наблюдалось не только в головном мозге, но и в других тканях организма, таких как легкие, сердце, чем можно объяснить развитие патологических состояний именно в этих органах и системах при нейродегенерации.
Установлено, что длительное введение ротенона сопровождалось развитием выраженной эндотелиальной и митохондриальной дисфункции, которая свидетельствовала об очаговой дегенерации клеток в тканях продолговатого мозга. В стриатуме подобные изменения были менее выражены: имели место признаки эндотелиальной дисфункции с активацией динамических процессов в митохондриальном аппарате, что позволяет рассматривать эти изменения как формирование компенсаторных реакций. В миокарде также наблюдается развитие выраженной эндотелиальной и митохондриальной дисфункции. Следует обратить внимание на тот факт, что из исследуемых тканей только в миокарде отмечалось истончение эндотелиального слоя гематоэнцефалического барьера, что, вероятно, могло быть обусловлено выраженными деструктивными процессами в эндотелии. В легочной ткани формировалась выраженная митохондриальная дисфункция с образованием септированных митохондрий и миелиноподобных крист в органеллах, но эндотелиальная дисфункция была менее выражена, чем в миокарде.
Под влиянием Капикора существенно уменьшались проявления митохондриальной и эндотелиальной дисфункции, причем более выраженная нормализация ультраструктуры наблюдалась в тканях с первично выраженными нарушениями, а именно в продолговатом мозге, легких и миокарде. Отмечалась также активация морфогенеза митохондрий (МХ) с увеличением их количества на 20–45 % в зависимости от исследованной ткани, уменьшалась гипергидратация биологических барьеров, значительно восстанавливался конвейер митохондрий с уменьшением количества структурно поврежденных органелл (рис. 4).
/23-1.jpg)
Можно полагать, что выявленные изменения ультраструктуры МХ являются свидетельством формирования митохондриальной дисфункции и указывают на механизмы, которые принимают участие в формировании и течении патологического процесса при БП [14–16]. С другой стороны, развитие митохондриальной дисфункции при экспериментальном ПС в различных тканях организма и в тромбоцитах у пациентов с БП может способствовать усугублению вторичной тканевой гипоксии, прогрессированию нейродегенерации, а также развитию сопутствующей бронхолегочной и сердечно-сосудистой патологии. Именно последние, как правило, являются причиной соматического отягощения клинического течения заболевания и развития его фатальных исходов на выраженных стадиях заболевания. Есть основания считать, что полученные экспериментальные данные о полиорганных локусах митохондриальной дисфункции (мозг — легочная ткань — кардиомиоциты) не только могут быть сопоставимы
с результатами известных исследований, доказавших вовлечение периферических отделов вегетативной нервной системы (миокард, бронхолегочная система, кишечник) с образованием там телец Леви и включений α-синуклеина в формирование дофадефицитного дисбаланса еще на доклинических стадиях развития БП, но и могут рассматриваться в качестве биомаркеров стадийности и прогноза течения заболевания.
В наших клинико-экспериментальных исследованиях изучена также экспрессия мРНК гена паркина в лейкоцитах крови больных БП до и после применения препарата Капикор. С уровнем значимости р < 0,05 было установлено, что до лечения препаратом относительный уровень экспрессии матричной РНК гена PARK2 (паркин) составлял 10,53 ± 5,52 условных единиц, а после курсового применения препарата этот уровень повысился до 195,39 ± 67,29 условных единиц, то есть почти в 20 раз.
Можно полагать, что увеличение экспрессии мРНК гена паркина после терапии Капикором приводит к усилению протеасомного протеолиза вышеуказанных субстратов и, таким образом, улучшает функциональное состояние больных с болезнью Паркинсона, а следовательно, может способствовать замедлению прогрессирования заболевания. Кроме того, увеличение экспрессии гена паркина свидетельствует о его влиянии на нейропротекторную функцию, регуляцию проявлений оксидативного стресса и митохондриального биогенеза [18–20].
Показана также динамика про- и антиоксидантного баланса в плазме крови больных болезнью Паркинсона под влиянием лечения препаратом Капикор. Так, у пациентов с БП до лечения препаратом Капикор в плазме крови регистрировали увеличение содержания вторичных продуктов перекисного окисления липидов (ТБК-АП) на 76 % на фоне снижения активности антиоксидантного фермента глутатионпероксидазы на 16,3 % по сравнению со здоровыми людьми (контроль) (табл. 2).
После лечения препаратом Капикор интенсивность оксидативных процессов в крови значительно снижалась, о чем свидетельствует уменьшение в плазме крови содержания ТБК-АП на 35 % и увеличение активности глутатионперокидазы на 11,0 % в сравнении с показателями до лечения.
Таким образом, лечение Капикором приводит к восстановлению баланса между прооксидантной системой (за счет уменьшения содержания малонового диальдегида) и антиоксидантной системой защиты (за счет повышения активности глутатионпероксидазы), что свидетельствует о нормализующем влиянии Капикора на функцию глутатионовой системы антирадикальной защиты.
Необходимо подчеркнуть хорошую переносимость препарата Капикор и отсутствие каких-либо побочных реакций у обследованных пациентов с болезнью Паркинсона.
Выводы
1. После курсового лечения Капикором наблюдается положительная динамика клинических симптомов болезни Паркинсона: уменьшение выраженности моторных флуктуаций и двигательных нарушений за счет улучшения постуральной активности и уменьшения проявлений акинетико-ригидного симптомокомплекса.
2. В результате курсового лечения препаратом Капикор происходит уменьшение латентного периода когнитивного потенциала Р300 и снижение его амплитуды, указывающие на активацию роли переднефронтальных нейрональных генераторов в регуляции когнитивных функций.
3. Препарат Капикор способствует облегчению процесса центрального супраспинального контроля движений, что проявляется улучшением показателей фонового и функционального электрогенеза мышц по данным ЭМГ-исследования.
4. При курсовом лечении препаратом Капикор повышаются возможности динамического контроля позы и уменьшаются проявления постуральной нестабильности.
5. У больных БП препарат Капикор вызывал интенсификацию морфогенеза митохондрий и процесса их продольной ассоциации, что свидетельствует о нарастании энергетических возможностей мозга и увеличении интенсивности аутофагии этой структуры и способности клеток противостоять метаболическому стрессу как результату нейродегенерации.
6. Установлено влияние Капикора на экспрессию мРНК гена паркина у больных болезнью Паркинсона в виде увеличения протеасомного протеолиза и опосредованного этим нейропротективного эффекта препарата и возможного замедления степени прогрессирования заболевания.
7. Курсовое лечение Капикором у больных БП способствует восстановлению баланса между прооксидантной и межоксидантной системами защиты, приводит к нормализации глутатионовой системы антирадикальной защиты.
8. Комплексное клинико-экспериментальное исследование показало, что включение препарата Капикор в комплексную патогенетическую терапию больных болезнью Паркинсона способствует снижению выраженности уровня оксидативного стресса — ключевого механизма развития заболевания, уменьшению степени эндотелиальной дисфункции, что дает основания рекомендовать Капикор как эндотелийстабилизирующее средство в фармакотерапии нейродегенеративного процесса на всех стадиях течения болезни Паркинсона.
Конфликт интересов. Не заявлен.
Список литературы
1. Lauer T., Kleinbongard P. Kelm M. Indexes of NO bioavailability in human blood // News Physiol. Sci. — 2002. — V. 17, 12. — P. 251-255.
2. Wiley K.E. Davenport A.P. Nitric oxide-mediated modulation of the endothelin-1 signaling pathway in the human cardiovascular system // Br. J. Pharmacol. — 2001. — 132. — Р. 213-220.
3. Зупанец И.А., Шебеко С.К., Отришко И.А. Значение элементов политропности в механизме реализации фармакологического потенциала препарата Капикор // Therapia. — 2015. — 5 (98). — С. 2-4.
4. Петрищев Н.Н. Дисфункция эндотелия. Причины, механизмы, фармакологическая коррекция. — СПб.: Изд-во СПбГМУ, 2003. — 181 с.
5. Сьяксте Н.И., Дзинтаре М.Я., Калвиныш И.Я. Роль индукции NO в механизме действия цитопротектора капикора — оригинального регулятора эндотелиальной функции // Медичні перспективи. — 2012. — Т. 17, № 2. — С. 1-8.
6. Кувачева Н.В., Салмина А.Б., Комлева Ю.К. и др. Проницаемость гематоэнцефалического барьера в норме, при нарушении развития головного мозга и нейродегенерации // Журн. неврологии и психиатрии им. С.С. Корсакова. — 2013. — 4. — С. 80-85.
7. Desai B.S., Monahan A.J., Carvey P.M. et al. Blood-brain barrier pathjlogy in Alzheimer’s and Parkinson’s disease: Implication’s for Drug Therapy // Cell. Transplantation. — 2007. — 16. — 285-299.
8. Vangilder R.L., Rosen C.L., Barr T.L. et al. Targeting the neurovascular unit for treatment of neurological disorders // Pharmacol. Ther. — 2011. — 130, 3. — 239-247.
9. Braverman E.R., Blum K. P300 (latency) event-related potential: an accurate predictor of memory impairment // Clin. Electroenceph. — 2003. — 34 (3). — P. 124-39.
10. Van Dinteren R., Arns M., Jongsma M.L.A et al. P300 Development across the Lifespan: A Systematic Review and Meta-Analysis // PLоS One. — 2014. — 9 (2). — doi:10.1371/journal. pone. 0087347.
11. Schneider-Garces N.J., Gordon B.A., Brumback-Peltz C.R. et al. Span, CRUNCH, and beyond: working memory capacity and the aging brain // J. Cogn. Neurosci. — 2010. — 22. — P. 655-669.
12. Li L., Gratton C., Fabiani M. et al. Age-related frontoparietal changes during the control of bottom-up and top-down attention: an ERP study // Neurobiol. Aging. — 2013. — 34. — P. 477-488.
13. Cabeza R., Anderson N.D., Locantore J. K. et al. Aging Gracefully: Compensatory Brain Activity in High-Performing Older Adults // Neuroimage. — 2002. — 17. — P. 1394-1402.
14. Przedborski S., Tieu K., Perier C., Vila M. MPTP as a mitochondrialneurotoxic model of Parkinson’s disease // J. Bioenerg. Biomembr. — 2004. — 36 (4). — 375-379.
15. Choi W.S., Kruse S.E., Palmiter R.D., Xia Z. Mitochondrial complexI inhibition is not required for dopaminergic neuron deathinduced by rotenone, MPP1, or paraquat // Proc Natl. Acad. Sci USA. — 2008. — 105. — 15136-1514.
16. Guaras A., Perales-Clemente E., Calvo E. et al. The CoQH2 /CoQratio serves as a sensor of respiratory chain efficiency // Cell. Rep. — 2016. — 15 (1). — 197-209.
17. Wirth C., Brandt U., Hunte C., Zickermann V. Structure and function of mitochondrial complex I // Biochim. Biophys. Acta. — 2016. — 1857. — 902-914.
18. Hudson G., Nalls M., Evans J.R. et al. Two-stage association study and meta-analysis of mitochondrial DNA variants in Parkinson disease // Neurology. — 2013. — 80. — 2042-2048.
19. Bender A., Krishnan K.J., Morris C.M. et al. High levels of mitochondrial DNA deletions in substantia nigra neurons in aging and Parkinson disease // Nat. Genet. — 2006. — 38. — 515-517.
20. Tzoulis C., Schwarzlmuller T., Biermann M., Haugarvoll K., Bindoff L.A. Mitochondrial DNA homeostasis is essential for nigrostriatal integrity // Mitochondrion. — 2016. — 28. — 33-37.

/21-1.jpg)
/22-1.jpg)
/22-2.jpg)
/23-1.jpg)
/24-1.jpg)