Введение
Когнитивные нарушения считаются облигатным признаком болезни Паркинсона (БП) наряду с гипокинезией, ригидностью и постуральной неустойчивостью. В большинстве случаев на начальных стадиях заболевания нарушения высших психических функций выражены в легкой и умеренной степени. У пожилых пациентов с длительным анамнезом заболевания когнитивный дефицит может достигать стадии деменции, существенно снижая качество жизни больных. Отклонения когнитивных функций от возрастной нормы определяются с помощью нейропсихологических тестов у 90–95 % больных с БП [10, 13]. Показано, что на ранних стадиях заболевания преобладают легкие или умеренные когнитивные нарушения и лишь у небольшого числа больных развивается деменция, а спустя 5 лет и более число больных БП с деменцией начинает увеличиваться. При одномоментном обследовании больших групп людей с БП деменция выявляется в 15–40 % случаев. Метаанализ 13 исследований показал, что средняя распространенность деменции при БП составляет 31,5 % [11]. В то же время кумулятивная распространенность деменции при БП, отражающая ее возникновение на любом этапе заболевания и выявляемая при многолетнем наблюдении за избранной когортой больных, оказывается существенно выше, достигая почти 80 % [12]. Риск развития деменции у больных с БП в 5–6 раз выше, чем у лиц того же возраста в общей популяции [11].
Когнитивные и поведенческие нарушения, сопровождающие БП, оказывают существенное негативное влияние как на больных, так и на лиц, ухаживающих за пациентом, а также общество в целом. Деменция и комплекс связанных с ней поведенческих проблем (психозы, агрессивность, негативизм, галлюцинации) резко затрудняют уход за больным и служат основной причиной дистресса у ухаживающих лиц, часто приводят к помещению больного в дом престарелых, что в значительной мере повышает расходы, связанные с уходом [6, 14, 15]. Следует отметить, что риск летального исхода в случае наличия деменции при БП повышается [6].
Согласно рекомендациям по фармакологическому лечению БП на разных стадиях течения заболевания, разработанным Европейской федерацией неврологических обществ и Европейской секцией Международного общества двигательных расстройств (EFNS/MDS-ES, 2013), лечение нейропсихиатрических нарушений и деменции при БП предусматривает применение ингибиторов холинэстеразы (ИХЭ) [14]. Первоначально эффективность ИХЭ была показана в клинических испытаниях при болезни Альцгеймера. К ИХЭ второго поколения относятся галантамин, ривастигмин, донепезил, обладающие хорошей переносимостью, но различающиеся по механизму действия и фармакологическим параметрам [15]. Так, если донепезил является истинным ингибитором ацетилхолин–эстеразы, то ривастигмин в равной степени блокирует ацетилхолинэстеразу (АХЭ) и бутирилхолинэстеразу (БХЭ); галантамин, помимо блокады АХЭ, модулирует Н-холинорецепторы, повышая их чувствительность к лиганду [15].
Механизм действия ривастигмина связан с блокированием активности ферментов АХЭ и БХЭ в ЦНС, что приводит к замедлению распада ацетилхолина, выделяемого остающимися сохранными холинергическими нейронами, увеличению продолжительности его действия на постсинаптические рецепторы и усилению холинергической передачи, ослабление которой является одним из важнейших факторов развития деменции при целом ряде заболеваний. Снижение активности холинергической системы отмечено при болезни Альцгеймера, деменции с тельцами Леви, болезни Паркинсона с деменцией, смешанной деменции, отчасти при сосудистой и посттравматической деменции. С учетом этого ИХЭ оказались одним из наиболее эффективных средств, способных помочь при всех основных нозологических формах деменций [1, 5, 14].
Цель исследования: изучение влияния ингибитора холинэстеразы Ривастигмина Орион на мнестические функции у пациентов с когнитивным дефицитом, ас–социированным с БП.
Материалы и методы
В исследование были включены 43 пациента пожилого возраста (60–74 года) с БП. Диагноз БП выставлялся согласно клиническим диагностическим критериям Британского банка мозга (UK Brain Bank Criteria) [8]. Для оценки двигательных нарушений применялась шкала оценки стадийности БП (Hoehn-Yahr). Степень нарушений двигательной активности определялась с помощью стандартизированной международной шкалы Unified Parkinson’s Disease Rating Scale (UPDRS III), которая оценивает функцию речи, мимики, тремор покоя, наличие динамического и постурального тремора, ригидности, пробы с пронацией-супинацией, сжатия в кулак, подвижности ног, вставания со стула, позу, ходьбу, постуральную нестабильность, общую двигательную активность [9]. Всем пациентам проведено нейропсихологическое обследование с использованием краткой шкалы оценки психического статуса (Mini Mental State Examination — MMSE), Монреальской шкалы когнитивной оценки (The Monreal Cognitive Assessment — MoCA), батареи тестов по оценке лобной дисфункции (Frontal Assessment Battery — FAB), опросника депрессии Бека, нейровизуализационное обследование (КТ, МРТ).
MMSE разработана для скрининга когнитивных функций пациента и включает оценку ориентации во времени и месте, состояние кратко- и долговременной памяти, функцию речи, гнозиса, праксиса [2].
MoCA используется для скрининга мягких когнитивных нарушений. Шкала оценивает различные когнитивные функции, такие как внимание и концентрация, исполнительные функции, память, называние предметов, зрительно-пространственную деятельность, абстрактное мышление, счет и ориентировку в месте и времени [3].
FAB — сжатая батарея из шести нейропсихологических заданий, используется для оценки функций, находящихся под контролем лобных долей, в первую очередь это концептуализация, психическая гибкость, программирование, чувствительность к интерференции, тормозной контроль, хватательный рефлекс [4].
Методы нейровизуализации применены для исключения ранее перенесенных острых нарушений мозгового кровообращения. Для дифференциальной диагностики псевдодеменции, которая характерна для аффективных расстройств, использовали опросник депрессии Бека [7].
Все пациенты находились на лечении леводопасодержащими препаратами и отмечали снижение памяти в течение не менее одного года. Когнитивный дефицит составлял ≤ 25 баллов по МоСА.
Пациенты были распределены на две группы в зависимости от получаемой терапии:
— основная группа — пациенты с БП и когнитивным дефицитом, получавшие курсовое лечение ингибитором холинэстеразы (Ривастигмин Орион) (n = 21);
— контрольная группа — пациенты с БП и когнитивным дефицитом, получавшие базисную терапию основного заболевания (n = 22).
Пациенты обеих групп были сопоставимы по уровню образования, выраженности степени двигательных нарушений по показателям UPDRS и стадии выраженности заболевания. Средний возраст пациентов основной и контрольной группы — соответственно 69,4 ± 5,0 года и 65,9 ± 7,3 года.
Критериями исключения были прием холинолитиков (циклодол, акинетон), прием препаратов, влияющих на когнитивные функции (мемантин гидрохлорид, другие ИХЭ), менее одного года, перенесенный инсульт в анамнезе, сопутствующая соматическая патология (синдром слабости синусового узла, атриовентрикулярная блокада, бронхиальная астма, язва желудка в фазе обострения, обструкция мочевыводящих путей) [5].
Пациенты основной группы принимали препарат Ривастигмин Орион в суточной дозе 3–6 мг дважды в день в течение 3 месяцев. В процессе первичного обследования пациенты подписывали информированное согласие.
Статистический анализ данных проведен с использованием Microsoft Excel v. 12, пакета статистических программ StatSoft Statistica v. 10.0. Статистическую оценку отличий между независимыми выборками проводили при помощи критерия Манна — Уитни. В качестве значимых рассматривали отличия, для которых р < 0,05.
Результаты и обсуждение
При анализе жалоб пациентов с БП и когнитивным дефицитом выявлялись снижение продуктивности процессов внимания, рассеянность и неспособность к длительной концентрации внимания, повышенная забывчивость, снижение инициативы и неспособность к переключению, нарушение ориентации во времени и пространстве, затруднение при выполнении привычных действий.
Усредненные значения базовых показателей двигательной активности, когнитивного статуса и эмоционально-волевой сферы контрольной и основной групп обследованных пациентов представлены в табл. 1.
После курсового приема препарата Ривастигмин Орион у пациентов с БП наблюдались достоверные отличия при нейропсихологическом обследовании. Так, улучшение когнитивных функций в основной группе происходило за счет увеличения балла по шкале MMSE с 25 [21; 26] до 26 [24; 28] баллов (p < 0,05), тогда как в группе контроля общий балл практически не изменился и составил 26 [24; 27] до и 26 [25; 27] баллов (p > 0,05) на фоне базисной терапии без Ривастигмина Орион соответственно (рис. 1). Установлено улучшение показателей, характеризующих ориентировку во времени и пространстве, концентрацию внимания и запоминание материала по сравнению с исходным уровнем.
Нужно отметить, что группы обследованных пациентов были изначально различны по результатам шкалы МоСА: в контрольной группе данный показатель составлял 23 [20; 24] балла, в основной — 21 [14; 23] балл, что свидетельствовало о более выраженном когнитивном дефиците в основной группе. После курса терапии в основной группе отмечается достоверное увеличение показателя по суммарному баллу МоСА до 22 [20; 26] (p < 0,05), в то время как в группе контроля динамики показателя не наблюдалось — 23 [19; 24] балла (p > 0,05). Межгрупповые отличия после лечения в обеих группах не имели статистически значимых отличий, что подтверждает действие препарата на когнитивный статус (рис. 2).
При детальном анализе субшкал МоСА в основной группе улучшение произошло за счет позитивной динамики в сфере зрительно-пространственных функций, концентрации внимания, способности к абстракции и долговременной памяти.
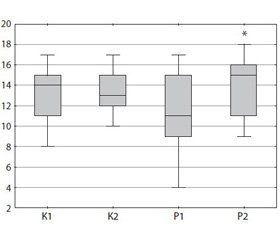
На следующем этапе исследования оценивали нарушение исполнительных функций с помощью шкалы FAB. После курса лечения Ривастигмином Орион происходило достоверное улучшение когнитивного статуса в основной группе: общий балл фонового уровня по шкале FAB составил 11 [9; 15] баллов, после лечения — 15 [11; 16] баллов (p < 0,05). Статистически значимых изменений в группе контроля не наблюдалось: 14 [11; 15] баллов до и 13 [12; 15] баллов — после лечения (p > 0,05) (рис. 3). Этот факт, в свою очередь, подтверждает положительное влияние препарата на функции, находящиеся под контролем префронтальных отделов лобных долей и базальных ганглиев, образующих фронтостриарную систему, которая обеспечивает формирование замыслов и целей психической деятельности, регуляцию и контроль отдельных действий и поведения в целом. Изменения показателя FAB произошли за счет улучшения концептуализации (способность к абстракции) и чувствительности к интерференции (простая реакция выбора).
/43-1.jpg)
Следует отметить хорошую переносимость препарата, отсутствие побочных явлений и широкий диапазон индивидуальных терапевтических доз от 3 до 6 мг (максимальная терапевтическая доза составляет 12 мг/сут) [5].
Как известно при БП существует дисбаланс между дофаминергической и холинергической системами в различных структурно-функциональных отделах головного мозга. Если в базальных ганглиях холинергическая система преобладает над ослабленной дофаминергической, то в лимбической системе и коре более сохранная дофаминергическая регуляция доминирует над пораженной холинергической [15]. В наших исследованиях показано, что позитивная динамика показателей нейропсихологических шкал под влиянием лечения Ривастигмином Орион сопровождалась достоверным улучшением двигательной активности больных БП. Так, в основной группе достоверно уменьшился общий балл UPDRS с 52 [44; 67] до 42 [37; 60] (p < 0,05). Изменения общего балла UPDRS произошли за счет I и III частей. Так, показатель UPDRS I, отражающий субъективное состояние психического статуса пациента, составил 3 [2; 5] балла до и 2 [1; 4] балла — после лечения (p < 0,05). Это подтверждает и другой аспект положительного влияния Ривастигмина Орион на когнитивный статус больных БП за счет повышения мотивации и побуждения к действию, что расширяет возможности дальнейшего комплайенса пациента к данному виду лечения. Изменения показателя UPDRS III, отражающего степень нарушений двигательной активности, имели положительную динамику в основной группе. Снижение моторного балла с 33 [32; 43] баллов до 31 [27; 40] балла (p < 0,05) после лечения свидетельствует о патогенетически значимом антихолинэстеразном действии препарата Ривастигмин Орион у больных БП с когнитивным дефицитом (табл. 1). Достоверных изменений выраженности двигательной активности по общему баллу UPDRS в группе контроля не наблюдалось, он составил 56 [51; 61] баллов до и 53,5 [47; 67] балла — после трех месяцев наблюдения (p > 0,05).
Таким образом, результаты исследования подтвердили эффективность препарата Ривастигмин Орион относительно его влияния на общее состояние мнестических функций при нейропсихологическом обследовании у пациентов с БП с когнитивным дефицитом.
Выводы
1. Пероральный прием Ривастигмина Орион показал хорошую переносимость препарата у пациентов с БП, отсутствие побочных эффектов и широкий диапазон индивидуальных доз при курсовом приеме в течение трех месяцев.
2. Под влиянием Ривастигмина Орион происходит улучшение холинергической передачи во фронтостриарной системе, детерминирующей состояние мнестических функций у пациентов с когнитивным дефицитом, ассоциированным с БП, что подтверждается результатами динамического нейропсихологического тестирования с использованием шкал MMSE, МоСА, FAB.
3. Отмечена положительная динамика отдельных когнитивных функций у пациентов с БП и когнитивным дефицитом за счет улучшения зрительно-пространственных функций, концентрации внимания, способности к абстракции и долговременной памяти по данным МоСА. Показано улучшение ориентации в пространстве и времени, процессов концентрации внимания и запоминания материала по шкале MMSE. Также отмечается положительный эффект на функции, обеспечивающие способность к абстракции, и чувствительность к интерференции по FAB.
4. Курсовое лечение Ривастигмином Орион вызывает положительную динамику в двигательной сфере у больных БП, что подтверждает необходимость мультимодального подхода к лечению нейродегенеративных заболеваний. Улучшение когнитивного статуса и расширение двигательной активности пациентов с БП пожилого возраста ведет к социальной и бытовой независимости и улучшению качества жизни пациента.
5. Результаты комплексного анализа влияния курсового приема Ривастигмина Орион на мнестические функции пациентов с когнитивным дефицитом, ассоциированным с БП, позволяют рекомендовать включение препарата в комплексную патогенетическую терапию БП на развернутых стадиях заболевания.
Конфликт интересов. Не заявлен.
Список литературы
1. Waldemar G., Dubois B., Emre M. et al. Alzheimer’s disease and other disorders associated with dementia // European handbook of neurological management / R. Hughes et al. — Oxford Blackwell Publishing, 2006. — P. 266-298.
2. Folstein M.F., Folstein S.E., McHugh P.R. «Mini-mental state». A practical method for grading the cognitive state of patients for the clinician // J. Psychiatr. Res. — 1975. — № 12. — Р. 189-98.
3. Ziad S., Natalie A. et al. The Montreal Cognitive Assessment, MoCA: A Brief Screening Tool For Mild Cognitive Impairment // Journal of the American Geriatrics Society. — 2005. — 53, 4. — 695-699.
4. Dubois B., Litvan I. The FAB: A frontal assessment battery at bedside // Neurology. — 2000. — 55(11). — 1621-1626.
5. Инструкция по применению препарата Ривастигмин Орион.
6. Aarland D., Andersen K., Larsen J.P., Lolk A., Nielsen H., Kragh-Sorensen P. Risk of dementia un Parkinson’s disease: a community-based, prospective study // Neurology. — 2001. — 56, № 6. — Р. 720-736.
7. Beck A.T., Ward C.H., Mendelson M., Mock J., Erbaugh J. An inventory for measuring depression // Archives of General Psychiatry. — 1961. — № 4. — P. 561-571.
8. Hughes A.J., Daniel S.E., Kilford L., Lees A.J. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases // J. Neurol. Neurosurg. Psychiatry. — 1992. — 55. — 181-184. doi:10.1136/jnnp.55.3.181.
9. Fahn S., Elton R., Members of the updrs Development Committee // Developments in Parkinson’s Disease / Ed. by Fahn S., Marsden C.D., Calne D.B., Goldstein M. Recent. — Vol. 2. — NJ, Florham Park: Macmillan Health Care Information, 1987. — Р. 153-163, 293-304.
10. Захаров В.В. Нарушение когнитивных функций при болезни Паркинсона и симптоматическом паркинсонизме: Автореф. дис… д-ра мед. наук. — М., 2003. — 36 с.
11. Emre M., Aaraland D., Brown R. et al. Clinical diagnostic criteria for dementia associated with Parkinson disease // Mov. Disord. — 2007. — 22. — 1689-1707.
12. Aarsland D., Andersen K., Larsen J.P. et al. Prevalence and characteristics of dementia in Parkinson disease: an 8-year prospective study // Arch. Neurol. — 2003. — 60. — 387-392.
13. Левин О.С. Клинико-нейропсихологические и нейровизуализационные аспекты дифференциальной диагностики паркинсонизма: Автореф. дис… д-ра мед. наук. — М., 2003. — 36 с.
14. Ferreira J.J., Katzenschlaqer R., Bloenn B.R., Bonuccelli U. et al. Summary of the recjmmendations of the EFNS/MDS-ES review on therapeutic management of Parkinson’s disease // Eur. J. Neurol. — 2013. — 20 (1). — 5-15. doi: 10.1111/j.1468-1331.2012.03866.x.
15. Левин О.С. Диагностика и лечение деменции в клинической практике / О.С. Левин. — М.: МЕДпресс-информ, 2010. — 256 с.

/42-1.jpg)
/43-1.jpg)