Резюме
Актуальність. Найшвидше відновлення кровообігу в міокарді часто потребує оперативного втручання на фоні штучного кровообігу, зокрема аортокоронарного шунтування. Мета дослідження: вивчення впливу левосимендану в періопераційному періоді на стан кровообігу та кисневого бюджету у хворих, що піддалися операції аортокоронарного шунтування при гострому коронарному синдромі. Матеріали та методи. Обстежено 85 пацієнтів із гострим коронарним синдромом, яким була виконана операція аортокоронарного шунтування. Обстежені хворі були розподілені на 2 групи. У пацієнтів 1-ї групи (n = 40) використовували локальний протокол анестезії та інтенсивної терапії, прийнятий в ДУ «Інститут серця МОЗ України», пацієнтам 2-ї групи (n = 45) додатково вводили левосимендан за наступною схемою: до індукції в наркоз 10 мкг/кг упродовж 10 хв, потім зі швидкістю 0,1 мкг/кг/хв до 8 годин після операції. Дослідження проводилось на наступних етапах: 1) перед операцією; 2) при виході з перфузії; 3) при переведенні до відділення інтенсивної терапії; 4) при переведенні з відділення інтенсивної терапії. На цих етапах оцінювали стан кровообігу, кисневого бюджету в організмі. Результати. При застосуванні локального протоколу анестезії кінцевий систолічний індекс починав перевищувати вихідний рівень тільки наприкінці дослідження, а додавання левосимендану забезпечило достовірне перевищення його вихідного рівня вже на виході з перфузії. Фракція викиду на всіх етапах дослідження (крім першого) також була достовірно вище при використанні левосимендану. Ударний індекс і серцевий індекс почали перевищувати вихідні рівні в обох групах також вже на виході з перфузії, але з моменту переведення до відділення інтенсивної терапії ці показники при додаванні левосимендану були достовірно вище, ніж при використанні локального протоколу. При цьому необхідна для підтримки кровообігу доза добутаміну при використанні левосимендану була нижче майже в 3 рази. Позитивний вплив левосимендану позначився і на показниках кисневого бюджету. Після початку штучного кровообігу внаслідок необхідності в гемодилюції значно знизилася киснева ємність крові, проте, незважаючи на це, левосимендан дозволив дещо збільшити доставку кисню за рахунок достатнього для цього підвищення серцевого індексу, тоді як використання локального протоколу не змогло цього забезпечити, і транспорт кисню знизився. Рівень споживання кисню при використанні обох схем лікування був однаковим, унаслідок чого коефіцієнт екстракції кисню тканинами у хворих, які отримували левосимендан, був достовірно нижче. Закономірно, що й рівень лактату в останньому випадку був нижче, зрівнявшись із рівнем групи хворих, які не отримували левосимендан, тільки на кінець дослідження. Висновки. Левосимендан сприяє прискоренню відновлення скорочувальної здатності міокарда і поліпшенню показників кисневого бюджету при зниженні необхідної для підтримки кровообігу дози добутаміну майже в 3 рази.
Актуальность. Быстрейшее восстановление кровообращения в миокарде зачастую требует оперативного вмешательства на фоне искусственного кровообращения (ИК), в частности аортокоронарного шунтирования. Цель исследования: изучение влияния левосимендана в периоперационном периоде на состояние кровообращения и кислородного бюджета у больных, подвергшихся аортокоронарному шунтированию по поводу острого коронарного синдрома. Материалы и методы. Обследовано 85 пациентов с острым коронарным синдромом, которым было выполнено аортокоронарное шунтирование. Обследованные больные были разделены на 2 группы. У пациентов 1-й группы (n = 40) использовали локальный протокол анестезии и интенсивной терапии, принятый в Институте сердца МЗ Украины; пациентам 2-й группы (n = 45) дополнительно вводили левосимендан по следующей схеме: до индукции в наркоз 10 мкг/кг в течение 10 мин, затем со скоростью 0,1 мкг/кг/мин до 8 часов следующих после операции суток. Исследования проводили на следующих этапах: 1) перед операцией; 2) на выходе из перфузии; 3) при переводе в отделение интенсивной терапии (ОИТ); 4) при переводе из отделения интенсивной терапии. На этих этапах оценивали состояние кровообращения, кислородного бюджета в организме. Результаты. При применении локального протокола анестезии конечный систолический индекс начинал превышать исходный уровень только к концу исследования, а добавление левосимендана обеспечивало достоверное превышение его исходного уровня уже на выходе из перфузии. Фракция выброса на всех этапах исследования (кроме первого) также была достоверно выше при использовании левосимендана. Ударный индекс и сердечный индекс начали превышать исходные уровни в обеих группах также уже на выходе из перфузии, но с момента перевода в ОИТ эти показатели при добавлении левосимендана были достоверно выше, чем при использовании локального протокола. При этом необходимая для поддержания кровообращения доза добутамина при использовании левосимендана была ниже почти в 3 раза. Положительное влияние левосимендана сказалось и на показателях кислородного бюджета. После начала ИК вследствие необходимости гемодилюции значительно снизилась кислородная емкость крови, однако, несмотря на это, левосимендан позволил несколько увеличить доставку кислорода за счет достаточного для этого повышения сердечного индекса, тогда как использование локального протокола не смогло этого обеспечить, и транспорт кислорода снизился. Уровень потребления кислорода при использовании обеих схем лечения был одинаковым, вследствие чего коэффициент экстракции кислорода тканями у больных, получавших левосимендан, был достоверно ниже. Закономерно, что и уровень лактата в последнем случае был ниже, сравнявшись с уровнем группы больных, не получавших левосимендан, только к концу исследования. Выводы. Левосимендан способствует ускорению восстановления сократительной способности миокарда и улучшению показателей кислородного бюджета при снижении необходимой для поддержания кровообращения дозы добутамина почти в 3 раза.
Background. Rapid recovery of blood flow in the myocardium often requires surgical intervention with cardiopulmonary bypass, in particular — coronary artery bypass graft. The purpose of the study: to examine the influence of levosimendan in the perioperative period on the state of blood circulation and oxygen budget in patients with acute coronary syndrome undergoing coronary artery bypass graft. Materials and methods. 85 patients with acute coronary syndrome undergoing coronary artery bypass graft were examined. The examined patients were divided into 2 groups. In patients of the 1st group (n = 40), a local protocol of anesthesia and intensive care of the State Institution “Heart Institute of the Ministry of Health of Ukraine” was used, patients of the 2nd group (n = 45) additionally received levosimendan according to the following scheme: before induction into anesthesia — 10 μg/kg for 10 min, then at a rate of 0.1 μg/kg/min — to 8 hours following the day’s surgery. The research was carried out at the following stages: 1) before surgery; 2) аfter cardiopulmonary bypass; 3) transfer to the intensive care unit; 4) transfer from the intensive care unit. At these stages, the condition of blood circulation, oxygen budget in the body was assessed. Results. When there was used the local protocol, the end systolic index started to exceed the baseline level only at the end of the study, and the addition of levosimendan provided its significant excess of the baseline level аfter cardiopulmonary bypass. Ejection fraction at all stages of the study (except the first) was also significantly higher with levosimendan. Stroke index and heart index began to exceed the baseline levels in both groups also аfter cardiopulmonary bypass, but from the time of transfer to the intensive care unit, these parameters were significantly higher when levosіmendan was added than when a local protocol was used. At the same time, when levosіmendan was administered, the dose of dobutamine necessary for maintaining blood circulation was almost 3 times lower. The positive impact of levosimendan also influenced the oxygen budget. After the onset of the cardiopulmonary bypass, due to the need for hemodilution, the oxygen capacity of the blood decreased significantly, but despite this, levosimendan allowed several-fold increase in oxygen delivery due to a sufficient increase in heart index, while the use of a local protocol could not provide this, and oxygen transport decreased. The level of oxygen consumption in both groups was the same, as a result, the ratio of oxygen extraction of tissues in patients treated with levosimendan was significantly lower. It is natural that the level of lactate in the 2nd group was lower, equaling the level of the 1st group only by the end of the study. Conclusions. Levosimendan helps to accelerate the restoration of myocardial contractility, to improve the oxygen budget and may reduce the dose of dobutamine necessary to maintain blood circulation almost by 3 times.
Введение
Термин «острый коронарный синдром» (ОКС) был введен в клиническую практику, когда было достигнуто понимание того, что активные методы лечения обострения ишемической болезни сердца (в частности, тромболизис) должны начинать применяться до окончательного решения вопроса о наличии или отсутствии крупноочагового инфаркта миокарда. Развитие ОКС ведет к снижению насосной функции сердца [1], что может осложниться кардиогенным шоком [2]. Декомпенсированная сердечная недостаточность широко распространена, характеризуется большой частотой осложнений и высокой смертностью, несмотря на лечение [3]. Скорейшее восстановление кровообращения в миокарде зачастую требует оперативного вмешательства на фоне искусственного кровообращения (ИК), в частности аортокоронарного шунтирования (АКШ) [4–6].
Традиционным методом восстановления сократительной способности миокарда в периоперационном периоде при операциях с ИК является применение β1-адреномиметиков, однако в настоящее время наблюдается повышенный интерес к сенситизаторам кальция, одним из которых является левосимендан, эффективность которого показана во многих исследованиях [7–11].
Основным механизмом действия левосимендана является сенситизация сократительных белков кардиомиоцитов к кальцию. В начале систолы левосимендан избирательно связывается с насыщенным кальцием сердечным тропонином C и стабилизирует его конформацию, что запускает сокращение миофибрилл. Под действием левосимендана продлевается связь поперечных миозиновых мостиков с актином, вследствие чего растет количество связей в единицу времени на единицу объема миофибриллы и сила мышечного сокращения увеличивается [12–14]. Во время диастолы, когда концентрация кальция в миофибрилле снижается, связь левосимендана с тропонином С разрывается, поэтому расслабление миокарда не нарушается [14, 15].
Целью исследования стало изучение влияния левосимендана в периоперационном периоде на состояние кровообращения и кислородного бюджета у больных, подвергшихся АКШ по поводу ОКС.
Материалы и методы
Обследовано 85 пациентов с ОКС, которым было выполнено АКШ. Возраст больных — 56,1 ± 4,7 года. Обследованные больные были разделены на 2 группы. У пациентов 1-й группы (n = 40) использовали локальный протокол анестезии и интенсивной терапии, принятый в Институте сердца МЗ Украины, пациентам 2-й группы (n = 45) дополнительно вводили левосимендан по следующей схеме: до индукции в наркоз 10 мкг/кг в течение 10 мин, затем со скоростью 0,1 мкг/кг/мин до 8 часов следующих после операции суток.
Исходное состояние кровообращения у всех больных характеризовалось уровнем СНI-2A. Всем больным при поступлении проводили коронарографию с целью уточнения степени стенозирования коронарных артерий. В пред–операционной выполняли вводный наркоз (пропофол 1,5–2 мг/кг, фентанил 1,5–3 мкг/кг, ардуан 0,08 мг/кг), интубировали трахею и начинали искусственную вентиляцию легких (ИВЛ). Для профилактики фибрилляции и достижения коронаролитического эффекта вводили β1-адреноблокатор метопролол (2–2,5 мг), после чего пациенты поступали в операционную. Основной наркоз осуществляли севофлюраном по полузакрытому контуру (1,5–5 об%), обеспечивали газоток 3,2–3,7 л/мин, анальгезию проводили фентанилом (3–5 мкг/кг∙час). После наложения на аорту кисетного шва вводился гепарин в дозе 300 ед/кг под контролем АСТ (целевой уровень не менее 450 с) и начиналось ИК. Газоток в легкие составлял 0,45–0,9 л/мин под PEEP 4 мм H2O, испаритель севофлюрана подключался к газовой линии АИК (1,5–2,5 об%). По окончании ИК больных согревали до температуры 34–35° C и проводили электрическую дефибрилляцию в 10 Дж, после чего начинали инфузию добутамина под контролем давления в левом предсердии (целевой уровень 8–12 мм рт.ст.). Общее периферическое сосудистое сопротивление (ОПСС) нормализовали норадреналином в дозе до 200 нг/кг∙мин, коронаролитического эффекта добивались нитроглицерином в дозе 2–4 мкг/кг∙мин, фибрилляцию предупреждали метопрололом в дозе 3–7 мг болюсно. Время от индукции в наркоз до перевода пациентов из операционной составляло 4,2 ± 0,8 часа.
Исследования проводили на следующих этапах: 1) перед операцией; 2) на выходе из перфузии; 3) при переводе в ОИТ; 4) при переводе из ОИТ. На этих этапах фиксировали конечный диастолический индекс (КДИ) и конечный систолический индекс (КСИ) левого желудочка, частоту сердечных сокращений (ЧСС), концентрацию гемоглобина, гематокрит, насыщение гемоглобина кислородом (SO2), парциальное напряжение кислорода в крови (pO2), концентрацию лактата в крови. На основании полученных результатов рассчитывали фракцию выброса (ФВ) левого желудочка, ударный индекс (УИ), сердечный индекс (СИ), доставку, потребление и коэффициент экстракции кислорода (TO2, VO2, EO2).
Результаты
Исходные показатели внутрисердечной (ВСГД) и центральной гемодинамики (ЦГД) пациентов обеих групп статистически не различались между собой (табл. 1).
У 29 (72,5 ± 7,1 %) пациентов 1-й группы и у 36 (80,0 ± 6,0 %) пациентов 2-й группы ФВ была ниже 55 %, УИ был ниже 40 мл/м2 у 35 (87,5 ± 5,2 %) больных 1-й группы и у 43 (95,6 ± 3,1 %) больных 2-й группы, а СИ ниже 2,5 л/мин∙м2 отмечался у 29 (72,5 ± 7,1 %) больных 1-й группы и у 30 (66,7 ± 7,0 %) больных 2-й группы.
Характер изменений кровообращения определял показатели кислородного бюджета. В гемическом звене транспорта кислорода (уровни гемоглобина и гематокрита) у больных обеих групп патологических изменений не выявлено, концентрация гемоглобина находилась на уровне 135,3 ± 9,4 г/л и 134,5 ± 8,6 г/л соответственно в 1-й и 2-й группах (p > 0,6), гематокрит — соответственно 39,9 ± 4,5 % и 38,2 ± 4,8 % (p > 0,2). Не было статистически существенных различий между группами и в других показателях кислородного бюджета (табл. 2).
Артериовенозная разница по содержанию кислорода в крови (Ca-vO2) была выше 0,05 л/л у 23 (57,5 ± 7,8 %) больных 1-й группы и у 29 (64,4 ± 7,1 %) больных 2-й группы, доставка кислорода (TO2) ниже 0,52 л/мин∙м2 — у 32 (80,0 ± 6,3 %) пациентов 1-й группы и у 35 (77,8 ± 6,2 %) — 2-й группы. Потребление кислорода не превышало 0,11 л/мин∙м2 у 22 (55,0 ± 7,9 %) обследованных 1-й группы и у 27 (60,0 ± 7,3 %) — 2-й группы. Коэффициент экстракции кислорода тканями (EO2) превышал 0,32 % у 4 (10,0 ± 4,7 %) больных 1-й группы и у 6 (13,3 ± 5,1 %) — 2-й группы. Уровень лактата был выше 1,5 ммоль/л у 26 (65,0 ± 7,5 %) пациентов 1-й группы и у 24 (53,3 ± 7,4 %) — 2-й группы.
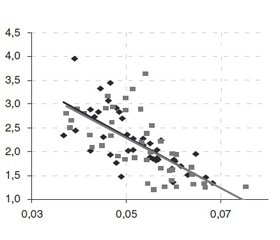
Выраженность сердечной недостаточности, оцененной по СИ, тесно коррелировала с показателями кислородного бюджета (рис. 1).
На последующих этапах исследования произо–шли следующие изменения изучаемых показателей (табл. 3).
На 2-м этапе (выход из перфузии) на фоне инфузии добутамина КДИ в обеих группах несущественно возрос без статистически значимых различий между ними. КСИ в 1-й группе уменьшился незначительно, тогда как во 2-й группе это уменьшение было более выраженным и статистически значимым как по сравнению с предыдущим этапом, так и с 1-й группой. Повышение ФВ было достоверным в обеих группах, но во 2-й группе оно было статистически более значимым, чем в 1-й группе. УИ и СИ повысились в обеих группах в статистически равной степени, хотя различия в СИ были близки к достоверным (p = 0,065). Потребность в добутамине в группах достоверно различалась, во 2-й группе она была достоверно ниже почти в 3 раза.
На 3-м этапе (перевод в ОИТ) КДИ в обеих группах повысился, оставаясь в удовлетворительных пределах, но в 1-й группе он стал достоверно выше только по сравнению с исходным уровнем, а во 2-й группе — достоверно выше по сравнению с предыдущим этапом. КСИ в обеих группах уменьшился недостоверно по сравнению со 2-м этапом, но во 2-й группе КСИ стал достоверно ниже по сравнению с исходным и с 1-й группой. ФВ в обеих группах увеличилась достоверно, но во 2-й группе она достоверно превышала уровень 1-й группы. Такие же изменения коснулись УИ и СИ. Необходимая для поддержания кровообращения доза добутамина в 1-й группе достоверно снизилась, но оставалась достоверно выше, чем во 2-й группе.
На 4-м этапе (перевод из ОИТ) КДИ в обеих группах существенно не изменился. КСИ в 1-й группе только на этом этапе стал достоверно ниже исходного уровня (во 2-й группе это произошло на предыдущем этапе), оставаясь все же достоверно ниже уровня 2-й группы. ФВ в 1-й группе повысилась достоверно по сравнению с 3-м этапом, а во 2-й группе достоверно не изменилась, однако была значимо больше, чем в 1-й группе. УИ в обеих группах повысился достоверно, но во 2-й группе он был значимо выше. СИ в обеих группах увеличился несущественно, но и он был достоверно выше во 2-й группе.
К моменту перевода пациентов из ОИТ ФВ нормализовалась практически у всех больных обеих групп (у 1 больного 1-й группы ФВ была на уровне 51 % и у 1 больного 2-й группы — 53 %), УИ не ниже 40 мл/м2 был у 80,0 ± 6,3 % пациентов 1-й группы и у 82,2 ± 5,7 % — 2-й группы, СИ не ниже 2,5 л/мин∙м2 — у 95,0 ± 3,4 % пациентов 1-й группы и у 93,3 ± 3,7 % — 2-й группы.
Динамика показателей кровообращения во время исследования определила и состояние кислородного бюджета. Кроме того, на него оказала выраженное влияние гемодилюция в связи с подключением АИК, вследствие чего кислородная емкость крови снизилась (табл. 4). Выраженность снижения кислородной емкости крови после ИК в обеих группах была одинаковой, статистически значимой разницы между группами не наблю–далось.
/139-1.jpg)
На 2-м этапе отмечалась разнонаправленная динамика SvO2 в группах: в 1-й группе она несущественно снизилась, тогда как во 2-й группе — достоверно повысилась, став значимо выше, чем во 2-й группе (табл. 5). Такой же характер носила и динамика артериовенозной разницы в насыщении гемоглобина кислородом. Различий в pO2 не наблюдалось. Содержание кислорода в венозной крови (CvO2) снизилось в обеих группах, но во 2-й группе оно было достоверно выше, чем в 1-й, хотя на артериовенозной разнице в содержании кислорода в крови это не сказалось, ее величина во 2-й группе была ниже, чем в 1-й группе, незначимо. Доставка кислорода в 1-й группе достоверно снизилась, во 2-й группе практически не изменилась и стала достоверно выше, чем в 1-й группе, но потребление кислорода, незначимо снизившись в обеих группах, осталось одинаковым. Описанные изменения сказались на коэффициенте экстракции кислорода тканями: их разнонаправленные изменения (в 1-й группе повышение, во 2-й группе — снижение) привели к появлению достоверной разницы между группами: во 2-й группе EO2 был ниже, что отразилось на уровне лактата. Он повысился в обеих группах, но во 2-й группе в меньшей степени достоверно, чем в 1-й.
На 3-м этапе SvO2 и Sa-vO2 в 1-й группе не подверглись существенным изменениям, а во 2-й группе SvO2 стала значимо выше, чем в 1-й группе, а Sa-vO2 — ниже. PO2 в 1-й группе по-прежнему осталось без изменений, во 2-й же группе pvO2 значимо повысилось и достоверно превысило уровень 1-й группы. CvO2 достоверно повысилось в обеих группах, но во 2-й группе — в значимо большей степени. Ca-vO2 на этом этапе существенно не изменилось, но в 1-й группе его превышение уровня 2-й группы было близко к достоверному (p = 0,06). VO2 достоверно возросло в обеих группах, не имея различий, хотя во 2-й группе отмечено достоверное превышение исходного уровня. EO2 во 2-й группе был значимо ниже, чем в 1-й, а уровень лактата — ниже.
На 4-м этапе во 2-й группе отмечено достоверное превышение SvO2, pvO2, CvO2 и TO2 уровней 1-й группы, а в 1-й группе — достоверное превышение Sa-vO2, Ca-vO2 и EO2 уровней 2-й группы. Уровень лактата в обеих группах был значимо ниже исходного, между группами различий не было.
Обсуждение
Полученные результаты исследования показывают, что при ОКС, требующем оперативного вмешательства с ИК, в подавляющем большинстве случаев наблюдается сердечная недостаточность, проявляющаяся снижением ФВ, УИ и СИ, то есть нарушением сократительной способности миокарда. При этом особое внимание, по-видимому, следует уделять ФВ, поскольку, если УИ просто отражает разницу между КДИ и КСИ, то ФВ скорее говорит о способности миокарда подчиняться закону Франка — Старлинга при нормальном венозном возврате. Недостаточность кровообращения закономерно определяет недостаточность транспорта кислорода и гипоксию тканей, что подтверждается не только соответствующими показателями, но и их тесной корреляционной зависимостью от показателей ЦГД.
Вследствие этого при выполнении АКШ с использованием ИК сократительная способность миокарда требует соответствующей поддержки. Использование локального протокола анестезии и интенсивной терапии, принятого в Институте сердца МЗ Украины, позволяет в большинстве случаев нормализовать ВСГД и ЦГД, однако это требует инфузии добутамина в дозе от 6,49 ± 2,33 мкг/кг∙мин по выходе из перфузии до 5,25 ± 1,90 мкг/кг∙мин при переводе в ОИТ, затем эта доза постепенно снижается. Однако добутамин повышает энергетические затраты миокарда и даже может усугубить сердечную недостаточность (по меткому высказыванию S. Kumar, «добутамин убивает хорошие сердца» [10]). Использование же сенситизаторов кальция, таких как левосимендан, повышает сократимость миокарда без увеличения потребления им энергии, вызывая в то же время артериальную, венозную и коронарную вазодилатацию [10]. Эти эффекты сенситизаторов кальция снижают потребность в добутамине, что делает менее вероятным развитие его побочных эффектов.
Результаты нашего исследования подтверждают вышесказанное. Если при применении локального протокола анестезии КСИ начинал превышать исходный уровень только к концу исследования, то добавление левосимендана обеспечивало достоверное превышение исходного уровня уже на выходе из перфузии. ФВ на всех этапах исследования (кроме первого) также была достоверно выше при использовании левосимендана. УИ и СИ начали превышать исходные уровни в обеих группах также уже на выходе из перфузии, но с момента перевода в ОИТ эти показатели при добавлении левосимендана были достоверно выше, чем при использовании локального протокола. При этом необходимая для поддержания кровообращения доза добутамина при использовании левосимендана была ниже почти в 3 раза.
Положительное влияние левосимендана сказалось и на показателях кислородного бюджета. После начала ИК вследствие необходимости в гемодилюции значительно снизилась кислородная емкость крови, однако, несмотря на это, левосимендан позволил несколько повысить доставку кислорода за счет достаточного для этого повышения СИ, тогда как использование локального протокола не смогло этого обеспечить, и транспорт кислорода снизился. Уровень потребления кислорода при использовании обеих схем лечения был одинаковым, вследствие чего коэффициент экстракции кислорода тканями у больных, получавших левосимендан, был достоверно ниже. Закономерно, что и уровень лактата в последнем случае был ниже, сравнявшись с уровнем группы больных, не получавших левосимендан, только к концу исследования.
Выводы
1. Развитие острого коронарного синдрома у больных, нуждающихся в аортокоронарном шунтировании с использованием искусственного кровообращения, ведет к снижению сократительной способности миокарда, что проявляется снижением фракции выброса левого желудочка, ударного и сердечного индексов.
2. Левосимендан способствует ускорению восстановления сократительной способности миокарда и улучшению показателей кислородного бюджета при снижении необходимой для поддержания кровообращения дозы добутамина почти в 3 раза.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. McMurray J.J. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: the task force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC / McMurray J.J., Adamopoulos S., Anker S.D., Auricchio A., Böhm M., Dickstein K., et al. // Eur. Heart J. — 2012. — Vol. 33 (14). — P. 1787-1847.
2. Thiele H. Management of cardiogenic shock / Thiele H., Ohman E.M., Desch S., Eitel I., de Waha S. // Eur. Heart J. — 2015. — Vol. 36 (20). — P. 1223-1230.
3. Моисеев B.C. Острая сердечная недостаточность. Новые возможности лечения с применением сенситизатора кальция левосимендана. — М.: Фарма Пресс, 2004.
4. Акишбая М.О. Отдаленные результаты и качество жизни пациентов после хирургической коррекции аортального стеноза // Грудная и сердечно-сосудистая хирургия. — 2006. — № 2. — C. 51-55.
5. Бокерия Л.А. Отдаленные результаты после хирургической коррекции аортального стеноза и сопутствующей ишемической болезни сердца / Л.А. Бокерия, И.И. Скопин, Т.Г Никитина с соавт. // Грудная и сердечно-сосудистая хирургия. — 2007. — № 2. — С. 12-16.
6. Yusuf S. Effect of coronary artery bypass graft surgery on survival: overview of 10-year results from randomised trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration / Yusuf S., Zucker D., Peduzzi P. et al. // Lancet. — 1994. — Vol. 344 (8922). — Р. 563-570.
7. Лобачева Г.В., Харькин A.B., Старовойтов A.A. Первый опыт применения левосимендана в комплексной интенсивной терапии низкого сердечного выброса после кардиохирургических вмешательств // Бюллетень НЦССХ им. А.Н. Бакулева РАМН, Материалы XI ежегодной сессии НЦССХ им. А.Н. Бакулева с Всероссийской конференцией молодых ученых, 2007. — М., 2007. — С. 240.
8. Яворовский А.Г. Дисфункция миокарда и синдром низкого сердечного выброса в коронарной хирургии: Автореф. дис... д-ра мед. наук: спец. 14.00.37 «Анестезиология и реаниматология» / А.Г. Яворовский. — М., 2005. — 35 с.
9. Braun J.-P., Jasulaitis D., Moshirzadeh M. et al. Levosimendan may improve survival in patients requiring mechanical assist devices for post-cardiotomy heart failure / Braun J.-P., Jasulaitis D., Moshirzadeh M. et al. // Crit. Care. — 2006. — Vol. 10. — P. 17.
10. Kumar S. Dobutamine kills good hearts! Levosimendan may not / Kumar S. // Intern. J. Cardiol. — 2003. — Vol. 1. — P. 10 14.
11. Tritapepe1 L. Levosimendan pretreatment improves outcomes in patients undergoing coronary artery bypass graft surgery / Tritapepe1 L., Santis V. De, Vitale D., Guarracino F., Pellegrini F., Pietropaoli P., Singer M. // Br. J. Anaesth. — 2009. — Vol. 102 (2). — P. 198 204.
12. Nieminen M. Hemodynamic and neurohumoral effects of continuous infusion of levosimendan in patients with congestive heart failure / Nieminen M., Akkila J., Hasenfuss G. et al. // JACC. — 2000. — Vol. 36. — P. 1903-1912.
13. Slawsky M.T. Acute hemodynamic and clinical effects of levosimendan in patients with severe heart failure / Slawsky M.T., Colucci W.S., Gottlieb S.S. et al. // Curculation. — 2000. — Vol. 102. — P. 2222-2227.
14. Lilleberg J. Effects of a new calcium sensitizer, levosimendan, on haemodynamics, coronary blood flow and myocardial substrate utilization early after coronary artery bypass grafting / Lilleberg J., Nieminen M.S., Akkila J. et al. // Eur. Heart J. — 1998. — Vol. 19. — P. 660-668.
15. Sorsa Т. Binding of levosimendan, a calcium sensitizer, to cardiac troponin / Sorsa Т., Heikkinen S., Abbott M.B. et al. // С. J. Biol. Chem. — 2001. — Vol. 276. — P. 9337-9343.

/137-1.jpg)
/138-1.jpg)
/139-1.jpg)
/140-1.jpg)