Введение
Мозговой инсульт — одна из ведущих причин заболеваемости, смертности и инвалидизации населения во всем мире. Известно, что продолжительность жизни пациента, перенесшего первый инсульт, составляет в среднем 8,8 года, а в случае развития повторного инсульта или инфаркта миокарда (ИМ) этот показатель может уменьшаться до 3,9 года [1–3, 11]. Около половины больных инсультом умирают в течение первого месяца, а из тех, кто выживает, возвращаются к труду 10 %, при этом у выживших наблюдаются выраженные неврологические нарушения, приводящие к стойкой инвалидизации [2–4, 12]. Особый интерес представляют случаи повторных нарушений мозгового кровообращения, которые встречаются у 30 % больных, в течение 12 месяцев после первого инсульта и у 15 % — в течение первых пяти лет. При этом доказано, что повторный инсульт имеет более широкий спектр неврологических, когнитивных и психоэмоциональных нарушений, которые обу–словлены не только повторным очагом церебральной ишемии, но и стойкими остаточными явлениями после первого инсульта [1, 2, 4, 8].
На сегодняшний день хорошо изучены прогностические факторы исхода первичного мозгового инсульта, при этом, по данным разных авторов, размеры очага поражения и его локализация, а также сопутствующая соматическая и кардиальная патология являются наиболее значимыми. Ряд авторов акцентируют внимание на важности биологических маркеров, являющихся индикаторами эндотелиальной дисфункции и эндогенной интоксикации — ключевых звеньев в патогенезе мозгового инсульта [3, 7, 10].
Проведены исследования в отношении влияния гендерных, возрастных и антропометрических параметров на исход инсульта [5, 8, 10]. Доказана взаимосвязь качества оказания помощи в условиях терапевтического окна и исходов заболевания [12]. Много работ посвящено взаимосвязи лабораторных показателей и клинических исходов инсультов, в частности доказана роль системы гемостаза, уровня гликемии и острофазовых белков в прогнозировании исходов инсульта [6–8, 11]. В то же время большинство авторов считают, что исход инсульта определяют много факторов, а при повторном инсульте — это целый комплекс нарушений. В связи с этим представляют интерес вопросы прогнозирования исхода острого периода повторного мозгового ишемического полушарного инсульта (ПМИПИ), ответы на которые позволяют оптимизировать тактику ведения пациентов с первых суток заболевания.
Цель работы — прогнозирование исхода острого периода ПМИПИ путем создания математических моделей на основании комплексного клинико-параклинического исследования пациентов.
Материалы и методы
На кафедре нервных болезней Запорожского государственного медицинского университета, клинической базой которой является Запорожский ангионеврологический центр при городской больнице № 6, проведено открытое сравнительное проспективное когортное исследование, которое включало 66 больных ПМИПИ в остром периоде заболевания (29 мужчин, 37 женщин, средний возраст — 74,00 ± 1,23 года). Критериями включения пациентов в исследование были: возраст от 50 до 80 лет, мозговой ишемический полушарный инсульт, подтвержденный данными компьютерной томографии (КТ), суммарный балл по шкале NIHSS 5–20. Критерии исключения: геморрагический или смешанный тип ПМИПИ, более 24 часов от развития заболевания, соматическая патология в стадии декомпенсации, анамнестические данные о черепно-мозговых травмах, злоупотреблении алкоголем. Все пациенты были распределены в две группы наблюдения: основную группу составил 41 (62,1 %) пациент (21 мужчина, 20 женщин, средний возраст — 73,63 ± 1,12 года), у которых исход острого периода заболевания был благоприятным для жизни, а контрольную — 25 (37,9 %) пациентов (16 мужчин и 9 женщин, средний возраст — 75,96 ± 1,44 года), у которых был неблагоприятный исход заболевания. Всем пациентам проведено детализированное клинико-неврологическое обследование по специально разработанному протоколу, который включал сбор анамнеза, изучение сопутствующих факторов риска, оценку соматического статуса, коморбидной патологии, тяжести инсульта с помощью шкалы инсульта Национального института здоровья (NIHSS), инвалидизации по шкале Рэнкина (mRS), нейровизуализационное (проведенное с помощью мультиспирального компьютерного томографа Siemens Somatom Spirit, Германия) и лабораторные (общеклинические и биохимические) обследования. Статистическую обработку полученных результатов проводили с помощью лицензионной программы Statistica 6.0 (StatSoft, США; серийный номер AXXR712D833214FAN5). Данные описательной статистики приведены в виде среднего и среднеквадратичного отклонения (M ± m) и медианы межквартильного размаха, Ме (Q25 : Q75). С учетом распределения данных сравнение исследуемых параметров между группами выполняли с помощью t-критерия Стьюдента и критерия Манна — Уитни. Статистически значимым принимали значение критерия p < 0,05. С целью прогнозирования исхода заболевания был проведен дискриминантный анализ, где значения дискриминационной модели больше или меньше нуля были конечными точками наблюдения и рассматривались как неблагоприятный (летальный) и нелетальный (благоприятный) исход.
Результаты и обсуждение
Сведения об исследованных нами больных основной и контрольной групп (анамнестические данные, факторы риска и сопутствующая патология) представлены в табл. 1.
Анализ распределения больных по пораженному полушарию показал, что у 31 (75,6 %) пациента основной и 13 (52 %) — контрольной группы повторный инсульт развился в правом полушарии, а у 10 (24,4 %) больных основной и 12 (48 %) — контрольной — в левом. Ипсилатеральное расположение повторного очага встречалось у 22 (53,7 %) пациентов основной группы и 9 (36 %) больных контрольной, а контрлатеральное — у 19 (46,3 %) и 16 (64 %) пациентов соответственно. Вышеуказанная тенденция свидетельствует о том, что контрлатеральное расположение ПМИПИ может ассоциироваться с летальным исходом заболевания. Атеротромботический и кардиоэмболический подтипы ПМИПИ среди пациентов основной группы наблюдения определялись у 20 (48,8 %) и 21 (51,2 %) больного, а среди пациентов контрольной группы — у 10 (40 %) и 15 (60 %) пациентов соответственно.
У пациентов основной группы наблюдения очаг повторного инсульта чаще располагался в правом полушарии и ипсилатеральном каротидном бассейне, а у пациентов контрольной группы — в правом полушарии и контрлатеральном каротидном бассейне.
Степень восстановления пациентов после перенесенного инсульта определялась суммарным баллом по шкале Рэнкина (mRS), а именно значение шкалы 0–1 балл рассматривалось как полное восстановление, а 2 балла и выше — как частичное, при этом полное восстановление определялось у 20 (48,8 %) пациентов основной группы и 6 (24 %) больных контрольной, а частичное — у 21 (51,2 %) и 19 (76 %) больных с благоприятным и неблагоприятным исходом острого периода.
Все пациенты были доставлены в стационар в течение 24 часов от дебюта ПМИПИ, при этом больные основной группы наблюдения были госпитализированы в первые 6 часов, что является важным компонентом, существенно влияющим на результаты лечения и исход острого периода заболевания.
С учетом анамнестических данных установлено, что пациенты основной группы наблюдения перенесли повторный инсульт спустя 2,5 года после первого инсульта, а пациенты контрольной группы — в среднем через 1,5 года.
Исследование факторов риска ПМИПИ выявило, что артериальная гипертензия (АГ), ишемическая болезнь сердца (ИБС), фибрилляция предсердия (ФП), сахарный диабет 2-го типа (СД2) оказались наиболее распространенными в выборке пациентов. У всех больных определялась АГ 3-й стадии, ФП — у 20 (48,8 %) пациентов основной и 15 (60 %) — контрольной группы, ИБС была представлена хронической сердечной недостаточностью (СН) 1-й ст., которая определена у 2 (4,9 %) больных основной группы наблюдения, СН 2а ст. выявлена у 36 (87,8 %) больных основной и 17 (68 %) пациентов контрольной группы, а СН 2б — у 3 (7,3 %) и 8 (32 %) больных основной и контрольной групп наблюдения соответственно, СД2 страдали 6 (14,6 %) пациентов основной группы наблюдения и 7 (28 %) — контрольной. 4 (9,8 %) пациента основной и 13 (52 %) больных контрольной группы перенесли инфаркт миокарда.
Исследование уровня сознания показало, что у 30 (73,2 %) больных основной группы было ясное сознание, умеренное оглушение — у 5 пациентов (12,2 %), глубокое оглушение — у 5 (12,2 %), сопор — у 2 (4,9 %) больных. Среди пациентов контрольной группы наблюдения ясное сознание было у 6 (24 %) больных, умеренное оглушение — у 15 (60 %), глубокое оглушение — у 2 (8 %), сопор — у 2 (8 %) больных.
Детальное клинико-неврологическое обследование позволило выявить следующие двигательные нарушения: легкий гемипарез (ОАД 4–4,5 балла) определялся у 4 (9,8 %) пациентов основной и 3 (12 %) больных контрольной группы, умеренный гемипарез (ОАД — 2,5–3,5 балла) — у 18 (43,9 %) больных основной и 8 (32 %) контрольной группы, выраженный гемипарез (ОАД 0,5–2 балла) — у 12 (29,2 %) больных основной группы и 5 (20 %) — контрольной, гемиплегия (ОАД 0 баллов) — у 7 (17,1 %) пациентов основной и 9 (36 %) больных контрольной группы наблюдения.
Суммарный балл по шкале инсульта NIHSS в 1-е сутки заболевания у пациентов основной группы наблюдения составил 9,63 ± 0,80 балла, а у больных контрольной — 14,28 ± 1,07 балла, что соответствует средней и тяжелой степени инсульта соответственно.
В конце острого периода ПМИПИ была проведена оценка его исходов. Больные основной группы наблюдения провели в стационаре 10,78 ± 0,57 койко-дня, а контрольной — 6,00 ± 0,86 койко-дня, при этом летальный исход в период с 1-го по 7-й день стационарного лечения определялся у 18 (72 %) больных, с 8-го по 14-й день — у 5 (20 %), 15 дней и выше — у 2 (8 %).
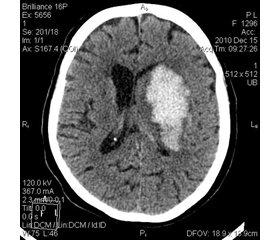
Всем больным в первые сутки заболевания для верификации диагноза проводилась компьютерная томография головного мозга, при этом учитывали локализацию, размер (определяли по форме эллипсоида: 3,14/6 • а • b • c), локализацию и объем кисты, индексы желудочков, размеры подоболочечных пространств, дислокационные процессы. Клинико-компьютерно-томографическая характеристика больных ПМИПИ приведена в табл. 2.
/24-1.jpg)
Анализ данных компьютерной томографии показал, что у 32 (78,1 %) больных основной группы и 9 (36,0 %) пациентов контрольной очаг располагался в корково-подкорковых отделах головного мозга. Подкорковое расположение очага церебральной ишемии встречалось у 9 (21,9 %) больных основной и 16 (64,0 %) пациентов контрольной групп наблюдения. При этом медиана объема очага поражения у пациентов основной группы составила 22,1 (10,0; 55,5), а у больных контрольной — 46,3 (25,0; 125,6), медиана объема кисты (признак ранее перенесенного МИПИ) — соответственно 13,5 (6,9; 32,5) и 16,9 (7,4; 23,5). Определялась статистически значимая разница индекса 4-го желудочка, при этом медиана данного показателя у пациентов основной группы составила 18,1 (17,1; 20,8), а у больных контрольной — 20,7 (17,7; 22,9).
У всех пациентов наблюдалось расширение подоболочечных пространств над лобными, теменными долями и над сильвиевой щелью, при этом у больных основной группы наблюдения медиана этих показатели составила 14,0 (12,0; 16,0), 17,0 (14,0; 18,0) и 14,0 (12,0; 17,0), а контрольной — 12,5 (11,0; 17,0), 15,0 (8,0; 21,0), 15 (11,0; 17,0) соответственно.
Данные лабораторных показателей (общий анализ крови, креатинин, глюкоза крови и коагулограмма) пациентов двух групп наблюдения приведены в сравнительной табл. 3.
Учитывая статистически значимую разницу показателей пациентов двух групп наблюдения, путем дискриминантного анализа мы построили математические модели, включающие данные анамнеза, объективного неврологического осмотра, компьютерно-томографического исследования и лабораторные показатели.
На основании данных анамнеза нами построена математическая модель, определяющая благоприятный исход при значениях результата формулы Y < 0 и неблагоприятный исход при значении Y > 0.
Y = –0,013 • X1 + 0,028 • X2 – 0,039 • X3 – 0,001 × X4 + 0,005 • X5 + 0,059 • Х6 – 0,491 • X7 + 2,798 × X8 + k,
где Y — исход; Х1 — количество месяцев после первого инсульта, Х2 — время госпитализации (от возникновения первых симптомов до назначения медикаментозного лечения), Х3 — наличие или отсутствие ФП (0 — нет, 1 — есть), Х4 — ст. СН (2а — 1, 2б — 2), Х5 — продолжительность ГБ, Х6 — балл по mRS после первого инсульта, Х7 — наличие СД, Х8 — перенесенный ИМ, k — константа канонических переменных, равная –1,950. Прогностическая ценность модели: чувствительность — 92 %, специфичность — 88 %.
Дискриминантная модель, построенная на основании данных компьютерно-томографического исследования, представлена формулой:
Y = –0,078 • X1 + 0,008 • X2 – 0,754 • X3 – 0,035 × X4 + k,
где Y — исход; Х1 — локализация очага (1 — корково-подкорковые отделы, 2 — подкорковые отделы), Х2 — объем очага (3,14/6 • а • b • c), Х3 — локализация кисты (1 — ипсилатерально очагу, 2 — контрлатерально очагу), Х4 — объем кисты (3,14/6 • а•b • c), k — константа канонических переменных, равная 1,412. Прогностическая ценность модели: чувствительность — 80 %, специфичность — 68 %, при этом благоприятный исход соответствовал значению формулы Y > 0, а неблагоприятный — Y < 0.
С учетом лабораторных показателей, которые включали данные общего анализа крови, гликемического профиля и коагулограммы, построена следующая дискриминантная модель, имеющая чувствительность и специфичность 76 и 71 % соответственно:
Y = 0,032 • Х1 + 0,526 • Х2 + 0,069 • Х3 – 0,113 × Х4 – 0,099 • Х5 – 0,012 • Х6 + 0,031 • Х7 + 11,918 × Х8 – 0,135 • Х9 + 0,147 • Х10 + 0,049 • Х11 + 0,106 × Х12 – 0,009 • Х13 + 0,195 • Х14 + k,
где Y — исход; Х1 — протромбиновый индекс, Х2 — фибриноген, Х3 — БНТ (1+, 2++, 3+++, 4++++, 5-отриц.), Х4 — гематокрит, Х5 — гликемия, Х6 — гемоглобин, Х7 — эритроциты, Х8 — цветовой показатель, Х9 — лейкоциты, Х10 — палочкоядерные нейтрофилы, Х11 — сегментоядерные нейтрофилы, Х12 — лимфоциты, Х13 — скорость оседания эритроцитов, Х14 — моноциты, k — константа канонических переменных, равная –13,592. Благоприятный исход определялся при значении Y > 0, а летальный — Y < 0.
Наиболее значимая прогностическая модель состояла из дискриминантного анализа переменных, включающих следующие показатели: пораженное полушарие (Х1, 1 — правое полушарие, 2 — левое полушарие), количество месяцев после первого инсульта (Х2), время госпитализации (Х3), длительность ГБ, лет (Х4), балл по mRS (Х5), тяжесть общего состояния (Х6, 1 — средней тяжести, 2 — тяжелое, 3 — крайне тяжелое), суммарный балл по шкале NIHSS (Х7), объем очага поражения (Х8), уровень гематокрита (Х9), глюкозы крови (Х10), гемоглобина (Х11), лейкоцитов (Х12), лимфоцитов (Х13) и скорости оседания эритроцитов (Х14).
Формула представлена в следующем виде:
Y = –0,433 • Х1 – 0,024 •Х2 + 0,046 • Х3 + 0,139 × Х4 – 0,130 • Х5 + 1,093 • Х6 + 0,009 • Х7 + 0,001 × Х8 + 0,039 • Х9 + 0,047 • Х10 + 0,0121 • Х11 + 0,159 × Х12 – 0,015 • Х13 + 0,016 • Х14 + k,
где k — константа канонических переменных, равная –7,967.
Значение формулы Y < 0 определяло благоприятный исход, а Y > 0 — летальный, прогностическая значимость дискриминантной модели: чувствительность — 92 %, специфичность — 83 %.
Таким образом, проведенное нами комплексное клинико-параклиническое обследование с разработкой математических моделей прогнозирования исхода острого периода ПМИПИ позволило сделать следующие выводы.
Выводы
1. Наиболее значимыми факторами риска неблагоприятного исхода острого периода повторного мозгового ишемического полушарного инсульта были: фибрилляция предсердий, сахарный диабет 2-го типа, сердечная недостаточность 2а степени, перенесенный инфаркт миокарда, длительность гипертонической болезни свыше 20 лет и неполное восстановление после перенесенного первого инсульта, при этом неблагоприятный исход чаще наблюдался в первые 7 суток заболевания.
2. Локализация очага поражения при повторном мозговом ишемическом полушарном инсульте в подкорковых отделах головного мозга объемом свыше 45 см3, а также кисты (после перенесенного первого инсульта) в контрлатеральном полушарии объемом свыше 15 см3 ассоциировались с неблагоприятным исходом острого периода заболевания.
3. Параклинические данные: коагулограмма, общий анализ крови, анализ крови на глюкозу — были также информативными при построении математических моделей исходов острого периода повторного мозгового ишемического полушарного инсульта.
4. Построенные математические модели с использованием клинических и параклинических данных позволяют определить тактику ведения больных в первые сутки заболевания и прогнозировать исход острого периода повторного мозгового ишемического полушарного инсульта.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/24-1.jpg)
/25-1.jpg)