Мозочкові інфаркти різні за територією ураженої артерії, розмірами інфарктного вогнища, вираженістю мозочкового рухового і нерухового синдрому, клінічним перебігом. Проте в наукових джерелах і дотепер залишається маловивченим спектр неврологічних порушень у період їх максимальної вираженості при гострих мозочкових інфарктах різних судинних територій. Описання клінічних проявів при ізольованих інфарктах мозочка має важливе значення для визначення локалізації вогнища ураження, вибору стратегії лікування, прогнозування наслідків інсульту.
Розвиток унілатерального інфаркту мозочка нерідко супроводжується одночасним або послідовним виникненням інфарктного вогнища на відстані від первинного вогнища ураження. Згідно з даними літератури попередніх і останніх років, унілатеральні мозочкові інфаркти досить часто зумовлюють синергічне зниження кровотоку і нейронального метаболізму в контрлатеральній півкулі головного мозку. Такі дистантні патофізіологічні ефекти пояснювались феноменом діашизу (Heiss W.D. et al., 1983; Jamauchi H. et al., 1991; Infeld B. et al., 1995; Переверзев И.В., 2010; Виничук С.М., 2013).
Вперше J.C. Baron та співавтори (1981) використали термін «мозочковий діашиз» для позначення зниження кровотоку та утилізації кисню в півкулі мозочка, контрлатеральній супратенторіальному півкульному інфаркту. Як виявилося в подальшому, подібний феномен виникає і в зворотному напрямку. Вперше описали його K. Broich та співавтори (1987) у пацієнта з правопівкульним мозочковим інфарктом, що поєднувався з явним дефіцитом перфузії та гіпометаболізмом у контрлатеральній лівій півкулі великого мозку, головним чином у премоторній ділянці лобової частки. Автори класифікували його як перехресний півкульний діашиз.
Механізми розвитку перехресного мозочково-півкульного діашизу залишаються недостатньо вивченими. Деякі дослідники основною причиною його виникнення вважають перерив еферентних імпульсів по мозочково-зубчастому або зубчасто-таламо-кірковому шляху до перехрестя Вернекінга у верхній ніжці мозочка (Botez M.I. et al., 1991; Rousseaux M., Steinling M., 1992). За таких умов дефіцит кровотоку і порушення метаболізму глюкози реєстрували з використанням однофотонної емісійної комп’ютерної томографії, позитронної емісійної томографії (ПЕТ) не тільки в ділянці первинного вогнища інсульту, але й в контрлатеральній півкулі головного мозку, переважно в корі лобової, тім’яної, скроневої часток (Fulham M.J., 1992; Schmahmann J.D., Caplan D., 2006; Reinhard M. et al., 2008; Шмырев В.И. и соавт., 2009).
Згідно з даними нещодавно опублікованого дослідження (Переверзев И.В., 2010), що ґрунтується на обстеженні 24 пацієнтів із мозочковим інфарктом із використанням ПЕТ, комп’ютерної томографії (КТ), магнітно-резонансної томографії (МРТ), гіпометаболічні порушення в корі контрлатеральної півкулі головного мозку і підкіркових утвореннях автор виявляв у 95,8 % хворих; структурно-морфологічних змін тканини мозку за даними КТ і МРТ не виявлено. Водночас автор зазначає, що інсульт мозочка в обстежених хворих проявлявся не тільки мозочковим дефіцитом, але й порушенням чутливості, парезами кінцівок. Перехресний мозочково-півкульний діашиз не тільки зумовлює віддалені циркуляторно-метаболічні порушення, але й може призводити до розвитку супратенторіального інфаркту (Botez M.I. et al., 1991; Виничук С.М., 2013).
Таким чином, головною віддаленою подією гострого ізольованого інфаркту мозочка є перехресний мозочково-півкульний діашиз. Він спричиняє несприятливі ефекти, зокрема порушує функціонування супратенторіальної тканини головного мозку, зумовлює синхронне або послідовне виникнення гострого пошкодження в анатомічних і функціонально взаємопов’язаних ділянках, що призводить до тяжчого неврологічного дефіциту, ніж можна було б очікувати від ураження лише певної території мозочка або півкулі головного мозку. Звичайно, супратенторіальні півкульні ураження в пацієнтів із мозочковим інфарктом можуть модулювати функціональні результати, визначати наслідки інсульту.
Однак у вітчизняній літературі практично не висвітлені особливості неврологічної клініки ізольованих інфарктів мозочка з очевидними клінічними і МР-томографічними проявами дистантного перехресного мозочково-півкульного діашизу. Виконання такого дослідження має важливе значення для діагностики проявів феномена діашизу та вибору стратегії лікування.
Мета дослідження: оцінити динаміку відновлення втрачених мозочкових рухових функцій на фоні лікування в різні періоди спостереження в пацієнтів із гострим ізольованим інфарктом мозочка та в разі перехресного мозочково-півкульного діашизу.
Матеріали та методи
Проведено комплексне клініко-неврологічне, ультразвукове допплерографічне, нейровізуалізаційне обстеження 60 хворих. До I групи увійшли 44 хворі віком від 28 до 89 років (середній вік — 59,6 ± 10,8 року), неврологічні порушення у яких при інфарктах на території верхньої артерії мозочка (ВАМ) (n = 22), задньої нижньої артерії мозочка (ЗНАМ) (n = 17) і передньої нижньої артерії мозочка (ПНАМ) (n = 5) проявлялися лише мозочковим руховим синдромом. II групу становили 16 пацієнтів віком від 32 до 84 років (середній вік — 65,3 ± 14,7 року), у яких після перенесеного ізольованого інфаркту на території ВАМ (n = 10) і ЗНАМ (n = 6) виявляли як симптоми мозочкового рухового синдрому, так і клінічні ознаки дистантного перехресного мозочково-півкульного діашизу.
Хворі госпіталізовані в клініку в перші 6–24 год після появи перших симптомів інсульту. Для об’єктивної оцінки загального неврологічного дефіциту, ступеня інвалідизації хворого використовували сучасні неврологічні шкали: NIHSS (National Institutes of Health Stroke Scale) (Lyden R. et al., 1994), модифіковану шкалу Ренкіна (Rankin J., 1957), індекс Бартел (ІБ) (Mohoney F., Barthel D., 1965), напівкількісну Міжнародну кооперативну рейтингову шкалу атаксії ICARS (International Cooperative Ataxia Rating Scale) (Trouillas P. et al., 1997).
Діагностику мозочкового інфаркту проводили за допомогою МРТ головного мозку на апараті Vantage MRI System (Японія) із напругою поля 1,5 Тл через 24–48 год після появи перших симптомів інсульту.
Статистична обробка отриманих даних проводилася з використанням пакета статистичних програм SPSS 16.0 та Stata 12. При нормальному розподілі ознак результати описані у вигляді середнього значення ± стандартне відхилення (M ± SD). Порівняння частотних характеристик показників проводилось із використанням методів порівняння пропорцій, оцінки суттєвості різниці за критерієм хі-квадрат. Довірчі межі визначали за відкоректованим методом Вальда. При зіставленні ознак, розподіл яких відрізнявся від нормального, використовувався непараметричний критерій Манна — Уїтні для порівняння двох та трьох незалежних груп. Оцінка всіх параметрів аналізу проводилась із прийнятим рівнем статистичної значимості не нижче 95 % (р < 0,05).
Результати та обговорення
Динаміка відновлення мозочкового рухового синдрому на фоні лікування (у гострий період, на 14-ту, 21-шу та 90-ту добу) в обох групах була різною.
Консервативну терапію проводили відповідно до сучасних вітчизняних рекомендацій з ведення пацієнтів з ішемічним інсультом [34]. Лікування пацієнтів передбачало також застосування препаратів із нейропротекторною активністю [28, 35]. З огляду на високу ефективність цитиколіну (Цераксон®) при гостро–му порушенні мозкового кровообігу, описану в ряді досліджень, а також добру його переносимість [28] хворим обох клінічних груп лікування гострого ізольованого інфаркту мозочка проводилось за схемою: базисна терапія та препарат Цераксон®. Базисна терапія включала: гіпотензивну, антиагрегантну, антикоагулянтну та протинабрякову терапію. Зниження артеріального тиску (АТ) проводили в перші години і першу добу, якщо систолічний тиск > 220 мм рт.ст., або діастолічний — > 120 мм рт.ст., або середній — > 130 мм рт.ст. (під час повторних вимірювань). Цільовий рівень АТ для пацієнтів з артеріальною гіпертензією підтримували на рівні 160–180/90 мм рт.ст. Через 2–3 доби розпочинали планову гіпотензивну терапію.
Як початкову терапію інфарктів мозочка використовували антиагрегантні засоби — ацетилсаліцилову кислоту 325 мг/добу впродовж 1 місяця з подальшим зменшенням дози до 100 мг/добу і тривалим прийомом. Серед ускладнень мозочкового інфаркту досить часто (17 — 54 %) виникав набряк головного мозку, пік якого здебільшого припадав на 3-тю добу [5, 10]. Тому медикаментозне лікування передбачало короткочасне проведення осмотерапії: манітол гексанітрат (200 мл 15–20% розчину на 2–3 прийоми внутрішньовенно краплинно впродовж 5 діб).
Цитиколін призначали по 1000 мг у 200 мл фізіологічного розчину хлориду натрію внутрішньовенно краплинно 1 раз на добу протягом 10–14 діб.
На фоні проведеної базисної терапії та лікування цитиколіном спостерігалась позитивна динаміка відновлення мозочкових рухових функцій у пацієнтів обох клінічних груп. Однак темпи відновлення втрачених після інсульту функцій були неоднаковими. Аналізуючи дані, одержані за допомогою шкали атаксії ICARS, у хворих I групи ми спостерігали статистично значуще зменшення середнього бала мозочкового рухового дефіциту при інфарктах на різних артеріальних територіях (табл. 1).
Як видно з наведених даних табл. 1, активнішим і швидшим був регрес атаксичних порушень у пацієнтів з інфарктами на території ВАМ і ПНАМ, ніж на території ЗНАМ (p < 0,005).
Упродовж 2 тижнів спостерігалось також значуще зменшення середнього бала неврологічного дефіциту за шкалою NIHSS до 2,0 бала при інфаркті на території ВАМ, ЗНАМ, ПНАМ (p < 0,001), що на такому ж рівні утримувався протягом всього періоду спостереження.
Повільнішими були темпи регресу атаксичних порушень у пацієнтів II групи з ізольованим інфарктом мозочка і феноменом перехресного мозочково-півкульного діашизу: у пацієнтів з інфарктом на території ВАМ — 55,8 ± 3,2 бала, ЗНАМ — 71,0 ± 4,1 бала (р < 0,001), хоча статистично вірогідну різницю показників ICARS (відповідно 38,2 ± 2,6 бала та 47,3 ± 8,9 бала; р < 0,004) і NIHSS порівняно з фоновими виявлено уже на 14-ту добу лікування.
Таким чином, у пацієнтів після гострого ізольованого мозочкового інфаркту на території ВАМ і ЗНАМ із феноменом перехресного мозочково-півкульного діашизу і через 3 міс. проспективного спостереження відмічались рухові порушення легкого ступеня за шкалою ICARS. Темпи відновлення рухових функцій значною мірою визначались ураженою судинною територією васкуляризації мозочка.
Відновлення неврологічних функцій за шкалою NIHSS було ідентичним при інфарктах на території ВАМ і ЗНАМ та на 90-ту добу спостереження відповідало рівню 3,0 ± 0,3 бала (p < 0,001).
Для оцінки наслідків мозочкових інфарктів на території васкуляризації ВАМ, ЗНАМ і ПНАМ окремо та з феноменом перехресного мозочково-півкульного діашизу в гострий і віддалений періоди пацієнти були розподілені за параметрами індексу Бартел на 3 підгрупи: повне функціональне відновлення (одужання) без залишків рухової недостатності — ІБ ≥ 95 балів; помірне відновлення втрачених функцій — ІБ ≥ 80 балів; втрата працездатності, значний ступінь інвалідизації — ІБ < 80 балів [2, 18].
Найсприятливішим був результат мозочкового інфаркту в пацієнтів з інфарктом на території васкуляризації ВАМ і ПНАМ без проявів дистантного діашизу: на території ВАМ на 14-ту добу повне функціональне відновлення зареєстровано в 57,4 % пацієнтів, помірне — у 42,6 %; на 21-шу добу — відповідно у 87,3 і 12,7 % випадків, а на 90-ту — повне функціональне відновлення було досягнуто в 100 % пацієнтів; при інфарктах на території ПНАМ на 14-ту добу повне функціональне відновлення настало у 80 % пацієнтів, помірне — у 20,0 % випадків, а на 21-шу добу в усіх хворих спостерігалось повне відновлення функцій.
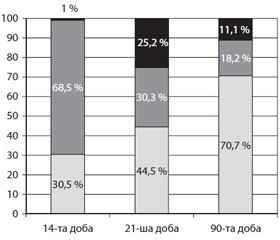
Менше сприятливими були наслідки після перенесеного інфаркту на території васкуляризації ЗНАМ: на 14-ту добу повне одужання настало в 30,5 % пацієнтів, помірне — у 68,5 % випадків, на 21-шу добу — відповідно в 44,5 і 30,3 % пацієнтів; на 90-ту добу проспективного спостереження в значної більшості обстежених (70,7 %) настало повне функціональне відновлення і в 18,2 % випадків — помірне відновлення функцій (рис. 1).
Іншим був розподіл наслідків після ізольованого інфаркту мозочка на артеріальних територіях ВАМ і ЗНАМ з урахуванням наявного перехресного мозочково-півкульного діашизу при інфарктах на території васкуляризації ВАМ: на 14-ту добу повне функціональне відновлення настало в 40 % обстежених, ще в такої ж кількості (40 %) — помірне; на 21-шу добу — відповідно в 50 і 30 % випадків; добрі результати досягнуті лише на 90-ту добу — відповідно в 70 і 20 % випадків (рис. 2).
На території ЗНАМ на 14-ту добу лише в 16,7 % випадків спостерігалось повне функціональне відновлення, у 50 % — помірне, ще в третини (33,3 %) обстежених зберігалась утрата працездатності; на 21-шу добу повне і помірне відновлення функцій наставало з однаковою частотою (33,3 %); на 90-ту добу в 50 % обстежених зареєстровано повне відновлення неврологічних функцій, у 33,3 % — помірне (рис. 3).
Окремого уточнення потребувало питання стосовно короткострокових і довгострокових наслідків ізольованого інфаркту мозочка та рівня самообслуговування в групах пацієнтів без клінічних проявів перехресного мозочково-півкульного діашизу (I група) і хворих із клінічними і МР-томографічними ознаками перехресного мозочково-півкульного діашизу (II група) без урахування ураженої артеріальної території.
На 14-ту добу лікування повне функціональне відновлення в пацієнтів I та II досліджуваних груп спостерігалось відповідно в 46,3 і 31,3 % і було статистично вірогідним щодо початкового рівня (p < 0,05), але відмінності між групами хворих були статистично незначущими (р < 0,48). Щодо помірного відновлення функцій, то воно з однаковою частотою виявлялoся в пацієнтів обох груп (відповідно в 37,6 і 43,7 % випадків).
Позитивні результати в пацієнтів досліджуваних груп досягнуті на 21-шу добу спостереження: повне функціональне відновлення спостерігалося відповідно в 68,3 і 37,5 % випадків. Відмінності між групами за даними показниками були статистично значущими (р < 0,05). Втрата працездатності в пацієнтів із проявами діашизу зберігалась на попередньому рівні (25 %).
На 90-й день проспективного спостереження повне функціональне відновлення після мозочкового інфаркту без проявів дистантного діашизу виявлено у 85,4 % хворих, з проявами перехресного мозочково-півкульного діашизу — у 62,5 % обстежених, тобто статистична різниця між показниками вирівнювалася (р = 0,353); втрата працездатності утримувалась відповідно в одного (2,4 %) і двох (12,5 %) пацієнтів.
Висновки
Неврологічний дефіцит після ізольованого інфаркту мозочка з феноменом перехресного мозочково-півкульного діашизу характеризувався не тільки типовим мозочковим руховим синдромом, але й руховим і чутливим дефіцитом за рахунок ураження кори лобових і тім’яних часток контрлатеральної півкулі головного мозку, що знаходяться поза межами васкуляризації мозочкових артерій.
Додавання цитиколіну в проведеному дослідженні, на нашу думку, посилило позитивний ефект базисної терапії в різні періоди ізольованого інфаркту мозочка, що проявлялась як у зменшенні вираженості клінічних проявів мозочкового рухового синдрому, так і в повному їх регресі.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Виничук С.М. Диашиз и его роль в развитии рефлекторно-двигательных расстройств при мозговом инсульте // Укр. мед. часопис. — 2013. — 5(73). — 1-5.
2. Віничук С.М., Фартушна О.Є. Прогнозування ризику розвитку повторного інсульту після перенесеної транзиторної ішемічної атаки у пацієнтів з осередком інфаркту за даними МРТ та без нього // Укр. мед. часопис. — 2009. — 5(73). — 53-57.
3. Лебедев В.В., Крилов В.В., Тиссен Т.П., Халчевский В.М. Компьютерная томография в неотложной нейрохирургии. — М., 2005. — 360 с.
4. Переверзев И.В. Метаболические нарушения в головном мозге у больных, перенесших инсульт мозжечка // Врач. — 2010. — 5. — 77-79.
5. Шмырев В.И., Рудас М.Н., Переверзев И.В. Метаболические нарушения при инсультах мозжечка (сопоставление с данными позитронно-эмиссионной томографии) // Кремлевская медицина. Клинический вестник. — 2009. — 2. — 152-155.
6. Amarenco P. The spectrum of cerebellar infarctions // Neuro–logy. — 1991. — 41. — 973-979.
7. Amarenco P., Cuse C.S., Rosengart A. et al. Very small (border zone) cerebellar infarcts: distribution, mechanisms, causes and clinical features // Brain. — 1993. — 116. — 161-186.
8. Baron J.C., Bousser M.G., Comar D. et al. Crossed cerebellar diaschisis in human supratentorial brain infarction // Trans. Am. Neurol. Assoc. — 1981. — 105. — 459-461.
9. Botez M.I., Léveilé J., Lambert R. et al. Single photon emission computed tomography (SPEСT) in cerebellar disease: cerebello-cerebral diaschisis // Eur. Neurol. — 1991. — 31(6). — 405-412.
10. Broich K., Hartmann A., Biersack H.J., Horn R. Crossed cerebello-cerebral diaschisis in a patient with cerebellar infarction // Neurosc. Lett. — 1987. — 83(1–2). — 7-12.
11. Canaple S., Bogousslavsky J. Multiple large and small cerebellar infarcts // J. Neurol. Neurosurg. Psychiatry. — 1999. — 66. — 739-745.
12. Cristomoto R.A., Gorcia M.M., Tong D.C. Detection of diffusion — weighted attack and minor stroke patients using acute magnetic resonanse imaging // Ann. Neurol. — 2003. — 57(6). — 848-859.
13. Fulham M.J., Brooks R.A., Hallet M. et al. Cerebellar diaschisis revisited: pontine-hypometabolism and dentate sparing // Neurology. — 1992. — 42. — 2267-2273.
14. Grips E., Sedlaczek O., Bazner H. et al. Supratentorial age-related white matter changes predict outcome in cerebellar stroke // Stroke. — 2005. — 36. — 1988-1993.
15. Heiss W.D., Pawlik G., Wagner R. et al. Functional hypometabolism of noninfarcted brain regions in ischemic stroke // J. Cereb. Blood Flow Metab. — 1983. — 3 (Suppl. 1). — 582-583.
16. Infeld B., Davis S.M., Lichtenstein M. et al. Crossed cerebellar diaschisis and brain recovery after stroke // Stroke. — 1985. — 26. — 90-95.
17. Juttler E. Expansive cerebellar stroke-how to deteсt and treat? // 14th Congress of the European Federation of Neurological Societies, Geneva, Switzerland, September 28–30, Teaching Course 3. — 2010. — 1-22.
18. Kim H.-A., Lee H., Sohn S.I. et al. Bilateral infarcts in the territory of the superior cerebellar artery: clinical presentation, presumed cause and outcome // J. Neurol. Sci. — 2006. — 246. — 103-109.
19. Korbel E., Razdera L., Searls E. Clinical features of vertebrobasilar infarcts in the New England medical center posterior circulation registry / 19th World Congress of Neurology, Poster Abstracts // J. Neurol. Sci. — 2009. — 285(SI). — 174.
20. Kumral E., Kisabay A., Atac C. et al. Spectrum of the posterior inferior cerebellar artery territory infarcts. Clinical-diffusion-weighted imaging correlates // Cerebrovasc. Dis. — 2005. — 20. — 370-380.
21. Lyden P., Trott T., Tilley B. et al. Improved reability of the NIN Stroke Scale using video training. NINDS tPA Stroke Study Group // Stroke. — 1994. — 25. — 2220-2226.
22. Mohoney F., Barthel D. Functional evolution: the Barthel Index // MD State Med. J. — 1965. — 14. — 61-65.
23. Moon I.S., Kim J.S., Choi K.D. et al. Isolated nodular infarction // Stroke. — 2009. — 40. — 487-491.
24. Rankin J. Cerebral vascular accidents in patients over the age of 60: prognosis // Scott. Med. J. — 1957. — 2. — 200-215.
25. Reinhard M., Waldkircher Z., Timmer J. et al. Cerebellar autoregulation dynamics in humans // Journal of Cerebral Blood Flow. Metabolism. — 2008. — 28. — 1605-1612.
26. Rousseaux M., Steinling M. et al. Crossed hemispheric diaschisis in unilateral cerebellar lesions // Stroke. — 1992. — 23. — 511-514.
27. Schmahmann J.D., Caplan D. Cognition, emotion and cerebellum // Brain. — 2006. — 129. — 288-292.
28. Secades J.J., Alvarez-Sabín J., Castillo J. at al. Citicoline for Acute Ischemic Stroke: A Systematic Review and Formal Meta-analysis of Randomized, Double-Blind, and Placebo-Controlled Trials // Stroke. — 2016. — 25(8). — 1984-96. — doi: 10.1016/j.jstrokecerebrovasdis.2016.04.010. Epub 2016 May 24.
29. Tatu L., Maulin T., Bogousslavsky J. et al. Arterial territories of human brain: brainstem and cerebellum // Neurology. — 1996. — 47(5). — 1125-1135.
30. Trouillas P., Takayanagi T., Hallet M. et al. International Cooperative Ataxia Rating Scale for pharmacological assessment of the cerebellar syndrome // J. Neurol. Science. — 1997. — 145. — 205-211.
31. von Monakow C. Neuegesichtspubcte in der frage nach der lokalisation im grosshirm. — Wiesbaden: J.F. Bergman, 1911. — 20 р.
32. Yamauchi H., Fukuyama H., Kimura J. Hemodynamic and metabolic changes in crossed cerebellar hypoperfusion. — 1992. — 23. — 855-860.
33. Ye B.S., Kim J.D., Nam H.S. et al. Clinical manifestations of cerebellar infarcts according to specific lobular involvement // Cerebellum. — 2010. — 9. — 571-579.
34. Ішемічний інсульт (екстренна, первинна, вторинна (спеціалізована) медична допомога, медична реабілітація). Уніфікований клінічний протокол медичної допомоги: Наказ МОЗ України № 602 від 03.08.2012 р. — Київ. — С. 120 (http://www.moz.gov.ua).
35. Dávalos A., Castillo J., Álvarez-Sabín J. et al. Oral Citicoline in Acute Ischemic Stroke: An Individual Patient Data of pooling analysis of Clinical Trials // Stroke. — 2002. — 33. — 2850-2857. — doi: 10.1161/01.STR.0000038691.03334.71.

/40-2.jpg)
/40-1.jpg)
/41-1.jpg)