Вступ
Щорічно в Україні реєструють 100–120 тис. нових випадків мозкового інсульту, більша частина яких має ішемічний характер. Зважаючи на те, що близько 50 % хворих помирає протягом 1 року після перенесеного інсульту, а більша частина тих хворих, які вижили, залишаються інвалідами, пошук шляхів оптимізації інтенсивної терапії в гострому періоді інсульту та наступної реабілітації є важливим медичним завданням [1–4]. Розуміння процесів, що відбуваються в ішемізованих тканинах, їх впливу на гомеостаз організму необхідне для застосування патогенетично обґрунтованої схеми лікування.
Ішемічний інсульт нерідко супроводжується розвитком набряку головного мозку, що значно погіршує його прогноз. У той же час низка заходів з профілактики та адекватна терапія, якщо набряк все ж виник, здатні суттєво покращити результати лікування. Останніми роками обґрунтованою вважається тактика підтримання нормоволемії та нормоосмолярності в плазмі крові хворого [5, 6].
Порожнина черепа — це перш за все обмежений об’єм. Згідно з доктриною Монро — Келлі, всередині нього має утримуватися динамічна рівновага трьох складових: мозку, ліквору й крові. При збільшенні об’єму одного з інгредієнтів або при появі нового, наприклад гематоми, об’єм решти складових компенсаторно зменшується. Якщо цього не відбувається, спостерігається підвищення внутрішньочерепного тиску (ВЧТ) і розвиток дислокації мозку. Доктрина Монро — Келлі існує більше двохсот років і добре поєднується з концепцією запобігання вторинній ішемії головного мозку при ішемічному інсульті. Схематично можна накреслити таку послідовність подій. Наростаюча ішемія мозку викликає його набряк із збільшенням об’єму церебральної тканини. Підвищення мозкового об’єму супроводжується збільшенням ВЧТ. Внутрішньочерепна гіпертензія перешкоджає адекватному кровотоку, знижуючи церебральний перфузійний тиск. Це, у свою чергу, поглиблює ішемію й набряк мозку. Відповідно до доктрини для профілактики вторинних пошкоджень необхідні заходи щодо забезпечення адекватної церебральної перфузії й оксигенації, що зменшує вірогідність поширення ішемічних пошкоджень і набряку мозку. Отже, ці лікувальні дії фактично є засобами протинабрякової терапії [10].
Чим же по суті є набряк? Це збільшення кількості рідини в тканинах за межами судин. Коли йдеться про водно-електролітний гомеостаз організму, всю рідину поділяють на дві частини: більша частина знаходиться всередині клітини (66 %), а менша — позаклітинно, розподіляючись у судинах та інтерстиції. Утримуючи об’ємне співвідношення між цими трьома секторами (внутрішньоклітинний, інтерстиціальний (міжклітинний) та внутрішньосудинний простори), забезпечуємо нормальне функціонування організму. При збої цього балансу клітина або бубнявіє, або зморщується, або ж спостерігається набряк мозку — накопичення рідини в міжклітинному просторі [5, 10].
Щоб зберегти рівновагу трьох основних секторів в організмі, слід розуміти їх властивості. Так, плазма (внутрішньосудинний простір) та інтерстиціальна рідина відрізняються за складом тільки за рахунок концентрації білків; в інтерстиції білка менше. Така різниця створює колоїдно-осмотичний тиск, що дозволяє переміщувати рідину з інтерстицію в судинне русло. А електролітний склад цих двох рідин однаковий.
Для того щоб клітина нормально функціонувала, і температура, і склад цитоплазми повинні утримуватися у вузьких межах нормального гомеостазу. Склад цитоплазми відрізняється від складу інтерстиціальної рідини. Але осмолярність внутрішньоклітинної й інтерстиціальної рідин однакова та становить 285–310 мосмоль/л.
Увесь обмін речовин між клітиною та інтерстиціальним простором відбувається через клітинну мембрану. Підтримка гомеостазу — енергоємний процес, тому гіпоксія й голод — це основні фактори клітинного ушкодження.
Отже, метою осмотичної регуляції є підтримка постійного об’єму клітини. Простими осмолітами — речовинами, що впливають на переміщення води через клітинну мембрану для підтримки об’єму клітини — є неорганічні іони, такі як натрій, калій, хлор, магній, кальцій, іони фосфату, сульфату й гідрокарбонату. Натрію, калію й хлору належить найбільша роль у регуляції об’єму клітини. Крім того, всі органічні речовини, розчинені в цитоплазмі, також беруть участь у підтриманні осмотичної рівноваги відповідно до законів осмосу.
Na+ — це основний катіон, що створює електричний потенціал позаклітинної рідини: у нормі в клітині — негативний заряд, в інтерстиціальному просторі — позитивний. Рівень Na+ формує осмолярність плазми та інтерстиціальної рідини. Цей електроліт майже повністю відсутній в цитоплазмі й не проходить у клітину. Клітинна мембрана вільно пропускає тільки воду й речовини, що розчинні в жирах. Це кисень, вуглекислий газ, сечовина, етанол і метанол. Інші розчинні речовини проходять через клітинну мембрану через спеціально керовані канали або в результаті активного транспорту, що виконують білки-переносники. Тому зниження концентрації Na+ в інтерстиції призводить до переміщення води в клітину — клітина набухає. Підвищення концентрації Na+ в інтерстиції призводить до переміщення води з клітини в міжклітинний простір — клітина зморщується.
У табл. 1 подано стан свідомості хворих відповідно до рівня Na+ в плазмі крові.
Варіанти набряку мозку:
— цитотоксичний;
— осмотичний;
— вазогенний;
— фільтраційний.
Набряк виникає при оклюзії:
— ВСА;
— проксимального відділу CМA.
Перший варіант набряку, цитотоксичний, який ще називають набуханням головного мозку, зумовлений порушенням проникності мембран унаслідок несправності калій-натрієвого насосу, коли в клітині накопичується Na+, а разом з ним і вода. Робота Na+-K+-АТФази досить енерговитратна: для викидання всього трьох іонів Na+ з клітини необхідно багато енергії для перетворення АДФ у АТФ. Це неможливо при ішемії й досить проблематично при гіпоксії. Цитотоксичний набряк локалізується переважно в сірій речовині головного мозку, там, де розташовані тіла нейронів — найбільш енергозалежних клітин.
Вазогенний набряк (це і є власне набряк) виникає при порушенні функцій гематоенцефалічного бар’єра, що призводить до підвищення проникності мозкових капілярів, унаслідок чого відбувається ексудація білків, а також будь-яких інших розчинених в плазмі речовин і рідини в міжклітинний простір. Небезпека цього набряку залежить від кількості ушкоджених капілярів. Він більш виражений у білій речовині головного мозку. Гідростатичний набряк, як варіант вазогенного, спостерігається при гострій гіпертензивній енцефалопатії в результаті прямої передачі гідростатичного тиску на капіляри головного мозку й найчастіше виникає на тлі гіперволемії. Перитуморозний набряк мозку за механізмом розвитку також вважається варіантом вазогенного.
Осмотичний набряк розвивається в результаті порушення осмотичного градієнта внутрішньоклітинного й внутрішньосудинного секторів при непошкодженому гематоенцефалічному бар’єрі. При цьому вода переміщується із судинного русла в тканину мозку, що спостерігається при надлишковому вживанні води й при розвитку синдрому надмірної секреції антидіуретичного гормону, в умовах гемодіалізу або при швидкій корекції гіперглікемії при лікуванні гіперосмолярно-гіперглікемічного стану.
Інтерстиціальний набряк ще називають гідроцефальним; він розвивається при арезорбтивній або оклюзійній гідроцефалії. Під впливом підвищеного лікворного тиску відбувається посилена фільтрація ліквору в перивентрикулярну зону мозку, що виявляється зниженням щільності мозкової речовини за даними комп’ютерної томографії.
Зазвичай при набряку мозку має місце поєднання кількох механізмів.
У патогенезі набряку головного мозку при ішемічному інсульті найважливішу роль відіграють два компоненти — цитотоксичний та вазогенний.
Так, унаслідок ішемії з критично низьким енергетичним потенціалом і викликаної нею аноксичної деполяризації порушується функція калій-натрієвого насосу, у результаті чого калій виходить, а натрій, навпаки, заходить у надмірній кількості в клітини. Вода за законом осмосу надходить слідом за натрієм у клітини нейроглії та нейрони, що викликає цитотоксичний набряк головного мозку. Виникає набухання ней–ронів, і перш за все астроцитів, що розташовані навколо капілярів. Важливим є те, що й ендотеліоцити також набухають. Якщо швидко відновити кровотік, відбувається регрес цих змін. Але при тривалій ішемії просвіт капілярів за рахунок набухлих структур (ендотелію — зсередини, астроцитів — ззовні) звужується (але самі судини не спазмують!) настільки, що навіть після відновлення плину кров не надходить у капіляри, проникність гематоенцефалічного бар’єра продовжує збільшуватися й набряк наростає.
Водночас унаслідок ішемії також відбувається пошкодження гематоенцефалічного бар’єра. Особливістю церебральних капілярів є дуже щільні контакти між ендотеліальними клітинами порівняно з іншими тканинами організму. Це необхідно для того, щоб вода та інші компоненти крові взагалі не проникали між ендотеліоцитами — щоб не відбувався пасивний транспорт. Увесь обмін речовин через гематоенцефалічний бар’єр здійснюється через мембрани ендотеліоцитів. Ішемія при інсульті вражає не тільки нейрони та нейроглію, але й ендотеліоцити мозкових капілярів, викликаючи накопичення в них рідини. Унаслідок цитотоксичного набряку ендотеліоцитів контакти між ними розтягуються, слабшають, тобто створюються умови для проникнення рідини в міжклітинний простір.
Набряк головного мозку в пацієнтів з ішемічним інсультом може розвиватись із різною швидкістю. У деяких випадках має місце блискавичний перебіг (24–36 год), в інших — поступово прогресуючий (протягом кількох днів). Чим повільніше це відбувається, тим більше можливостей у лікарів зупинити його прогресування.
У яких же пацієнтів варто очікувати розвитку набряку мозку, щоб застосувати відповідні профілактичні заходи? На жаль, високоспецифічних методів прогнозування на сьогодні немає, однак деякі закономірності все ж виявлені. Так, предикторами та факторами ризику розвитку набряку мозку на тлі ішемічного інсульту є:
— дифузне сповільнення й збільшення амплітуди дельта-активності на електроенцефалограмі в перші 24 години;
— такі симптоми, як геміплегія, тотальна або виражена афазія, виражена дизартрія, парез погляду, неглект, ранній синдром Горнера, рання нудота та блювання;
— ступінь тяжкості інсульту за шкалою NIHSS (National Institutes of Health Stroke Scale) понад 20 балів для домінуючої півкулі та понад 15 балів — для недомінуючої;
— застійна серцева недостатність;
— лейкоцитоз;
— жіноча стать.
Немає чутливих методів для передбачення набухання/набряку мозку та його перебігу. За деякими даними, дифузне сповільнення й збільшення дельта-активності на електроенцефалограмі в перші 24 години може вважатись ознакою ймовірного скорого набряку.
Профілактика набряку головного мозку при інсульті передбачає оптимізацію перфузії, оксигенації та венозного дренажу, зниження метаболічних потреб мозку, уникнення втручань, що можуть погіршувати іонний та осмолярний градієнт. Важливі контроль та підтримка нормального артеріального тиску (АТ), підвищене положення верхньої частини тіла (приблизно на 30 градусів), достатнє харчування (ентеральне чи парентеральне), емоційний спокій. Важливим є моніторинг кількості рідини, що вводиться й виводиться, і аналіз водно-електролітного статусу з контролем і підтримкою осмолярності крові. Неприпустимим є використання осмотично активних препаратів в умовах гіпернатріємії й гіпоосмолярних синдромів.
Слід враховувати, що в людини масою 70 кг втрата води при мінімальних фізичних навантаженнях приблизно така: сеча — 1500 мл (60 %), втрата через шкіру й легені — 700 мл (28 %), піт — 200 мл (8 %), фекалії — 100 мл (4 %), усього — 2500 мл.
При підвищенні температури тіла на 1 градус Цельсію організм втрачає ще 500 мл рідини. Надходження рідини становить: випита рідина — 1500 мл (60 %), їжа — 750 мл (30 %), метаболічна вода — 250 мл (10 %), усього — 2500 мл. Рекомендовано утримувати позитивний водний баланс, дотримуючись постулатів 3H-терапії: керована артеріальна гіпертензія та гіперволемічна гемодилюція (Triple-H: Нypertension, Нypervolemia, Нemodilution).
На осмолярність крові при інсульті можуть впливати зовнішні чинники, наприклад неадекватна інфузійна терапія або, що спостерігається частіше, відсутність питного режиму, недостатнє харчування. Якщо осмолярність плазми знижується до < 290 осмоль/л, рідина починає переміщуватися з судинного русла до тканин, зокрема головного мозку, що викликає його набряк. Отже, у пацієнтів з інсультом важливо контролювати осмолярність крові (кілька разів на день, оскільки рівень швидко змінюється) та підтримувати її в діапазоні 290–320 осмоль/л (у нормальному стані осмолярність крові становить 280–300 осмоль/л). Для розрахунку рівня осмолярності використовуються наступні формули: 2 × Na+ + глюкоза + сечовина, або 2 × (Na+ + K+), або 1,862 × (Na+ + глюкоза + сечовина) + 9.
Найбільш доступним, але досить приблизним може бути такий розрахунок осмолярності крові: Na+ × 2.
З того часу, як у 1919 році було встановлено вплив осмолярності на вміст води в мозку, внутрішньовенне введення гіпертонічних розчинів стало наріжним каменем у лікуванні набряку мозку й внутрішньочерепної гіпертензії. Згідно з доктриною Монро — Келлі підвищений ВЧТ лікували, впливаючи на об’єм інтракраніальних судин за допомогою гіпервентиляції або зменшуючи об’єм ліквору. В ургентних випадках зменшували об’єм мозку шляхом введення гіпертонічних розчинів, зокрема сорбітолу, або зниження в’язкості крові (гемодилюція!), або ж вазоконстрикції (не розширювати судини!). Для зниження ВЧТ також використовували осмотерапію.
У літературі поняття «протинабрякова терапія» замінене термінами «корекція внутрішньочерепної гіпертензії» або «зниження ВЧТ».
При веденні пацієнтів з інсультом та набряком головного мозку доцільно керуватися в першу чергу рекомендаціями Американської асоціації серця (AHA) та Американської асоціації інсульту (ASA) — єдиним на сьогодні досить детальним клінічним керівництвом з цієї теми, що було опубліковане у 2014 році [52].
Згідно з цією клінічною настановою, значна роль у веденні пацієнтів з інсультом та набряком головного мозку відводиться адекватній інфузійній терапії з використанням ізотонічних розчинів (клас рекомендації IIb, рівень доказів С). При її проведенні не рекомендовано використання гіпотонічних чи гіпоосмолярних розчинів (клас рекомендації III, рівень доказів С). Інфузійну терапію слід проводити під контролем діурезу (мета — нульовий баланс рідини).
Осмотичні діуретики (манітол, гіпертонічні та гіпер–осмолярні розчини) не рекомендовано застосовувати з профілактичною метою при інсульті (клас рекомендації III, рівень доказів С), але їх призначення доцільне при прогресуючому погіршенні набряку головного мозку (клас рекомендації IIа, рівень доказів С). Загалом застосування осмодіуретиків як гіперосмолярних розчинів може призвести до порушення функціонального стану гематоенцефалічного бар’єра за рахунок збільшення міжендотеліальних щілин. Салуретики в лікуванні набряку головного мозку використовувати взагалі заборонено [52].
Тонічність інфузійних розчинів:
— р-н Рінгера лактат — 273 мОсм/л;
— р-н глюкози 5% — 286 мОсм/л;
— гекодез — 300 мОсм/л;
— 0,9% NaCl — 308 мОсм/л;
— р-н Рінгера — 309 мОсм/л;
— альбумін 5% — 350 мОсм/л;
— глюкоза 10% — 586 мОсм/л;
— Е-АКК — 670 мОсм/л;
— гекотон — 890 мОсм/л;
— реосорбілакт — 900 мОсм/л;
— манітол — 1382 мОсм/л;
— сорбілакт — 1670 мОсм/л;
— 7,5% NaCl — 2400 мОсм/л.
Конкретні цільові показники артеріального тиску в цієї категорії хворих не встановлені, але при вираженій гіпертензії (> 220/105 мм рт.ст.), що характеризується високим ризиком геморагічної трансформації, варто розглянути доцільність антигіпертензивної терапії (клас рекомендації IIb, рівень доказів C) [52].
Дуже важливим є агресивне лікування серйозних порушень серцевого ритму (фібриляція передсердь зі швидкою шлуночковою відповіддю) з подальшим його моніторингом (клас рекомендації I, рівень доказів C).
Ефективність гіпотермії, барбітуратів та кортико–стероїдів при набряку мозку в пацієнтів з ішемічним інсультом не доведено, тому на сьогодні ці методи не рекомендовані до рутинного застосування (клас рекомендації III, рівень доказів С). Кортикостероїди ефективні при вазогенному набряку, що супроводжує пухлини, запальні процеси, хірургічні втручання тощо, але, згідно з результатами відповідного огляду Кокранівського товариства, вони виявились неефективними при ішемічному інсульті.
Що стосується температурного режиму, то, оскільки ефективність гіпотермії не доведено, визнано доцільним підтримувати нормальну температуру (клас рекомендації IIа, рівень доказів С).
Недоцільною визнана профілактика судом за їх відсутності в пацієнта з огляду на відносно невисокий ризик розвитку цього ускладнення (клас рекомендації III, рівень доказів С).
Згідно з наказом № 602 [6]:
— необхідно підтримувати нормоволемію;
— введення рідини має становити не менше від добової потреби (30–35 мл/кг/добу): m = 80 кг, V ріди-
ни/добу = 2400–2800 мл;
— якщо при госпіталізації в пацієнта є ознаки гіповолемії (низький артеріальний тиск, підвищений гематокрит (Ht), сухість слизових оболонок) і немає протипоказань (декомпенсована серцева недостатність), інфузійна терапія може бути призначена в об’ємі 1000–1500 мл 0,9% розчину NaCl або р-ну Рінгера;
— для проведення інфузійної терапії в непритомних пацієнтів рекомендована постановка центрального венозного катетера, що дозволяє проводити моніторинг центрального венозного тиску, який бажано підтримувати на рівні 80–100 мм вод.ст.
Гематокрит у хворих з гострим розладом мозкового кровообігу (ГРМК) при надходженні у відділення інтенсивної терапії:
— Ht ≤ 0,35 л/л — 4,8 %;
— Ht ≥ 0,35–0,55 л/л — 38,4 %;
— Ht ≥ 0,55 л/л — 44,8 %;
— Ht ≥ 0,65 л/л — 12 %.
≈ 95 % хвориx з ГРМК необхідна інфузійна корекція агрегатного стану крові!
Терапевтична гемодилюція
Показання — гематокрит вище від 0,45 л/л.
Види:
1. Гіперволемічна: при Ht > 0,45 л/л.
Методика: 500 мл 0,9% NaCl упродовж 1 години, далі 1000–1500 мл розчину Рінгера до кінця доби + рідина перорально (у зонд в об’ємі фізіологічної потреби).
2. Ізоволемічна: при Ht > 0,55 л/л. Методика: ексфузія 300–500 мл крові + 500–1000 мл 0,9% NaCl чи розчину Рінгера впродовж 1–2 годин + рідина перорально (у зонд в об’ємі фізіологічної потреби).
Церебральний перфузійний тиск (ЦПТ)
Норма ЦПТ: 90–95 мм рт.ст.
Розрахунок:
ЦПТ (мм рт.ст.) = АТ сер. – ЛТ, або ЦПТ (мм рт.ст.) =
= АТ сер. – ЦВТ.
Сист. АТ (мм рт.ст.) = АТ діаст. + 1/3 пульсового тиску.
Пульсовий тиск = АТ сист. – АТ діаст.
Коефіцієнт перерахунку мм водн.ст. в мм рт.ст. = ÷ 13,6.
Незатратні неінвазивні розрахунки ВЧТ та ЦПТ за даними локації середньої мозкової артерії методом дуплексного сканування
Чутливість — низька.
ЦПТ = АТ сер. – ВЧТ = 100 мм рт.ст./N.
ВЧТ — не більше від 10 мм рт.ст./N.
Якщо АТ сер. = ВЧТ, то ЦПТ = 0.
Важливе місце в рекомендаціях посідають нейрохірургічні методи лікування. Зокрема, у пацієнтів віком < 60 років з одностороннім інфарктом у басейні середньої мозкової артерії, неврологічний статус яких невпинно погіршується протягом 48 годин, незважаючи на максимальну медикаментозну терапію, ефективним методом лікування визнано декомпресійну краніектомію (клас рекомендації I, рівень доказів В). Відповідно, у пацієнтів із мозочковим інсультом і погіршенням неврологічного статусу, незважаючи на потужну медикаментозну терапію, рекомендовано виконання субокципітальної краніектомії (клас рекомендації I, рівень доказів В). Як критерій відбору пацієнтів для хірургічного втручання експерти AHA/ASA рекомендують зниження рівня свідомості (клас рекомендації IIa, рівень доказовості А). Ефективність та оптимальний час проведення декомпресійної краніектомії в пацієнтів, старших за 60 років, не визначено (клас рекомендації IIa, рівень доказовості А).
У керівництві підкреслюється, що рутинний моніторинг внутрішньочерепного тиску при гемісферному ішемічному інсульті не показаний (клас рекомендації III, рівень доказів С). Ця рекомендація пояснюється тим, що клінічне погіршення частіше за все зумовлене зміщенням серединних структур, таких як таламус і стовбур головного мозку, а не глобальним підвищенням внутрішньочерепного тиску. Існує достатньо доказів того, що в перші дні після розвитку гемісферного ішемічного інсульту внутрішньочерепний тиск взагалі не підвищується й надалі може бути меншим за 20 мм рт.ст. навіть у пацієнтів із тяжким набряком мозку. У той же час у пацієнтів із мозочковим інсультом може виникнути гостра гідроцефалія. Таким пацієнтам рекомендується вентрикулостомія в поєднанні з декомпресійною краніектомією (клас рекомендації I, рівень доказів С).
У пацієнтів, які перенесли інсульт, ризик тромбоемболічних ускладнень є дуже високим, тому вони потребують проведення тромбопрофілактики. З цією метою слід використовувати підшкірне введення нефракціонованого гепарину або низькомолекулярні гепарини (клас рекомендації I, рівень доказів С). У той же час пацієнтам з інсультом та набряком головного мозку згідно з рекомендаціями AHA/ASA-2014 не рекомендоване призначення внутрішньовенного гепарину або комбінації антиагрегантів/аспірину і клопідогрелю (клас рекомендації III, рівень доказів С) у зв’язку з підвищенням ризику геморагічної трансформації. Монотерапію аспірином у пацієнтів з набряком головного мозку можна продовжити.
Більшість пацієнтів з гострим інсультом вже при надходженні до стаціонару мають симптоми дегідратації, що в подальшому асоціюватиметься з несприятливим перебігом і наслідками при невчасній інфузійній терапії. Рекомендується стартове введення фізіологічного розчину натрію хлориду. Крім достатньої волемії, ця опція забезпечує й адекватну осмолярність крові, запобігаючи набуханню/набряку мозку чи усуваючи його.
Етапи терапії ішемічного інсульту (відповідно до послідовності патогенетичних ланок процесу, хоча ця «послідовність» перекривається в часі й просторі):
1. Ішемічне прекондиціювання (астроцит-опосередкований механізм перепрограмованої геномної відповіді при запуску ішемічного каскаду) — це профілактична терапія ішемічного інсульту в пацієнтів з високим ризиком його розвитку.
2. Тромболізис.
3. Фармакотерапевтичний маршрут інсульту: мішенню є нейрон, глія, стінка судин, нейронне середовище, тому більш доречним у даному випадку є розширений варіант нейропротекції — цито(церебро)протекція. Необхідна комплексна церебропротекторна програма, спрямована на підтримку адекватної церебральної перфузії, енергозабезпечення, своєчасне запобігання водно-електролітним порушенням та їх усунення, комплексний захист нейронів від пошкодження.
До переваг застосування нейрон- та цитопротекторів при гострому інсульті належать такі:
— неагресивність, мінімальна інвазивність;
— можливість безпечного застосування при будь-якому виді інсульту;
— не потрібна магнітно-резонансна/комп’ютерна томографія чи будь-які інші попередні діагностичні дослідження;
— можливість застосування на будь-якому етапі лікування хворого;
— відсутність ускладнень чи побічних ефектів;
— доведена ефективність у багатьох контрольованих дослідженнях.
У доклінічних дослідженнях були випробувані понад 1000 потенційних нейропротекторів (мембраностабілізатори, трофічні фактори, GABA-агоністи, AMPA-антагоністи, антагоністи іонів кальцію, антагоністи глутамату, непрямі модулятори глутамату, магнію сульфат, опіоїдні антагоністи, скавенджери вільних радикалів тощо). Майже 200 із них при ішемічному інсульті були невдалими. Найбільш переконливі дані отримані щодо ефективності цитиколіну (цитидин-5’-дифосфохоліну) — попередника фосфатидилхоліну, що є основним компонентом усіх клітинних мембран, у тому числі й нейронних.
Цитиколін стимулює синтез структурних фосфоліпідів у мембрані нейронів і нейрорецепторах, завдяки цьому стабілізуючи функцію іонних насосів, що забезпечує його протинабрякові властивості. Крім того, в умовах ішемії виникає дефіцит нейромедіаторів, тому мембранні фосфоліпіди гідролізуються, забезпечуючи джерело холіну для синтезу нейромедіаторів (так званий феномен автоканібалізму). Цитиколін при цьому мінімізує активність фосфоліпази А2, зменшуючи інтенсивність гідролізу фосфоліпідів, і виступає джерелом холіну як основного субстрату для подальшого синтезу нейромедіаторів. Крім того, цитиколін стимулює синтез глутатіону та пригнічує процеси пероксидації ліпідів та білків, активує енергетичні процеси в нейронах; нормалізує процеси тканинного дихання; інгібує глутаматіндукований апоптоз; відновлює нормальні рівні фосфоліпідних компонентів внутрішньої мітохондріальної мембрани; знижує експресію прокаспаз та інших білків, що беруть участь у апоптозі нервових клітин після ішемії [8, 12, 13].
В Україні в 2016 році з’явився комплексний інфузійний середник — нейропротектор Нейроцитин® виробництва ТОВ «Юрія-Фарм». Його унікальність полягає в тому, що це готовий ізотонічний сольовий розчин для інфузій зі збалансованим вмістом електролітів: крім натрію хлориду, він містить калій хлорид, кальцій хлорид дигідрат, фізіологічний буфер натрію лактату; а також цитиколін. Лактат, який входить до складу препарату Ней–роцитин, перетворюється на аніони бікарбонату, присутність яких змінює реакцію крові в лужний бік, що є позитивним моментом в умовах метаболічного ацидозу.
Матеріали та методи
Обстежено 55 пацієнтів із гострим ішемічним інсультом віком від 40 до 75 років (36 чоловіків, 19 жінок, середній вік 54,0 ± 5,2 року). Дослідження проводилось на базі відділення судинної неврології Івано-Франківської обласної клінічної лікарні. Хворі були рандомізовані на 2 групи методом випадкових чисел. Пацієнти контрольної групи (КГ) отримували стандартну терапію ішемічного інсульту згідно з Уніфікованим клінічним протоколом медичної допомоги «Ішемічний інсульт (екстрена, первинна, вторинна (спеціалізована) медична допомога, медична реабілітація» (Наказ МОЗУ № 602 від 03.08.2012). Пацієнти основної групи (ОГ) окрім стандартної терапії отримували Нейроцитин у дозі 1000 мг внутрішньовенно краплинно двічі на добу протягом 1–14 днів.
Усім пацієнтам проведено загальноклінічне та клініко-неврологічне обстеження. Ішемічний інсульт був верифікований за допомогою методів нейровізуалізації. Ступінь неврологічного дефіциту та функціональний стан хворих визначали за допомогою шкали NIHSS та модифікованої шкали Ренкіна (мШР) на 1-й та 14-й день ішемічного інсульту. Ступінь пошкодження нейронів оцінювали за рівнем нейронспецифічної єнолази (НСЄ) за допомогою імуноферментного аналізу з використанням тест-систем F. Hoffmann-La Roche (Швейцарія) [14, 20–31].
Біоелектричну активність кори головного мозку визначали за допомогою біспектрального індексу (BIS-індекс), що застосовується в анестезіології для оцінки глибини загальної анестезії та ступеня седації. При цьому ВIS-індекс, що дорівнює 100, спостерігається в пацієнтів у свідомості; 0 — при відсутності активності мозку; 40–50 — норма при загальній анестезії; 60–85 — норма для седації. Рівень оксигенації крові визначали за допомогою церебральної оксиметрії.
Статистичну обробку одержаних результатів проведено з використанням пакету статистичного аналізу даних Statistica 6.0 (StatSoft, США) та MS Excel 2010 з використанням параметричних та непараметричних методів. Статистично вірогідною вважали різницю p < 0,05 між порівнюваними групами.
Результати
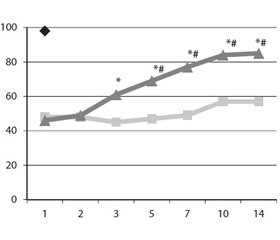
Протягом 14 днів спостереження на фоні терапії в пацієнтів спостерігалась позитивна динаміка біоелектричної активності кори за даними BIS-моніторингу (рис. 1). Уже з 3-го дня лікування BIS-індекс у хворих ОГ був вищим на 35,6 % порівняно із КГ (p < 0,05), а починаючи з 5-го дня показник вірогідно підвищився й порівняно з вихідним рівнем (p < 0,05). На 14-й день лікування BIS-індекс на фоні терапії Нейроцитином зріс на 84,0 % від вихідного рівня (p < 0,01) та був на 49,1 % вищим порівняно з показником КГ (p < 0,05), тоді як динаміка BIS-індексу пацієнтів КГ упродовж 14 днів (+18,8 %) не досягла статистично вірогідних значень (p > 0,05).
Описані зміни біоелектричної активності супроводжувались змінами показників церебральної оксиметрії, що мали аналогічну тенденцію (рис. 2). Початковий рівень показника в обох групах був на 64,6 % нижчим за норму (p < 0,05). Суттєвої динаміки показника у КГ протягом 5 днів не спостерігалось (p > 0,05), на той час як в ОГ з 3-го дня лікування він вірогідно перевищував вихідні показники на 31,1 % (p < 0,05), з 5-го дня — на 57,8 % (p < 0,01), практично не відрізняючись від показників здорових осіб (p > 0,05). Крім того, рівень показника на 5-ту добу спостереження в ОГ на 44,9 % перевищував аналогічний у КГ (p < 0,05).
/60-1.jpg)
/61-2.jpg)
В обох групах протягом 14 днів знизився рівень НСЄ в крові (рис. 3), проте вірогідно більш вираженими ці зміни були лише в пацієнтів ОГ на фоні терапії Нейроцитином починаючи з 3-го дня, коли показник знизився на 65,2 % (p < 0,05), а на 14-й день він був на 72,5 % нижчим порівняно з початковим (p < 0,01). Різниця спостерігалась і між показниками обох груп спостереження починаючи із 7-го дня, коли рівень НСЄ в ОГ був на 57,1 % нижчим (p < 0,05), ніж у КГ, а на 14-й день — на 60,4 % (p < 0,05).
У неврологічному статусі пацієнтів ОГ на 5-й та 7-й день лікування прояви неврологічного дефіциту за NIHSS (рис. 4) вірогідно знизились на 26,7 % (p < 0,05) та 30,2 % (p < 0,05) відповідно порівняно з початковими показниками, а на 14-й день бал за NIHSS був на 59,7 % (p < 0,01) нижчим за вихідний і на 36,6 % — порівняно з аналогічним показником КГ (p < 0,05).
При спостереженні в динаміці за функціональним станом хворих (рис. 5) через 1,5 міс. після ішемічного інсульту бал за мШР у пацієнтів, які отримували стандартну терапію та Нейроцитин, вірогідно знизився порівняно з вихідним рівнем (p < 0,05), тоді як у КГ такі зміни не досягли статистично вірогідних значень (p > 0,05).
Висновки
Отже, лише одночасна корекція метаболічних та волемічних порушень може бути ефективною. З огляду на склад Нейроцитину зазначений середник спроможний здійснювати комплексну нейропротекцію на тлі адекватної підтримки водно-електролітного балансу для легшого перебігу інсульту, а також для досягнення мінімального неврологічного дефіциту після нього. Включення Нейроцитину в схему лікування хворих із гострим ішемічним інсультом достеменно сприяє зменшенню пошкодження нейронів, відновленню електричної активності кори та оксигенації головного мозку порівняно із терапією без нейропротекції.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Мищенко Т.С. Лечение больных ишемическим инсультом // Здоров’я України. — 2015. — http://health-ua.com
2. Главный специалист МЗ Украины о профилактике и лечении мозговых инсультов. — http://www.umj.com.ua/article/22059/glavnyj-specialist-ministerstva-zdravooxraneniya-ukrainy-o-profilaktike-i-lechenii-mozgovogo-insulta
3. Академия инсульта — 2015: время действовать! // Здоров’я України. — 2015 (тематичний номер). — С. 14-16.
4. Тромболизис при ишемическом инсульте — реканализация, нейропротекция и последующая каротидная эндартерэктомия / Евтушенко С.К., Шепотинник Е.В., Родин Ю.В., Дюба Д.Ш. // Журнал неврології ім. Б.М. Маньковського. — 2013. — Т. 1, № 2. — С. 69-72.
5. Тітов І.І. Ключові питання інтенсивної терапії хворих з гострими мозковими катастрофами // III Міжнародний конгрес з інфузійної терапії — 2016. — https://www.youtube.com/watch?v = ex274I1TXJU
6. Наказ МОЗ України від 03.08.2012 № 602 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при ішемічному інсульті». — http://www.moz.gov.ua
7. Sahota P., Savitz S.I. Investigational Therapies for Ischemic Stroke: Neuroprotection and Neurorecovery // Neurotherapeutics. — 2011. — Vol. 8, № 3. — P. 434-451.
8. Secades J.J., Lorenzo J.L. Citicoline: pharmacological and clinical review, 2006 update // Methods Find. Exp. Clin. Pharmacol. — 2006. — Vol. 28, Suppl. B. — P. 1-56.
9. Álvarez-Sabín J., Román G.C. The Role of Citicoline in Neuroprotection and Neurorepair in Ischemic Stroke // Brain Sciences. — 2013. — Vol. 3, № 3. — P. 1395-1414.
10. Stroke management / Warburton E., Alawneh J.A., Clatworthy P.L., Morris R.S. // BMJ Clin. Evid. — 2011. — Vol. 2011, pii: 0201.
11. Overgaard K. The effects of citicoline on acute ischemic stroke: a review // J. Stroke Cerebrovasc. Dis. — 2014. — Vol. 23, № 7. — P. 1764-1769.
12. Citicoline for Acute Ischemic Stroke: A Systematic Review and Formal Meta-analysis of Randomized, Double-Blind, and Placebo-Controlled Trials / Secades J.J., Alvarez-Sabín J., Castillo J. et al. // J. Stroke Cerebrovasc. Dis. — 2016. — Vol. 25, № 8. — P. 1984-1996.
13. Early application of citicoline in the treatment of acute stroke: A meta-analysis of randomized controlled trials / Shi P.Y., Zhou X.C., Yin X.X. et al. // J. Huazhong Univ. Sci. Technolog. Med. Sci. — 2016. — Vol. 36, № 2. — P. 270-277.
14. Al-Rawi N.H., Atiyah K.M. Salivary neuron specific enolase: an indicator for neuronal damage in patients with ischemic stroke and stroke-prone patients // Clin. Chem. Lab. Med. — 2009. — Vol. 47, № 12. — P. 1519-1524.
15. Neuron-specific enolase and tau protein as neurobiochemical markers of neuronal damage are related to early clinical course and long-term outcome in acute ischemic stroke / Wunderlich M.T., Lins H., Skalej M. et al. // Clin. Neurol. Neurosurg. — 2006. — Vol. 108, № 6. — P. 558-563.
16. S-100 protein and neuron-specific enolase concentrations in blood as indicators of infarction volume and prognosis in acute ische–mic stroke / Missler U., Wiesmann M., Friedrich C., Kaps M. // Stroke. — 1997. — Vol. 28, № 10. — P. 1956-1960.
17. Li Y., Wang X., Yang Z. Neuron-specific enolase in patients with acute ischemic stroke and related dementia // Chin. Med. J. (Engl). — 1995. — Vol. 108, № 3. — P. 221-223.
18. Sulter G., Elting J.W., De Keyser J. Increased serum neuron specific enolase concentrations in patients with hyperglycemic cortical ischemic stroke // Neurosci. Lett. — 1998. — Vol. 253, № 1. — P. 71-73.
19. Correlative study between neuron-specific enolase and blood sugar level in ischemic stroke patients / Pandey A., Saxena K., Verma M., Bharosay A. // J. Neurosci. Rural. Pract. — 2011. — Vol. 2, № 1. — P. 50-54.
20. Serum neuron-specific enolase and S100 calcium binding protein B biomarker levels do not improve diagnosis of acute stroke / González-García S., González-Quevedo A., Peña-Sánchez M. et al. // J. R. Coll. Physicians Edinb. — 2012. — Vol. 42, № 3. — P. 199-204.
21. Serum neuron-specific enolase, carnosinase, and their ratio in acute stroke. An enzymatic test for predicting outcome? / Butterworth R.J., Wassif W.S., Sherwood R.A. et al. // Stroke. — 1996. — Vol. 27, № 11. — P. 2064-2068.
22. Pandey A., Shrivastava A.K., Saxena K. Neuron specific enolase and c-reactive protein levels in stroke and its subtypes: correlation with degree of disability // Neurochem. Res. — 2014. — Vol. 39, № 8. — P. 1426-1432.
23. Prognostic value of neuron specific enolase and IL-10 in ische–mic stroke and its correlation with degree of neurological deficit / Singh H.V., Pandey A., Shrivastava A.K. et al. // Clin. Chim. Acta. — 2013. — Vol. 419. — P. 136-138.
24. Short-term prognostic value of serum neuron specific enolase and S100B in acute stroke patients / González-García S., González-Quevedo A., Fernández-Concepción O. et al. // Clin. Biochem. — 2012. — Vol. 45, № 16-17. — P. 1302-1307.
25. Islam N., Ullah E., Akhtar N. Correlation between serum neuron specific enolase and functional neurological outcome in patients of acute ischemic stroke / Zaheer S., Beg M., Rizvi I. et al. // Annals of Indian Academy of Neurology. — 2013. — Vol. 16, № 4. — P. 504-508.
26. Correlation of Brain Biomarker Neuron Specific Enolase (NSE) with Degree of Disability and Neurological Worsening in Cerebrovascular Stroke / Bharosay A., Bharosay V.V., Varma M. et al. // Indian J. Clin. Biochem. — 2012. — Vol. 27, № 2. — P. 186-190.
27. Prognostic value of somatosensory evoked potentials, neuron-specific enolase, and S100 for short-term outcome in ischemic stroke / Haupt W.F., Chopan G., Sobesky J. et al. // J. Neurophysiol. — 2016. — Vol. 115, № 3. — P. 1273-1278.
28. Temporal profile and clinical significance of serum neuron-specific enolase and S100 in ischemic and hemorrhagic stroke / Brea D., Sobrino T., Blanco M. et al. // Clin. Chem. Lab. Med. — 2009. — Vol. 47, № 12. — P. 1513-1518.
29. The second elevation of neuron-specific enolase peak after ischemic stroke is associated with hemorrhagic transformation / Kim B.J., Kim Y.J., Ahn S.H. et al. // J. Stroke Cerebrovasc. Dis. — 2014. — Vol. 23, № 9. — P. 2437-2443.
30. Anand N., Stead L.G. Neuron-specific enolase as a marker for acute ischemic stroke: a systematic review // Cerebrovasc. Dis. — 2005. — Vol. 20, № 4. — P. 213-219.
31. Kaca-Oryńska M., Tomasiuk R., Friedman A. Neuron-specific enolase and S 100B protein as predictors of outcome in ischaemic stroke // Neurol. Neurochir. Pol. — 2010. — Vol. 44, № 5. — P. 459-463.
32. Myles P.S. Bispectral index monitoring in ischemic-hypoxic brain injury // J. Extra. Corpor. Technol. — 2009. — Vol. 41, № 1. — P. 15-19.
33. Bispectral Index Changes during Acute Brainstem TIA/Ische–mia / Bleeker C.P., Smits B., Vos P.E., Mourisse J.M. // Case. Rep. Med. — 2010. — Vol. 2010, Article ID 697185.
34. Bigham C., Bigham S., Jones C. Does the bispectral index monitor have a role in intensive care? // J. Intensive Care Soc. — 2012. — 13. — 314-9.
35. Monitoring of cortical activity postreperfusion. A powerful tool for predicting clinical response immediately after recanalization / Flores A., Ribó M., Rubiera M. et al. // J. Neuroimaging. — 2015. — Vol. 25, № 2. — P. 257-262.
36. Leggat C.S., Fischer G.W. Early detection of an acute cerebral event during cardiopulmonary bypass using a bispectral index monitor // Semin. Cardiothorac. Vasc. Anesth. — 2008. — Vol. 12, № 1. — P. 80-82.
37. The bispectral index in the diagnosis of perioperative stroke: a case report and discussion / Welsby I.J., Ryan J.M., Booth J.V. et al. // Anesth. Analg. — 2003. — Vol. 96, № 2. — P. 435-437.
38. Murkin J.M., Arango M. Near-infrared spectroscopy as an index of brain and tissue oxygenation // Br. J. Anaesth. — 2009. — Vol. 103, Suppl. 1. — P. i3-i13.
39. Validation of frontal near-infrared spectroscopy as noninvasive bedside monitoring for regional cerebral blood flow in brain-injured patients / Taussky P., O’Neal B., Daugherty W.P. et al. // Neurosurg. Focus. — 2012. — Vol. 32, № 2. — P. E2.
40. The evaluation of cerebral oxygenation by oximetry in patients with ischaemic stroke / Demet G., Talip A., Nevzat U. et al. // J. Postgrad. Med. — 2000. — Vol. 46, № 2. — P. 70-74.
41. Brain oxygen supply in the residual period of ischemic stroke / Kamenskaia O.V., Levicheva E.N., Loginova I.Iu., Karpenko A.A. // Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova. — 2012. — Vol. 112, № 8 (Pt. 2). — P. 20-24.
42. Cerebral oximetry with cerebral blood volume index in detec–ting pediatric stroke in a pediatric ED / Abramo T.J., Harris Z.L., Meredith M. et al. // Am. J. Emerg. Med. — 2015. — Vol. 33, № 11. — P. 1622-1629.
43. Noninvasive cerebral oximetry during endovascular therapy for acute ischemic stroke: an observational study / Hametner C., Sta–narcevic P., Stampfl S. et al. // J. Cereb. Blood Flow Metab. — 2015. — Vol. 35, № 11. — P. 1722-1728.
44. Outcome improvement and cost reduction in an increasingly morbid cardiac surgery population / Goldman S.M., Sutter F.P., Wertan M.A. et al. // Semin. Cardiothorac. Vasc. Anesth. — 2006. — Vol. 10, № 2. — P. 171-175.
45. Murkin J.M. Is it better to shine a light, or rather to curse the darkness? Cerebral near-infrared spectroscopy and cardiac surgery // Eur. J. Cardiothorac. Surg. — 2013. — Vol. 43, № 6. — P. 1081-1083.
46. Cerebral near-infrared spectroscopy monitoring and neurologic outcomes in adult cardiac surgery patients: a systematic review / Zheng F., Sheinberg R., Yee M.S. et al. // Anesth. Analg. — 2013. — Vol. 116, № 3. — P. 663-676.
47. Cerebral monitoring in patients undergoing carotid endarterectomy using a triple assessment technique / Ali A.M., Green D., Zayed H. et al. // Interact. Cardiovasc. Thorac. Surg. — 2011. — Vol. 12, № 3. — P. 454-457.
48. The value of near-infrared spectroscopy measured cerebral oximetry during carotid endarterectomy in perioperative stroke prevention. A review / Pennekamp C.W., Bots M.L., Kappelle L.J. et al. // Eur. J. Vasc. Endovasc. Surg. — 2009. — Vol. 38, № 5. — P. 539-545.
49. Cerebral oximetry monitoring during carotid endarterectomy: effect of carotid clamping and shunting / Cuadra S.A., Zwerling J.S., Feuerman M. et al. // Vasc. Endovascular. Surg. — 2003. — Vol. 37, № 6. — P. 407-413.
50. Continuous cerebral blood flow autoregulation monitoring in patients undergoing liver transplantation / Zheng Y., Villamayor A.J., Merritt W. et al. // Neurocrit. Care. — 2012. — Vol. 17, № 1. — P. 77-84.
51. Cerebrovascular effects of hemodialysis in chronic kidney di–sease / Prohovnik I., Post J., Uribarri J. et al. // J. Cereb. Blood Flow Metab. — 2007. — Vol. 27, № 11. — P. 1861-1869.
52. Walter N. Kernan, Bruce Ovbiagele, Henry R. Guidelines for the Prevention of Stroke in Patients With Stroke and Transient Ische–mic Attack. A Guideline for Healthcare Professionals From the American Heart // Stroke. — 2014. — 45.

/56-1.jpg)
/59-1.jpg)
/60-1.jpg)
/61-2.jpg)
/61-1.jpg)
/61-3.jpg)
/62-1.jpg)