Введение
Мигрень (М) — идиопатическое заболевание, проявляющееся приступами головной боли (ГБ) средней или значительной интенсивности, часто односторонней локализации, пульсирующего характера, усиливающейся при физической нагрузке и сопровож–дающейся вегетативными симптомами, такими как тошнота, рвота, фотофобия, фонофобия [1]. По результатам проведенного ВОЗ в 2010 году самого большого систематизированного обзора для объяснения развития и причин болезней, факторов риска для здоровья, М признана третьим заболеванием в мире по распространенности среди населения (14,4 %) и входит в 10 наиболее часто встречающихся расстройств, приводящих к нетрудоспособности [2]. По экономическим затратам среди неврологических заболеваний в Европейском сообществе М занимает второе место после когнитивных нарушений [3].
Исследования ГБ у детей показали, что более 80 % составляют первичные ГБ, преимущественно мигрень, головная боль напряжения, их сочетание [4, 5]. Эпидемиологические данные представлены в табл. 1 [6].
/11-1.jpg)
Распространенность мигрени в педиатрической популяции варьирует от 3,3 до 21,4 % [4, 7, 8], достигая 28 % в возрастном периоде от 13 до 18 лет [9, 10]. За последние десятилетия отмечается неуклонный рост данной патологии среди детей [5]. Результаты популяционных исследований в Финляндии головных болей у детей семи лет и старше, которые проводились в 1974, 1992, 2002 годах и включали соответственно 1927, 1436, 1066 детей, выявили значительное увеличение частоты М у мальчиков и у девочек. Распространенность мигрени с аурой (МСА) увеличилась с 5,2 на 1000 человек в 1974 году до 41,3 на 1000 человек в 2002 году, мигрени без ауры (МБА), соответственно, с 14,5 до 91,9 на 1000 человек [5]. На основании полученных результатов авторы указывают на необходимость исследования связи М с изменением образа жизни детей [5].
М рассматривается как хроническое заболевание с высокой вариабельностью и непредсказуемой частотой приступов, с наличием разнообразных коморбидных состояний, которые влияют на клиническое течение мигрени и усложняют ее лечение [11–13].
Термин «коморбидность», предложенный в 1970 году A.R. Feinstein, используется для обозначения взаимосвязи между заболеваниями у одного пациента. Наличие коморбидной связи между заболеваниями подразумевает существование общих механизмов патогенеза или факторов риска, кроме того, одно заболевание может обусловливать возникновение другого [14]. В соответствии с определением Pasnau et al. (1994) и Silberstein (1998), коморбидными М следует считать те заболевания/нарушения, которые встречаются при М чаще, чем в общей популяции, и имеют с ней некоторые общие патогенетические механизмы [11].
По результатам исследований у взрослых с М описано более двадцати коморбидных расстройств, среди которых: депрессия (80 %), генерализованное тревожное расстройство (64 %), аллергия/поллиноз (55 %), нарколепсия (44 %), хроническая боль (39,5 %), гиперхолестеринемия (33 %), синдром раздраженного кишечника (25–50 %), фибромиалгия (22–40 %), ожирение (24 %), бронхиальная астма (19,9 %), артериальная гипертензия (17,6 %), эпилепсия (до 17 %) и другие нарушения [11, 15, 16].
Результаты немногочисленных исследований коморбидности М у детей разноречивы, что, по-видимому, обусловлено разновозрастной группой пациентов, разной представленностью доли отдельных форм М, давностью заболевания и др. [4].
В 10 исследованиях с метаанализом, опубликованных между 1996 и 2011 годами (406 пациентов, возраст 11,6 ± 2,3 года), установлено, что у детей с М по сравнению с группой контроля чаще отмечались психологические нарушения [19]. Результаты обзора изучаемой проблемы у детей в возрасте 4–17 лет также показывают, что при М в детском возрасте отмечаются эмоциональная неустойчивость, раздражительность, депрессия, эпилепсия, тики и диссомнии [4, 8, 20–22]. В одном исследовании 251 ребенка с ГБ, структура которых преимущественно состояла из головной боли напряжения и в меньшей степени М, установлена высокая частота астенического синдрома — 90,8 % [23]. Астения (от греч. asthenia — «бессилие, слабость») — это неспецифический синдром, который может сопровождать любую болезнь, [24, 25]. Астения — разновидность патологической усталости, сопровождаемая уменьшением энергии для поддержания нормальной активности и внимания со значительным уменьшением работоспособности [24]. В литературе и медицинской практике термин «астения» не является устоявшимся, ряд исследователей в качестве синонимов используют понятия «астенический синдром», «астеническое состояние», «астеноневротическое состояние», «неврастения», если его развитие имеет психогенный характер, и др. [25]. В МКБ-10 астения входит в следующие рубрики: F06.0, F45.3, F48.0-48.8, G93, G99, R45, R53, в неврологической практике используются последние четыре [25].
Существует гипотеза, что именно в детском возрасте начинает формироваться связь между М и эмоциональными тревожными расстройствами, которые усиливаются с течением заболевания и во взрослом возрасте проявляются тревогой, депрессией [26]. Это подчеркивает актуальность изучения коморбидных неврологических и эмоциональных нарушений при М именно в детстве.
В настоящее время не изучена частота и структура неврологических коморбидных нарушений у детей при МБА и МСА в первые годы заболевания; не исследована их связь с частотой атак; также не установлено влияние проведенной терапии коморбидных заболеваний на течение М.
Этиология коморбидности неясна, и в настоящее время нет никаких исследований по фармакологическому лечению сопутствующих нарушений М у детей и оценки влияния проведенной терапии на течение заболевания [26].
Анализ коморбидности М у детей является важным для выработки терапевтической тактики, поскольку ассоциированные расстройства могут существенно влиять на КЖ пациента и утяжелять течение заболевания [13]. Установление взаимной связи между тяжестью течения мигрени и ведущими коморбидными неврологическими и эмоциональными нарушениями в детском возрасте даст основания к исследованию влияния на течение заболевания путем терапии указанных расстройств, усовершенствует подходы к лечению М в педиатрической популяции, что определяет актуальность исследования в данном направлении.
Лечение М является актуальной и сложной задачей, особенно в педиатрической популяции. Все лекарственные средства (ЛС), используемые при лечении М, можно разделить на несколько групп: 1) для купирования приступа; 2) для профилактического (превентивного) лечения; 3) вспомогательные [15]. Цель терапии острой атаки М состоит в том, чтобы быстро купировать ГБ и сопутствующие специфические и вегетативные симптомы, которые физически и эмоционально усугубляют тяжесть приступа. У взрослых пациентов с М для купирования атаки используют ЛС разных фармакологических групп: 1) неспеци–фические ЛС: анальгетики, нестероидные противовоспалительные (НПВС); 2) специфические ЛС, к которым относят алкалоиды спорыньи (ЛС эрготаминового ряда), триптаны (агонисты 5-НТ-рецепторов); 3) противорвотные ЛС для купирования тошноты и рвоты, а также для улучшения всасывания анальгетиков во время приступа и, соответственно, увеличения их обезболивающего эффекта [1].
В настоящее время единственными анальгетиками с доказанной эффективностью по купированию приступа М у детей являются ибупрофен и парацетамол [28]. У большинства детей в первые годы существования М приступы хорошо купируются простыми анальгетиками. Но встречаются и тяжелые приступы, когда требуется назначение специфических ЛС.
В настоящее время триптаны занимают ведущую позицию при назначении терапии купирования приступа у взрослых [15]. Это ЛС с избирательным воздействием на серотониновые рецепторы мозговых сосудов, предотвращающие выделение субстанции Р из окончаний тройничного нерва и нейрогенное воспаление. Однако в педиатрической популяции из группы триптанов только суматриптан в виде назального спрея показал положительные результаты в плацебо-контролируемых исследованиях по купированию приступа М, применение других триптанов в детском возрасте не одобрено FDA (Food and Drug Administration, или Управление по контролю качества пищевых продуктов и лекарственных препаратов). В Республике Беларусь и многих странах ближнего и дальнего зарубежья назначение триптанов регламентировано возрастом — с 18 лет. Крайне важно, что триптаны не должны использоваться при лечении базилярной и гемиплегической мигрени.
Алкалоиды спорыньи (эрготамины) останавливают развитие приступа без прямого анальгезирующего действия, препараты этой группы оказывают мощное сосудосуживающее действие. Однако тяжесть побочных эффектов не позволяет использовать эту группу ЛС для лечения М в детском возрасте.
В ряде случаев для повышения эффективности анальгетиков или триптанов используют противорвотные антидофаминергические средства [1, 15].
Профилактическая (превентивная) терапия назначается с целью уменьшения частоты и тяжести мигренозных атак. Эффективное межприступное лечение способствует сокращению количества потребляемых анальгетиков, предупреждает развитие лекарственной зависимости и лекарственной формы ГБ. Как у взрослых, так и у детей регулярное (более 2 дней в неделю) использование ЛС для купирования приступов ГБ является фактором риска возникновения лекарственно-индуцированной головной боли [15, 29].
По мнению экспертной группы, в отношении любого пациента, даже ребенка или подростка, чьи приступы мигрени оказывают существенное влияние на качество жизни, должен рассматриваться вопрос о профилактическом лечении в дополнение к купирующей терапии [29, 30]. Профилактическая терапия может обсуждаться с пациентом для решения о ее добавлении в следующих случаях [1, 29]: значительно нарушены качество жизни, профессиональная деятельность или посещение школы у детей; частота приступов мигрени — 2 и более в месяц; отсутствие эффекта от купирующей терапии; мигренозная аура частая, длительная или доставляет выраженный дискомфорт. Профилактика М считается успешной при снижении частоты приступов не менее чем на 50 % в течение 3 месяцев [1].
В соответствии с международными рекомендациями в межприступном периоде подросткам с профилактической целью для снижения частоты атак М назначают одно ЛС из следующих фармакологических групп: бета-блокатор, антидепрессант, противоэпилептическое ЛС, однако большинство ЛС не рекомендуется для применения в педиатрической практике из-за недостатка информации о безопасности применения у детей и эффективности в условиях возрастных анатомо-физиологических особенностей растущего организма. При этом Управление по контролю за продуктами и лекарствами (FDA) не одобрило некоторые ЛС для профилактики М у детей, поэтому в ряде случаев имеет место назначение off-label. Последствия отсутствия лечения М у детей могут быть существенными и приводить к развитию депрессии, дефициту внимания, психоэмоциональным нарушениям [31].
Таким образом, в связи с ограничением по возрасту большинства ЛС для терапии М у детей перспективно изучение лечебного подхода к МБА путем коррекции коморбидных неврологических нарушений с оценкой динамики частоты атак, что позволит проанализировать эффективность данной стратегии в педиатрической популяции.
Цель исследования: оценить частоту и структуру ведущих неврологических коморбидных нарушений при мигрени без ауры у детей и динамику частоты атак после их лечения.
Материалы и методы
Сформировано две группы в зависимости от формы заболевания: 1-я группа (основная) — МБА, 2-я группа (сравнения) — МСА. Группу МБА составили 142 пациента, из них 90 (63,4 %) — лица мужского пола и 52 (36,6 %) — женского. Группу МСА составили 96 (n = 96) пациентов, из них 61 (63,5 %) — лица женского пола и 35 (36,5 %) — мужского. Численная и возрастная структура детей с МБА и МСА на момент включения в исследование (первый год заболевания) представлена в табл. 2.
При МБА основная доля детей в начале исследования была дошкольного (62,0 %) и младшего школьного (36,6 %) возраста.
Выполнен анализ сопутствующих нарушений со стороны нервной системы в группе МБА и МСА до лечения (рис. 1).
Анализ данных показал, что при МБА неврологические коморбидные нарушения встречаются в 77,5 % (110 случаев), что в 2,5 раза чаще, чем при МСА — 31,2 % (30 случаев) (pФишера < 0,001).
Проанализирована структура коморбидных неврологических нарушений при МБА (n = 142) и МСА (n = 96), во всех случаях выявлен АС (в изолированном виде или в сочетании с другими нарушениями: вегетативная дисфункция, заикание, тики, СДВГ, диссомния, судорожный синдром, эссенциальный тремор и др.): в 77,5 % (110 случаев) при МБА и почти в 2,5 раза реже при МСА — 31,2 % (30 случаев) (pФишера < 0,001).
Наличие коморбидных нарушений может усугуб–лять течение заболевания, ограничивать обычную жизнедеятельность и школьную активность ребенка, что требует качественно нового подхода к принципам терапии детей с мигренью.
Выдвинуто предположение, что коррекция эмоциональной сферы и коморбидной неврологической патологии может не только улучшить КЖ, но и существенно повлиять на течение основного заболевания с уменьшением атак, что в условиях ограничения по возрасту большинства ЛС оптимизирует подходы к лечению М у детей.
На первом этапе исследования анализировалась динамика заболевания на фоне и после курса терапии с акцентом на нефармакологические методы. Комплекс мероприятий включал: рекомендации по исключению провоцирующих факторов, режим труда и отдыха с учетом коморбидных неврологических и психоэмоциональных нарушений — занятия с психотерапевтом, психологом, нефармакологические методы лечения (акупунктурные воздействия, физиотерапия и др.). Допускался прием ЛС для купирования приступа М.
Результаты и обсуждение
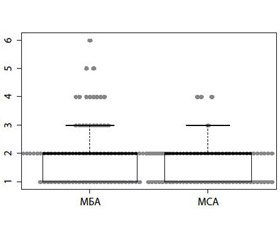
В первый этап исследования включено 176 пациентов, из них 96 — с МБА и 80 — с МСА. Выполнена оценка частоты приступов МБА и МСА за три предшествующих месяца, данные представлены на рис. 2.
В ходе исследования выявлены отличия в частоте атак двух исследуемых групп (pУилкоксона — Манна — Уитни = 0,011): при МБА Me = 2 (Q25 = 1; Q75 = 2) с диапазоном от 1 до 6 приступов; аналогичные данные при МСА — Me = 2 (Q25 = 1; Q75 = 2) с вариабельностью частоты от 1 до 4.
Эффекты терапии оценивались спустя три месяца. Следует отметить, что, согласно клиническим рекомендациям, лечение М считается эффективным при снижении частоты приступов не менее чем на 50 % в течение трех месяцев [1]. Учитывая данный факт, к случаям с положительной динамикой на фоне лечения относили отсутствие приступов или снижение их частоты на 50 % и более; с сомнительной — отсутствие изменения частоты; с отрицательной — увеличение количества атак.
В ходе исследования установлена положительная динамика в группе МБА (n = 96) — 47,9 % (n = 46), в частности: 35,4 % (n = 34) — снижение частоты на 50 % и более, 12,5 % (n = 12) — приступы не повторялись, по сравнению с МСА (n = 80) — 42,5 % (n = 34): 18,8 % (n = 15) и 23,7 % (n = 19), значимых отличий между формами М не установлено. Выявлено, что во всех случаях положительной динамики исходное количество атак у детей не превышало 3 за три месяца и приступы были неосложненными.
Также в исследовании установлены случаи без динамики по частоте приступов: при МБА — 38,5 % (n = 37), при МСА — 48,7 % (n = 39), значимых различий не выявлено (pФишера > 0,05).
Отрицательная динамика в виде увеличения частоты приступов зафиксирована в 13,5 % (n = 13) случаев при МБА и 8,8 % (n = 7) при МСА без значимых различий между группами (pФишера > 0,05). Данные о динамике частоты атак за три месяца до и после лечения представлены на рис. 3.
В ходе исследования выявлена связь между количеством приступов до лечения и эффектом от проведенной терапии (pУилкоксона — Манна — Уитни < 0,001), что послужило основанием для поиска точки разделения, при которой более вероятен эффект с отрицательной динамикой в виде учащения атак. С этой целью выполнен ROC-анализ, по данным которого выявлено, что при исходном количестве приступов от 4 и выше последующий эффект от проводимой терапии с акцентом на нефармакологические методы лечения ожидается в виде отрицательной динамики с учащением атак. Существует мнение о низкой эффективности нефармакологических методов лечения М у детей по сравнению со взрослыми [32]. Однако полученные результаты демонстрируют, что подход в терапии с комплексом мероприятий, включающим организацию режима и отдыха, устранение провоцирующих факторов, занятия с психотерапевтом, психологом, физиотерапевтические и другие методы воздействия, прием ЛС для купирования атак МБА и МСА, эффективен у детей в 47,9 и 42,5 % случаев соответственно при М легкой степени тяжести с частотой приступов не более 3 за три исходных месяца и отсутствием осложнений, а при количестве атак 4 и более динамика отрицательная.
В исследовании установлено, что у детей с М при учащении атак и снижении КЖ наибольшие изменения происходят в эмоциональной и социальной сферах, также установлен факт коморбидных неврологических нарушений с высокой частотой АС при МБА (77,5 %), в связи с этим при сохранении/учащении приступов М и наличии АС выполнено исследование эффективности метода лечения М путем фармакологической коррекции АС и других коморбидных неврологических расстройств. Спектр коморбидных нарушений и возраст детей определили выбор ЛС, которое может официально применяться в педиатрической практике и корректировать большой спектр психосоматических и неврологических нарушений — g-амино-b-фенилмасляной кислоты гидрохлорид (МНН: ноофен; МНН: фенибут). Назначение на этом этапе исследования включало курсовой прием в возрастных педиатрических дозировках указанного ЛС наряду с разовым приемом ЛС для купирования атаки М в случае ее развития, а также рекомендации первого этапа исследования.
Критерием включения в данный этап исследования для всех наблюдаемых детей являлось наличие АС до лечения. В исследование включено 109 пациентов с МБА и 29 с МСА.
Выполнен анализ динамики распространенности АС и других неврологических коморбидных нарушений при МБА до и после лечения (n = 109), данные представлены в табл. 3.
В ходе исследования установлена эффективность проведенного лечения со снижением частоты коморбидных неврологических нарушений при МБА (n = 109) в 10 раз — до 10 % (n = 10) и при МСА (n = 29) в 2,4 раза — до 41,4 % (n = 12) случаев.
Выполнен анализ динамики частоты приступов МБА и МСА до и после лечения, данные представлены на рис. 4.
В ходе исследования установлено, что после лечения коморбидных неврологических нарушений у детей с МБА (n = 109) значимо снизилось количество атак МБА за три месяца (pУилкоксона — Манна — Уитни < 0,001): с исходных показателей Me = 4 (Q25 = 2; Q75 = 6; Q0 = 1; Q100 = 12) до Me = 0 (Q25 = 0; Q75 = 1; Q0 = 0; Q100 = 8). В группе МСА (n = 29) соответствующая динамика данных: Me = 4 (Q25 = 0; Q75 = 4; Q0 = 1; Q100 = 37) и Me = 1 (Q25 = 2; Q75 = 6; Q0 = 0; Q100 = 20).
Выводы
Таким образом, установлено, что коррекция коморбидных неврологических нарушений, и в частности АС, уменьшает количество приступов М (за три контрольных месяца) у детей, что обосновывает целесообразность данного подхода в лечении МБА в детском возрасте.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Клинические рекомендации по неврологии Европейской федерации неврологических сообществ / Под ред. N.E. Gilhus, M.P. Barnes, M. Brainin. — М.: АБВ-пресс, 2012. — 696 c.
2. Migraine without aura and migraine with aura are distinct disorders. A population-based twin survey / M.B. Russell [et al.] // Headache. — 2002. — Vol. 42, № 5. — P. 332-336.
3. Stovner L.J. Eurolight Steering Committee. Impact of heada–che in Europe: a review for the Eurolight project / L.J. Stovner, C. Andree // J. Headache Pain. — 2008. — Vol. 9, № 3. — P. 139-146.
4. Prevalence of headache and migraine in children and adolescents: a systematic review of population-based studies / I. Abu-Arafeh [et al.] // Dev. Med. Child. Neurol. — 2010. — Vol. 52, № 12. — P. 1088-1097.
5. Anttila P. Long-trends in the incidence of headache in Fin–nish schoolchildren / P. Anttila, L. Metsahonkala, M. Sillanpaa // Pediatrics. — 2006. — Vol. 117, № 6. — P. 1197-1201.
6. Сергеев А.В. Мигрень и головная боль напряжения у детей: основные подходы к эффективной терапии. Ч. 1. / А.В. Сергеев // Вопр. соврем. педиатрии. — 2012. — Т. 11, № 5. — С. 64-69.
7. Будчанова Н.Ю. Распространенность и особенности клинических проявлений первичных головных болей у школьников / Н.Ю. Будчанова, В.М. Делягин, Г.Ш. Хондкарян // Педиатрия. — 2008. — Т. 87, № 5. — С. 138-140.
8. Headache and comorbidity in children and adolescents / B. Bellini [et al.] // J. Headache Pain. — 2013. — Vol. 14. — P. 79.
9. Oakley C.B. Migraine and Epilepsy in the Pediatric Population / C.B. Oakley, E.H. Kossoff // Curr. Pain Headache Rep. — 2014. — Vol. 18, № 3. — P. 402.
10. Spiri D. Pediatric migraine and episodic syndromes that may be associated with migraine / D. Spiri, V. E. Rinaldi, L. Titomanlio //
Ital. J. Pediatr. — 2014. — Vol. 40. — P. 92.
11. Осипова В.В. Коморбидность мигрени: обзор литературы и подходы к изучению / В.В. Осипова, Т.Г. Вознесенская // Журн. неврологии и психиатрии им. С.С. Корсакова. — 2007. — Т. 107, № 3. — С. 64-73.
12. Осипова В.В. Мигрень и головная боль напряжения. Клинические рекомендации. Неврология и нейрохирургия / В.В. Осипова; под ред. Е.И. Гусева, А.Н. Коновалова. — 2-е изд., перераб. и доп. — М.: ГЭОТАР-Медиа, 2015. — 434 с.
13. Rothrock J.F. Understanding migraine a tale of hope and frustration / J.F. Rothrock // Headache. — 2011. — Vol. 51, № 7. — P. 1188-1190.
14. Defining Comorbidity: Implications for Understanding Health and Health Services / J.M. Valderas [et al.] // Ann. Fam. Med. — 2009. — Vol. 7, № 4. — P. 357-363.
15. Табеева Г.Р. Мигрень / Г.Р. Табеева, Н.Н. Яхно. — М.: ГЭОТАР-Медиа, 2011. — 624 с.
16. Comorbidity in migraine / J. Shoenen, D.W. Dodick, P.S. Sandor, eds. — Chichester: Wiley-Blackwell, 2011. — 152 p.
17. Цефалгии. Головная боль (диагностика и лечение) / Н.М. Жулев [и др.]. — СПб.: ХОКА, 2007. — 135 с.
18. Prevalence of headache and migraine in children and adolescents: a systematic review of population-based studies / I. Abu-Arafeh [et al.] // Dev. Med. Child. Neurol. — 2010. — Vol. 52, № 12. — P. 1088-1097.
19. Chilhood and adolescents migraine: a neuropsychiatric disorder? / U. Ballottin [et al.] // Med. Hypotheses. — 2011. — Vol. 76, № 6. — P. 778-781.
20. Psychopathology in children and adolescents with migraine in clinical studies: a systematic review / J. Bruijn [et al.] // Pediatrics. — 2010. — Vol. 126, № 2. — P. 323-332.
21. Guidetti V. Psychiatric comorbidity in chronic daily headache: pathophysiology, etiology, and diagnosis / V. Guidetti, F. Galli // Curr. Pain Headache. — 2002. — Vol. 6, № 6. — P. 492-497.
22. Anxiety and depression are associated with migraine and pain in general: an investigation of the interrelationships /
L. Ligthart [et al.] // J. Pain. — 2013. — Vol. 14, № 4. — P. 363-370.
23. Делягин В.М. Анализ влияния социально-биологических факторов у школьников с первичными головными болями / В.М. Делягин, Н.Ю. Будчанова, Г.Ш. Хондкарян // Медицина крит. состояний. — 2008. — № 3. — С. 35-38.
24. The asthenic symptom complex in patients with emotional burnout syndrome / L.S. Chutko [et al.] // Neurosci. Behav. Phy–siol. — 2015. — Vol. 45, № 3. — P. 354-359.
25. Шалькевич Л.В. Астения в педиатрической практике: взгляд невролога / Л. В. Шалькевич, А. В. Малаш // Мед. новости. — 2016. — № 9. — С. 5-9.
26. Migraine and psychiatric comorbidity: a review of clinical findings / F. Antonaci [et al.] // J. Headache Paine. — 2011. — Vol. 12, № 2. — P. 115-125.
27. Migraine and psychiatric comorbidity: a review of clinical findings / F. Antonaci [et al.] // J. Headache Paine. — 2011. — Vol. 12, № 2. — P. 115-125.
28. Akuttherapia und Prophylaxe der Migräne. Leitlinie der Deutschen Migräne- und Kopfschmerzgesellschaft und der Deutschen Gesselschaft für Neurologia / S. Evers [et al.] // Nervenheikunde. — 2008. — Vol. 27, № 10. — P. 933-949.
29. Европейские принципы ведения пациентов с наиболее распространенными формами головной боли в общей практике: практ. рук. для врачей / Т. Дж. Стайнер [и др.]; пер. с англ. под науч. ред. В.В. Осиповой, Т.Г. Вознесенской, Г.Р. Табеевой. — М.: ОГГИ. РП, 2010. — 56 с.
30. Steiner T.J. Aids for management of common headache disorders in primary care / T.J. Steiner, P. Martelletti // J. Headache Pain. — 2007. — Vol. 8 (suppl. 1). — P. S2.
31. Bral E. Migraine in children / E. Bral // Am. J. Nurs. — 1999. — Vol. 99, № 11. — P. 35-41.
32. Overview of diagnosis and management of paediatric heada–che. Part II: therapeutic management / C. Termine [et al.] // J. Headache Pain. — 2011. — Vol. 12, № 1. — P. 25-34.

/11-1.jpg)
/13-1.jpg)
/13-2.jpg)
/13-3.jpg)
/14-1.jpg)