Вступ
Черепно-мозкова травма (ЧМТ) належить до числа найбільш поширених пошкоджень і становить близько 40 % усіх видів травм. Згідно зі статистикою Всесвітньої організації охорони здоров’я (ВООЗ), має місце тенденція до зростання показників ЧМТ у середньому на 2 % щорічно [1]. В Україні майже 100 тис. осіб отримують ЧМТ щороку [2].
Існують різні підходи та критерії класифікації черепно-мозкової травми. Так, за перебігом ЧМТ розрізняють такі періоди: гострий, підгострий, проміжний та віддалений. Періодизація ґрунтується на клінічних, патофізіологічних, патоморфологічних критеріях. У гострому періоді має місце взаємодія травмуючого впливу, реакцій пошкодження та захисту, підгострий та проміжний періоди характеризуються організацією пошкоджених ділянок та мобілізацією компенсаторно-пристосувальних механізмів, у віддаленому періоді процеси регенерації та дегенерації завершуються.
Тривалість (протяжність) періодів перебігу ЧМТ варіює, головним чином залежно від клінічної форми [3]. За механізмом розрізняють такі пошкодження мозку: 1) первинні — вогнищеві забої та розтрощення мозку, дифузні аксональні пошкодження, первинні внутрішньочерепні гематоми, розриви стовбура, множинні внутрішньомозкові крововиливи; 2) вторинні: а) за рахунок вторинних факторів — відстрочені гематоми (епідуральні, субдуральні, внутрішньомозкові), порушення гемо- та ліквороциркуляції в результаті субарахноїдального або внутрішньошлуночкового крововиливів, збільшення обсягу мозку або його набухання внаслідок набряку, гіперемії або венозного повнокров’я, внутрішньочерепна інфекція тощо; б) за рахунок артеріальної гіпотензії, гіпоксемії, гіперкапнії, анемії та ін. [3, 4].
Головні завдання в запобіганні та лікуванні вторинних уражень головного мозку при ЧМТ: обмеження та скорочення об’єму загибелі нервових клітин, відновлення зв’язків між збереженими після мозкової катастрофи клітинами (ремоделювання нейронних мереж) [5]. За шкалою наслідків Глазго (Glasgow Outcome Scale) розрізняють такі наслідки ЧМТ: 1) смерть; 2) вегетативний стан; 3) нейром’язова неспроможність; 4) тяжка неспроможність; 5) помірна неспроможність; 6) легка неспроможність; 7) добре відновлення; 8) повне відновлення [6].
Серед посттравматичних психічних дисфункцій переважають синдроми граничного рівня — астенічні, неврозоподібні, психопатоподібні.
Важливою патофізіологічною особливістю реакції мозку на травму є порушення метаболізму нейромедіаторів (ацетилхоліну, катехоламінів) та їх рецепторних апаратів. Активація відповідних рецепторів сприяє надходженню та подальшому накопиченню кальцію в клітині, що призводить до активації внутрішньоклітинних ензимів (протеаз і ліпаз), вивільнення вільних радикалів кисню, перекису ліпідів і деструкції клітин [7, 8].
Подальше вдосконалення та впровадження сучасних принципів і методів лікування дозволило знизити летальність хворих з ЧМТ, проте при цьому зросла кількість хворих, які залишилися глибокими інвалідами [9, 10].
За даними літератури, препарат Нейромідин® стимулює та покращує проведення нервового імпульсу не тільки в нервово-м’язовому синапсі, але й у центральній нервовій системі, що пояснює позитивний вплив препарату на мнестичні процеси. Нейромідин® має біологічно вигідну комбінацію двох молекулярних ефектів — блокади калієвої проникності мембрани та інгібування холінестерази. Крім того, здатність даного препарату блокувати проникність мембрани для натрію визначає його седативні та знеболюючі властивості [11]. Згідно з даними, отриманими в результаті досліджень у 2013 році, використання препарату Нейромідин® у комплексній терапії хворих із закритими черепно-мозковими травмами дозволяє не тільки покращити клінічні та електрофізіологічні показники, а й вірогідно підвищити рівень BDNF у сироватці крові (маркер нейропластичності), відіграє нейропротективну роль та може бути маркером терапевтичної ефективності при лікуванні хворих [11].
Мета дослідження: виявити ефективність застосування препарату Нейромідин® у комплексному лікуванні легких та помірно виражених когнітивних порушень у пацієнтів у підгострому й проміжному періодах черепно-мозкової травми.
Завдання дослідження: вивчення ефективності препарату Нейромідин® як модулятора адаптивної ней–ропластичності при легких і помірно виражених когнітивних порушеннях у підгострому та проміжному періодах черепно-мозкової травми; вивчення ефективності модулюючої дії препарату Нейромідин® на інтегративну діяльність головного мозку, консолідацію пам’яті, покращання концентрації уваги та розумової діяльності.
Матеріали та методи
У дослідження включені 60 хворих із травматичними пошкодженнями головного мозку, які лікувались консервативно у відділенні нейрохірургії МКЛШМД м. Вінниці за період з 2016 по 2018 рік.
Критерії включення:
— легкі та помірно виражені когнітивні порушення в пацієнтів у підгострому й проміжному періодах черепно-мозкової травми;
— вогнищеві неврологічні симптоми (рухові або чутливі порушення, афатичні, зорові, вестибуло-атактичні порушення);
— тривалість захворювання — період відновлення та реабілітації від 1 до 6 місяців після черепно-мозкової травми.
Критерії виключення — наявність протипоказань до застосування даного препарату:
— епілепсія;
— екстрапірамідні розлади;
— стенокардія;
— виражена брадикардія;
— бронхіальна астма;
— гіперфункція щитоподібної залози;
— виразкова хвороба шлунка та дванадцятипалої кишки;
— сечокам’яна хвороба;
— вагітність і лактація.
У цілому всі хворі були розподілені на 2 групи. До групи А включені хворі, які отримували комплексне лікування за стандартною методикою (судинні препарати, вітамінотерапія, легка седативна терапія), а також додатково застосовувався препарат Нейромідин® («Олайнфарм», Латвія), до групи Б — хворі, які отримували тільки комплексне лікування за стандартною методикою. Середній вік пацієнтів — 46,00 ± 0,25 року, більшість із них становили особи середнього (працездатного) віку.
Пацієнти групи А отримували Нейромідин® 1,5% у дозі 2 мл в/м 1 раз на день протягом 10 днів, з наступним пероральним застосуванням Нейромідину® по 1 табл. (20 мг) 2 рази на день протягом 20 днів.
Препарати комплексної терапії застосовувались протягом 30 днів у пацієнтів обох груп з чергуванням різних форм введення препаратів.
Розподіл хворих вибірки залежно від нозології поданий на рис. 1.
Дані рис. 1 свідчать, що обидві створені групи вибірки за нозологіями є максимально наближеними між собою для підвищення об’єктивності оцінювання отриманих результатів.
Усі хворі висловлювали скарги на головний біль, періодичні головокружіння, порушення концентрації уваги та лабільність нервової системи. Вогнищеві неврологічні симптоми зафіксовані в 39 хворих (65 %) обох груп спостереження.
Розподіл хворих вибірки залежно від прояву вогнищевих симптомів подано на рис. 2.
Розподіл хворих вибірки залежно від оцінки за розширеною шкалою наслідків Глазго (Glasgow Outcome Scale Extended (GOSЕ), 1997) подано в табл. 1.
Результати лікування визначались на основі:
— даних неврологічного огляду;
— оцінки за розширеною шкалою наслідків Глазго;
— оцінки уваги (таблиці Шульте);
— оцінки тривоги та депресивності (госпітальна шкала тривоги і депресії — Hospital Anxiety and Depression Scale (HADS), 1983) [12];
— показників реоенцефалограми (рео-ЕГ).
Результати та обговорення
Результати лікування хворих, включених у дослідження, оцінювали за даними клінічного, лабораторного та інструментального (рео-ЕГ) досліджень, з метою збору інформації застосовано методи опитування та анкетування. Усі 100 % хворих після проведення курсу лікування відмічали регрес скарг, покращення загального самопочуття й неврологічної симптоматики в спостереженнях обох груп вибірки. Серед пацієнтів, включених до групи А, відмічали більш інтенсивний регрес вогнищевих симптомів (рухових, чутливих розладів та порушень мовлення) на фоні прийому лікування за період спостереження.
Динаміка показників за шкалою наслідків Глазго на фоні проведеного лікування в пацієнтів обох груп подана на рис. 3.
Аналіз отриманих результатів за шкалою GOSE свідчить про ефективність вибраної тактики лікування в пацієнтів обох груп, більш детальне вивчення результатів свідчить про відсутність статистично значимої різниці в кінцевих показниках, проте простежується більш інтенсивна динаміка показників у пацієнтів групи А під час спостереження. У цілому найбільш значимою була динаміка показників хворих із середнім балом понад 6 у пацієнтів обох груп. Негативних результатів у вигляді зменшення градації в пацієнтів обох груп вибірки виявлено не було.
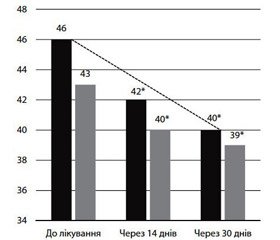
Оцінка уваги та її динаміка за таблицями Шульте на фоні проведеного лікування в пацієнтів обох груп подана на рис. 4.
Проведено аналіз показників, отриманих у результаті дослідження уваги у хворих груп спостереження з використанням таблиць Шульте, на основі вищевказаних графіків встановлено позитивну динаміку у хворих обох груп спостереження на фоні проведеного лікування. При детальному аналізі виявлено покращення у хворих групи А вже на 14-ту добу лікування з подальшим закріпленням ефекту на 30-й день лікування. На основі графіків виявлено вирівнювання показників рівня уваги після завершення дослідження в обох групах, незважаючи на потенційно кращі початкові показники, виявлені в пацієнтів групи Б до початку лікування.
Оцінка рівнів тривоги та депресії згідно з HADS на фоні проведеного лікування в пацієнтів обох груп подана на рис. 5, 6.
Проведений аналіз динаміки рівнів тривоги й депресії у хворих обох груп спостереження виявив позитивну динаміку у хворих обох груп вибірки. Звертає на себе увагу більш виражений перехід хворих до категорії з меншою сумою балів на фоні лікування Нейромідином® (група А), з повною відсутністю серед хворих, включених до групи А, спостережень із яскраво вираженими проявами тривожних та депресивних розладів та зменшенням до мінімуму кількості хворих із субклінічними проявами вищевказаних розладів після завершення лікування. Наростання тривожних та депресивних розладів в обох групах вибірки не виявлено.
Оцінка показників реоенцефалографії до та після завершення дослідження подана на рис. 7–9.
За основу аналізу серед показників у пацієнтів обох груп взято величину реосистолічного індексу (РІ). Проведено порівняльну характеристику даного показника до та після проведеного лікування у пацієнтів обох груп вибірки. Виявлено позитивну динаміку в обох групах спостереження, з чітко встановленою тенденцією до значно вищих значень РІ в пацієнтів групи А, зокрема, РІ вище від 1,3 зафіксовано в 40 % хворих, на відміну від групи Б (13,3 %).
Під час порівняння показників реоенцефалографії в ряду спостережень виявлено відсутність значимих змін РІ при виконанні повторних досліджень, зокрема у 20 % хворих групи А та 17 % хворих групи Б відповідно. Вищевказаний результат було пояснено надмірною ригідністю стінок судин у хворих вибірки, проте в усіх цих хворих мав місце регрес неврологічних даних та позитивна динаміка згідно з іншими (вказаними вище) критеріями ефективності лікування.
Побічних ефектів препаратів при проведенні дослідження в обох групах спостереження виявлено не було.
Переносимість препарату згідно зі встановленими критеріями була задовільною.
Висновки
Отже, у результаті проведеного дослідження отримані дані, що свідчать про ефективність застосування препарату Нейромідин®, зокрема покращення уваги, зниження тривожно-депресивних розладів, регрес неврологічних порушень, у комплексному лікуванні пацієнтів у підгострому та проміжному періодах черепно-мозкової травми.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Гайдар Б.В. Практическая нейрохирургия / Б.В. Гайдар. — СПб.: Гиппократ, 2002. — 656 с.
2. Лехан В.М. Особливості епідеміології черепно-мозкової травми в Україні / В.М. Лехан, А.П. Гук // Україна. Здоров’я нації. — 2010. — № 2. — С. 7-14.
3. Клиническое руководство по черепно-мозговой травме / Под ред. А.Н. Коновалова, Л.Б. Лихтермана, А.А. Потапова. — Т. 1. — М., 1998. — 550 с.
4. Никифоров А.С. Клиническая неврология / А.С. Никифоров, А.Н. Коновалов, Е.И. Гусев. — М.: Медицина, 2004. — 448 с.
5. Molecular Neuroscience / Еd. A. Revest & A. Longstaff. — 1st edition. — London, 1998. — Р. 256.
6. Wilson J.T., Pettigrew L.E., Teasdale G.M. Structured interviews for the Glasgow Outcome Scale and the extended Glasgow Outcome Scale: guidelines for their use // J. Neurotrauma. — 1998. — Vol. 15. — P. 573-585.
7. Hall E. Further studies on the efficacy of the cytoprotective lipid peroxidation inhibitor tirilazad // International conference on recent advances in neurotraumatology. — Italy, 1996. — Р. 22.
8. Hall E.D., Andrus P.K., Yonkers P.A. Brain hydroxyl radical generation in acute experimental head injury // J. Neurochem. — 1993. — 60. — 588-594.
9. Marshall L.F., Gautille T., Klauber M.R. et al. The outcome of severe closed head injury // J. Neurosurg. — 1991. — 75. — S28-S36.
10. Miller J.D. Head injury // J. Neurol. Neurosurg. Psychyatry. — 1993. — 56. — 440-447.
11. Дамулин И.В., Живолупов С.А., Зайцев О.С. и др. Нейромидин в клинической практике. — М.: Медицинское информационное агентство, 2014. — С. 56.
12. Zigmond A.S., Snaith R.P. The Hospital Anxiety and Depression Scale // Acta Psychiatrica Scandinavica. — 1983. — 67(6). — 361-370.

/46-1.jpg)
/47-1.jpg)
/47-2.jpg)
/48-1.jpg)
/49-1.jpg)
/49-2.jpg)