Вступ
Травма спинного мозку є складним інвалідизуючим ураженням, механізми якого нині далекі до вичерпного розуміння. У випадку травми головного мозку, за винятком незворотного ураження життєво важливих регуляторних центрів, втрачені функції компенсуються шляхом пластичних перебудов власних нейрональних мереж [1, 2]. При травмі периферичних нервів відновлення втрачених функцій здійснюється шляхом проростання перетнутих волокон через зону ушкодження [3], а також за допомогою компенсаторної перебудови нейрональних мереж на рівні передусім головного мозку [4]. Відновлення спинного мозку зазначеними механізмами вкрай утруднене через малий об’єм локальних (пропріоспінальних) мереж та багатофакторне обмеження регенерації аксонів провідних шляхів [5–7].
Окремим питанням патофізіології травми спинного мозку є патогенез нейрогенних ускладнень — хронічного больового синдрому, синдрому спастичності та синдрому вісцеральної дисфункції. Ці три синдроми — рівночасті в епідеміологічному відношенні — суттєво погіршують якість життя спінальних хворих, обумовлюють значні витрати на лікування та медичний догляд [8].
Спастичність при травмі спинного мозку, особливо її прояви у гострому та проміжному періодах, тісно пов’язані з тканинним запаленням [9, 10], активністю глутамат- [11, 12], ГАМКергічної [9, 13] та ряду інших систем електрохімічної передачі збудження у нейрональних мережах спинного мозку [14]. Стовбурові клітини кісткового мозку (СККМ) — відомий засіб відновлення функції травмованого мозку — у випадку спінальної травми чинять протизапальний та нейропротекторний вплив [8, 15]. Імуномодулюючий протизапальний [16–20] та протиспастичний [21] вплив виявлено для нейрогенних стовбурових клітин (НСК) — еталонного засобу відновних нейроінженерних втручань при експериментальній травмі спинного мозку [22–24]. Окрім цього, СККМ можуть позитивно впливати на перебіг епілептичного процесу [25], імовірно, шляхом непрямої дії на збуджувальну медіацію у вогнищі [26]. Ці дані актуалізують дослідження впливу СККМ та НСК на перебіг спастичності при спінальній травмі. З’ясування механізмів такого впливу можливе шляхом ретельного вивчення динаміки спастичності на тлі трансплантації зазначених клітинних фенотипів. Співставлення періодів найвираженіших змін рівня спастичності із відомими фазами перебігу спінальної травми [5, 27–31] дозволяє визначити провідні ланки впливу СККМ та НСК.
Матеріали та методи
Як первинні цифрові дані використано емпіричний матеріал, отриманий у ряді попередніх досліджень [32–34], виконаних із дотриманням чинних норм біоетики на білих щурах-самцях (ДУ «Інститут нейрохірургії імені акад. А.П. Ромоданова НАМН України»; інбредна лінія на основі Wistar; групи «ЛПП», «ЛПП + NG») та щурах-самцях лінії Wistar (Інститут фізіології імені О.О. Богомольця НАН України; групи «ЛПП + НСК» та «ЛПП + СККМ»), віком 5 міс., масою 250 г, утримуваних у стандартних умовах.
Експериментальні групи:
— «ЛПП» — лівобічний половинний перетин (ЛПП) спинного мозку (n = 16);
— «ЛПП + NG» — ЛПП + негайна гомотопічна імплантація фрагмента макропористого гідрогелю (NeuroGelTM — NG; n = 20);
— «ЛПП + НСК» — ЛПП + гомотопічна імплантація фрагмента макропористого гідрогелю, асоційованого з фетальними НСК миші (n = 20);
— «ЛПП + СККМ» — ЛПП + гомотопічна імплантація фрагмента макропористого гідрогелю, асоційованого з СККМ зрілої миші (n = 16).
Оперативні втручання здійснювали під загальним знеболюванням (внутрішньоочеревинне введення суміші розчинів ксилазину і кетаміну у звичних дозах [35]), протокол ЛПП включав ламінектомію на рівні Т11, перетин лівої половини спинного мозку, контроль повноти перетину [35]. Макропористий гідрогель NeuroGelTM [36] (полі[N-(2-гідроксипропіл)-метакриламід]) синтезовано в лабораторії E. Pinet (FISO Technologies Inc., Quebec, Канада). СККМ отримували із стегнової кістки статевозрілих мишей-самців лінії FVB-Cg-Tg(GFPU)5Nagy/J, культивували за стандартних умов, фенотипували [32]. НСК отримували з гіпокампа плодів (Е17) миші аналогічної лінії, фенотипували [34]. Через 5 діб у обох випадках у культуральне середовище укладали фрагменти NeuroGelTM, які через 10 діб ім–плантували у зону ЛПП одразу ж після моделювання травми [35].
Показник спастичності (ПС) паретичної задньої кінцівки визначали починаючи із 7-ї доби, згідно зі шкалою Ashworth [37]. Враховуючи асинхронність визначення ПС у різних когортах кожної з експериментальних груп, у цьому та попередніх дослідженнях [32–35, 37–43] використано стандартизовану часову шкалу відображення результатів, яка включає 1, 2, 3, 4, 5, 6, 7, 8, 12, 16, 20, 24-й та 28-й тижні спостереження. Приведення індивідуальних результатів моніторингу ПС до зазначеної шкали здійснено шляхом квазилінійної рандомізованої інтерполяції за алгоритмом змінного середнього. Відсутність суттєвого впливу використаного алгоритму на динаміку та внутрішньогруповий розподіл значень ПС з’ясовано окремим дослідженням із використанням релевантних методів статистичного аналізу.
Протягом перших 2 місяців спостереження щотижневий приріст ПС згідно зі стандартизованою часовою шкалою (VПС) визначали за формулою:
{VПС}n = ПСn – ПСn–1,
де n — тиждень спостереження.
Починаючи з 3-го місяця VПС отримували за формулою:
Розрахунок здійснювали автоматично у межах програмного пакета Statistica 10.0, умовно приймаючи значення ПС і VПС одразу ж після виходу тварини зі стану наркотичного сну рівними нулю (стан спінального шоку).
Усереднені в межах групи значення VПС представляли у вигляді М ± m, де М — середнє значення величини, m — стандартна похибка середнього значення. Для порівняльної оцінки середніх значень VПС використовували непараметричний U-тест Манна — Уїтні (Mann — Whitney U-test). У всіх випадках припущення щодо статистичної значущості отриманого результату вважали правильним, якщо ймовірність нульової гіпотези була меншою ніж 0,05 (р < 0,05).
Кореляцію між середніми значеннями ПС та рівнем функції паретичної кінцівки (оціненими за шкалою Basso — Beattie — Bresnahan [44, 45]) у групах «ЛПП + НСК» і «ЛПП + СККМ» упродовж експерименту оцінювали за допомогою непараметричного коефіцієнту рангової кореляції Спірмена (Spearman’s rank correlation coefficient), результати оцінки виражали у вигляді значення коефіцієнту r зі звичним їх трактуванням.
Результати та обговорення
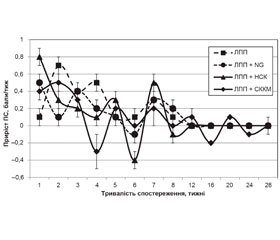
Для VПС групи «ЛПП» характерна динаміка з максимумами на 2, 4 та 7-му тижнях спостереження. Вірогідними виявилися зміни ПС, реєстровані станом на 2, 3, 4, 6, 7-й та 20-й тиждень [32, 34].
Максимуми VПС у групі «ЛПП + NG» реєстрували станом на 1, 3 та 7-й тиждень спостереження, мінімуми — на 2, 6, 12–26-й тиждень. Статистично значущі зміни ПС у групі виявлено станом на 3, 7, 8, 12, 16, 20-й та 24-й тиждень [32, 34], вірогідна різниця значень VПС із відповідним показником групи «ЛПП» характерна для перших 2 тижнів (р = 0,011; р = 0,007 відповідно).
Максимуми VПС у групі «ЛПП + НСК» реєстрували на 1, 5 і 7-му тижні спостереження, мінімуми — на 4, 6 і 8-му тижні. Статистично значущі часові зміни ПС у групі виявлено протягом 3–28-го тижня [32, 34]. Статистично значущу різницю значень VПС та показника групи «ЛПП» виявляли на 1–2-му (р < 0,001; р = 0,002) та 5–7-му тижнях (р = 0,014; р = 0,008; р = 0,018), стосовно показника групи «ЛПП + NG» — лише на 1-му тижні (р = 0,033) спостереження.
Максимуми VПС групи «ЛПП + СККМ» реєстрували на 2, 5, 7, 12, 20-му тижні спостереження, мінімуми — на 4, 6, 8, 16, 24-му тижні. Статистично значущі часові зміни ПС групи виявлено станом на 2, 7, 8, 12, 16, 20, 24-й тиждень спостереження [32, 34], вірогідну різницю значень VПС та відповідного показника групи «ЛПП» — на 1, 2, 16, 20-му тижні (р < 0,03), стосовно показника групи «ЛПП + NG» — впродовж 4–5-го місяців (р < 0,026), групи «ЛПП + НСК» — на 6-му та 16-му тижні (р = 0,036; р = 0,016).
Стосовно динаміки VПС протягом перших тижнів спостереження наявні 2 пари експериментальних груп: «ЛПП + NG» і «ЛПП + НСК» — зменшення VПС, «ЛПП» і «ЛПП + СККМ» — збільшення VПС, більш виражено у групі «ЛПП». Значущі максимуми VПС у групі «ЛПП + NG» виявляли на 3-му тижні, у групі «ЛПП + НСК» — на 1, 5 і 7-му тижнях, у групі «ЛПП» — на 2, 4 і 7-му тижнях, у групі «ЛПП + СККМ» — на 2-му та 7-му тижнях. Отже, динаміка спастичності у групах «ЛПП» і «ЛПП + СККМ», попри вірогідні відмінності значень VПС на 1, 2, 16, 20-му тижнях, схожа протягом усього періоду спостереження.
Особливості динаміки VПС у групах «ЛПП + НСК» і «ЛПП + СККМ» аналогічні виявленим для приросту показника функції, досліджуваного згідно зі шкалою Basso — Beattie — Bresnahan [46]. Додатна кореляція середніх по групі показників спастичності та функції впродовж експерименту («ЛПП + НСК» — r = 0,4 за Спірменом; «ЛПП + СККМ» — r = 0,9 за Спірменом) підтверджує цей висновок. Окрім висвітлених у попередній публікації механізмів виявленої динаміки [46] (проангіогенного впливу СККМ та гліогенного диференціювання НСК), її наявність щодо VПС, як і додатна кореляція середніх по групі показників функції та спастичності паретичної кінцівки, може мати пояснення методологічного характеру. Так, у зв’язку з особливостями шкали Ashworth диференціація «мимовільного» та «довільного» компонентів тонусу м’язів утруднена.
Крім того, регенераційне налагодження серотонінергічних впливів на денервовані мотонейрони, що експресують аутоактивні і, водночас, надмірно афінні до серотоніну форми рецепторів серотоніну (5-НТ2С) [47], до моменту відновлення редагування мРНК цих рецепторів, їх заміни на звичайні, редаговані форми буде супроводжуватися парадоксальним серотонінзалежним підвищенням збудливості мотонейронів на тлі появи її довільної керованості. Іншими словами, на початкових етапах відновлення рухової функції у тварин, у яких має місце ініціація залежного від редагування серотонінових рецепторів механізму спастичності [9, 10], позитивна кореляція між динамікою рухової функції та спастичності протягом певного початкової фази відновного процесу вірогідна. Аналогічний патофізіологічний механізм може реалізуватися й стосовно глутаматергічної системи, оскільки на ранніх етапах спінальної травми наявна денерваційна надчутливість мотонейронів до глутамату [48], обумовлена збільшенням експресії NR1- і NR2-субодиниць NMDA-рецепторів [12, 48, 49].
У групах «ЛПП» і «ЛПП + NG» динаміка VПС і приросту показника функції [46] протилежні. При цьому для середніх показників функції та спастичності впродовж загального періоду спостереження у групі «ЛПП» виявлено слабку додатну кореляцію (r = 0,34 за Спірменом), у групі «ЛПП + NG» — сильну додатну кореляцію (r = 0,92 за Спірменом) [38]. Аргументоване пояснення такої особливості стосовно групи «ЛПП + NG» нині відсутнє. Як важлива причина може виявитися різна швидкість відновлення впливу на мотонейрони низхідних глутаматергічних (близько 60 % усіх низхідних волокон [50–53]) та серотонінергічних (лише 1–2 % синапсів на поверхні мотонейрона [54]) проекцій. Обидві системи медіації беруть участь у формуванні спастичності: глутаматергічна — на більш ранніх стадіях травматичного процесу, серотонінергічна — відтерміновано [47]; обидві відіграють ключову роль у збудженні мотонейрона під час нормальної функції рухової системи: серотонінергічна — як фоновий засіб створення плато-деполяризації, тобто збудливості клітини, глутаматергічна — як безпосередній засіб передачі точних збуджувальних впливів [9]. Зважаючи на це, можна припустити, що у групі «ЛПП» (показники відновлення функції найнижчі [46]) кількісне співвідношення між глутамат- та серотонінергічними входами на мотонейрони, іннервація яких поступово відновлюється, станом на 7-му добу зміщена у бік глутаматергічних. У групі «ЛПП + NG» на цьому ж терміні співвідношення може бути зміщено у бік серотонінергічних. Протягом другого тижня співвідношення в обох групах змінюється на протилежне. Нарешті, у групах «ЛПП + СККМ» і «ЛПП + НСК» об’єм глутаматергічної та серотонінергічної передачі збудження на мотонейрони нижче від рівня травми уже починаючи з першого тижня спостереження значний, їх співвідношення у структурі синаптичних входів ближче до нормального, отже специфіка динаміки приросту рухової функції та спастичності визначається іншими факторами [46]. Частка глутаматергічного чи серотонінергічного впливу на мотонейрон нижче від рівня ураження у межах такої патофізіологічної моделі визначається щонайменше трьома компонентами: швидкістю ремієлінізації кожного з видів волокон, швидкістю встановлення синапсів, часовою динамікою рецепторного спектра та молекулярно-генетичного апарату сигнальної трансдукції мотонейрона.
Для верифікації (чи фальсифікації) запропонованої моделі необхідні подальші дослідження.
Висновки
1. Між динамікою спастичності у випадку травми спинного мозку, імплантації у зону травми макропористого гідрогелю або імплантації аналогічного гідрогелю у поєднанні з СККМ чи НСК існують суттєві відмінності протягом перших тижнів відновного процесу.
2. У випадку ізольованої травми спинного мозку та імплантації у зону травми гідрогелю у поєднанні з СККМ спостерігають збільшення приросту спастичності протягом перших двох тижнів, у випадку імплантації у зону травми гідрогелю або гідрогелю у поєднанні з НСК — зменшення приросту спастичності.
3. Динаміка приросту рухової функції, обрахованої за шкалою Basso — Beattie — Bresnahan, та спастичності у випадку ізольованої травми спинного мозку та імплантації у зону травми гідрогелю протягом перших двох тижнів спостереження протилежна, у випадку імплантації у зону травми гідрогелю, поєднаного з СККМ чи НСК, — однотипна.
4. Особливості динаміки спастичності у випадку імплантації у зону травми спинного мозку гідрогелю, поєднаного з СККМ або НСК, протягом першого місяця спостереження можна пояснити проангіогенним впливом СККМ та гліогенним диференціюванням НСК.
5. Особливості динаміки рухової функції та спастичності у випадку ізольованої травми спинного мозку та імплантації у зону травми гідрогелю протягом перших тижнів відновного процесу можна пояснити різними темпами відновлення супраспінальної серотонінергічної та глутаматергічної передачі збудження на денервовані мотонейрони.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Werner J.K. Traumatic brain injury: recent advances in plasticity and regeneration / J.K. Werner, R.D. Stevens // Curr. Opin. Neurol. — 2015. — Vol. 28, № 6. — P. 565-573.
2. Wen Z. Therapeutic potentials of synapses after traumatic brain injury: a comprehensive review [Електронний ресурс] / Z. Wen, D. Li, M. Shen, G. Chen // Neural. Plast. — 2017. — Vol. 2017, ID 4296075. — P. 1-8. — Режим доступу: https://www.hindawi.com/journals/np/2017/4296075/.
3. Cattin A.-L. The multicellular complexity of peripheral nerve regeneration / A.-L. Cattin, A.C. Lloyd // Cur. Opin. Neurobiol. — 2016. — Vol. 39. — P. 38-46. — doi: 10.1016/j.conb.2016.04.005.
4. Mohanty C.B., Bhat D., Devi B.I. Role of central plasticity in the outcome of peripheral nerve regeneration / C.B. Mohanty, D. Bhat, B.I. Devi // Neurosurgery. — 2015. — Vol. 77, № 3. — P. 418-423. — doi: 10.1227/NEU.0000000000000851.
5. Цымбалюк В.И. Спинной мозг. Элегия надежды: монография / В.И. Цымбалюк, В.В. Медведев. — Винница: Нова Книга, 2010. — 944 с.
6. Young W. Spinal cord regeneration / W. Young // Cell. Transplantation. — 2014. — Vol. 23, № 4-5. — P. 573-611. — doi: 10.3727/096368914X678427.
7. Rao S.N.R. Regulating axonal responses to injury: the intersection between signaling pathways involved in axon myelination and the inhibition of axon regeneration [Електронний ресурс] / S.N.R. Rao, D.D. Pearse // Front. Mol. Neurosci. — 2016. — Vol. 9, ID 33. — Режим доступу: http://journal.frontiersin.org/article/10.3389/fnmol.2016.00033/full.
8. Oliveri R.S. Mesenchymal stem cells improve locomotor recovery in traumatic spinal cord injury: Systematic review with meta-analyses of rat models / R.S. Oliveri, S. Bello, F. Biering-Sørensen // Neurobiol. Dis. — 2014. — Vol. 62. — P. 338-353. — doi: 10.1016/j.nbd.2013.10.014.
9. Recovery of neuronal and network excitability after spinal cord injury and implications for spasticity [Електронний ресурс] / J.M. D’Amico, E.G. Condliffe, K.J.B. Martins [et al.] // Front. Int. Neurosci. — 2014. — Vol. 8, Article 36. — P. 1-24. — Режим доступу: http://journal.frontiersin.org/article/10.3389/fnint.2014.00036/full.
10. Decrease of mRNA editing after spinal cord injury is caused by down-regulation of ADAR2 that is triggered by inflammatory response [Електронний ресурс] / A.F. Di Narzo, A. Kozlenkov, Y. Ge, B. Zhang, L. Sanelli, Z. May [et al.] // Sci. Rep. — 2015. — Vol. 5, Article 12615. — P. 1–15. — Режим доступу: http://www.nature.com/articles/srep12615.
11. Spinal shock revisited: a four-phase model / J.F. Ditunno, J.W. Little, A. Tessler, A.S. Burns // Spinal. Cord. — 2004. — Vol. 42, № 7. — P. 383-395.
12. Global gene expression analysis of rodent motor neurons following spinal cord injury associate molecular mechanisms with development of post-injury spasticity / J. Wienecke, A.-C. Westerdahl, H. Hultborn, O. Kiehn, J. Ryge // J. Neurophysiol. — 2010. — Vol. 103, № 2. — P. 761-778.
13. Down-regulation of the potassium-chloride cotransporter KCC2 contributes to spasticity after spinal cord injury / P. Boulenguez, S. Liabeuf, R. Bos [et al.] // Nat. Med. — 2010. — Vol. 16, № 3. — P. 302-307.
14. Вплив експериментальної спінальної травми на тканинну експресію мРНК деяких елементів медіаторних систем спинного мозку / В.І. Цимбалюк, В.В. Медведєв, І.Г. Васильєва, В.І. Козявкін, О.С. Галанта, О.І. Цюбко [та ін.] // Клінічна хірургія. — 2017. — № 4. — С. 69-73.
15. Concise review: spinal cord injuries — how could adult mesenchymal and neural crest stem cells take up the challenge? / V. Neirinckx, D. Cantinieaux, C. Coste [et al.] // Stem. Cells. — 2014. — Vol. 32, № 4. — P. 829-843. — doi: 10.1002/stem.1579.
16. Рухові функції та імунний статус хворих на розсіяний склероз після ендолюмбального введення алогенних фетальних нейроклітин / В.І. Цимбалюк, Л.І. Соколова, М.І. Лісяний, О.В. Маркова, Л.Д. Пічкур, Л.Л. Чеботарьова [та ін.] // Український неврологічний журнал. — 2007. — № 1(2). — С. 40-45.
17. Ben-Hur T. Immunomodulation by neural stem cells / T. Ben-Hur // J. Neurol. Sci. — 2008. — Vol. 265, № 1–2. — P. 102-104.
18. Human neural stem cells ameliorate autoimmune encephalomyelitis in non-human primates / S. Pluchino, A. Gritti, E. Blezer, S. Amadio, E. Brambilla, G. Borsellino [et al.] // Ann. Neurol. — 2009. — Vol. 66, № 3. — P. 343-354. — doi: 10.1002/ana.21745.
19. Treatment of multiple sclerosis by transplantation of neural stem cells derived from induced pluripotent stem cells / C. Zhang, J. Cao, X. Li, H. Xu, W. Wang, L. Wang [et al.] // Sci. China Life Sci. — 2016. — Vol. 59, № 9. — P. 950-957. — doi: 10.1007/s11427-016-0114-9.
20. Cell transplantation therapy for spinal cord injury / P. Assinck, G.J. Duncan, B.J. Hilton, J.R. Plemel, W. Tetzlaff // Nat. Neurosci. — 2017. — Vol. 20, № 5. — P. 637-47. — doi: 10.1038/nn.4541.
21. Amelioration of motor/sensory dysfunction and spasticity in a rat model of acute lumbar spinal cord injury by human neural stem cell transplantation [Електронний ресурс] / S. van Gorp, M. Leerink, O. Kakinohana [et al.] // Stem. Cell Res. Ther. — 2013. — Vol. 4, Article 57. — P. 1-22. — Режим доступу: https://stemcellres.biomedcentral.com/articles/10.1186/scrt209.
22. Hydrogels and cell based therapies in spinal cord injury regeneration [Електронний ресурс] / R.C. Assunção-Silva, E.D. Gomes, N. Sousa, N.A. Silva, A.J. Salgado [et al.] // Stem. Cells International. — 2015. — Vol. 2015, Article 948040. — P. 1-24. — Режим доступу: https://www.hindawi.com/journals/sci/2015/948040.
23. Siebert J.R. Biomaterial approaches to enhancing neurorestoration after spinal cord injury: strategies for overcoming inherent biological obstacles [Електронний ресурс] / J.R. Siebert, A.M. Eade, D.J. Osterhout // BioMed. Res. Int. — 2015. — Vol. 2015, Article 752572. — P. 1-20. — Режим доступу: https://www.hindawi.com/journals/bmri/2015/752572.
24. Tian L. Strategies for regeneration of components of nervous system: scaffolds, cells and biomolecules / L. Tian, M.P. Prabhakaran, S. Ramakrishna // Regen. Biomater. — 2015. — Vol. 2, № 1. — P. 31-45. — doi: 10.1093/rb/rbu017.
25. Treatment of refractory epilepsy patients with autologous mesenchymal stem cells reduces seizure frequency: an open label study / F. Hlebokazov, T. Dakukina, S. Ihnatsenko, S. Kosmacheva, M. Potapnev, A. Shakhbazau [et al.] // Adv. Med. Sci. — 2017. — Vol. 62, № 2. — P. 273-279. — doi: 10.1016/j.advms.2016.12.004.
26. Shakhbazau A. Autologous mesenchymal stromal cells as a therapeutic in ALS and epilepsy patients: treatment modalities and ex vivo neural differentiation / A. Shakhbazau, M. Potapnev // Cytotherapy. — 2016. — Vol. 18, № 10. — P. 1245-1255. — doi: 10.1016/j.jcyt.2016.06.001.
27. Ng M.T.L. Vascular disruption and the role of angiogenic proteins after spinal cord injury / M.T.L. Ng, A.T. Stammers, B.K. Kwon // Transl. Stroke Res. — 2011. — Vol. 2, № 4. — P. 474-491. — doi: 10.1007/s12975-011-0109-x.
28. Posttraumatic inflammation as a key to neuroregeneration after traumatic spinal cord injury / A. Moghaddam, C. Child, T. Bruckner [et al.] // Int. J. Mol. Sci. — 2015. — Vol. 16, № 4. — P. 7900-7916. — doi: 10.3390/ijms16047900.
29. Advances in regenerative therapies for spinal cord injury: a biomaterials approach / M. Tsintou, K. Dalamagkas, A.M. Seifalian // Neural. Regen. Res. — 2015. — Vol. 10, № 5. — P. 726-742. — doi: 10.4103/1673-5374.156966.
30. Cytokine and growth factor activation in vivo and in vitro after spinal cord injury [Електронний ресурс] / E. Garcia, J. Aguilar-Ce-vallos, R. Silva-Garcia, A. Ibarra // Mediators Inflamm. — 2016. — Vol. 2016, Article ID 9476020. — P. 1-21. — Режим доступу: https://www.hindawi.com/journals/mi/2016/9476020.
31. Kjell J. Rat models of spinal cord injury: from pathology to potential therapies / J. Kjell, L. Olson // Dis. Model. Mech. — 2016. — Vol. 9, № 10. — P. 1125-1137. — doi: 10.1242/dmm.025833.
32. Вплив імплантації NeuroGelTM у асоціації з ксеногенними стовбуровими клітинами кісткового мозку на динаміку синдрому спастичності після спінальної травми в експерименті / В.І. Цимбалюк, В.В. Медведєв, О.А. Рибачук, В.І. Козявкін, Н.Г. Драгунцова // Міжнародний неврологічний журнал. — 2016. — № 7. — C. 20-26. — doi: 10.22141/2224-0713.7.85.2016.86913.
33. Вплив обмеження спонтанної локомоторної активності на перебіг синдрому спастичності за умови експериментальної травми спинного мозку та імплантації матриксу NeuroGelTM, асоційованого з нейрогенними стовбуровими клітинами / В.І. Козявкін, В.І. Цимбалюк, В.В. Медведєв, О.А. Рибачук, Н.Г. Драгунцова // Буковинський медичний вісник. — 2016. — Т. 20, № 4. — С. 83-89.
34. Вплив ксенотрансплантації нейрогенних стовбурових клітин у комплексі з тканинним матриксом NeuroGelTM на перебіг синдрому посттравматичної спастичності в експерименті / В.І. Цимбалюк, В.В. Медведєв, О.А. Рибачук, В.І. Козявкін, Н.Г. Драгунцова // Клінічна хірургія. — 2017. — № 3. — С. 44-47.
35. Модель пересічення половини поперечника спинного мозку. Частина І. Технічні, патоморфологічні та клініко-експериментальні особливості / В.І. Цимбалюк, В.В. Медведєв, В.М. Семенова, Н.Я. Гридіна, Ю.Ю. Сенчик, О.М. Величко [та ін.] // Український нейрохірургічний журнал. — 2016. — № 2. — С. 18-27.
36. Reconstruction of the transected cat spinal cord following NeuroGel implantation: axonal tracing, immunohistochemical and ultrastructural studies / S. Woerly, V.D. Doan, N. Sosa [et al.] // Int. J. Dev. Neurosci. — 2001. — Vol. 19, № 1. — Р. 63-83.
37. Модель поперечного пересічення половини спинного мозку. Частина ІІ. Стан нервово-м’язового апарату, синдром посттравматичної спастичності та хронічний больовий синдром / В.І. Цимбалюк, В.В. Медведєв, Н.Я. Гридіна, Ю.Ю. Сенчик, Л.М. Сулій, М.М. Татарчук [та ін.] // Український нейрохірургічний журнал. — 2016. — № 3. — С. 9-17.
38. Медведєв В.В. Варіативність кореляції рівня функції та спастичності паретичної кінцівки за різного перебігу відновного процесу на моделі спінальної травми / В.В. Медведєв // Шпитальна хірургія. — 2016. — № 4. — С. 21-26. — doi 10.11603/2414-4533.2016.4.7180.
39. Клініко-морфологічні особливості моделі відкритої проникної травми спинного мозку з тривалим перебуванням стороннього тіла у хребтовому каналі / В.І. Цимбалюк, В.В. Медведєв, В.М. Семенова, Н.Я. Гридіна, Ю.Я. Ямінський, Ю.Ю. Сенчик [та ін.] // Український нейрохірургічний журнал. — 2016. — № 4. — С. 16-25.
40. Вплив трансплантації тканини нюхової цибулини на перебіг синдрому спастичності та хронічного больового синдрому при травмі спинного мозку в експерименті / В.І. Цимбалюк, В.В. Медведєв, Ю.Ю. Сенчик, Н.Я. Гридіна, М.М. Татарчук, Н.Г. Драгунцова [та ін.] // Український неврологічний журнал. — 2016. — № 4. — С. 59-66.
41. Вплив трансплантації тканини фетального мозочка на перебіг синдрому спастичності та хронічного больового синдрому при експериментальній травмі спинного мозку у щурів / В.В. Медведєв, Ю.Ю. Сенчик, М.М. Татарчук, Н.Г. Драгунцова, С.М. Дичко, В.І. Цимбалюк // Клітинна та органна трансплантологія. — 2017. — Т. 5, № 1. — С. 44-49.
42. Вплив імплантації NeuroGelTM у поєднанні з ксеногенними стовбуровими клітинами нервового гребня на перебіг синдрому спастичності після експериментальної травми спинного мозку / В.І. Цимбалюк, В.В. Медведєв, Р.Г. Васильєв, О.А. Рибачук, В.І. Козявкін, Н.Г. Драгунцова // Міжнародний неврологічний журнал. — 2017. — № 1. — С. 12-17. — doi: 10.22141/2224-0713.1.87.2017.96533.
43. Модель відкритої проникної травми спинного мозку з тривалою персистенцією біосумісного стороннього тіла у каналі хребта. Синдром посттравматичної спастичності / В.І. Цимбалюк, В.В. Медведєв, Н.Я. Гридіна, Ю.Ю. Сенчик, М.М. Татарчук, Н.Г. Драгунцова [та ін.] // Клінічна хірургія. — 2016. — № 10. — С. 67-71.
44. Вплив ксенотрансплантації нейрогенних стовбурових клітин у комплексі з тканинним матриксом NeuroGelTM на відновлення рухової функції спинного мозку щура після експериментальної спінальної травми / В.І. Цимбалюк, В.В. Медведєв, О.А. Рибачук [та ін.] // Клінічна хірургія. — 2017. — № 1. — С. 64-66.
45. Вплив імплантації NeuroGelTM у асоціації з ксеногенними стовбуровими клітинами кісткового мозку на відновлення рухової функції задньої кінцівки щура після спінальної травми / В.І. Цимбалюк, В.В. Медведєв, О.А. Рибачук, В.І. Козявкін [та ін.] // Міжнародний неврологічний журнал. — 2016. — № 6(84). — С. 13-19.
46. Порівняльний аналіз динаміки відновлення рухової функції паретичної кінцівки щура після травми спинного мозку та відновних нейроінженерних втручань із використанням стовбурових клітин мезенхімального й нейрогенного фенотипу / В.І. Цимбалюк, В.В. Медведєв, Ю.Ю. Сенчик, Н.Г. Драгунцова // Міжнародний неврологічний журнал. — 2017. — № 7(93). — С. 16-22.
47. The time course of serotonin 2C receptor expression after spinal transection of rats: an immunohistochemical study / L.-Q. Ren, J. Wienecke, M. Chen [et al.] // Neuroscience. — 2013. — Vol. 236. — P. 31-46. — doi: 10.1016/j.neuroscience.2012.12.063.
48. Spinal shock revisited: a four-phase model / J.F. Ditunno, J.W. Little, A. Tessler, A.S. Burns // Spinal. Cord. — 2004. — Vol. 42, № 7. — P. 383-395. — doi: 10.1038/sj.sc.3101603.
49. Phrenic motoneuron expression of serotonergic and glutamatergic receptors following upper cervical spinal cord injury / C.B. Mantilla, J.P. Bailey, W.Z. Zhan, G.C. Sieck // Exp. Neurol. — 2012. — Vol. 234, № 1. — P. 191-199. — doi: 10.1016/j.expneurol.2011.12.036.
50. Neurotransmitter phenotypes of descending systems in the rat lumbar spinal cord / A. du Beau, S. Shakya Shrestha, B.A. Bannatyne [et al.] // Neuroscience. — 2012. — Vol. 227. — Р. 67-79. — doi: 10.1016/j.neuroscience.2012.09.037.
51. Origin and neurochemical properties of bulbospinal neurons projecting to the rat lumbar spinal cord via the medial longitudinal fasciculus and caudal ventrolateral medulla [Електронний ресурс] / Z. Huma, A. Du Beau, C. Brown, D.J. Maxwell // Front. Neural Circuit. — 2014. — Vol. 8, Article 40. — P. 1-14. — Режим доступу: http://journal.frontiersin.org/article/10.3389/fncir.2014.00040/full.
52. Terminations of reticulospinal fibers originating from the gigantocellular reticular formation in the mouse spinal cord / H. Liang, C. Watson, G. Paxinos // Brain Struct. Funct. — 2016. — Vol. 221, № 3. — P. 1623-1633. — doi: 10.1007/s00429-015-0993-z.
53. Synaptic control of motoneuronal excitability / J.C. Rekling, G.D. Funk, D.A. Bayliss [et al.] // Physiol. Rev. — 2000. — Vol. 80, № 2. ― P. 767-852.
54. Distribution of 5-hydroxytryptamine-immunoreactive boutons on alpha-motoneurons in the lumbar spinal cord of adult cats / F.J. Alvarez, J.C. Pearson, D. Harrington [et al.] // J. Comp. Neurol. — 1998. — Vol. 393, № 1. — P. 69-83.

/11-1.jpg)
/12-1.jpg)