Введение
Актуальность проблемы черепно-мозговой травмы (ЧМТ) не требует особых обоснований. В мире ежегодно более 10 миллионов человек погибают или госпитализируются из-за ЧМТ [1]. Большинство больных с ЧМТ относятся к наиболее трудоспособной части населения, лица в возрасте от 20 до 55 лет составляют до 85 % пострадавших. Согласно статистике ВОЗ, сохраняется многолетняя тенденция к нарастанию удельного веса ЧМТ. Повреждения головного мозга часто приводят к потере трудоспособности. Таким образом, проблема имеет не только медицинский, но и социальный характер.
В структуре ЧМТ от 75 до 92 % приходится на легкие закрытые черепно-мозговые травмы (ЛЗЧМТ). Острый период ЛЗЧМТ всегда сопровождается симптомами поражения гипоталамо-гипофизарной области, так как эта область в связи с особенностями строения и топографии наиболее ранима при травме [2].
Проведенное нами изучение состояния анимальной и вегетативной нервной системы (ВНС) у 100 больных в остром периоде сотрясения головного мозга показало, что нередко только проявления вегетативных стигм позволяют объективно судить о перенесенной травме, ее тяжести и течении [3]. Особое место в координации целостной деятельности организма занимает уникальная по своей анатомо-функциональной структуре гипоталамо-гипофизарная нейросекреторная система (ГГНС). Благодаря нейросекреторным клеткам гипоталамуса, которые одновременно являются нервными и эндокринными, именно на этом уровне происходит взаимодействие между нервной и эндокринной системами, осуществляется роль гипоталамуса в поддержании гомеостаза. Нарушения функции гипоталамо-гипофизарной области в остром периоде легкой закрытой черепно-мозговой травмы (ЛЗЧМТ) вызывает целый ряд нейроэндокринных и вегетативных сдвигов, которые в значительной мере определяют клиническую картину заболевания.
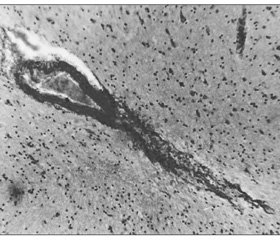
Изученная нами динамика нейросекреторной активности гипоталамуса в остром периоде ЛЗЧМТ и проведенное сопоставление функциональной активности ГГНС у людей, погибших в остром периоде ЛЗЧМТ, и у животных после экспериментальной ЛЗЧМТ выявили общность направленности нейросекреторных процессов. В момент травмы и в течение 30 минут после нее (по данным проведенных нами исследований) ГГНС находится в состоянии умеренной функциональной активности, которое через один час после ЛЗЧМТ сменяется значительным усилением синтеза и выведения нейросекрета из супраоптического ядра (СОЯ) и паравентрикулярного ядра (ПВЯ). Такая реакция является закономерной, так как в ответ на любой стрессовый раздражитель эта система приходит в состояние повышенной функциональной активности. Отмечаемое двадцатикратное увеличение содержания вазопрессина в крови непосредственно после 10-минутного болевого воздействия, а затем снижение его уровня через один час в 8 раз, по-видимому, указывают на то, что непосредственно в момент стресса адаптационные реакции осуществляются за счет экстренного выброса вазопрессина из его депо — нейрогипофиза. Об этом же свидетельствует значительное уменьшение количества нейросекрета в задней доле гипофиза спустя один час после травмы. Можно предположить, что одной из причин активации нейросекреторных клеток СОЯ и ПВЯ является компенсаторная реакция в ответ на уменьшение количества нейросекрета в гипофизе. Высокая активность ГГНС сохраняется в течение первых суток острого периода и проходит на фоне нарастающих явлений патологии сосудистой системы самого гипоталамуса. Уже с самых ранних сроков исследования отмечается гиперемия ткани, спазм артериальных сосудов на фоне паретического расширения капилляров и венозных сосудов, дистония сосудов, значительное количество мелких кровоизлияний. Надо отметить, что для ЛЗЧМТ более характерно преобладание диапедезных кровоизлияний (рис. 1), рексальные кровоизлияния были довольно редкой находкой (рис. 2).
/31-1.jpg)
Объясняется это, на наш взгляд, резким повышением проницаемости стенок сосудов при ЧМТ, при этом нужно учесть известное явление физиологически повышенной проницаемости сосудов в гипоталамической области. Различные изменения сосудов наблюдались не только в межъядерной зоне, но и в области нейросекреторных ядер. Расстройство кровообращения в области СОЯ и ПВЯ является отрицательным фактором и значительно нарушает нормальное функционирование ГГНС, особенно в условиях его активации. Высокая активность ГГНС с одновременным нарушением кровообращения в области гипоталамуса приводит эту систему к истощению на вторые сутки после ЛЗЧМТ. В нейросекреторных клетках СОЯ и ПВЯ наблюдалось снижение активности синтеза нейросекрета, хотя основное проявление патологии ГГНС идет за счет нарушения выведения нейросекрета из клеток и нейрогипофиза. Цитоплазма большинства клеток СОЯ и ПВЯ была заполнена нейросекретом (рис. 3).
/32-1.jpg)
Значительное его количество отмечалось и в задней доле гипофиза, в которой к этому сроку усиливался капилляростаз (рис. 4), увеличивалось количество спавшихся капилляров, нарастал периваскулярный и интерстициальный отек, а также число диапедезных кровоизлияний.
Возможно, что развивающееся угнетение функции ГГНС является следствием нарушения эвакуации нейросекрета из гипофиза, хотя немаловажную роль, конечно, играют и наблюдаемые изменения самих клеток гипоталамуса по типу гипоксии и гидропии (рис. 5).
/32-2.jpg)
Состояние пониженной функциональной активности ГГНС сохранялось с третьих по седьмые сутки после ЛЗЧМТ. Именно в эти сроки наблюдался наиболее выраженный отек ткани гипоталамуса и гипофиза. В то же время значительное уменьшение отека в наших наблюдениях происходит в течение третьей недели острого периода, что совпадает с периодом резкого усиления функции ГГНС. С определенной вероятностью можно заключить, что возрастание выделения нейрогормонов СОЯ и ПВЯ (участие которых в водном обмене общепризнано) к концу второй недели приводит к нормализации водно-солевого обмена и, как следствие, к регрессу отека мозга. Функциональная активность ГГНС в наших наблюдениях усиливалась на 10-е сутки, достигала своего максимума к концу второй недели и на 14-е и 21-е сутки была явно повышенной. Сроки восстановления функции ГГНС, вероятно, зависят от регресса расстройств кровоснабжения этой области и нормализации метаболизма в ткани гипоталамуса. Уменьшение сосудистой реакции в области нейросекреторных ядер и в нейрогипофизе начиналось на 10-е сутки и особенно проявлялось к концу второй недели. Восстановление кровообращения в задней доле гипофиза способствует выведению нейросекрета в кровь, а следовательно, созданию предпосылок к нормальному функционированию всей системы.
Проведенное исследование позволило выделить в динамике реакции ГГНС при ЛЗЧМТ шесть основных периодов: 1) первичной активации системы, 2) напряжения, 3) угнетения, 4) вторичной активации, 5) адаптации, 6) нормализации функции.
Первый период — первичной активации ГГНС — продолжительностью около часа, в течение которого состояние умеренной функциональной активности ГГНС, наблюдаемое непосредственно в момент травмы и в первые минуты после нее, сменялось высокой активностью ГГНС. Именно в это время происходил массовый выброс нейросекрета из нейрогипофиза в кровь.
Второй период — период напряжения — характеризовался высокой функциональной активностью системы и продолжался около суток. Нейросекреторные клетки СОЯ и ПВЯ активно синтезировали нейросекрет, но во всей системе его было мало, так как он сразу поступает в кровь. Снижение активности ГГНС наблюдалось уже спустя сутки после ЛЗЧМТ, но в состояние угнетения система приходит в течение вторых суток.
Третий период — период угнетения — характеризовался картиной резкого угнетения функции ГГНС. Вся система заполнена большим количеством нейросекрета, СОЯ и ПВЯ в основном представлены клетками с пониженной нейросекреторной активностью. Продолжается он всю первую неделю после травмы и лишь к 10-му дню сменяется периодом вторичной активации.
Реабилитация ГГНС происходила в течение второй недели, и к 14-му дню наблюдалось резкое усиление активности ГГНС, отмечаемое на протяжении всей третьей недели. Этот период высокой функциональной активности назван нами периодом адаптации, так как, по нашему мнению, избыточная активность ГГНС, отмечаемая на 14-е и 21-е сутки острого периода ЗЧМТ, связана с участием этой системы в осуществлении адаптационных реакций и приводила к относительному восстановлению гомеостаза организма, перенесшего ЧМТ.
Нормализация функции ГГНС после ЛЗЧМТ происходила на четвертой неделе острого периода. На 30-е и 45-е сутки наблюдалось состояние умеренной функциональной активности ГГНС, что отмечалось и у контрольных животных, травма которым не наносилась.
Патология гипоталамо-гипофизарной области в остром периоде заболевания вызвала у больных различные вегетативные нарушения, динамика которых в значительной степени коррелирует с динамикой функциональной активности гипоталамуса.
Так, проведенное изучение изменений вегетативной нервной системы в остром периоде ЛЗЧМТ показало, что различные симптомы поражения этой системы прослеживаются у большинства больных на всем протяжении острого периода заболевания. Вегетативно-сосудистые, температурные и адаптационные нарушения возникают сразу после травмы, прослеживаются до наиболее позднего срока наблюдения — 20–21-х суток, и динамика их имеет свои особенности.
Выявленное в первую неделю достоверное повышение экскреции адреналина и норадреналина с мочой указывает на возрастание активности симпатоадреналовой системы у больных после ЛЗЧМТ.
Таким образом, исследование вегетативных функций в динамике острого периода ЛЗЧМТ дало возможность сопоставить направленность вегетативных изменений в клинике с динамикой нейросекреторной активности гипоталамуса у погибших в этом периоде людей и в эксперименте у животных. Такое сопоставление позволило отметить, что определенные изменения у пострадавших в остром периоде ЛЗЧМТ могут быть объяснены состоянием гипоталамуса и, в частности, активностью ГГНС в этот период.
Так, наиболее выраженная симптоматика нарушения интегрирующей функции гипоталамуса отмечается на 7–8-е сутки после ЛЗЧМТ, что соответствует периоду угнетения функции ГГНС и в клинике проявляется наибольшим усилением вегетативно-сосудистых расстройств, нарушением вегетативного обеспечения деятельности. На 14–15-е сутки в период высокой активности ГГНС наблюдается значительное усиление вегетоадаптационных реакций в клинике, что обусловлено повышением симпатической реактивности у большинства больных, хотя симптомы вегетативного раздражения и преобладание симпатических реакций отмечаются сразу после травмы и прослеживаются первые две недели острого периода, с некоторым снижением их выраженности на 7–8-е сутки. Высокая функциональная активность ГГНС на 14-е и 21-е сутки острого периода ЛЗЧМТ, по нашему мнению, связана с участием этой системы в осуществлении относительного восстановления гомеостаза организма, что подтверждалось восстановлением интегрирующей функции гипоталамуса у большей части обследуемых лиц к 20–21-му дню.
Протокол оказания медицинской помощи больным с сотрясением головного мозга («Протокол надания медичної допомоги хворим зі струсом головного мозку» — Наказ Міністерства охорони здоров’я України № 245 від 25.04.2006) определяет сроки пребывания больного в нейрохирургическом, неврологическом отделениях — до 3 суток; при поражениях мягких тканей — до 8 суток, с последующим лечением в амбулаторных условиях под наблюдением невролога. Достаточно продолжительное течение острого периода травмы заставило нас искать пути медикаментозного ускорения реабилитационных процессов при ЛЗЧМТ. Ноотропные препараты — одна из наиболее динамично развивающихся групп лекарственных средств. Особенность ноотропов заключается в прямом активизирующем влиянии на обучение, улучшение памяти и умственной деятельности, повышение устойчивости мозга к агрессивным воздействиям — гипоксии, травме, интоксикации; этим препаратам свойственна амфотропность, т.е. отсутствие возможности оказывать влияние на высшую нервную деятельность и психику человека в норме и улучшать течение этих процессов при имеющихся функциональных или морфологических нарушениях.
Наше внимание привлек препарат Энтроп, созданный с целью повышения устойчивости ЦНС и коррекции функциональных систем организма в условиях пилотируемых космических полетов. Ноотропный эффект препарата проявляется уже в дозе 3 мг/кг, что практически в 72 раза выше эффекта пирацетама. Энтроп оказывает психостимулирующее, антиастеническое, более выраженное, чем у пирацетама вегетотропное действие и повышает устойчивость мозга к физическим и психическим нагрузкам, противосудорожную активность [4]. Ранее уже был показан умеренный, преобладающий в идеаторной сфере психостимулирующий эффект препарата в сочетании с анксиолитической активностью, улучшением настроения, повышением порога болевой чувствительности [5].
Многими авторами отмечалась эффективность включения препарата в комплекс лечения больных как в остром, так и в отдаленном периоде лечения травматической болезни мозга [6–8]. Т.В. Черний, И.А. Андронова, В.И. Черний (2009) показали, что применение Энтропа при тяжелой ЧМТ в дозе 300 мг в течение двух недель положительно влияет на мозговой кровоток, уменьшает дезорганизацию ЭЭГ-паттернов и снижает летальность [9].
Н.Н. Грицай с соавт. (2008), с учетом положительного влияния на интегративные функции, а также микроциркуляцию головного мозга, рекомендуют Энтроп как препарат с ноотропным и церебропротективным действием для лечения пациентов после перенесенных нейроинфекций и черепно-мозговых травм курсом не менее 2 месяцев в дозе 150 мг в сутки [10]. Л.Л. Чеботарева с соавт. (2016) доказала целесообразность назначения препарата в отдаленном периоде ЧМТ [11].
Нами была поставлена цель: изучить влияние препарата Энтроп на психоэмоциональное состояние и зависимое от здоровья качество жизни пациентов с сотрясением головного мозга.
Материалы и методы
Изучены результаты лечения 60 больных с сотрясением головного мозга, 30 — в контрольной группе, получавшей базовую терапию, 30 — в экспериментальной, где к базовой терапии был добавлен Энтроп по 100 мг два раза в сутки в течение 5 дней, а затем один раз в сутки в течение 10 дней.
Группы были сопоставимы по полу — 56,7 % мужчин, 43,3 % женщин, а также по возрасту (средний возраст 41 год, в диапазоне от 25 до 57 лет).
Проводилось общее неврологическое обследование с учетом субъективных и объективных симптомов, а также применялся ряд дополнительных методик.
Для оценки зависимого от здоровья качества жизни была использована краткая версия опросника здоровья (MOS 36-Item Short-Form Health Survey, или MOS SF-36, автор — Ware J.E., 1992) [12]. Использовалась версия опросника, созданная исследователями Межнационального центра исследования качества жизни в 1998 году [13, 14]. Данная версия опросника SF-36 обладает надежными психометрическими свойствами [15, 16]. Опросник состоит из 11 пунктов, часть из которых, в свою очередь, имеет от трех до десяти подпунктов, общее число вопросов — 36 [17].
Для оценки астенических проявлений использовалась субъективная шкала оценки астении (Multidimensional Fatigue Inventory — МFI-20) (Smets E.M., Garssen B.J., Bonke B., DeHaes J.C.), предназначенная для экспресс-диагностики астенического состояния.
Шкала имеет следующие субшкалы:
Общая астения (вопросы № 1, 5, 12, 16).
Пониженная активность (вопросы № 3, 6, 10, 17).
Снижение мотивации (вопросы № 4, 9, 15, 18).
Физическая астения (вопросы № 2, 8, 14, 20).
Психическая астения (вопросы № 7, 11, 13, 19).
По каждой из перечисленных субшкал вычисляется свой суммарный балл. Кроме того, высчитывается общий суммарный балл.
В норме общее количество баллов не должно превышать 20–30.
Итоговые баллы используются для принятия целостного решения относительно степени тяжести астении. Результат по каждой шкале может изменяться в интервале от 4 до 20 баллов. Сумма баллов больше 12 хотя бы по одной шкале может являться основанием для диагноза «астенический синдром».
Для выявления наличия и степени выраженности тревожных и депрессивных расстройств использовалась госпитальная шкала тревоги и депрессии (Hospital Anxiety and Depression Scale, или HADS), разработанная A. Zigmond и R. Snaith в 1983 году [18, 19]. Шкала предназначена для скринингового выявления тревоги и депрессии [11, 12]. Она имеет 14 утверждений, при этом нечетные пункты (1, 3, 5, 7, 9, 11, 13) составляют субшкалу тревоги, а четные пункты (2, 4, 6, 8, 10, 12, 14) — субшкалу депрессии. Каждому утверждению соответствуют 4 варианта ответов, которые отражают различную степень выраженности признака и кодируются по нарастанию тяжести симптома от 0 баллов (отсутствие) до 3 (максимальная выраженность). Результирующая сумма баллов подсчитывается раздельно для субшкал тревоги и депрессии. Выделяют следующие области значений суммарного балла по каждой субшкале: 0–7 баллов — норма; 8–10 баллов — субклинически выраженная тревога или депрессия; 11 и более баллов — клинически выраженная тревога или депрессия.
Статистическая обработка полученных данных проводилась с помощью лицензионной статистической программы Stadia 6.3 с использованием критериев Вилкоксона и Колмогорова — Смирнова.
Результаты
Изучение параметров качества жизни пациентов группы Энтропа и контрольной группы до лечения не выявило их существенной разницы. Качество жизни у пациентов группы Энтропа и контрольной группы после лечения выявило улучшение параметров практически по всем субшкалам опросника с наилучшими результатами в области ролевого функционирования, критерия Колмогорова — Смирнова < 0,01. Детально параметры качества жизни представлены ниже.
Показатели физического функционирования у пациентов, получавших базовую терапию, составили 94,7 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 % (рис. 6).
Показатели ролевого физического функционирования у пациентов, получавших базовую терапию, составили 77 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 % (рис. 7).
Показатели боли у пациентов, получавших базовую терапию, составили 89 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 % (рис. 8).
Показатели общего здоровья у пациентов, получавших базовую терапию, составили 92,5 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 % (рис. 9).
Показатели жизнеспособности у пациентов, получавших базовую терапию, составили 80 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 % (рис. 10).
Показатели социального функционирования у пациентов, получавших базовую терапию, составили 83 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 % (рис. 11).
Показатели ролевого эмоционального функционирования у пациентов, получавших базовую терапию, составили 64,8 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 % (рис. 12).
Показатели психологического здоровья у пациентов, получавших базовую терапию, составили 69,4 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 % (рис. 13).
Исследование выраженности депрессивных расстройств в соответствии с HADS у пациентов группы Энтропа и контрольной группы выявило, что различий между группами до лечения не наблюдалось. Значимость теста Колмогорова — Смирнова при сравнении результатов после лечения практически равнялась нулю, т.е. различия между группами после лечения являлись статистически высоко значимыми: среднее количество баллов — 6,0 в группе пациентов, получавших Энтроп, и 10,1 в контрольной группе (рис. 14).
Средний уровень астенических проявлений до лечения был практически равным в группе Энтропа и контрольной группе. Значимость теста Колмогорова — Смирнова при сравнении результатов лечения практически равна нулю, т.е. различия между группами после лечения являлись статистически высоко значимыми, с лучшими показателями по общему количеству баллов по шкале MFI у пациентов, получавших Энтроп, — 50 баллов против 70 у пациентов контрольной группы (рис. 16, 17).
Обсуждение
Положительные результаты лечения, заключающиеся в улучшении показателей зависимого от здоровья качества жизни пациентов с сотрясением головного мозга, отмечены нами и в контрольной группе, и в группе, получавшей Энтроп. При этом в группе пациентов, получавших Энтроп, отмечалось статистически более значимое улучшение состояния психоэмоциональной сферы и зависимого от здоровья качества жизни.
Таким образом, уменьшение проявлений астении, выраженности тревожных и депрессивных расстройств, улучшение показателей зависимого от здоровья качества жизни пациентов с сотрясением головного мозга отмечены и в контрольной, и в экспериментальной группе.
Влияние Энтропа на состояние психоэмоциональной сферы и зависимое от здоровья качество жизни демонстрирует статистически более значимое улучшение этих параметров в группе больных, принимавших Энтроп, в сравнении с контрольной группой. Применение Энтропа в дополнение к стандартной терапии способствует лучшим результатам лечения и показано больным с сотрясением головного мозга.
Нейробиохимические механизмы реализации эффектов Энтропа определяются усилением метаболических, биоэнергетических и пластических процессов в головном мозге, усилением синтеза белка и фосфолипидов, повышением скорости оборота информационных молекул, полимодальным влиянием на широкий диапазон синаптических систем — холинергическую, адренергическую, дофаминергическую, глутаматергическую и, главным образом, ГАМКергическую.
Выводы
Энтроп показан при лечении заболеваний, сопровождающихся астенией, повышенной утомляемостью, нарушением процессов памяти и мышления сосудистого, посттравматического, возрастного и иного происхождения. В отличие от других ноотропных препаратов Энтроп эффективен уже при 10-дневном курсе применения.
Конфликт интересов. Не заявлен.
Список литературы
1. Шанько Ю.Г., Сидорович Р.Р., Танин А.Л. и др. Эпидемиология черепно-мозговой травмы в Республике Беларусь // Міжнародний неврологічний журнал. — 2017. — № 5 (91). — С. 31-37.
2. Курако Ю.Л., Букина В.В. Легкая закрытая черепно-мозговая травма. — К.: Здоровья, 1989. — 160 с.
3. Горанский Ю.И., Герцев В.Н. Астения при черепно-мозговой травме как отражение вегетативной дисфункции // Міжнародний неврологічний журнал. — 2016. — № 4 (82). — С. 67-73.
4. Ахапкина В.И. Адаптогенное действие ноотропных препаратов // Российский медицинский журнал. — 2005. — 3. — 40-43.
5. Горанский Ю.И., Герцев В.Н., Лебедь Е.П., Парневая Е.В. Применение препарата энтроп у больных с дисциркуляторной энцефалопатией // Тезисы докладов III Южно-Украинской научно-практической конференции «Лечение болезней сердечно-сосудистой системы и ассоциированной патологии». — Одесса, 2008. — С. 32-34.
6. Ахапкина В.Н., Федин А.И., Аведисова А.С., Ахапкин Р.В. Эффективность Фенотропила при лечении астенического синдрома и синдрома хронической усталости // Атмосфера. Нервные болезни. — 2004. — 3. — 28-31.
7. Ахапкина В.И. Адаптогенное действие ноотропных препаратов // Российский медицинский журнал. — 2005. — 3. — 40-43.
8. Мамчур В.И., Опрышко В.И., Кравченко К.А., Куник А.В. Особенности фармакологии ноотропов при когнитивном дефиците на фоне повышенной судорожной готовности мозга // Актуальные вопросы психоневрологии. — 2009. — С. 169-174.
9. Черний Т.В., Андронова И.А., Черний В.И. Возможности применения энтропа в комплексной терапии тяжелой ЧМТ // Нейронауки: теоретичні та клінічні аспекти. — 2009. — Т. 5, № 1-2. — С. 76-81.
10. Грицай Н.Н., Кобзистая Н.А., Силенко Г.Я., Мартынен-ко А.Н. Влияние ноотропного препарата энтроп на когнитивные функции мозга пациентов, перенесших нейроинфекцию или черепно-мозговую травму // Український вісник психоневрології. — 2008. — Т. 16, вип. 2 (55). — С. 10-11.
11. Чеботарьова Л.Л., Муравський А.В., Солонович О.С. Ефективність використання препарату ентроп у лікуванні астенії в пацієнтів, які перенесли черепно-мозкову травму // Міжнародний неврологічний журнал. — 2016. — № 7 (85). — С. 29-34.
12. Ware J.E., Sherbourne C.D. The MOS 36-Item short-form health survey (SF-36): conceptual framework and item selection // Med. Care. — 1992. — Vol. 30, № 6. — P. 473-483.
13. Кудряшова И.В. Ранняя диагностика хронического панкреатита с позиции использования ультразвуковой томографии и индекса качества жизни: Метод. рекоменд. — Смоленск: СГМА, 2003. — С. 8-14.
14. Новик А.А., Ионова Т.И. Руководство по исследованию качества жизни в медицине. — СПб.: Изд. дом «Нева»; М.: ОЛМА-ПРЕСС Звездный мир, 2002. — 320 с.
15. Новик А.А., Ионова Т.И., Кайнд П. Концепция исследования качества жизни в медицине. — СПб.: ЭЛБИ, 1999. — 140 с.
16. Новик А.А., Ионова Т.И., Шуваев В.А., Киштович А.В. Качество жизни больных язвенной болезнью желудка и двенадцатиперстной кишки в России // Исследование качества жизни в медицине: Матер. науч. конф. — СПб., 2000. — С. 97-98.
17. Белова А.Н. Шкалы, тесты и опросники в неврологии и нейрохирургии. — М., 2004. — С. 204-207.
18. Сыропятов О.Г., Дзеружинская Н.А., Астапов Ю.Н., Иванцова Г.В. Ранняя диагностика и лечение депрессии в общей медицинской практике (Гелариум-тест). — К.: Украинская военно-медицинская академия, 2003.
19. Zigmond A.S., Snaith R.P. The Hospital Anxiety and Depression Scale // Acta Psychiatr. Scand. — 1983. — Vol. 67, № 6. — P. 361-370.

/31-1.jpg)
/32-1.jpg)
/32-2.jpg)
/35-1.jpg)
/35-2.jpg)
/36-1.jpg)
/36-2.jpg)
/37-1.jpg)
/37-2.jpg)
/38-1.jpg)