Резюме
Актуальність. Близько 6–8 % всіх інсультів становить субарахноїдальний крововилив (САК) внаслідок розриву артеріальної аневризми. 10–15 % із них є фатальними, тобто пацієнт помирає ще до того, як надійшов до стаціонару. За даними деяких авторів, судоми в гострий період САК (перші 7 діб) асоціюються із збільшенням ризику смерті й інвалідності, тоді як інші автори заперечують вплив судом на перебіг САК. З огляду на суперечливість цих даних судоми не входять у класичні шкали з оцінки прогнозу перебігу САК. Мета: провести аналіз поширеності гострого симптоматичного епінападу при САК і дослідити його вплив на перебіг цього захворювання. Розробити прогностичну шкалу оцінки САК з урахуванням судомних нападів. Матеріали та методи. Проведено аналіз серії 127 клінічних випадків САК. Усіх пацієнтів оцінено за стандартними шкалами: Hunt — Hess Scale, the World Federation of Neurological Surgeons Scale, Glasgow Coma Scale. Досліджено поширеність гострого симптоматичного епінападу. Всіх пацієнтів оцінено за створеною шкалою комбінованої оцінки прогнозування наслідку у пацієнта після субарахноїдального крововиливу (ШКОП). Результати лікування оцінено за Glasgow Outcome Scale (шкала наслідку Глазго). Результати. У 13 пацієнтів із 127 спостерігалися судоми в гострий період захворювання. У кожного 10-го пацієнта епілептичний напад був першим клінічним симптомом хвороби. Поширеність епілептичних нападів становила 10,2 %, до того ж у 5 з 13 пацієнтів із судомами САК закінчився летально, що станоить 35,7 % всіх летальних випадків, зафіксованих у нашій групі пацієнтів. Запропоновано враховувати судоми в дебюті САК як ізольований предиктор поганого наслідку у пацієнтів. Розроблено ШКОП, до якої включено критерій наявності/відсутності судом у дебюті. Летальність серед пацієнтів, які набрали 5–6 балів за ШКОП, становила 77 %, серед пацієнтів, які набрали 7–8 балів, — 100 %. Висновки. Судомний напад у дебюті САК асоціюється з вірогідним підвищенням ризику смерті (p = 0,001). ШКОП із субарахноїдальним крововиливом дозволяє прогнозувати перебіг захворювання, що сприяє вчасним корекції лікування, призначенню швидкодіючих парентеральних антиконвульсантів і, відповідно, визначає кращий наслідок у пацієнтів.
Актуальность. Около 6–8 % всех инсультов составляет субарахноидальное кровоизлияние (САК) вследствие разрыва артериальной аневризмы. 10–15 % из них являются фатальными, то есть пациент умирает еще до того, как поступил в стационар. По данным некоторых авторов, судороги в острый период САК (первые 7 дней) ассоциируются с увеличением риска смерти и инвалидности, тогда как другие авторы отрицают влияние судорог на течение САК. С учетом противоречивости этих данных судороги не входят в классические шкалы оценки прогноза течения САК. Цель: провести анализ распространенности острого симптоматического эпиприпадка при САК и исследовать его влияние на течение этого заболевания. Разработать прогностическую шкалу оценки САК с учетом судорожных припадков. Материалы и методы. Проведен анализ серии 127 клинических случаев САК. Всех пациентов оценили по стандартным шкалам: Hunt — Hess Scale, the World Federation of Neurological Surgeons Scale, Glasgow Coma Scale. Исследована распространенность острого симптоматического эпиприпадка. Всех пациентов оценивали по созданной шкале комбинированной оценки прогнозирования исхода у пациента после субарахноидального кровоизлияния (ШКОП). Результаты лечения оценены по Glasgow Outcome Scale (шкала исхода Глазго). Результаты. У 13 пациентов из 127 наблюдались судороги в острый период заболевания. У каждого 10-го пациента эпилептический приступ был первым клиническим симптомом болезни. Распространенность эпилептических припадков составляла 10,2 %, к тому же у 5 из 13 пациентов с судорогами САК закончилось летально, что составило 35,7 % всех летальных случаев, зафиксированных в нашей группе пациентов. Предложено учитывать судороги в дебюте САК как изолированный предиктор плохого исхода у пациентов. Разработана ШКОП, в которую включены критерии наличия/отсутствия судорог в дебюте. Летальность среди пациентов, набравших 5–6 баллов по ШКОП, составляла 77 %, среди пациентов, набравших 7–8 баллов, — 100 %. Выводы. Судорожный припадок в дебюте САК ассоциируется с вероятным повышением риска смерти (p = 0,001). ШКОП с субарахноидальным кровоизлиянием позволяет прогнозировать течение заболевания, что способствует своевременным коррекции лечения, назначению быстродействующих парентеральных противосудорожных препаратов и, соответственно, определяет лучший исход у пациентов.
Background. Subarachnoid haemorhage (SAH) is a type of stroke and comprises 6–8 % of all strokes. Up to half of all cases of SAH are fatal, and 10–15 % of patients die before reaching a hospital, and those who survive could have neurological or cognitive impairment. Seizures occur in 13–24 % of patients with SAH, usually in the first 24 hours after the bleeding. Seizures can lead to increased cerebral blood flow, hypertension, and elevated intracranial pressure, thereby increasing the risk of re-bleeding and neurologic deterioration. The Hunt and Hess scale, Glasgow Coma Scale (GCS) and the World Federation of Neurosurgical Societies (WFNS) grading system have been shown to correlate well with disease outcome. But they do not consider onset seizure in SAH as a predictor of poor outcome. The purpose was to evaluate the prevalence of onset seizure in SAH and to investigate its effect on disease outcome, to develop a prognostic scale for examining patients with SAH that includes seizures as a bad prognostic predictor. Materials and methods. We have analyzed a series of 127 patients with SAH who were treated in our clinic from 2013 to 2016. All patients were examined using Hunt and Hess scale, WFNS grading system, and GCS. The prevalence of acute onset seizure has been found. All patients were screened using the developed Combined Patient Rating Scale. Disease outcomes after subarachnoid hemorrhage and treatment were assessed by Glasgow Outcome Scale. Results. Thirteen patients among 127 had seizures during disease onset. In each 10 patients, epileptic seizure was the first clinical symptom of SAH. The prevalence of seizures was 10.2 %, in addition, 5 of 13 cases with seizures were lethal, this was near 35.7 % of all fatal cases recorded in our group of patients. That’s why we have suggested that seizure in the onset of SAH is an isolated predictor of poor outcome. The Combined Patient Rating Scale has been developed and includes the criteria of seizure presence and/or absence in SAH onset. The mortality among patients who scored 5–6 points by this new scale was 77 %, 7–8 points — 100 %, respectively. Conclusions. Seizure in the onset of SAH is associated with an increased risk of death (p = 0.001). The Combined Patient Rating Scale in subarachnoid hemorrhage allows making an early outcome prognosis, correcting the treatment, prescribing intravenous antiepileptic drug and determines the best outcomes in patients.
Вступ
Субарахноїдальний крововилив (САК) — це прорив крові в субарахноїдальний простір, що найчастіше виникає внаслідок розриву артеріальної аневризми.
Близько 20 % всіх інсультів є геморагічними, з яких 6–8 % — це частка, що становить САК внаслідок розриву артеріальних аневризм [1].
Смертність від САК у 30-денний строк після розриву аневризми становить 30–40 % [1]. 10–15 % субарахноїдальних крововиливів є фатальними, тобто пацієнти помирають ще до надходження в медичний стаціонар. А серед тих пацієнтів, які вижили, 30 % у подальшому матимуть помірний чи виражений ступінь інвалідності та низьку якість життя, когнітивні й емоційні проблеми, погіршення працездатності, зміну особистості [2]. Близько 80 % випадків САК є наслідком розриву мішкоподібних аневризм артеріального кола головного мозку, що є специфічними для внутрішньочерепних артерій, у 40 % випадків — аневризм передньої сполучної артерії та передньої мозкової артерії, 30 % — внутрішньої сонної артерії [3].
Згідно з епідеміологічними розрахунками в Україні щороку відбувається до 5 тисяч САК аневризматичного генезу. Тобто якщо враховувати загальну кількість населення України у 2016 р. — 45 млн чол., то захворюваність на САК має становити близько 11,1 особи на 100 000 населення.
Перші клінічні симптоми субарахноїдального крововиливу включають громоподібний біль голови, нудоту, блювання та інші менінгеальні симптоми, такі як ригідність м’язів потилиці, фото- та фонофобія, сильний біль у шиї, спині й в обох нижніх кінцівках, що виникають у 80 % випадків. Також можуть виникнути фокальний неврологічний дефіцит, сплутаність свідомості та інколи судоми [4].
Доведено, що вплив ряду факторів, таких як низький рівень за шкалою Hunt — Hess, the World Federation of Neurological Surgeons Scale (WFNS), Glasgow Outcome Scale (GОS) в дебюті захворювання, наявність внутрішньомозкової гематоми, оклюзійної гідроцефалії, симптомного вазоспазму, асоціюється з незадовільним прогнозом при субарахноїдальному крововиливі. Тоді як вплив судом, що виникли в дебюті САК, є найбільш дискутабельним і найменш вивченим питанням. Серед дослідницьких груп, що займаються даним захворюванням, одні заперечують факт впливу судом на загальний прогноз пацієнтів із САК [5–7], а інші розглядають судоми як ізольований предиктор поганого наслідку [8, 9].
Гострий симптоматичний судомний напад розвивається в 13–24 % пацієнтів у дебюті САК, найчастіше — в перші 24 год. Найбільш поширені при розриві аневризми середньої мозкової артерії. Тип судом — від генералізованих, парціальних до складних парціальних нападів. Судоми можуть призводити до підвищення церебрального кровотоку, гіпертензії, підвищення внутрішньочерепного тиску і, як наслідок, повторного розриву аневризми. Однак досі ще не проводили рандомізованих досліджень, на підставі яких можна було б скласти рекомендації щодо профілактики та лікування епілептичних нападів у гострому періоді САК.
І якщо тактика ведення симптоматичної епілепсії, що розвинулася після САК, описана в клінічних настановах, то принципи лікування гострого симптоматичного нападу в дебюті субарахноїдального крововиливу як фактора ризику повторного розриву аневризми та поганого наслідку у пацієнтів не описані в базових рекомендаціях.
Судоми не входять до класичної шкали з оцінки прогнозу перебігу САК. Найбільш використовуваними в клінічній практиці є шкала коми Глазго, Hunt — Hess та WFNS [10–12]. Дані шкали є достатньо простими в користуванні і дозволяють швидко оцінити стан пацієнта та певним чином передбачити перебіг захворювання. Однак не враховують судоми як вагомий чинник у перебігу та прогнозуванні субарахноїдального крововиливу.
Мета
Враховуючи суперечливі дані світової та вітчизняної літератури та незначну кількість досліджень, що б стосувалися впливу судом на перебіг та прогнозування наслідку у пацієнта після САК, ми поставили перед собою такі цілі:
1) провести аналіз поширеності гострого симптоматичного епінападу в дебюті САК і дослідити його вплив на перебіг цього захворювання;
2) розробити клінічну шкалу оцінки САК для прогнозування перебігу захворювання з урахуванням судомних нападів у дебюті;
3) розробити практичні рекомендації щодо тактики ведення судом у гострий період субарахноїдального крововиливу.
Матеріали та методи
Проведено аналіз клінічних, анамнестичних та радіологічних даних 127 пацієнтів із субарахноїдальним крововиливом, які перебували на лікуванні в Обласному клінічному центрі нейрохірургії та неврології м. Ужгород за період із 2013 по 2016 р.
Діагноз САК встановлювався на основі клінічних даних, даних ургентної комп’ютерної томографії/КТ-ангіографії (апарат Siemens Somatom emotion 16 slise). Співвідношення жінок та чоловіків — 1 : 1 (67 жінок і 60 чоловіків відповідно).
Середній вік пацієнтів становив 50,3 року: 52,1 — у жінок; 48,2 — у чоловіків (наймолодший — 12 років, найстарший — 78). Деталі розподілу пацієнтів за віком наведено на рис. 1, на якому видно, що найбільша захворюваність на САК припадає на 5–6-ту декаду життя.
Усіх пацієнтів оцінено за шкалами Hunt — Hess, WFNS, GОS у дебюті захворювання та протягом динамічного спостереження (табл. 1).
Наслідок у пацієнтів оцінювали за Glasgow Outcome Scale (шкала наслідку Глазго), що дозволяє оцінити якість життя пацієнта після перенесеного субарахноїдального крововиливу з урахуванням соціальної активності та залишкових психоневрологічних порушень:
— GOS1 — смерть;
— GOS2 — вегетативний стан;
— GOS3 — тяжка інвалідність;
— GOS4 — інвалідність, при якій пацієнт може бути незалежний від оточуючих;
— GOS5 — добре відновлення пацієнта, відсутність інвалідності та незалежність.
Ми розподілили пацієнтів у 3 групи згідно з даними Glasgow Outcome Scale (рис. 2).
Група 1 — GOS1: смерть — 14 осіб.
Група 2 — GOS2–3: тяжка інвалідність – 24 особи.
Група 3 — GOS4–5: добре відновлення — 89 осіб.
Проведено статистичний аналіз для порівняння основних клініко-інструментальних показників між групами.
Результати та обговорення
Статистично вірогідної різниці за статтю та віком між групами не виявлено, тобто співвідношення жінок та чоловіків у групі померлих (група 1), групі з тяжкою інвалідністю (група 2) та групі з добрим відновленням (група 3) після САК становило 1 : 1 (рис. 3), а пік захворювання в кожній групі припадав на 5–6-ту декаду життя (рис. 4).
При аналізі всієї серії спостережень виявлено, що в 13 пацієнтів із 127 спостерігалися вторинно-генералізовані тоніко-клонічні судоми в гострий період захворювання. У кожного 10-го пацієнта епілептичний напад був першим клінічним симптомом хвороби. Поширеність епілептичних нападів у загальній групі становила 10,2 %, тоді як у групі померлих пацієнтів (група 1 — GOS1) цей показник становив 35,7 %, що суттєво відрізнялося від груп 2 та 3 (пацієнти, які вижили) — 7,1 % (GOS2–3 та GOS4–5 відповідно) (p = 0,001) (рис. 5). Слід зазначити, що більшість летальних випадків були пов’язані з повторним судомним нападом і, як наслідок, повторним розривом аневризми.
Загальна летальність у пацієнтів із САК становила 11 % (14 осіб із 127). У групі пацієнтів, які не мали судом у дебюті САК (114 осіб), виявлено майже 8 % летальних випадків, тоді як у групі пацієнтів із судомами частка померлих становила 38,5 % (5 із 13 спостережень) (рис. 6, 7).
Отже, у загальній групі пацієнтів судоми в гострий період зустрічалися в 1 з 9 випадків, тоді як у групі пацієнтів із летальним кінцем хвороби — в 1 з 3. Таким чином, епілептичний напад у гострий період САК був одним із несприятливих факторів щодо перебігу захворювання. У зв’язку з цим ми вважаємо, що наявність судом у дебюті САК є вірогідно несприятливим фактором прогнозування наслідку після субарахноїдального крововиливу.
Нами запропоновано та створено шкалу комбінованої оцінки пацієнта з субарахноїдальним крововиливом (ШКОП, табл. 2), яка б, окрім відомих факторів, враховувала також наявність або відсутність судом у гострому періоді.
Нами запропоновано оцінювати пацієнтів за 8-бальною шкалою:
— Hunt — Hess I–II — 0 балів, ІІІ — 1 бал, IV–V — 2 бали;
— WFNS I–II — 0 балів, ІІІ — 1 бал, IV–V — 2 бали;
— GCS 13–15 — 0 балів, 10–12 — 1 бал, 9 і менше балів — 2 бали;
— епілептичних нападів немає — 0 балів, епінапад у гострий період САК — 2 бали.
У кінцевому результаті пацієнт оцінюється від 0 до 8 балів, де 0 асоціюється з позитивним прогнозом, а 8 із вкрай негативним (смерть). Ефективність шкали оцінювалася шляхом порівняння даних, отриманих за допомогою ШКОП із шкалою наслідку Глазго, що на сьогодні є основним методом оцінки клінічних наслідків САК. Стандартна похибка становить 0,1.
Усіх пацієнтів оцінено за запропонованою шкалою. Проведено порівняння між клінічними наслідками у пацієнтів за GOS та балом за ШКОП. Вивчено поширеність летальності серед пацієнтів залежно від оцінки за ШКОП (табл. 3).
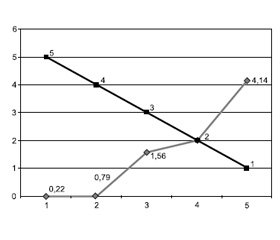
Як видно з табл. 3, вищий бал у пацієнта за ШКОП чітко корелює з вищою летальністю та, відповідно, нижчим показником GOS. Так, серед пацієнтів з оцінкою 5–6 балів за ШКОП летальність становила 70 %, серед пацієнтів з оцінкою 7–8 балів — 100 %.
Проведено визначення середнього показника за ШКОП залежно від клінічного наслідку у пацієнтів за GOS, що продемонстровано на рис. 8. Як видно, у пацієнтів із гіршим клінічним наслідком відмічається більший показник за ШКОП. Тобто чим вищий показник за ШКОП має пацієнт на момент госпіталізації, тим більша ймовірність негативного клінічного наслідку (смерть, тяжка інвалідність) (рис. 8).
Отримані дані дозволяють розглядати ШКОП як можливий інструмент для оцінки прогнозу перебігу САК.
Обговорення
Судомний напад у дебюті САК є досить частим явищем. За даними нашого дослідження, поширеність його становить 10,2 %.
С. Fung et al. з університетської клініки в м. Берн, Швейцарія [9], вважають, що судомний напад у дебюті може впливати на ступінь вираженості неврологічного дефіциту за шкалою WFNS, але вони не розглядають його як окремий фактор поганого наслідку пацієнтів після САК.
Ряд досліджень також вказує на те, що судомний напад може бути причиною розвитку внутрішньолікарняної пневмонії, віддаленої ішемії головного мозку [13], іноді, за даними тривалого ЕЕГ-моніторингу, можуть розвиватись безсудомні епінапади [14], проте це не впливає на загальний прогноз для пацієнта.
Ми вважаємо, що судомний напад є ізольованим предиктором поганого наслідку у пацієнтів із САК. За нашими даними, рівень смертності в пацієнтів із судомами в дебюті захворювання майже в 4,8 раза перевищує такий у групі без судом (38 і 8 % відповідно).
Деякі дослідження останніх років також виявляють тісний зв’язок судомного нападу в дебюті та поганого прогнозу для пацієнта [8, 15–17]. Крім вже відомих факторів (гідроцефалія, вазоспазм, внутрішньомозкова гематома, високий рівень глікемії, вік), вони пропонують враховувати наявність судом як прогностично несприятливого чинника. Н. Butzkueven [8] у дослідженні, що включало 412 пацієнтів, вказує на те, що судомний напад у дебюті був предиктором ризику повторного розриву аневризми і, як наслідок, високої смертності. Проте він не впливав на розвиток інших ускладнень, таких як гідроцефалія чи вазоспазм.
Спираючись на вищесказане, вважаємо доцільним включити судомний напад у дебюті САК у рутинні методи прогнозування виходу, додатково до стандартних шкал. Вважаємо, що використання розробленої та запропонованої нами шкали комбінованої оцінки пацієнта може сприяти вчасній корекції тактики лікування та запобігти повторному розриву аневризми до проведення хірургічного лікування.
Також через це постає питання доцільності рутинного призначення антиконвульсантів пацієнтам із САК та судомами в дебюті. Підхід до протисудомної терапії в таких випадках суттєво відрізняється залежно від медичного закладу, оскільки немає чітких рекомендацій, що б спирались на рандомізовані дослідження. Використання антиконвульсантів може бути обгрунтованим у гострому періоді крововиливу (клас: IIb; рівень доказовості: B) [18]. Призначення антиконвульсантів може бути розглянутим у пацієнтів із високими факторами ризику (внутрішньомозкова гематома, некерована артеріальна гіпертензія, ішемія на фоні вазоспазму, судоми в анамнезі до САК, аневризма СМА) (клас: IIb; рівень доказовості: B) [18].
У зв’язку з високою ймовірністю повторного розриву аневризми при наступному судомному нападі вважаємо доцільним невідкладне призначення таким пацієнтам протисудомної терапії. В Україні практикується короткочасне призначення антиконвульсантів (найчастіше — карбамазепіну) хворим з епілептичними нападами при САК, проте, як правило, відсутній лабораторний контроль за рівнем його в плазмі крові.
Первинне використання таблетованих форм антиконвульсантів є низькоефективним у зв’язку з тим, що стабільна плазмоконцентрація препарату буде досягнута тільки через декілька днів, а ризик повторного розриву аневризми є найвищим у перші 48–72 год. Також слід враховувати, що ряд традиційних антиконвульсантів (зокрема, карбамазепін та фенобарбітал) має значні міжмедикаментозні взаємодії, що не робить їх препаратами вибору для використання при САК. Нами запропоновано лікування гострого симптоматичного епінападу у вигляді в/в інфузії вальпроєвої кислоти в дозі 1000–2000 мг на добу з подальшим переходом на таблетовані форми. Лікування, на нашу думку, слід продовжувати до моменту ліквідації аневризми мікрохірургічним або ендоскопічним шляхом. Альтернативою може бути в/в введення леветирацетаму [16, 19]. Але у зв’язку з відсутністю парентеральних форм леветирацетаму на українському фармацевтичному ринку цей спосіб не є практичним.
Висновки
1. Епінапад у дебюті САК асоціюється з підвищенням ризику смерті (p = 0,001).
2. Шкала комбінованої оцінки пацієнта дозволяє прогнозувати перебіг захворювання, що може сприяти вчасній корекції тактики лікування та запобігти повторному розриву аневризми до проведення хірургічного лікування (кліпування чи коїлінг) і, відповідно, впливати на наслідок у пацієнта із САК.
3. Використання в/в інфузії вальпроатів сприяє запобіганню повторного епінападу в гострий період САК та, відповідно, зменшенню ризику смертності пацієнтів із таким захворюванням.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Suarez J.I. Aneurysmal subarachnoid hemorrhage / J.I. Suarez, R.W. Tarr, W.R. Selman // New England Journal of Medicine. — Jan 2006. — P. 387-96.
2. Chou H.S. Outcomes after early anticonvulsant discontinuation in aneurismal subarahnoid hemorrhage / H.S. Chou, J.G. Latorre,
G. Alpargu // J. Vasc. Med. Surgery. — 2015. — Vol. 3. — P. 1-6.
3. van Gijn J. Subarachnoid hemorrhage: diagnosis, causes and management / J. van Gijn, G.J. Rinkel // Brain. — 2001. — P. 249-278.
4. Kyu-Sun Choi. Seizures and Epilepsy following Aneurysmal Subarachnoid Hemorrhage: Incidence and Risk Factors / Choi Kyu-Sun, Chun Hyoung-Joon, Yi Hyeong-Joong // J. Korean Neurosurg Soc. — 2009. — P. 93-98.
5. Baker C.J. Short-term perioperative anticonvulsant prophylaxis for the surgical treatment of low-risk patients with intracranial aneurysms / C.J. Baker, C.J. Prestigiacomo, R.A. Solomon // Neurosurgery. — 1995. — P. 863-70.
6. Byrne J.V. Seizures after aneurysmal subarachnoid hemorrhage treated with coil embolization / J.V. Byrne // Neurosurgery. — 2002. — P. 545-51.
7. Daniere F. Complications and follow up of subarachnoid he–morrhages / F. Daniere, G. Gascou, N. Menjot de Champfleur, P. Machi, N. Leboucq, C. Riquelme, C. Ruiz, A. Bonafe, V. Costalat // Diagnostic and Interventional Imaging. — 2015. — 96. — P. 677-686.
8. Butzkueven H. Onset seizures independently predict poor outcome after subarachnoid hemorrhage / H. Butzkueven, A. Evans, E. Pitman, C. Leopold // Neurology. — 2000. — 55. — P. 1315-1320.
9. Fung C. Impact of early-onset seizures on grading and outcome in patients with subarachnoid hemorrhage / C. Fung, M. Balmer, M. Murek, W.J. Z’Graggen // J. Neurosurg. — 2015. — P. 408-413.
10. Drake C.G. Report of World Federation of Neurological Surgeons committee on a universal subarachnoid hemorrhage grading scale / C.G. Drake, W.E. Hunt, K. Sano et al. // J. Neurosurgery. — 1988. — P. 985-986.
11. Gotoh O. Glasgow Coma Scale in the prediction of outcome after early aneurysm surgery / O. Gotoh, A. Tamura, N. Yasui, A. Suzuki, H. Hadeishi, K. Sano // Neurosurgery. — 1996. — P. 19-24.
12. Rosen D. Subarachnoid hemorrhage grading scales: A systematic review / D. Rosen, R. Macdonald // Neurocritical Care. — 2005. — Vol. 2. — P. 110-18.
13. De Marchis G.M. Tonic-Clonic Activity at Subarachnoid Hemorrhage Onset: Impact on Complications and Outcome / G.M. De Marchis, D. Pugin, H. Lantigua, C. Zammit, D. Pugin, H. Lantigua // PLoS ONE. — 2013. — Vol 8(8). — P. 1-8.
14. O’Connor, Kathryn L. High Risk for Seizures Following Subarachnoid Hemorrhage Regardless of Referral Bias / Kathryn L. O’Connor // Neurocrit Care. — Dec 2014. — P. 476-482.
15. Starke R.M. Rebleeding aneurysmal subarachnoid hemorrhage / R.M. Starke, E.S. Connolly // Neurocrit. Care. — 2011. — P. 241-6.
16. Mohamad Z. Authors Clinical Guide on «Seizures in Cerebrovascular Disorders» / Z. Mohamad. — June 2015.
17. Guidelines for the Management of Aneurysmal Subarachnoid Hemorrhage A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association // Stroke. — 2012. — 43. — P. 1711-1737.
18. Wang H. Levetiracetam is neuroprotective in murine mo-dels of closed head injury and subarachnoid hemorrhage / H. Wang, J. Gao, T.F. Lassiter et al. // Neurocrit. Care. — 2006. — Vol. 5. — P. 71-78.
19. Feigin V.L. Risk factors for subarachnoid hemorrhage: an updated systematic review of epidemiological studies / V.L. Feigin, G.J. Rinkel, C.M. Lawes et al. // Stroke. — 2005. — Vol. 36(12). — P. 2773-2780.
20. Hackett M.L. Health outcomes 1 year after subarachnoid hemorrhage: an international population-based study / M.L. Hackett, C.S. Anderson // Neurology. — 2000. — P. 658-662.
21. Kellner C.P. Evaluation of a Revised Scale for the Prediction of Long-Term Outcome in Poor-Grade Aneurysmal Subarachnoid Hemorrhage Undergoing Operative Repair / C.P. Kellner // Neurosurgery. — Sep 2006. — P. 529-38.
22. Kowalski R.G. Initial misdiagnosis and outcome after subarachnoid hemorrhage / R.G. Kowalski, J. Claassen, K.T. Kreiter et al. // Journal of the American Medical Association. — Feb 2004. — P. 866-69.
23. Ravnik J. Long-term cognitive deficits in patients with good outcomes after aneurysmal subarachnoid hemorrhage from anterior communicating artery / J. Ravnik, B. Starovasnik, Z. Pirtošek, G. Bunc, R. Bošnjak // Croat. Med. J. — 2006. — P. 253-263.
24. Rodriguez D.R. Predictor’s of Mortality in Patients with Aneurysmal Subarachnoid Haemorrhage and Reebleding / D.R. Rodriguez, C.S. Matamoros, L.F. Cue, J.L. Miranda Hernandez, Y.P. Sanchez, J.P. Nellar, Hindawi // Corporation Neurology Research International. — 2015. — P. 1-6.
25. Rooij N.K. Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends / N.K. de Rooij, F.H. Linn, J.A. van der Plas, A. Algra, G.J.E. Rinkel // J. Neurol. Neurosurg. Psychiatry. — Dec 2007. — P. 1365-1372.
26. Shiue I. Life events and risk of subarachnoid hemorrhage: the Australasian Cooperative Research on Subarachnoid Hemorrhage Study (ACROSS) / I. Shiue, H. Arima, C.S. Anderson // Stroke. — 2010. — P. 1304-1306.
27. van Gijn J. Subarachnoid haemorrhage / J. van Gijn, R.S. Kerr, G.J. Rinkel // Lancet. — 2007. — P. 306-18.
28. Vilkki J.S. Relationship of local infarctions to cognitive and psychosocial impairments after aneurysmal subarachnoid hemorrhage / J.S. Vilkki, S. Juvela, J. Siironen, T. Ilvo-nen, J. Varis, M. Porras // Neurosurgery. — 2004. — P. 790-803.
29. Visser-Meily J.M.A. Long-term health-related quality of life after aneurismal subarachnoid hemorrhage: relationship with psychological symptoms and personality characteristics / J.M.A. Visser-Meily, M.L. Rhebergen, G.J.E. Rinkel, M.J. van Zandvoort // Stroke. — 2009. — P. 1526-1529.

/49-1.jpg)
/49-2.jpg)
/49-3.jpg)
/50-1.jpg)
/50-2.jpg)
/50-3.jpg)
/50-4.jpg)
/51-1.jpg)
/51-2.jpg)