Резюме
Цель: определить частоту и характер метастатического поражения головного мозга при раке легкого (РЛ), связи с другими клиническими признаками заболевания (локализация, форма, гистологический вариант, степень дифференциации и стадийность опухолевого процесса, метастазирование в другие участки тела), выделить прогностические критерии возможных метастазов в головной мозг (МГМ), изучить побочные действия противоопухолевой терапии и оценить влияние МГМ на выживаемость больных. Материалы и методы. Под наблюдением находился 1071 больной раком легкого в возрасте от 24 до 86 лет. Никто из обследованных лиц по поводу основного заболевания ранее не был прооперирован, а после установления диагноза все пациенты получали лучевую терапию, 3/4 из них — комбинированную радиохимиотерапию. Результаты. МГМ возникают у 8 % от числа больных РЛ (в 2,2 раза чаще у женщин), на что влияют периферическая форма, гистологический вариант (плоско- и крупноклеточная карциномы) и интегральная тяжесть опухолевого процесса, наличие экссудативного канкрозного плеврита, прорастания опухоли в средостение и сопутствующий сахарный диабет типа 2. Степень тяжести МГМ при РЛ прямо коррелирует с метастазированием в надключичные, паховые и забрюшинные лимфатические узлы, перикард, надпочечники, брюшную стенку, печень и поджелудочную железу. Прогностическими критериями МГМ у больных РЛ могут быть повышенные параметры в крови трансформирующего фактора роста ß1, сосудистого эндотелиального фактора роста и остеопонтина. В 6 % случаев осложнений радиохимиотерапии наблюдаются разные по степени тяжести острые нарушения мозгового кровообращения, тесно связанные с артериальной гипертензией и сахарным диабетом, формой РЛ, количеством метастазов в лимфатических узлах (но не в головном мозге) и с использованием в комплексном лечении противоопухолевых алкилирующих средств. Выводы. Так называемая мозговая форма РЛ отличается большей степенью тяжести течения заболевания, требует коррекции медикаментозной химиотерапии, определяет выживаемость больных, которая у пациентов с МГМ меньше.
Мета: визначити частоту та характер метастатичного ураження головного мозку при раку легені (РЛ), зв’язки з іншими клінічними ознаками захворювання (локалізація, форма, гістологічний варіант, ступінь диференціації й стадійність пухлинного процесу, метастазування в інші ділянки тіла), виділити прогностичні критерії можливих метастазів в головний мозок (МГМ), вивчити побічні дії протипухлинної терапії та оцінити вплив МГМ на виживаність хворих. Матеріали та методи. Під наглядом знаходився 1071 хворий на рак легені віком від 24 до 86 років. Жодна з обстежених осіб з приводу основного захворювання раніше не була прооперована, а після встановлення діагнозу усі пацієнти отримували променеву терапію, 3/4 з них — комбіновану радіохіміотерапію. Результати. МГМ виникають у 8 % від числа хворих на РЛ (у 2,2 раза частіше у жінок), на що впливають периферійна форма, гістологічний варіант (плоско- й крупноклітинна карциноми) та інтегральна тяжкість пухлинного процесу, наявність ексудативного канкрозного плевриту, проростання пухлини в середостіння і супутній цукровий діабет типу 2. Ступінь тяжкості МГМ при РЛ прямо корелює з метастазуванням в надключичні, пахові й зачеревні лімфатичні вузли, перикард, надниркові залози, черевну стінку, печінку та підшлункову залозу. Прогностичними критеріями МГМ у хворих на РЛ можуть бути підвищені параметри в крові трансформуючого фактора зростання β1, судинного ендотеліального фактора зростання і остеопонтину. У 6 % випадків ускладнень радіохіміотерапії спостерігається різна за ступенем тяжкість гострого порушення мозкового кровообігу, щільно пов’язаного з артеріальною гіпертензією й цукровим діабетом, формою РЛ, кількістю метастазів в лімфатичних вузлах (але не в головному мозку) та з використанням в комплексному лікуванні протипухлинних алкілуючих засобів. Висновки. Так звана мозкова форма РЛ відрізняється більшим ступенем тяжкості перебігу захворювання, вимагає корекції медикаментозної хіміотерапії, визначає виживаність хворих, яка у пацієнтів з МГМ менше.
Background. The purpose of our work was to determine the incidence and nature of metastatic brain lesions in lung cancer (LC), correlation with other clinical signs of the disease (localization, shape, histology, degree of differentiation and staging of tumor, metastasis to other parts of the body), to identify the prognostic criteria of possible brain metastases (BM), to study the side effects of anticancer therapy and to evaluate the impact of BM on survival of the patients. Materials and methods. The study included 1,071 patients with lung cancer aged 24 to 86 years. None of the exa-mined patients had been operated previously for underlying disease, all patients received radiation therapy after establishment of the diagnosis, 3/4 of them underwent combined radiochemotherapy. Results. BM occur in 8 % of patients with LC (2.2 times more often in women) that is influenced by the peripheral form, histological variant (squamous and large cell carcinoma) and integrated severity of the tumor process, the presence of exudative malignant pleurisy, tumor invasion into the mediastinum and concomitant diabetes mellitus type 2. The severity of BM in lung cancer directly correlates with metastasis in the supraclavicular, inguinal and retroperitoneal lymph nodes, pericardium, adrenal glands, abdominal wall, liver and pancreas. The predictor of BM in patients with lung cancer may be elevated blood level of transforming growth factor β1, vascular endothelial growth factor and osteopontin. In 6 % of radiochemotherapy complications, there were detected acute cerebrovascular accidents of varying severity, which is closely associated with hypertension and diabetes, the form of LC, the number of metastases in the lymph nodes (but not in the brain) and with antitumor alky-lating agents used in comprehensive treatment. Conclusions. The so-called “brain form” of LC is characterized by greater severity, requires correction of drug chemotherapy, determines the survival of the patients that is lower in patients with BM.
Введение
В структуре онкологической заболеваемости первое место занимает рак легкого (РЛ) [5, 9, 13], от которого ежегодная смертность в некоторых регионах увеличивается в среднем на 10 % [17]. Метастазы в головной мозг (МГМ) относятся к наиболее частой локализации метастатического процесса при РЛ и встречаются у 13–60 % от числа больных [2, 4, 6, 8], определяя их выживаемость [10, 18]. В свою очередь, РЛ занимает лидирующие позиции среди причин метастазирования всех злокачественных опухолей в головной мозг [1, 3, 7], в связи с чем даже выделяют так называемую мозговую форму РЛ [4]. При этом рассматривают дуральные, лептоменингеальные, внутрисосудистые и милиарные локализации МГМ [19]. В контексте сказанного в настоящее время у больных РЛ иногда выполняют облучение головы с целью профилактики возможного метастазирования опухоли в мозг [20].
Цель и задачи: определить частоту и характер метастатического поражения головного мозга при РЛ, связи с другими клиническими признаками заболевания (локализация, форма, гистологический вариант, степень дифференциации, стадийность, метастазирование в другие участки тела), выделить прогностические критерии возможных МГМ, изучить побочные действия противоопухолевой терапии и оценить влияние МГМ на выживаемость больных.
Материалы и методы
Под наблюдением находился 1071 больной РЛ в возрасте от 24 до 86 лет (в среднем 59,20 ± 0,31 года), среди которых было 887 (82,8 %) мужчин и 184 (17,2 %) женщины. Никто из больных по поводу РЛ ранее не был прооперирован. Правосторонняя локализация РЛ констатирована в 59,9 % наблюдений, левосторонняя — в 38,9 %, двусторонняя — в 1,1 %. Поражение верхних долей легких установлено в 27 % случаев, нижних — в 15,3 %, верхненижней локализации слева — в 18,7 %, средневерхней — в 25 %, средненижней — в 1,4 %, средней доли — в 3,7 %. Медиастинальный вариант болезни имел место у 8,9 % от числа больных, а у 1,2 % мужчин диагностирована верхушечная опухоль Панкоста — Тобиаса. У 78,7 % обследованных отмечена центральная форма РЛ, у 21,3 % — периферическая. Мелкоклеточный гистологический вариант заболевания обнаружен в 17,6 % случаев, а немелкоклеточный — в 82,5 % (аденокарцинома констатирована в 38,8 % от общего числа обследованных пациентов и в 47,1 % от числа с немелкоклеточной формой, плоскоклеточная карцинома — соответственно в 33,4 и 40,5 %, крупноклеточная карцинома — в 10,2 и 12,3 %). IA стадия заболевания установлена у 0,3 % пациентов, IB — у 0,6 %, IIA — у 1,1 %, IIB — у 3,3 %, IIIA — у 35,1 %, IIIB — у 23,7 %, IV — у 36 %. Средний показатель дифференциации РЛ составил 1,190 ± 0,038 балла, интегральной стадийности — 5,870 ± 0,032 о.е., тяжести опухолевого процесса — 2,850 ± 0,024 ln о.е. Среднее число метастазов РЛ в лимфатические узлы составило 1,57 ± 0,03, в отдаленные органы — 1,360 ± 0,037, в скелет — 2,10 ± 0,08.
Для диагностики РЛ и его метастазов применяли методы обычной рентгенографии, компьютерной томографии, магнитно-резонансной томографии и сонографии (аппараты Multix-Compact-Siеmens, Германия; Somazom-Emotion-6-Siemens, Германия; Gygoscan-Intera-Philips, Нидерланды; Envisor-Philips, Нидерланды), эзофагогастроскопии (фиброскоп Olympus-GIF-Q20, Япония). Иммуноферментным и биохимическим анализом (ридер PR2100-Sanofi diagnostic pasteur, Франция; анализатор Olympus-AU640, Япония) изучали в сыворотке крови уровни трансформирующего фактора роста (TGF) β1, сосудистого эндотелиального фактора роста (VEGF), остеопонтина (OP), фибронектина (FN), С-реактивного протеина (CRP) и α2-макроглобулина (α2MG), которые относятся к опухолевым маркерам.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного непараметрического корреляционного регрессионного одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica StatSoft, США). Оценивали средние значения (M), их стандартные ошибки (m), стандартные отклонения (SD), коэффициенты корреляции (r), критерии множественной регрессии (R), дисперсии (D), Стьюдента (t), Макнемара — Фишера (χ2) и достоверность статистических показателей (p).
Результаты и обсуждение
Нами МГМ диагностированы у 80 (7,5 %) больных РЛ (в 2,2 раза чаще наблюдались у женщин; χ2 = 12,03, р = 0,001), которые включены в основную группу обследованных. По данным выполненного ANOVA, на метастазирование в мозг влияют форма РЛ (D = 6,51; p = 0,011), гистологический вариант опухоли (в частности, плоскоклеточная и крупноклеточная карциномы, соответственно D = 8,42, p = 0,004 и D = 11,70, p = 0,001), а также параметры интегральной тяжести опухолевого процесса (D = 50,33; p < 0,001), которую оценивали по формуле: {ln [T + N2 + (ΣM)2]}, где ln — десятичный логарифм, Т — международный показатель характера первичной опухоли, N — международный показатель метастатического поражения региональных лимфатических узлов, ΣМ — сумма метастазов в отдаленных органах. Если в основной группе соотношение центральной и периферической формы РЛ составило 2 : 1, то среди остальных пациентов (контрольная группа) — 4 : 1 (χ2 = 9,70; р = 0,002). Как свидетельствует регрессионный анализ, развитие МГМ прямо высокодостоверно зависело (p < 0,001) от наличия у больных экссудативного канкрозного плеврита (R = +4,90) и прорастания опухоли в средостение (R = +3,66).
У 31 (38,8 %) пациента с МГМ констатированы солитарные метастазы, когда в других органах и участках скелета их не было, у 21 (26,3 %) отмечены единичные метастазы (один МГМ и несколько метастазов в других регионах тела). Множественные МГМ имели место в остальных 28 (35 %) случаях. Мы не наблюдали метастазирования в мозжечок и ствол головного мозга. У 63 (78,8 %) больных МГМ обнаружили одновременно с диагностированием РЛ.
На МГМ оказывают дисперсионное воздействие число метастазов в лимфатических узлах (D = 3,90; p = 0,048) и отдаленных органах (D = 33,18; p < 0,001), но не в костно-суставном аппарате. Существуют прямые корреляционные связи тяжести МГМ с метастатическим поражением надключичных, паховых и забрюшинных лимфатических узлов (соответственно r = +0,063, p = 0,039; r = +0,077, p = 0,012; r = +0,062, p = 0,042), перикарда (r = +0,061; p = 0,046), надпочечников (r = +0,065; p = 0,033), брюшной стенки (r = +0,182; p < 0,001) и поджелудочной железы (r = +0,111; p < 0,001). Из сопутствующей патологии на метастазирование в мозг при РЛ влияет наличие сахарного диабета типа 2 (D = 3,53; p = 0,047), который имел место у 14,1 % от общего числа больных. Необходимо подчеркнуть, что сами МГМ влияли на другие интегральные признаки РЛ, о чем свидетельствовал выполненный многофакторный дисперсионный анализ Уилкоксона — Рао (WR = 5,21; p < 0,001).
По данным литературы, прогностическую значимость процессов метастазирования РЛ имеют уровни в крови TGF-β1 [9], VEGF и ОР [12], FN [13, 19], CRP [10, 20] и α2MG [14]. По результатам наших исследований, у больных основной группы с МГМ (табл. 1) достоверно возрастают (p < 0,001) на 30 % параметры в крови TGF-β1 (t = 3,97), на 22 % — VEGF (t = 6,30) и на 25 % — ОР (t = 7,50) при неизмененных по сравнению с конт–рольной группой показателях FN, CRP и α2MG. Можно считать, что прогнозопозитивными факторами в отношении МГМ при РЛ могут быть концентрации в крови TGF-β1 > 600 нг/мл, VEGF > 550 пг/мл и ОР > 50 нг/мл (> M + SD больных с МГМ).
/98-1.jpg)
А теперь остановимся еще на одном важном вопросе. У 15 (1,4 %) больных РЛ в процессе радиохимиотерапии возникли разные степени тяжести острого нарушения мозгового кровообращения (ОНМК), что составило 6 % от общего количества осложнений вследствие проведенных лечебных мероприятий. На развитие ОНМК оказывали влияние наличие артериальной гипертензии (D = 4,78; p = 0,029), сахарного диабета (D = 14,17; p < 0,001), форма РЛ (D = 7,27; p = 0,007) и количество метастазов в лимфатиче-ских узлах (D = 6,22; p = 0,013), но не наличие МГМ (D = 3,46; p = 0,063), параметры Ω (D = 0,97; p = 0,325) и Ψ (D = 0,15; p = 0,696).
Лучевая терапия выполнена у всех без исключения больных, а химиотерапия — у 76,3 % из числа представителей основной группы и 72,6 % контрольной (χ2 = 0,51; р = 0,475). Средняя доза облучения головного мозга составила 36,90 ± 3,44 Гр. Дозы противоопухолевых препаратов {< М + SD} определяли как минимальные (1 балл), дозы {M + SD ÷ М + 2SD} — как умеренные (2 балла), {M + 2SD ÷ M + 3SD} — как высокие (3 балла) и {> M + 3SD} — как очень высокие (4 балла). Мощность лучевой терапии (Ω) и химиотерапии (Ψ) подсчитывали по формуле: Ω(Ψ) = (a + b + c + d) : n, где a, b, c, d — соответственно количество зон облучения или препаратов в 1, 2, 3 и 4 балла, n — общее число зон облучения и общее количество использованных препаратов. Ω в группе больных с МГМ была достоверно большей (на 12 %) по сравнению с контрольной, составляя соответственно 1,330 ± 0,073 и 1,190 ± 0,016 о.е. (t = 2,35; p = 0,019), а Ψ превышала на 22 % (0,55 ± 0,04 и 0,450 ± 0,073 о.е.; t = 2,73, p = 0,007). Следует отметить, что у пациентов с МГМ чаще использовали паллиативную комбинированную радиохимиотерапию на медиастинальные, бронхопульмональные, надключичные шейные и другие группы лимфоузлов, а также, помимо головного мозга, на метастазы в скелете и внутренних органах без воздействия на первичную опухоль легкого (D = 9,18; p = 0,003).
Из 8 групп использованных противоопухолевых препаратов (производные платины, подофиллотоксины, антиметаболиты, алкиланты, таксаны, камптотецины, алкалоиды барвинка и антрациклиновые антибиотики) на возникновение ОНМК оказывали негативное воздействие только алкилирующие средства (циклофосфамид, ифосфамид, дакарбазин, ломустин), что показал ANOVA (D = 3,77; p = 0,046). Следовательно, алкиланты в комплексном лечении больных РЛ являются факторами риска развития ОНМК, что диктует необходимость разработки дополнительной медицинской технологии проведения химиотерапии в определенных группах пациентов, например у страдающих первичной артериальной гипертензией и сахарным диабетом.
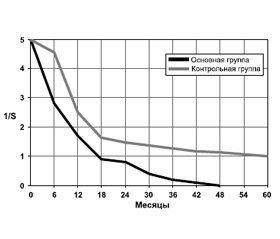
Средняя продолжительность жизни умерших больных контрольной группы составила 11,70 ± 0,44 месяца, мало отличаясь от показателей в основной (11,30 ± 1,46 месяца; t = 0,28, p = 0,778). Вместе с тем общая выживаемость пациентов с МГМ была существенно меньшей, что нашло свое отражение на рис. 1.
Выводы
1. МГМ возникают у 8 % от числа больных РЛ (в 2,2 раза чаще у женщин), на что влияют периферическая форма, гистологический вариант (плоско- и крупноклеточная карциномы) и интегральная тяжесть опухолевого процесса, наличие экссудативного канкрозного плеврита, прорастания опухоли в средостение и сопутствующий сахарный диабет типа 2.
2. Степень тяжести МГМ при РЛ прямо коррелирует с метастазированием в надключичные, паховые и забрюшинные лимфатические узлы, перикард, надпочечники, брюшную стенку, печень и поджелудочную железу.
3. Прогностическими критериями МГМ у больных РЛ могут быть повышенные параметры в крови TGF-β1, VEGF и ОР.
4. В 6 % случаев осложнений радиохимиотерапии наблюдаются разные по степени тяжести ОНМК, тесно связанные с артериальной гипертензией и сахарным диабетом, формой РЛ, количеством метастазов в лимфатических узлах (но не в головном мозге) и с использованием в комплексном лечении противоопухолевых алкилирующих средств.
5. Выживаемость пациентов с МГМ меньше, чем у остальных больных РЛ, и не превышает 4 лет.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Беляков К.М., Густов А.В. Паранеопластические полиневропатии. — Астрахань: Медицина, 2007. — 95 с.
2. Зайцев А.М., Куржупов М.И., Пикин О.В., Картовещенко А.С. Одномоментное хирургическое вмешательство при раке легкого с метастатическим поражением головного мозга // Онкология. — 2013. — № 5. — С. 49-52.
3. Евтушенко С.К. Паранеопластические неврологические синдромы: клиника, диагностика и возможности лечения // Международный неврологический журнал. — 2011. — № 8. — С. 5-15.
4. Бондарь Г.В., Думанский Ю.В., Попович А.Ю. Онкология. — К.: Медицина, 2015. — 576 с.
5. Ceniceros L., Aristu J., Castanon E. Stereotactic body radiotherapy (SBRT) for the treatment of inoperable stage I non-small cell lung cancer patients // Clin. Transl. Oncol. — 2015. — № 55(8). — Р. 213-9.
6. Chaari A., Ben Nasr S., Labidi S. Metastatic non-small cell lung cancer: a tunisian retrospective study about 100 cases // Tunis Med. — 2015. — № 93(5). — Р. 294-6.
7. Chen K.H., Wang K.J., Adrian A.M. Diagnosis of brain metastases from lung cancer using a modified electromagnetism like mechanism algorithm // J. Med. Syst. — 2016. — № 40(1). — Р. 35-40.
8. D’Antonio C., Passaro A., Gori B. Bone and brain metastasis in lung cancer: recent advances in therapeutic strategies // Ther. Adv. Med. Oncol. — 2014. — № 6(3). — Р. 101-14.
9. Grаdalska-Lampart M., Karczmarek-Borowska B., Radziszewska A.U. Lung cancer in Podkarpackie region in the years 2002–2011 // Pneumonol. Alergol. Pol. — 2015. — № 83(2). — Р. 109-19.
10. Hong N., Joo J.H., Shin S.H. The efficacy of postoperative chemotherapy for patients with metastatic brain tumors from non-small cell lung cancer // Brain Tumor Res. Treat. — 2015. — № 3(2). — Р. 108-14.
11. Kang C.G., Han H.J., Lee H.J. Rho-associated kinase signa–ling is required for osteopontin-induced cell invasion through inactiva–ting cofilin in human non-small cell lung cancer cell lines // Bioorg. Med. Chem. Lett. — 2015. — № 25(9). — Р. 1956-60.
12. Kawashima M., Murakawa T., Shinozaki T. Significance of the Glasgow Prognostic Score as a prognostic indicator for lung cancer surgery // Interact. Cardiovasc. Thorac. Surg. — 2015. — № 12(8). — Р. 115-25.
13. Kukulj S., Popovic F., Budimir B. Smoking behaviors and lung cancer epidemiology: a cohort study // Psychiatr. Danub. — 2014. — № 26(3). — Р. 485-9.
14. Lin Q., Guo L., Lin G. Clinical and prognostic significance of OPN and VEGF expression in patients with non-small-cell lung cancer // Cancer Epidemiol. — 2015. — № 39(4). — Р. 539-44.
15. Munoz-Esquerre M., Huertas D., Escobar I. Gene and protein expression of fibronectin and tenascin-c in lung samples from COPD patients // Lung. — 2015. — № 193(3). — Р. 335-43.
16. Oh J.H., Craft J.M., Townsend R. A bioinformatics approach for biomarker identification in radiation-induced lung inflammation from limited proteomics data // J. Proteome Res. — 2011. — № 10(3). — Р. 1406-15.
17. Qu H.M., Bai Y.N., Cheng N. Trend analysis of cancer mortality in the jinchang cohort, China, 2001–2010 // Biomed. Environ. Sci. — 2015. — 28(5). — Р. 364-9.
18. Rong J., Chunhua M., Yuan L. Clinical interrogation and application of super-selective intracranial artery infusion chemotherapy for lung cancer patients with brain metastases // Indian J. Cancer. — 2015. — 52(Suppl.). — Р. 22-5.
19. Takei H., Rouah E., Ishida Y. Brain metastasis: clinical cha-racteristics, pathological findings and molecular subtyping for therapeutic implications // Brain Tumor. Pathol. — 2015. — № 3(10). — Р. 140-5.
20. Waqar S.N., Waqar S.H., Trinkaus K. Brain metastases at presentation in patients with non-small cell lung cancer // Am. J. Clin. Oncol. — 2015. — № 33(10). — Р. 167-75.
21. Zegers C.M., Rekers N.H. Radiotherapy combined with the immunocytokine L19-IL2 provides long-lasting antitumor effects // Clin. Cancer Res. — 2015. — № 21(5). — Р. 1151-60.
22. Zhou T., Zhan J., Hong S. Ratio of C-reactive protein/albumin is an inflammatory prognostic score for predicting overall survival of patients with small-cell lung cancer // Sci. Rep. — 2015. — № 18(5). — Р. 10481.

/98-1.jpg)
/99-1.jpg)