Введение
Одними из патогенетических факторов повреждений олигодендроцитов и нейронов при демиелинизирующих и нейродегенеративных заболеваниях являются реактивные радикалы и провоспалительные цитокины (туморнекротический фактор (TNF-α), интерферон-гамма (IFN-γ)), которые продуцируют активированные клетки микроглии/макрофаги [1]. Источником провоспалительных цитокинов также могут быть Т-лимфоциты, инфильтрирующие головной мозг при этих патологиях [2]. Дифференцировка Т-лимфоцитов и активность их субпопуляций находятся под регулирующим влиянием одного из гормонов тимуса — высокоактивного тимулина [3, 4]. Антивоспалительный эффект тимулина у животных с экспериментальной моделью повреждения головного мозга связан с угнетением синтеза провоспалительных цитокинов [5].
С возрастом наблюдается активация клеток микроглии/макрофагов головного мозга, нарушается функционирование Т-клеточного и макрофагального звеньев иммунной системы, снижается в крови уровень тимулина, что может отразиться на эффективности восстановления нейрогенеза после действия повреждающих факторов [6–10]. С возрастом в головном мозге также снижается экспрессия таких регуляторных факторов, как цитокины [11]. Известно важное значение цитокинов для репаративной регенерации структур центральной нервной системы (ЦНС) [11].
Лейкемия-ингибирующий фактор (LIF), как цитокин с нейротрофическими свойствами, влияет на рост нейтральных стволовых клеток (НСК), пролиферацию предшественников олигодендроцитов, регенераторный потенциал мотонейронов [12]. Ранее нами показано, что положительный эффект экзогенного рекомбинантного LIF человека (rhLIF) на поврежденную структуру нейронов ЦНС у мышей с экспериментальной токсической (купризоновой) моделью демиелинизации зависит от их возраста [10]. Исследование связи изменений макрофагов, Т-лимфоцитов в головном мозге и тимулина в крови мышей разного возраста в условиях влияния нейротоксина и LIF позволит установить возрастные особенности не только патогенетических факторов токсического повреждения нервных клеток, но и путей нейропротекторного влияния цитокина. Полученные результаты таких исследований в перспективе могут оказаться полезными при обосновании новых подходов к терапии демиелинизирующих заболеваний в стареющем организме. В связи с этим вызывает интерес рассеянный склероз, который в настоящее время все чаще встречается в возрасте старше 45 лет, имеет в основном токсическую и инфекционную природу и более тяжелое клиническое течение, чем у молодых людей [13, 14].
Цель: провести сравнительный анализ изменений уровня в крови тимулина и количества макрофагов и Т-лимфоцитов в головном мозге мышей разного возраста, получавших нейротоксин купризон и инъекции LIF.
Материалы и методы
Животные. Работу выполняли на мышах-самках линии 129/Sv (генотип Н-2b) в возрасте 3–5 мес. (n = 32) и 15–17 мес. (n = 32), полученных из вивария ГУ «Институт генетической и регенеративной медицины НАМН Украины». Мыши находились в стандартных условиях вивария при фиксированном световом режиме 12 : 12. Биологический материал получали в утренние часы под эфирным наркозом. Все работы проводили с соблюдением Европейской конвенции по защите позвоночных животных, которые используются с экспериментальной и другой научной целью (Страсбург, 1986), а также Закона Украины «О защите животных от жестокого поведения» (от 21.02.2006 г.).
Модели. Для воспроизведения экспериментальной токсической модели рассеянного склероза у мышей использовали нейротоксин купризон [бис(циклогексанон)-оксалдигидразон] (Sigma, США). Купризон — это медный хелатор, который в первую очередь повреждает митохондрии зрелых олигодендроцитов, вызывая их апоптоз [15]. Общими чертами экспериментальной купризониндуцированной модели рассеянного склероза и варианта этого заболевания у человека, связанного с первичной олигодендропатией (III–IV тип патологического повреждения при рассеянном склерозе), являются [15]: а) первичное поражение зрелых олигодендроцитов, их гибель и, как результат, демиелинизация аксонов нейронов; б) инфильтрат в области повреждений содержит в основном клетки микроглии/макрофаги и в меньшей степени Т-лимфоциты; в) набухание аксонов с гиперполяризацией нейрофиламентов; г) оксидативный стресс и усиление продукции провоспалительных цитокинов в головном мозге; д) демиелинизация мозолистого тела, гиппокампа, базальных ганглиев вызывает развитие характерных двигательных, когнитивных и эмоциональных проявлений; е) возможность развития острой и хронической демиелинизации, а также ремиелинизации; ж) защитный эффект половых гормонов при данной патологии; з) отсутствует повреждение миелина аутоиммунного характера.
Экспериментальные группы. Купризон давали мышам возрастных групп 3–5 мес. (молодые) и 15–17 мес. (стареющие) по адаптированной нами схеме, позволяющей получить у них не только демиелинизирующий, но и нейродегенеративный эффекты: из расчета 0,2 % от суточного корма, ежедневно, в течение трех недель [16].
В экспериментах использовали rhLIF, методика получения которого и оценки биологической активности были описаны ранее [10]. RhLIF вводили опытным мышам разного возраста по разработанной нами ранее схеме: с 8-го дня приема купризона, внутрибрюшинно, одна инъекция ежедневно, по 50 мкг/кг [17]. Контрольные группы мышей получали купризон и инъекции 0,9% раствора хлорида натрия. Исследования проводили через 7 и 21 день после начала приема купризона. В работе также использовали интактных мышей, находящихся на обычном рационе вивария.
Методы. Эндокринную функцию тимуса оценивали по уровню тимулина в сыворотке крови [4]. Метод основан на восстановлении тимическим гормоном чувствительности спонтанных розеткообразующих клеток селезенки молодых тимэктомированных мышей к азатиоприну (Sigma, США). Результаты выражали в виде log2 титра гормона.
При фенотипировании клеток головного мозга использовали моноклональные антитела (МАТ) к CD3 и CD4, конъюгированные с флюорохромами (Becton Dickinson, США). Согласно рекомендациям фирмы-производителя к гомогенату головного мозга (2 • 105 клеток/50 мкл) добавляли соответствующие МАТ в разведении 1 : 50. Измерения проводили на лазерном проточном цитофлюориметре-сортере BD FACSAria (Becton Dickinson, США) с помощью программы BD FACS Diva 6.1.
При оценке функционального состояния макрофагов клеточную суспензию адгезированных к пластику клеток головного мозга культивировали с суспензией латекса в течение 45 мин при 37 °С и 5% СО2 [10, 18]. Затем эти клетки фиксировали и окрашивали по Романовскому — Гимзе. В световом микроскопе подсчитывали не менее 200 макрофагов и определяли фагоцитарное число (количество частиц латекса, поглощенное одним макрофагом) и фагоцитарный индекс (процент фагоцитирующих клеток).
Лейкоцитарную формулу периферической крови оценивали общепринятым методом [18].
Статистический анализ результатов проводили с помощью t-критерия Стьюдента [19]. Различие между исследуемыми показателями считали статистически достоверным при значении P < 0,05.
Результаты
Макрофаги и Т-лимфоциты в головном мозге мышей разного возраста после введения купризона и rhLIF. Нами установлено, что количество и активность макрофагов в головном мозге молодых мышей через 7 дней приема купризона выше, чем у интактных животных, и остаются повышенными через 3 недели эксперимента (рис. 1, табл. 1, 2). У мышей в возрасте 15–17 мес. количество активных макрофагов повышается только через 3 недели приема купризона (табл. 1). После инъекций rhLIF значения исследуемых показателей не изменяются у молодых мышей, однако снижаются у мышей в возрасте 15–17 мес.
/116-1.jpg)
/117-1.jpg)
/117-2.jpg)
По данным Guillemin и Brew [20], при повреждениях головного мозга одним из источников макрофагов могут быть моноциты периферической крови, о чем свидетельствует снижение их количества в этих условиях. Нами не обнаружено существенных изменений количества циркулирующих моноцитов у молодых мышей через 3 недели приема купризона. Мы не исключаем возможности изменений значений показателя в ранние сроки действия нейротоксина (через 7 дней). У мышей в возрасте 15–17 мес. через 3 недели приема купризона количество моноцитов в периферической крови меньше, чем в интактной группе. После введения rhLIF значения показателя не изменяются у молодых опытных мышей и повышаются до уровня интактной группы у мышей старшего возраста.
У мышей обеих возрастных групп через 3 недели приема купризона количество клеток с фенотипом CD3+, CD4+ и CD3+4+ выше, чем у интактных мышей (p < 0,05), при этом изменения значений показателей выраженнее у молодых животных (табл. 2). Так, у опытных мышей в возрасте 3–5 мес. число CD3+-клеток выше в 2,7 раза, а у мышей в возрасте 15–17 мес. — в 1,9 раза по сравнению с группами интактных мышей. Более значительное повышение числа СD4+-клеток у молодых мышей с купризоновой диетой приводит к появлению возрастной разницы между значениями показателя (табл. 2). У молодых мышей после инъекций rhLIF количество клеток с фенотипом CD3+, CD4+ и CD3+4+ существенно снижается, однако остается выше, чем в интактной группе. У мышей старшего возраста после инъекций цитокина мы не наблюдали изменений числа клеток с указанным выше фенотипом.
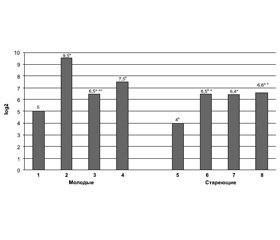
Эндокринная функция тимуса у мышей разного возраста, получавших купризон и rhLIF. Нами установлено, что у молодых мышей через 7 дней приема купризона уровень тимулина в крови в 16 раз выше (р < 0,05), чем в интактной группе (рис. 1). Через 3 недели его значения уменьшаются по сравнению с 7-дневным сроком (р < 0,05), однако по-прежнему существенно превышают таковые у интактной группы. Уровень тимулина в крови мышей в возрасте 15–17 мес. через 7 дней приема купризона в 4 раза выше, чем в интактной группе (р < 0,05), и практически остается таковым через 3 недели исследований (рис. 1).
Уровень тимулина в крови молодых мышей, получающих купризон вместе с инъекциями rhLIF, выше, чем в группе только с купризоном (p < 0,05), но у мышей старшего возраста различий между значениями показателя этих экспериментальных групп не обнаружено (р > 0,05).
Итак, особенности изменений количества Т-лимфоцитов и макрофагов в головном мозге, уровня тимулина в крови мышей, получавших нейротоксин купризон и rhLIF, зависят от возраста мышей.
Обсуждение
Иммунные клетки головного мозга и нейродегенерация. В наших работах, а также в исследованиях других авторов показано, что у молодых животных, получавших купризон, изменения структуры олигодендроцитов и нейронов головного мозга связаны с развитием оксидативного стресса, снижением активности антиоксидантных ферментов и повышением продукции провоспалительных цитокинов клетками микроглии/макрофагами [10, 15]. В этом эксперименте нами установлена связь между длительностью активации макрофагов в головном мозге опытных мышей и выраженностью изменений структуры нейронов ЦНС (умеренные повреждения нейронов через 7 дней приема купризона и деструктивные — через 3 недели) [10, 17].
По мнению Praet и соавторов [15], для развития повреждений нервных клеток важно не только увеличение числа активированных клеток микроглии/макрофагов, но и их взаимодействие с Т-лимфоцитами. В норме количество Т-лимфоцитов в головном мозге молодых животных незначительно, однако существенно повышается при его патологии [2]. При этом прохождению Т-лимфоцитов через гематоэнцефалический барьер способствуют провоспалительные цитокины (TNF-α, IFN-γ, интерлейкин-1β), которые продуцируют клетки активированной микроглии и макрофаги [2]. Указанные выше цитокины усиливают экспрессию адгезивных молекул на микроваскулярных эндотелиальных клетках. Мы не исключаем того, что повышение активности макрофагов у молодых мышей в ранний период действия купризона способствует последующему увеличению в головном мозге числа CD3+-Т-клеток.
Нами установлено, что в головном мозге молодых мышей с купризоновой диетой растет также число CD4+-клеток. Известно, что маркер CD4 свойственен не только Т-хелперам, но и моноцитам, макрофагам [21]. Вместе с тем повышение в головном мозге молодых опытных мышей числа CD3+4+-клеток дает нам основание говорить о повышении под влиянием купризона количества Т-хелперов. По данным Kang и соавторов [21], T-хелперы (Th17) играют роль в усилении купризониндуцированной демиелинизации в результате продукции IL-17, который стимулирует синтез провоспалительных цитокинов астроцитами [21].
Возрастные изменения самих нервных клеток, макрофагов и Т-лимфоцитов головного мозга могут отразиться на их реакции на действие повреждающих факторов.
Так, с возрастом снижаются нейрогенез и число неизмененных нейронов в головном мозге, повышаются количество Т-лимфоцитов, активность клеток микроглии, проницаемость гематоэнцефалического барьера и экспрессия астроцитами адгезивных молекул ICAM-1 (intercellular adhesion molecule) и хемокинов (МСР-1 — monocyte chemotactic protein 1, М1Р-1α — macrophage inflammatory protein 1α) [6, 7, 10]. В нашем эксперименте показано, что для мышей в возрасте 15–17 мес. характерна отсроченная активация макрофагов головного мозга под влиянием купризона. По-видимому, такая реакция макрофагов у стареющих мышей может быть одной из причин менее выраженного повышения у них числа СD3+-клеток и нарушений структуры нейронов ЦНС по сравнению с молодыми животными. Действительно, нами установлено, что после приема купризона в головном мозге стареющих мышей число нейронов с деструктивными изменениями в 2 раза меньше, чем у молодых животных [10]. Опыты Xu и соавторов [22] на стареющих животных с моделью воспалительной нагрузки подтвердили важность первоначальной активации клеток микроглии/макрофагов для последующей инфильтрации головного мозга Т-клетками.
Нами также показано значение возраста для особенностей изменений количества макрофагов и Т-лимфоцитов после введения rhLIF. Так, в головном мозге молодых опытных мышей, получающих цитокин, снижается количество СD3+-, СD4+- и СD3+4+-клеток. Известна способность LIF уменьшать образование Тh17 и замедлять развитие экспериментального рассеянного склероза [23]. Хотя после инъекций rhLIF количество макрофагов в головном мозге молодых опытных мышей оставалось повышенным, изменения структуры нейронов были положительными [10]. Мы не исключаем возможности смены под влиянием цитокина фенотипа макрофагов с провоспалительного на противовоспалительный, регенераторный. В исследованиях Praet и соавторов [15] показана такая возможность у молодых мышей с купризоновой диетой. В реализации нейропротекторного эффекта LIF важно также его стимулирующее влияние на образование олигодендроцитов и синтез ими миелина, дифференцировку НСК в нейрональном направлении, антиоксидантное и антиапоптотическое действие [10–12, 24].
Вместе с тем у стареющих мышей снижение доли патологических нейронов после инъекций rhLIF было менее существенным, чем у молодых животных [10]. Это может быть связано не только с особенностями баланса макрофагов и Т-лимфоцитов в головном мозге таких мышей, но и с возрастными изменениями нейрогенеза и чувствительности нервных клеток к действию регуляторных факторов [6].
Гормоны тимуса и иммунные клетки головного мозга. Активация эндокринной функции тимуса у мышей экспериментальных групп разного возраста — одно из важных звеньев изменений баланса макрофагов и Т-лимфоцитов в головном мозге. Так, у молодых мышей через 7 дней приема купризона наблюдался одновременный рост уровня тимулина в крови и количества активных макрофагов в головном мозге, а через 3 недели — уменьшение значений этих показателей. Показано влияние тимулина на структуры головного мозга и функционирование макрофагов [5, 25]. Снижение уровня тимулина в крови молодых мышей после 3-недельного приема купризона, скорее всего, связано с его повреждающим действием на клетки тимуса и повышением в крови уровня глюкокортикоидов, способных угнетать эндокринную функцию тимуса [9, 26, 27].
У стареющих мышей в ранний период действия купризона менее значительный рост уровня тимулина сочетался с отсутствием изменений количества активных макрофагов в головном мозге, тогда как повышение последних через 3 недели приема нейротоксина наблюдалось на фоне не снижающейся под действием последнего функции тимуса. Особенности изменений уровня тимулина у опытных стареющих мышей можно объяснить возрастным нарушением эндокринной функции тимуса, а также снижением количества и/или аффинитета рецепторов к глюкокортикоидам в железе [9].
Возрастные различия изменений эндокринной функции тимуса проявляются и в условиях введения rhLIF опытным мышам. Повышение под влиянием цитокина уровня тимулина в крови молодых мышей, скорее всего, связано со снижением концентрации в крови глюкокортикоидов, тогда как отсутствие его изменений в крови стареющих мышей — с возрастными изменениями чувствительности гипоталамо-гипофизарно-надпочечниковой системы к влиянию регуляторных факторов (цитокинов) [10, 28].
Таким образом, возрастные особенности взаимоотношений количества активных макрофагов и Т-лимфоцитов в головном мозге мышей, с одной стороны, и уровня тимулина в крови — с другой могут способствовать развитию возрастных различий в нарушении структуры нейронов головного мозга в условиях как действия нейротоксина купризона, так и влияния цитокина (LIF). Представляется перспективным изучение возможности применения биологически активных факторов тимуса у стареющих животных с купризоновой моделью рассеянного склероза.
Выводы
1. При экспериментальной купризониндуцированной модели рассеянного склероза баланс клеточных провоспалительных факторов (макрофаги и Т-лимфоциты головного мозга) и противовоспалительных факторов (тимулин в крови) имеет возрастные особенности. Так, повышение числа СD3+-, СD4+- и CD3+4+-клеток в головном мозге и уровня тимулина в крови стареющих мышей, получавших купризон, менее выражено, чем у молодых животных, а активация макрофагов имеет отсроченный характер.
2. Влияние экзогенного rhLIF на исследуемые показатели у мышей с купризоновой диетой зависит от возраста: у молодых мышей — снижение количества Т-лимфоцитов в головном мозге и повышение уровня в крови тимулина, а у стареющих мышей — снижение количества активных макрофагов в головном мозге.
3. Эффективность нейропротекторной терапии демиелинизирующей и нейродегенеративной патологии нервной системы (рассеянный склероз) с использованием LIF различается у животных разного возраста.
Благодарность: к.б.н. А.Е. Родниченко за помощь при проведении исследований и к.б.н. С.Е. Рымарь за любезно предоставленный цитокин.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Абдурасулова И.Н., Клименко В.М. Роль иммунных и глиальных клеток в процессах нейродегенерации // Мед. академ. журнал. — 2011. — 11(1). — С. 12-29.
2. Gonzalez H., Pacheco R. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases // J. Neuroinflammation. — 2014. — 11(201). — 11 p.
3. Csaba G. The immunoendocrine thymus as a pacemaker of lifespan // Acta Microbiol. Immunol. Hung. — 2016. — 63(2). — Р. 139-158.
4. Bach J.F., Bach M.A., Blanot D. et al. Thymic serum factor (FTS) // Bull. Inst. Pasteur (Paris). — 1978. — 76. — Р. 325-398.
5. Haddad J.J., Hanbali L.H. The anti-inflammatory and immunomodulatory activity of thymulin peptide is NF-kB dependent and involves the downregulation of I kB-α // Am. J. Med. Biol. Res. — 2013. — 1(2). — Р. 41-49.
6. Hamilton L.K., Joppe S.E., Cochard L., Fernandes K.J. Aging and neurogenesis in the adult forebrain: what we havelearned and where we should go from here // Eur. J. Neurosci. — 2013. — 37. — Р. 1976-1986.
7. Moraga A., Pradillo J.M., Garcia-Culebras A. et al. Aging increases microglial proliferation, delays cell migration, and decreases cortical neurogenesis after focal ischemia // JNI. — 2015. — 12, 87. — Р. 12. — DOI: 10.1186/s12974-015-0314-8.
8. Gemechu J.M., Bentivoglio M. T cell recruitment in the brain during normal aging // Front. Сell. Neurosci. — 2012. — 6. — 6 (Article 38). — Р. 5.
9. Labunets I. Pineal gland and rhythms of immune system in –aging. Experimental study. LAP LAMBERT Acad Publ: Saarbrucken, 2012. — 132 p.
10. Labunets I.F., Melnyk N.O., Rodnichenko A.E. et al. Cuprizone-Induced Disorders of Central Nervous System Neurons, Behavioral Reactions, Brain Activity of Macrophages and Antioxidant Enzymes in the Mice of Different Ages: Role of Leukemia Inhibitory Factor in their Improvement // J. Aging Geriatr. Med. — 2017. — 1(2). — Р. 8. — DOI: 10.4172/AGM.1000104.
11. Gudi V., Gingele S., Skripuletz Th., Stangel M. Glial response during cuprizon-induced de- and remyelination in the CNS: lessons learned // Front. Cell. Neurosci. — 2014. — 8 (Article 73). — 24 p.
12. Ostasov P., Houdek Z., Cendelin J., Kralickova M. Role of leukemia inhibitory factor in the nervous system and its pathology // Rev. Neurosci. — 2015. — 26(4). — P. 443-459.
13. Міщенко Е.С., Шульга О.Д., Бобрик Н.В., Шульга Л.А. Розсіяний склероз: глобальні перспективи // Укр. мед. часопис. — 2014. — 101(3). — С. 84-87.
14. Ismailov M.G., Shevchenko P.P., Yaschenko I.A. Multiple sclerosis and debut in the elderly // Adv. Curr. Nat. Sci. — 2014. — 6. — P. 122-123.
15. Praet J., Guglielmetti C., Berneman Z. et al. Cellular and molecular neuropathology of the cuprizone mouse model: Clinical relevance for multiple sclerosis // J. Neubiorev. — 2014. — 47. — P. 485-505.
16. Лабунець І.Ф., Мельник Н.О., Кузьмінова І.А., Бутенко Г.М. Патент України на корисну модель № 94458 u (UA), МПК G09B 23/28 «Спосіб моделювання структурних змін нейронів центральної нервової системи при демієлінізуючих захворюваннях» (2006.01). Опубл. 10.11.2014; Бюл. № 21. — 3 с.
17. Лабунець І.Ф., Мельник Н.О., Римар С.Ю. Патент України на корисну модель № 104976 (UA), МПК G09B23/28 «Спосіб моделювання регенерації ушкоджених нейронів головного мозку при нейродегенеративних захворюваннях». Опубл. 25.02.2016; Бюл. № 4. — 4 с.
18. Доклінічні дослідження лікарських засобів (методичні рекомендації) / Під ред. О.В. Стефанова. — К.: Авіцена, 2001. — 528 с.
19. Лакин Г.Ф. Биометрия. — М.: Высшая школа, 1990. — 350 с.
20. Guillemin G.J., Brew B.J. Microglial, macrophages, perivascular macrophages, and pericytes: a review of function and identification // J. Leukoc. Biol. — 2004. — 75. — P. 288-239.
21. Kang Z., Liu L., Spangler R. et al. IL-17-induced Act1-mediated signaling is critical for cuprizone-induced demyelination // J. Neurosci. — 2012. — 32(4). — P. 8284-8292.
22. Xu Y.-Zh., Nygard M., Krister Kristensson K, Bentivoglio M. Regulation of cytokine signaling and T-cell recruitment in the aging mouse brain in response to central inflammatory challenge // Brain. Behav. Immun. — 2010. — 24. — P. 138-152.
23. Cao W., Yang Y., Wang Zh. et al. Leukemia inhibitory factor inhibits T helper 17 cell differentiation and confers treatment effects of neural progenitor cell therapy in autoimmune disease // Immunity. — 2011. — 35. — P. 273-284.
24. Buono K.D., Vadlamuri D., Gan Q., Levison S.W. Leukemia inhibitory factor is essential for subventricular zone neural stem cell and progenitor homeostasis as revealed by a novel flow cytometric analysis // Dev. Neurosci. — 2012. — 34(5). — P. 449-462.
25. Лабунец И.Ф., Родниченко А.Е., Васильев Р.Г. Способность клеток-предшественниц гранулоцитов и макрофагов костного мозга мышей разных линий к образованию колоний in vitro при изменении содержания тимулина в организме и в культуре клеток // Гены & клетки. — 2017. — 12(2). — С. 97-103.
26. Urbach-Ross D., Kusnecov A.W. Effects of acute and repeated exposure to lipopolysaccharide on cytokine and corticosterone production during remyelination // Brain Behav. Immun. — 2007. — 21(7). — P. 962-974.
27. Savino W., Mendes-da-Cruz D.A., Lepletier A., Dardenne M. Hormonal control of T-cell development in health and disease // Nat. Rev. Endocrinol. — Аdvance online publication 6 October 2015. doi: 10.1038/nrend.2015.168. — 15 p.
28. Auernhammer C.J., Melmed S. Leukemia-inhibitory factor — neuro-immune modulator of endocrine function // Endocr. Rev. — 2000. — 21(3). — P. 313-345.

/116-1.jpg)
/117-1.jpg)
/117-2.jpg)