Введение
Нейропротективная защита мозга при хронической недостаточности мозгового кровообращения является одним из наиболее эффективных методов ее лечения. Церебролизин — препарат, имеющий выраженное нейропротективное действие. Эффективность Церебролизина объясняется тропностью его компонентов к нервной ткани, способностью проникать через гематоэнцефалический барьер и быстро усваиваться. Церебролизин обладает нейропротективной активностью — мультимодальным неспецифическим действием на нервную ткань, обеспечивающим защиту ней-ронов от гипоксии, ишемии, повреждающих воздействий, развития апоптоза. Нейротрофическая активность Церебролизина аналогична действию естественных нейротрофических факторов, функциональной нейромодуляции — поддержке ней-ропластичности и нейрогенеза, способствующей сохранению когнитивных и двигательных функций, метаболической регуляции, стимуляции мозгового метаболизма и внутриклеточного синтеза белка. Церебролизин повышает эффективность ассоциативных процессов в мозге, улучшает умственную активность, память, внимание, стабилизирует эмоциональный фон, способствует регрессу двигательных и экстрапирамидных расстройств, эффективно влияет на уровень общего функционирования, повседневной активности и когнитивных характеристик.
Цель исследования: изучение нейрофизиологических аспектов влияния Церебролизина на процессы восстановления функции стволовых отделов у пациентов с хронической недостаточностью мозгового кровообращения при применении комбинации «Церебролизин+ базовая терапия» по сравнению с базовой терапией (аспирин, статины, сартаны, мельдоний).
Материалы и методы
Проводилось обследование 52 пациентов, страдающих хронической недостаточностью мозгового кровообращения (подтвержденной методом ней-ровизуализации) в каротидном и вертебробазилярном бассейне (перенесенные малые глубинные инфаркты не ранее 1 года и не позднее 3 лет по отношению к проведенному исследованию), на базе 4-й городской клинической многопрофильной больницы г. Днепра. Из них 28 больных (13 мужчин и 15 женщин), средний возраст которых составил 59,9 ± 8,1 года, наряду с базовой терапией получали Церебролизин в суточной дозировке 20 мл внутривенно в течение 15 дней, и 24 пациента (10 мужчин и 14 женщин) контрольной группы, средний возраст которых составил 64,7 ± 3,4 года, получали базовую терапию. Критерием включения в исследование являлось подтвержденное документально, инструментально и лабораторно хроническое сосудистое поражение головного мозга у пациентов с жалобами на снижение памяти и концентрации внимания, эмоциональную лабильность, нарушение сна, несистемное головокружение, шум в голове, неустойчивость при ходьбе, клинически проявляющимися неврологической симптоматикой: недостаточностью конвергенции глазных яблок, анизорефлексией сухожильных и периостальных рефлексов, дизартрией, симптомами орального автоматизма, неустойчивостью в позе Ромберга, пирамидной и координаторной недостаточностью, легким и умеренным когнитивным дефицитом. Для исследования больных с хронической недостаточностью мозгового кровообращения критериями исключения были судорожные приступы в анамнезе, психические заболевания, тяжелая эндокринная патология, перенесенные обширные инсульты со стойкими остаточными явлениями, сосудистая деменция. В исследование также не включались лица, перенесшие черепно-мозговые травмы, и больные с энцефалопатиями другого генеза. Больным были выполнены клинико-неврологическое обследование с обязательной аускультацией каротидных артерий, нейровизуализация (КТ или МРТ головного мозга), психодиагностические обследования (MMSE, Монреальская шкала, заучивание 10 слов, таблицы Шульте и др.), допплерография интра- и экстракраниальных артерий, липидный профиль крови, гемостаз, клинический анализ крови с отражением содержания тромбоцитов, эритроцитов, гемоглобина, гематокрита, лейкоцитов с развернутой лейкоцитарной формулой, биохимическое исследование крови, офтальмоскопия, электрокардиография, электроэнцефалография (по показаниям). При поступлении на 1, 10 и 14-е сутки проводилось исследование мигательного рефлекса, неврологическое обследование. Группе пациентов из 28 человек помимо базовой терапии назначался Церебролизин 20 мл в сутки в/в капельно. Исследование мигательного рефлекса применялось для изучения функционального состояния стволовых структур. Стимулировалась первая ветвь тройничного нерва в области надглазничного отверстия неритмичными электрическими импульсами с интервалом до 15 с длительностью 0,1 мс силой тока 15–30 мА и регистрировались вызванные ответы активными электродами у наружного угла глаз, референтными на спинке носа. Проводилась стимуляция по методике J. Kimura на электронейромиографе «DХ-системы» (Украина). Выполнялась функциональная проба с открытием глаз. Использовали частотные фильтры с нижней границей 20 Гц, верхней — 10 кГц. При регистрации количественных показателей результатов мигательного рефлекса учитывались следующие показатели: сохранность компонентов рефлекса, амплитуда, латентность и длительность R1 и R2 на стороне стимуляции, латентное время компонента R2 на противоположной стороне, симметричность компонентов, наличие и сохранность позднего билатерального полисинаптического ответа R3, соотношение латентности и длительности компонента R2 (уровень возбудимости). Мигательный рефлекс представляет собой экстероцептивный активирующий рефлекс. Рефлекторная дуга мигательного рефлекса включает афферентную часть, реализуемую тройничным нервом, и эфферентную часть, реализуемую лицевым нервом, ядра тройничного и лицевого нервов, а также нейроны ретикулярной формации мозгового ствола. Рефлекторный ответ включает три компонента: ранний (R1) ответ с латентностью 10–14 мс, возникающий на стороне стимуляции в результате моносинаптического рефлекса, замыкающегося через ядро спинального тройничного тракта на уровне моста, поздний (R2) компонент с латентностью 30–34 мс, обусловленный активацией полисинаптической рефлекторной дуги, состоящей из афферентных волокон тройничного нерва, ядра спинального тройничного тракта, ипси- и контралатеральных интернейронов заднего продольного пучка, ядра лицевого нерва и волокна лицевого нерва. Билатеральность ответа R2 обусловлена двусторонней корковой иннервацией верхней части мимической мускулатуры. Поздний билатеральный полисинаптический ответ (R3) с латентностью 70–100 мс реализуется посредством интернейронных связей ретикулярной формации ствола головного мозга с участием структур ноцицептивного контроля на уровне околоводопроводного серого вещества и ядер шва.
Следует отметить, что компонент R1 более стабилен и достаточно четко анализируется ввиду ограниченных рамок латенции, устойчивости к надсегментарным влияниям. Полисинаптический поздний компонент R2 более вариабелен, его изменения более значимы в оценке стволовой дисфункции, которая практически всегда сопутствует структурным изменениям вещества мозга.
Результаты и обсуждение
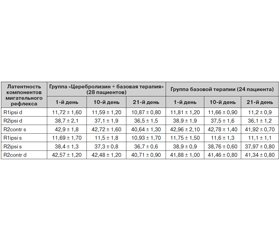
Проводился анализ моносинаптического и полисинаптического ответа в 2 группах пациентов (табл. 1).
При исследовании среди больных 1-й группы выявлен гиповозбудимый тип в 11 случаях, гипервозбудимый — в 7 случаях, гиперсинхронный — в 6, нормовозбудимый — в 3; среди больных 2-й группы выявлен гиповозбудимый тип в 7 случаях, гипервозбудимый — в 8, гиперсинхронный — в 5, нормовозбудимый — в 2, гиперсинхронный — в 2 случаях.
/40-1.jpg)
При анализе показателей в 2 группах пациентов отмечаются характерные изменения мигательного рефлекса при хронической ишемии мозга — увеличение латентности и длительности первичного компонента при его выраженной вариабельности, что свидетельствует о нестабильности функционирования рефлекторной системы, наряду с этим — увеличение длительности при уменьшении латентности позднего рефлекторного компонента, что является объективным критерием стволовой дисфункции. В результате проведенной терапии Церебролизином отмечается более выраженная динамика стабилизации показателей мигательного рефлекса — уменьшение латентности первичного компонента, нормализация латентности вторичного позднего компонента, уменьшение пороговых значений первичного и вторичного компонентов, увеличение амплитуды, уменьшение асимметрии компонентов к 10-му дню лечения, а в группе пациентов, получающих базовую терапию, выраженная стабилизация показателей происходит к 21-му дню. Нормализация показателей мигательного рефлекса соответствовала динамическому улучшению состояния и регрессу неврологической симптоматики.
Выводы
Тестирование функциональной активности мозга при цереброваскулярных нарушениях позволяет определить степень выраженности стволовой дисфункции головного мозга и дает возможность прогнозировать эффект проводимой терапии.
Изучение динамики мигательного рефлекса у больных с хронической ишемией мозга выявило сходство нейрофизиологических феноменов с острой ишемией, но с меньшей выраженностью и латерализацией. В исследовании мигательного рефлекса показана эффективность Церебролизина при хронической ишемии головного мозга. Поражение проводящей системы мезенцефального отдела ствола мозга практически регрессирует к 10-му дню терапии Церебролизином.
Конфликт интересов: не заявлен.
Список литературы
1. Николаев С.Г. Практикум по клинической электромиографии / С.Г. Николаев. — Иваново, 2013.
2. Jaaskelainen S.K. Electrophysiological testing of the trigeminofacial system: aid in the diagnosis of atypical facial pain / S.K. Jaaskelainen, H. Forssell, O. Tenovuo // Pain. — 1999. — Vol. 80, № 1–2. — P. 191-200.
3. Санадзе А.Г., Касаткина Л.Ф. Клиническая электромио-графия для практических неврологов. — М.: ГЭОТАР-Медиа, 2015.
4. Команцев В.Н. Методические основы клинической электронейромиографии: Руководство для врачей. — СПб., 2006. — 362 с.
5. Котов С.В. Восстановление речевых функций у больных с афазией в раннем реабилитационном периоде ишемического инсульта // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2017. — № 2. — С. 38-41.
6. Юн В.Л. Современный взгляд терапевта на гипертоническую болезнь с цереброваскулярными осложнениями: от ТИА до ишемического инсульта // Терапевт. — 2017. — № 5–6. — С. 13-19.
7. Гусев Е.И., Коновалов А.Н., Скворцова В.И. Неврология и нейрохирургия: В 2 томах. — 2015.
8. Кадыков А.С., Манвелов Л.С., Шахпаронова Н.В. Хронические сосудистые заболевания головного мозга // Дисциркуляторная энцефалопатия. Библиотека врача-специалиста. — М.: ГЭОТАР-Медиа, 2018.
9. Віничук С.М., Прокопів М.М. Гострий ішемічний інсульт. — К.: Наукова думка, 2006. — 280 с.
10. Бадалян Л.О., Скворцов И.А. Клиническая электронейромиография: Руководство для врачей. — 1986. — 368 с.
11. Kimura J. The blink reflex as a test for brainstem and higher central nervous system function. New developments in electromyography andclinical neurophysiology / J. Kimura, J.E. Desmedt (eds.). — Basel: Karger, 1973. — Vol. 3. — P. 682-697.
12. Esteban A. A neurophysiological approach to brainstem reflexes. Blink reflex // Neurophysiol. Clin. — 1999. — 29. — Р. 7-38.
13. Якупова А.А., Исмагилов М.Ф., Якупов Р.А. Клинико-электронейрофизиологическая характеристика полисинаптической рефлекторной возбудимости при головной боли напряжения // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2008. — № 3. — С. 53-57.
14. Авакян Г.Н., Абдухакимова У.Ф. Электрофизиологическая и клиническая значимость ранних и поздних компонентов мигательного рефлекса и их роль в диагностике // Журн. неврологии и психиатрии им. С. С. Корсакова. — 1988. — Т. 88, № 3. — С. 39-43.

/40-1.jpg)