Резюме
Мета. Оцінка ефективності глибинної мозкової стимуляції у лікуванні хвороби Паркінсона із супутніми психоневрологічними розладами. Матеріали та методи. У дослідження залучено 13 хворих на хворобу Паркінсона (ХП) віком від 37 до 70 років (у середньому 58,61 ± 5,43 року), яким була проведена імплантація системи для двобічної нейростимуляції субталамічних ядер. Середня тривалість захворювання становила 8,53 ± 1,82 року. Оцінку психоневрологічного стану хворих до та після операції проводили з використанням Уніфікованої оцінювальної шкали ХП (UPDRS II), шкали Хена — Яра, шкали денної активності Шваба — Інгланда, тесту Бека на депресію, тестів Гамільтона на депресію та тривожність, скороченої шкали оцінки когнітивних функцій (MMSE) і тесту оцінки якості життя PDQ-39. Хірургічні втручання виконували на стереотаксичній системі CRW Radionics. Післяопераційний катамнез становив від 1 до 7 років (у середньому 4,14 ± 0,42 року). Результати. Після операції повне припинення тремору та регрес ригідності спостерігались у 12 (92,31 %) осіб; регрес гіпокінезії відзначено в усіх 4 (100,00 %) хворих, у яких вона мала місце до операції. Через 6 місяців після операції відмічено покращення показників за шкалою UPDRS II у період «On» на 74,00 %, а в період «Off» — на 62,90 %. Дозу леводопи зменшено в середньому на 56,14 %. У більшості хворих спостерігалося зменшення рівня депресії та тривожності; показники якості життя за шкалою PDQ-39 покращилися у середньому на 30,00 %. Ускладнень, пов’язаних із хірургічним втручанням, не було. Висновки. Психоемоційні розлади у хворих на ХП перебувають у прямій залежності від тривалості захворювання, дози та тривалості вживання замісної леводопа-терапії. Глибинна мозкова стимуляція є безпечним і ефективним методом лікування ХП, який дає можливість усунути або зменшити моторні прояви захворювання, покращити психоемоційний стан і якість життя.
Цель. Оценка эффективности глубинной мозговой стимуляции при лечении болезни Паркинсона (БП) с сопутствующими психоневрологическими расстройствами. Материалы и методы. В исследование включены 13 пациентов с БП в возрасте от 37 до 70 лет (в среднем 58,61 ± 5,43 года), которым проведена имплантация системы для двусторонней нейростимуляции субталамических ядер. Средняя продолжительность заболевания составила 8,53 ± 1,82 года. Оценку психоневрологического статуса больных до и после операции проводили с использованием Унифицированной оценочной шкалы БП ІІ, шкалы Хена — Яра, шкалы повседневной активности Шваба — Ингланда, теста Бека на депрессию, тестов Гамильтона на депрессию и тревожность, сокращенной шкалы оценки когнитивных функций (MMSE) и теста оценки качества жизни PDQ-39. Хирургические вмешательства выполнялись на стереотаксической системе CRW Radionics. Послеоперационный катамнез прослеживания составил от 1 до 7 лет (в среднем 4,14 ± 0,42 года). Результаты. После операции полное прекращение тремора и регресс ригидности наблюдалось у 12 (92,31 %) лиц, регресс гипокинезии отмечен у всех 4 (100,00 %) больных, у которых он имел место до операции. Через 6 месяцев после операции отмечено улучшение показателей по шкале UPDRS II в период «On» на 74,00 %, в период «Off» — на 62,90 %. Доза леводопы уменьшена на 56,14 %. У большинства оперированных больных наблюдалось снижение уровня депрессии и тревожности; показатели качества жизни по шкале PDQ-39 улучшились в среднем на 30,00 %. Осложнений, связанных с хирургическим вмешательством, не было. Выводы. Психоэмоциональные расстройства у больных БП находятся в прямой зависимости от длительности заболевания, дозы и длительности леводопа-терапии. Глубинная мозговая стимуляция является безопасным и эффективным методом лечения БП, который позволяет устранить или уменьшить моторные проявления заболевания, улучшить психоэмоциональное состояние и качество жизни.
Background. Objective: to evaluate the efficacy of subthalamic nucleus deep brain stimulation in patients with Parkinson’s disease (PD) and psychoneurological comorbidities. Materials and methods. Thirteen patients with PD were enrolled in the study. Their age ranged from 37 to 70 years (mean 58.61 ± 5.43 years). Average duration of PD was 8.53 ± 1.82 years. Neuropsychological status was assessed before and after treatment by Unified Parkinson’s Disease Rating Scale (UPDRS) II, Hoehn and Yahr scale, Schwab and England scale, Mini-Mental State Exa-mination, Beck’s Depression Inventory, Hamilton Depression Rating Scale, Hamilton Anxiety Rating Scale and the 39-Item Parkinson’s Disease Questionnaire (PDQ-39). Surgery was performed using CRW stereotactic system. Postoperative follow-up ranged from 1 to 7 years (mean 4.14 ± 0.42 years). Results. After surgery, tremor stopped and rigidity regressed in 12 (92.31 %) patients; regression of hypokinesia was observed in all 4 (100.00 %) persons who have had it before surgery. Six months after the surgery, UPDRS II score improved by 74.00 % in “On” period and by 62.90 % — in “Off” period. After treatment, the dose of levodopa decreased on average by 56.14 %. The majority of ope-rated patients noted a reduction of depression and anxiety, average improvement on the PDQ-39 was 30.00 %. There were no surgical complications. Conclusions. Psychoneurological disorders in patients with PD are directly dependent on the duration of the disease, the dose and duration of levodopa therapy. Deep brain stimulation is effective and safe method of surgical treatment for PD, which improves motor symptoms, reduces psychoemotional disorders and increases the quality of life.
Вступ
Хвороба Паркінсона (ХП) є прогресуючим ней-родегенеративним захворюванням нервової системи, що обумовлене дегенерацією нейронів компактної частини чорної субстанції і порушенням функції базальних гангліїв. У клінічній картині ХП на перший план виходять рухові симптоми захворювання, а саме тремор, ригідність, гіпокінезія та постуральна нестабільність [1]. Протягом останнього часу все більше уваги приділяється неруховим або немоторним проявам захворювання, що можуть виникати на різних стадіях ХП і в деяких випадках призводити до більшої інвалідизації, ніж рухові розлади [2]. Психоемоційні розлади є одним із видів немоторних проявів ХП. Психоемоційні розлади можуть виникати на будь-яких стадіях ХП, часто можуть прогресувати, виступати провідним проявом клінічної картини захворювання, впливати на зниження якості життя хворих. Когнітивні порушення мають місце у 10–30 % хворих на ХП [3]. Серед емоційних розладів депресія зустрічається частіше за інші — у 40–50 % хворих. Депресія часто передує появі моторних проявів захворювання і спостерігається у 2–3 рази частіше у хворих на ХП порівняно із загальною популяцією людей похилого віку [4]. Серед інших розладів відзначається зниження самооцінки, апатія, підвищення тривожності, епізоди панічних атак, збудження та подразливості, поява суїцидальних думок.
У даний час глибинна мозкова стимуляція (ГМС) є найбільш поширеним методом хірургічного лікування ХП. ГМС має суттєві переваги порівняно з класичними аблятивними або деструктивними хірургічними втручаннями, а саме: високу ефективність при акінетичній формі захворювання, можливість одночасної двобічної стимуляції підкіркових структур головного мозку, можливість індивідуального підбору оптимальних параметрів стимуляції неінвазивним способом [5].
Метод нейростимуляції вперше був запроваджений у практику в середині минулого сторіччя й удосконалювався разом з аблятивними стереотаксичними втручаннями. Спочатку нейростимуляція використовувалась з метою лікування певних психічних розладів. Пізніше її почали застосовувати у лікуванні епілепсії, ХП, нестерпного больового синдрому та деяких інших захворювань нервової системи [6]. Сучасна ера хронічної мозкової стимуляції бере свій початок з кінця 20-го сторіччя, коли у 1987 році французькі нейрохірурги на чолі з професором A.L. Benabid доповіли про результати успішного використання нейростимуляції у хворих на есенціальний тремор і ХП [7]. У даний час у світі даним методом прооперовано понад 200 тисяч хворих.
Численними клінічними дослідженнями доведена висока ефективність та безпечність нейростимуляції [8, 9]. Показано, що ГМС призводить до значного регресу моторних проявів ХП і покращенню якості життя хворих [10, 11]. Протягом останніх років все більше уваги приділяється вивченню динаміки змін психічних розладів у хворих, яким проведена хронічна мозкова стимуляція [12, 13]. Різні автори відзначають як позитивний, так і негативний вплив нейростимуляції на психоемоційний стан хворих із ХП. Так, D.J. Burn та A.I. Troster (2004) говорять про те, що ГМС субталамічних ядер може викликати депресію, гіпоманію й апатію, а в рідкісних випадках — збудження та психози [15, 16]. У той же час показано, що регрес рухових розладів внаслідок нейростимуляції сприяє нормалізації емоційної сфери, усуває явища депресії або зменшує їх вираженість, що, в свою чергу, покращує якість життя хворих.
Метою даної роботи є оцінка ефективності глибинної мозкової стимуляції у лікуванні ХП із супутніми психоневрологічними порушеннями.
Матеріали та методи
У дослідження включено 13 хворих на ХП, яким була проведена імплантація внутрішньомозкових електродів для двобічної нейростимуляції субталамічних ядер (subthalamic nucleus — STN). Оперовані хворі мали тяжку форму ХП, яка характеризувалась проградієнтним перебігом, низькою ефективністю медикаментозної терапії, побічними ефектами від протипаркінсонічної терапії та прогресуючою соціально-побутовою дезадаптацією. Вік хворих коливався від 37 до 70 років (у середньому 58,61 ± 5,43 року). Серед них було 10 (76,92 %) чоловіків та 3 (23,10 %) жінки. Тривалість захворювання становила від 3 до 13 років (у середньому 8,53 ± 1,82 року). Терапію леводопою отримували 12 (92,31 %) хворих, тривалість якої в середньому дорівнювала 5,52 ± 2,14 року. У 10 з 12 (83,33 %) хворих мали місце моторні флюктуації та леводопа-індуковані дискінезії.
Неврологічний стан хворих оцінювався за загальноприйнятою Уніфікованою оцінювальною шкалою хвороби Паркінсона ІІ (Unified Parkinson’s Disease Rating Scale II — UPDRS II). Нейропсихологічна оцінка проводилася до та після хірургічного лікування. Для оцінки психічного статусу використовувалися: тести оцінки когнітивних функцій Mini-Mental State Examination (MMSE), шкали депресії Бека (BDI) та Гамільтона (HDRS), шкала тривоги Гамільтона (HARS), шкала ситуативної тривоги Спілбергера — Ханіна (STAI). Для оцінки якості життя застосовувався опитувальник із 8 підпунктів, які входять у складову 39 ключових питань, — Parkinson’s Disease Questionnaire (PDQ-39).
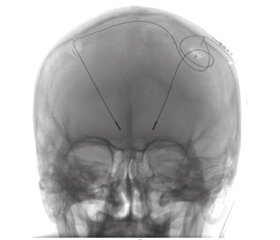
Стереотаксичні втручання виконувалися на стереотаксичній системі CRW Radionics (США). Розрахунки координат мішені деструкції та мішені введення нейростимулюючого електрода проводились на плануючих станціях iPlan (BrainLab) та Fraimlink (Medtronic) (рис. 1). З метою електрофізіологічного контролю коректного розміщення внутрішньомозкових електродів 5 (38,5 %) хворим була проведена інтраопераційна реєстрація електричної активності підкіркових ядер за допомогою мікроелектродів (microelectro recording — MER) (рис. 2). Мовленнєвий контакт із хворим та оцінка регресу тремору та ригідності досягалась шляхом використання wake-up-анестезії. Після операції всім хворим проводилась мультиспіральна комп’ютерна томографія (КТ). Налаштування параметрів нейростимуляції починалося на третій день після хірургічного втручання.
/43-1.jpg)
/44-1.jpg)
/44-2.jpg)
Катамнез відстежувався від 1 до 7 років після операції (у середньому 4,14 ± 0,41 року). Статистична обробка отриманих даних проводилась із використанням статистичної програми стандартних методів параметричної статистики, а саме: середнє арифметичне значення, похибка середнього значення та середньоквадратичне відхилення. Критичне значення статистичного рівня значущості вважали за менше 0,05 (5 %) [17].
Результати
Серед оперованих хворих у 9 (69,23 %) осіб була тремтливо-ригідна та у 4 (30,77 %) акінетико-тремтливо-ригідна форма захворювання. На момент хірургічного втручання всі пацієнти із ХП мали третю стадію за шкалою Хена — Яра, значення шкали денної активності Шваба — Інгланда коливались від 30 до 60 балів (у середньому 42,82 %). Всі хворі перенесли операцію добре, ускладнень, пов’язаних із хірургічним втручанням, не було.
Після операції тремор повністю припинився у 12 (92,31 %) осіб, ригідність регресувала у 12 (92,31 %), регрес гіпокінезії відзначено у всіх 4 (100,00 %) хворих, у яких вона мала місце до операції. Леводопа-викликані дискінезії припинилися у 4 із 5 хворих (80,00 %), у яких вони мали місце до імплантації нейростимулюючої системи. Моторні флюктуації регресували у 9 із 10 хворих (90,00 %). Через 6 місяців після операції відмічено покращення показників за шкалою UPDRS II у період «On» на 74,00 %, а в період «Off» — на 62,90 %. Дозу леводопи зменшено в середньому на 56,14 % (табл. 1). Слід зауважити, що хворі, які вживали препарати леводопи до операції, продовжували їх приймати після нейрохірургічного втручання.
/45-1.jpg)
Через 6 місяців після імплантації нейростимулюючої системи спостерігалось суттєве покращення якості життя хворих, про що свідчить підвищення показників за шкалою PDQ-39 на 30,00 %. Під час оцінки психоемоційного статусу хворих відмічені мінімальні когнітивні порушення, які за шкалою MMSE в середньому становили 26 балів. Після операції когнітивні розлади не посилилися. До хірургічного втручання у більшості хворих спостерігалися виражені ознаки депресії та тривожності. Рівень депресії за шкалою BDI становив у середньому 28 балів, а тривоги — 26 балів за шкалою HARS. Явища депресії та тривожності були більше виражені у хворих із більшою тривалістю захворювання, більшою тривалістю леводопа-терапії та високою дозою препаратів леводопи. Через 6 місяців після операції спостерігалося зменшення депресії у середньому до 20 балів (на 28,62 %) та тривожності до 16 балів (на 38,51 %). Слід зазначити, що після операції в жодному випадку не спостерігалися суїцидальні наміри. Отже, позитивного ефекту щодо покращення психоемоційної сфери вдалося досягти в усіх оперованих хворих.
Обговорення
ХП лишається одним із найпоширеніших ней-родегенеративних захворювань нервової системи. Прогредієнтний перебіг захворювання, недостатньо висока ефективність специфічної терапії, розвиток побічних ефектів від тривалого вживання протипаркінсонічних ліків обумовлюють показання до проведення хірургічного втручання. Отримані результати двобічної нейростимуляції субталамічного ядра свідчать про високу ефективність і безпечність цього методу хірургічного лікування ХП [18, 19]. У нашому дослідженні позитивного результату вдалося досягти в усіх оперованих хворих. Регрес рухових розладів, моторних флюктуацій, леводопа-викликаних дискінезій у поєднанні з покращенням психоемоційного стану хворих сприяв суттєвому покращенню якості життя хворих [20]. У зазначених хворих не було операційних ускладнень або побічних ефектів від нейростимуляції, що можна пояснити ретельним підбором пацієнтів для нейрохірургічного втручання та досвідом хірургів. Показаннями до хірургічного лікування ХП є: прогресування захворювання, низька ефективність специфічної медикаментозної терапії, розвиток побічних ефектів від леводопа-терапії. Оцінка психоемоційного стану хворого має одне з ключових значень під час призначення показань до імплантації нейростимулюючої системи. Когнітивні порушення та виражена депресія є протипоказаннями до використання нейростимуляції. Тому важливе значення має мультидисциплінарний підхід щодо визначення показань до імплантації нейростимулюючої системи з урахуванням даних нейровізуалізаційних і нейропсихологічних обстежень.
Висновки
Двобічна глибинна мозкова стимуляція субталамічних ядер є безпечним і ефективним методом лікування ХП, який надає можливість усунути моторні прояви захворювання, покращити психоемоційний стан і якість життя хворих. Висока ефективність ГМН залежить від мультидисциплінарного підходу до визначення показань щодо хірургічного вручання та досвіду нейрохірургів. Удосконалення нейростимуляційних систем, зокрема впровадження спрямованої нейростимуляції, сприяє ще більшому регресу рухових розладів і зведе до мінімуму розвиток побічних ефектів від нейростимуляції.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Wolters E.Ch. Parkinsonism and Related Disorders / E.Ch. Wolters, T. VanLaar, H.W. Berendse // VU University Press Amsterdam. — Amsterdam, 2008. — 576 p.
2. Карабань І.М. Хвороба Паркінсона: патогенетичні аспекти медикаментозної терапії та клінічного перебігу // Науковий журнал МОЗ України. — 2014. — № 2(6). — С. 60-70.
3. Bosboom J.L.W., Stoffers D., Wolters Ech. Cognitive function in Parkinson’s disease // J. Neural. Transm. — 2004. — Vol. III. — P. 1303-1315.
4. A systematic review of prevalence studies of depression in Parkinson's disease / J.S. Reijnders, U. Ehrt, W.E. Weber [et al.] // Mov. Disord. — 2008. — Vol. 30, № 23(2). — P. 183-189.
5. Deep brain stimulation of pallidal versus subthalamic for patients with Parkinson`s disease: a meta-analysis of controlled clinical trials / F. Xu, W. Ma, Y. Huang [et al.] // Neuropsychiatr. Dis. Treat. — 2016. — Vol. 12. — P. 1435-1444.
6. Hariz M.I., Blomstedt P., Zrinzo L. Deep brain stimulation between 1947 and 1987: the untold story // Neurosurg. Focus. — 2010. — Vol. 29(2). — E1.
7. Combined (thalamotomy and stimulation) stereotactic surgery of the VIM thalamic nucleus for bilateral Parkinson disease / A.L. Benabid, P. Pollak, A. Louveau [et al.] // Appl. Neurophysiol. — 1987. — Vol. 50 (1–6). — P. 344-346.
8. Kocabicak E., Temel Y. Deep brain stimulation of the subthalamic nucleus in Parkinson’s disease: surgical technique, tips, tricks and complications // Clin. Neurol. Neurosurg. — 2013. — Vol. 15. — P. 2318-2323.
9. Deep brain stimulation plus best medical therapy versus best medical therapy alone for advanced Parkinson’s disease (PD SURG trial): a randomised, open-label trial / A. Williams, S. Gill, T. Varma [et al.] // Lancet Neurol. — 2010. — Vol. 9(6). — P. 581-591.
10. Bilateral deep brain stimulation vs best medical therapy for patients with advanced Parkinson disease: a randomized controlled trial / F.M. Weaver, K. Follett, M. Stern [et al.] // JAMA. — 2009. — Vol. 1. — P. 63-73.
11. Sharma A., Szeto K., Desilets A.R. Efficacy and Safety of Deep Brain Stimulation as an Adjunct to Pharmacotherapy for the Treatment of Parkinson Disease // Ann. Pharmacother. — 2012. — P. 10-11.
12. Chronic deep brain stimulation of the subthalamic nucleus for Parkinson’s disease: effects on cognition, mood, anxiety and personality traits / L. Castelli, P. Perozzo, M. Zibetti [et al.] // Eur. Neurol. — 2006. — Vol. 55(3). — P. 136-144.
13. Ten-year outcome of sub- thalamic stimulation in Parkinson disease: a blinded evaluation / A. Castrioto, A.M. Lozano, Y.Y. Poon [et al.] // Arch. Neurol. — 2011. — Vol. 68(12). — P. 1550-1556.
14. Burn D.J., Tröster A.I. Neuropsychiatric Complications of Medical and Surgical Therapies for Parkinson`s Disease // Journal of Geriatric Psychiatry and Neurology. — Vol. 17(3). — P. 172-180.
15. Sinha N., Manohar S., Husain M. Impulsivity and apathy in Parkinson’s disease // J. Neuro-psychol. — 2013. — Vol. 7(2). — P. 255-283.
16. Impulse control and related disorders in Parkinson’s di–sease patients treated with bilateral subthalamic nucleus stimulation: a review Parkinsonism / M. Broen, A. Duits, V. Visser-Vandewalle [et al.] // Relat. Disord. — 2011. — Vol. 17(6). — P. 413-417.
17. Мінцер О.П. Оброблення клінічних і експериментальних даних у медицині: навч. посібник / О.П. Мінцер, Ю.В. Вороненко, В.В. Власов. — К.: Вища школа, 2003. — 350 с.
18. Fang J.Y., Tolleson C. The role of deep brain stimulation in Parkinson’s disease: an overview and update on new developments // Neuropsychiatr. Dis. Treat. — 2017. — Vol. 7(13). — P. 723-732.
19. Multicentre European study of thalamic stimulation for parkinsonian tremor: a 6 year follow-up / M.I. Hariz, P. Krack, F. Alesch [et al.] // J. Neurol. Neurosurg. Psychiatry. — 2008. — Vol. 79(6). — P. 694-910.
20. Quality of life in Parkinson’s disease patients with motor fluctuations and dyskinesias in European countries / M.C. Hechtner, T. Vogt, Y. Zöllner [et al.] // Parkinsonism Relat. Disord. — 2014. — Vol. 20(9). — P. 969-974.

/43-1.jpg)
/44-1.jpg)
/44-2.jpg)
/45-1.jpg)