Введение
В связи с военным конфликтом на Востоке Украины в течение последних 3 лет, внедрением новых видов вооружения, ведением гибридной войны возникает острая проблема сохранения не только физического, но и психического здоровья граждан, причастных к этим событиям [1]. К примеру, только на протяжении 2015 г. психоневрологическими диспансерами Украины взяты под наблюдение 3522 человека, у которых впервые в жизни установлен диагноз «расстройства психики из-за реакции на тяжелый стресс и нарушения адаптации» (F43), из них 941 военнослужащий — участник АТО [2]. К большому сожалению, вследствие недостаточности финансирования расстройства психики и поведения плохо выявляются, контролируются и курируются психиатрами и психологами, что приводит к самым тяжелым последствиям. Боевая психическая травма, базируясь на патоморфологических и гуморальных изменениях в структурах мозга, ведет к формированию «личностной дисгармонии и готовности к психопатологическому синдромообразованию» [3]. По данным официальной статистики ЕРДР Украины по состоянию на 01.04.2018, за время проведения АТО по меньшей мере 554 военных совершили самоубийство [4]. Составляющей боевого стресса является совокупность вегетативно окрашенных отрицательных переживаний (эмоциональный стресс) с физическим перенапряжением организма под внешним влиянием (физиологический стресс) в сочетании с общим утомлением, связанным с длительной работой без отдыха [5]. Таким образом, у трудоспособных лиц — участников АТО, перенесших ЧМТ, возможно возникновение совокупности патоморфологических, нейрофизиологических, психовегетативных, эмоционально-личностных, когнитивных изменений, которые в последующем формируют травматическую болезнь мозга (ТБМ).
В отдаленном периоде травмы характерно преобладание психовегетативной и эмоционально-личностной симптоматики над классическими неврологическими очаговыми и общемозговыми симптомами. Очаговая симптоматика чаще регрессирует, оставляя постоянной вегетососудистую дистонию с ведущим цефалгическим синдромом, а также выраженные психоэмоциональные расстройства. Важна не только тяжесть травматического повреждения с нарушением мозгового гомеостаза, но и наличие психовегетативных нарушений как в преморбиде, так и в момент получения травмы. Люди с вегетативной лабильностью часто обладают тревожной мнительностью и в стрессовом состоянии демонстрируют более ярко выраженные вегетативные проявления, что необходимо учитывать как фактор риска при медикаментозной коррекции. По данным литературы, выявлена закономерность, что у ветеранов войн по истечении нескольких лет после участия в боевых действиях сохраняется высокий уровень заболеваемости хроническими соматическими болезнями, часто выявляется множественная патология внутренних органов. Большинство авторов отмечают четкую взаимосвязь возникновения психоневротической симптоматики с ухудшением соматического здоровья, а обострение соматической патологии углубляет психические расстройства [6, 7]. Поэтому и подход к лечению таких пациентов обязательно должен быть комплексным, учитывающим воздействие на вегетативную, соматическую, психическую сферы организма.
Полиморфизм и стойкость клинических проявлений последствий ЧМТ могут быть связаны с недостаточной эффективностью ранних терапевтических мероприятий. Обнаружена четкая зависимость между остаточными функциональными и органическими последствиями ЧМТ и адекватностью лечебных мероприятий острого и промежуточного периода. Поэтому пострадавшие даже с легкими формами ЧМТ должны рассматриваться прежде всего как пациенты с метаболическими нарушениями, которые самостоятельно восстанавливаются только в 1/3 случаев. В патогенезе решающее значение имеет кислородное голодание мозга. При травматическом поражении мозга происходит нарушение мозгового гомеостаза с развитием психовегетативных расстройств, что изменяет адаптационные возможности организма. Причем оно связано не с нарушением поступления кислорода, а с нарушением его использования: угнетением окислительных процессов и нарушением газообмена.
Исходя из всех изложенных фактов, даже с учетом большого количества используемых медикаментозных и немедикаментозных способов влияния на различные звенья патогенеза ТБМ в остром и особенно в хроническом периодах, воздействие на полиморфизм клинических проявлений является сложной задачей. Требуются дальнейшее многостороннее изучение отдельных звеньев патогенеза ТБМ и углубленные многосторонние научные исследования для изучения клинической картины травматического повреждения мозга у людей трудоспособного возраста в стрессовой ситуации, а также поиск методов дифференцированной симптоматической терапии и профилактики в остром, промежуточном и отдаленном периодах ТБМ с целью снижения случаев инвалидизации и улучшения качества жизни пациентов.
Несмотря на большое количество работ, посвящен-ных значению терапии вегетативных нарушений в разные периоды травматической болезни головного мозга, не существует четко выработанных методик лечения для представления механизма воздействия на гипоталамо-гипофизарные структуры с вегетостабилизирующей целью.
Именно поэтому в своей практике мы применили методику эндоназального электрофореза препаратом Мексиприм («Штада Арцнаймиттель АГ», Германия) — антигипоксанта прямого действия, который метаболизирует энергетические потоки сукцинатом и восстанавливает энергетическую эффективность работы клеток головного мозга [8].
Препарат Мексиприм обладает мультимодальным эффектом, сочетающим антиоксидантное и антигипоксическое действие, оказывает анксиолитический и вегетостабилизирующий эффект. Определяющим фактором для использования Мексиприма явилось то, что препарат воздействует на разные рецепторные системы мозга, повышая связь транспортных белков с ГАМКергическими, бензодиазепиновыми и дофаминовыми рецепторами, что предполагает анксиолитическое и противосудорожное действие, особенно в комбинации с противоэпилептическими препаратами.
По методу эндоназального электрофореза под воздействием электрического тока препарат проникает через слизистую оболочку носа, передвигаясь периневрально непосредственно по лимфатическим путям в ликвор субарахноидального пространства, и влияет прежде всего на капиллярную систему гипоталамуса и других надсегментарных структур вегетативной нервной системы [9]. Такой способ введения обеспечивает выраженное и продолжительное нейрофизиологическое действие Мексиприма за счет создания в структурах мозга своеобразного депо препарата.
Мы считаем важным, что препарат вводится по наиболее короткому пути до максимально необходимой точки приложения. Благодаря отсутствию стабилизаторов в составе раствора для инъекций Мексиприм он является малотоксичным и имеет крайне низкий риск развития побочных реакций и неприятных ощущений у пациента. Важным фактором является его совместимость с психотропными препаратами, транквилизаторами и противосудорожными средствами [10].
Материалы и методы
С учетом описанных целей было проведено комплексное клинико-нейрофизиологическое обследование 50 бывших участников АТО трудоспособного возраста, пострадавших от минно-взрывного поражения, с разной степенью повреждения головного мозга и различной давностью черепно-мозговой травмы. Всем обследуемым проводилось клиническое и клинико-нейрофизиологическое обследование, а также экспериментально-психологическое обследование в виде тестирования и анкетирования. Клиническое исследование применения препарата Мексиприм методом эндоназального электрофореза проводилось с 01.01.18 по 01.07.18 г. на базе неврологического отделения Николаевской областной клинической больницы, использовались методики и разработки кафедры неврологии Одесского национального медицинского университета и опросники к Унифицированному клиническому протоколу первичной, вторичной, третичной медицинской помощи «Депрессия». В исследование были включены пациенты (n = 50) с подтвержденным медицинской документацией минно-взрывным (контузионно-коммоционным) поражением головного мозга, давностью ЧМТ от 18 до 35 месяцев и перманентными симптомами вегетососудистой дистонии в структуре психовегетативного синдрома (соматоформной дисфункции вегетативной нервной системы, шифр МКБ 10 — F45.3). Критерии исключения: высокий уровень АД (> 160/100 мм рт.ст.), онкологические и аутоиммунные заболевания, психические заболевания, тяжелые и декомпенсированные заболевания печени, почек и сердечно-сосудистой системы, туберкулез любой локализации в активной фазе и в анамнезе, а также индивидуальная непереносимость препарата и электролечения.
Методология и дизайн исследования: открытое клиническое проспективное контролируемое исследование.
На первом визите после включения пациента в исследование происходило заполнение опросников, проведение неврологического исследования, определение состояния ВНС и регистрация ЭЭГ.
Потом, после проведения 10-й процедуры эндоназального электрофореза препаратом Мексиприм, все вышеперечисленные исследования были проведены повторно и затем оценены.
Из 50 пациентов только 10 (20 %) получали сопутствующее лечение анксиолитиками (бензодиазепины), антидепрессантами из группы СИОЗ (4 человека), а 1 пациент получал противосудорожную терапию карбамазепином в дозе 600 мг/сутки.
Динамическое исследование ВНС проводилось для определения функционального состояния периферических вегетативных образований и заключалось в определении исходного вегетативного тонуса (ВТ), вегетативной реактивности, а также исследовании функции надсегментарных отделов ВНС, обеспечивающих адаптивное поведение.
Изучение общего ВТ проводилось с помощью таблицы «24 стигмы», созданной на кафедре нейрохирургии и неврологии Одесского национального медицинского университета для экспресс-диагностики вегетативного тонуса. По ней можно судить об исходном вегетативном тонусе при различных функциональных состояниях.
Исходный тонус характеризовался преимущественно парасимпатической направленностью у 24 пациентов, эйтоников было 7 человек, у 19 человек преобладала симпатическая направленность ВНС. Повышенная вегетативная реактивность по симпатическому типу наблюдалась у 17 пациентов (33 %), а по парасимпатическому типу — у 33 человек (66 %) (р < 0,05).
Методика эндоназального электрофореза. В качестве источника для эндоназального электрофореза с использованием 5% раствора Мексиприм (в 1 мл — 50 мг этилметилгидроксипиридина сукцината) был применен аппарат для гальванизации «Поток-1». Техника следующая: в обе ноздри пациента вводятся марлевые турунды, пропитанные 5% раствором Мексиприма, свободные концы турунды укладывают поверх клеенки на верхней губе, на них помещается токопроводящая пластина размером 1,5 × 2,5–3 см, соединенная с клеммой аппарата, а нижний край клеммы загибают на токопроводящую пластину. Далее все это фиксируется бинтом. Второй электрод площадью 80–100 см2 располагают на задней поверхности шеи. Препарат вводится с анода. Каждый пациент получил 10 сеансов терапии (табл. 1).
После проведенного лечения повышенная вегетативная реактивность по симпатическому типу определилась у 18 пациентов (36 %), по парасимпатическому типу — у 32 (66 %) исследуемых.
Исследование вегетативного обеспечения деятельности несет важную информацию о компенсаторных возможностях надсегментарных структур ВНС в разные периоды после перенесенной травмы, так как вегетативные симптомы сопровождают любой вид активной деятельности. Методика определения вегетативного обеспечения деятельности (ВОД) состояла в пробе с 20 приседаниями за 30 секунд с последующей пульсометрией и измерением АД. Избыточное ВОД исходно определилось у 24 (48 %), недостаточное — у 26 (52 %) пациентов. После курса электрофореза препаратом Мексиприм избыточное ВОД определилось у 32 (64 %) пациентов, что на 16 % выше исходного уровня.
Для выявления субъективных признаков вегетативной дисфункции использовался опросник для выявления признаков вегетативных изменений [11], который показал наличие вегетативной дисфункции у 100 % обследуемых. Вегетативная лабильность необходима для расширения диапазона физиологических сдвигов в рамках гомеостаза, а присоединение психовегетативного синдрома, как правило, ведет к патологическим изменениям и развитию выраженных психовегетативных расстройств (тревожный и депрессивный синдромы).
Исследование субъективных признаков вегетативной дисфункции проводилось с помощью следующих анкет: опросника пациента о состоянии здоровья (PHQ-9), русскоязычной версии Госпитальной шкалы тревоги и депрессии (Hospital Anxiety and Depression, или HADS), опросника для скрининга посттравматического стрессового расстройства. Шкала самооценки депрессии из девяти пунктов (PHQ-9) была использована для выявления депрессивного расстройства.
Результаты и обсуждение
Изначально отсутствие депрессивного синдрома отметили у себя 5 (10 %) человек, легкую (субклиническую) депрессию — 7 (14 %), умеренную депрессию — 18 (36 %), среднетяжелую депрессию — 16 (32 %), тяжелую депрессию — 4 (8 %) пациента. После проведения лечения препаратом Мексиприм были отмечены следующие изменения: количество пациентов с тяжелыми проявлениями депрессии уменьшилось до 4 (8 %), депрессивный синдром с клиническими проявлениями средней тяжести остался лишь у 6 (12 %) человек. При этом 9 (18 %) пациентов улучшили свой психоэмоциональный фон до легких клинических проявлений, а 1 пациент — до субклинических проявлений (χ2 = 19,8; df = 4; p = 0,0005) (табл. 2, рис. 1).
/51-1.jpg)
/51-2.jpg)
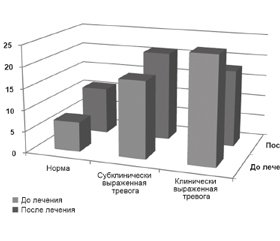
С помощью Госпитальной шкалы тревоги и депрессии (HADS) была осуществлена оценка состояния пациентов по шкалам тревоги (Т) и депрессии (Д). В нашем исследовании изначальный клинически выраженный тревожный синдром определился у 25 (50 %) обследуемых, субклинически выраженный — у 18 (36 %), а у 7 пациентов отсутствовали тревожные расстройства (табл. 3). Клинически выраженная депрессия была определена у 14 (28 %), а субклиническая — у 13 (26 %) человек. После проведенного курса лечения с использованием электрофореза препаратом Мексиприм клинически выраженная тревога осталась только у 18 пациентов (36 %), у 7 пациентов (14 %) интенсивность тревоги уменьшилась до субклинических проявлений (всего 21 пациент (42 %)), у 4 (8 %) пациентов тревожные проявления нормализовались, вариант нормы после лечения был определен у 11 (22 %) человек. Депрессивный синдром после лечения уменьшился у 6 (12 %) пациентов до субклиничной депрессии, у 5 (10 %) человек — до варианта нормы. Динамика наблюдения отражена в рис. 2 и 3.
/52-1.jpg)
/52-2.jpg)
Согласно данным шкалы HADS, после лечения у 11 (22 %) человек уменьшился тревожный синдром, у 11 (22 %) уменьшилась степень интенсивности депрессивного синдрома (χ2 = 12,4; df = 4; p = 0,005).
В связи с наличием характерных признаков ПТСР (наличие травматического события, повторное переживание симптоматики, избегающее поведение, повышенная раздражительность) использовался опросник для скрининга посттравматического стрессового расстройства. До лечения у 32 (64 %) человек были явные признаки ПТСР, а после проведенного лечения убедительные признаки ПТСР наблюдались лишь у 28 участников АТО, т.е. у пациентов наблюдались положительные изменения в стрессоустойчивости (χ2 = 4,8; df = 4; p = 0,03). После проведенного лечения все пациенты отмечали субъективное улучшение состояния в виде улучшения памяти, внимания, работоспособности. Улучшился эмоциональный фон в виде уменьшения апатии, повышения интереса к жизни.
Электрофизиологическое исследование (ЭЭГ) всех пациентов (n = 50) с визуальной оценкой динамики было выполнено на 16-канальном электроэнцефалографе медицинского комплекса «Нейроком» (разработанном «ХАИ-медика», г. Харьков, 2010 г.). Анализу подвергались не менее 10 мин фоновой записи ЭЭГ. Исследование проводили по стандартной методике как в покое, так и с функциональными нагрузками (гипервентиляция, ритмическая фотостимуляция, проба с открыванием глаз). Гипервентиляция с параллельной регистрацией ЭЭГ осуществлялась не менее 5 мин и 1 мин записи после окончания гипервентиляции. По показаниям проводилась фотофоностимуляция. Проведение электроэнцефалографии показало изменения у всех 50 исследуемых. В первую очередь были отмечены общемозговые диффузные изменения биоритмики, дезорганизация и гиперсинхронизация основного ритма со сглаженностью зональных различий, появлением высокоамплитудных вспышек α-ритма с амплитудой 70–80 мкВ и частотой 8–11 Гц в переднелобных и центральных отделах. Гиперсинхронизация основного ритма связана с усилением влияния гипоталамических образований и таламуса, а также тормозного центра Моруцци в каудальном отделе мозга, что говорит о заинтересованности надсегментарных отделов ВНС. Этот гиперсинхронный тип ЭЭГ (приблизительно II тип по Е.А. Жирмунской) встречался у большинства (40 (80 %)) исследуемых пациентов. В 8 случаях (16 %) регистрировалась «плоская» ЭЭГ, низкоамплитудная, с наличием α-, β-, θ-волн и практически с отсутствием зональных различий, что соответствовало десинхронной ЭЭГ (III тип по Е.А. Жирмунской). У 2 (4 %) исследуемых опре-делилась дезориентированная нерегулярная ЭЭГ (соответствующая IV типу ЭЭГ по Е.А. Жирмунской) с высокоамплитудным плохо модулированным α-ритмом и редким появлением усиленной β-активности в затылочной области, со вспышками билатеральных синхронных высокоамплитудных θ-, δ-колебаний, вспышками «острая — медленная волна», что говорит о заинтересованности глубинных лимбико-ретикулярных структур мозга.
У 15 (30 %) пациентов во время первого визита были обнаружены элементы эпилептиформности «острая — медленная волна», «пик-волна — полипик-волна» с тенденцией к генерализации, что говорит о снижении порога судорожной готовности при отсутствии клинически судорожного синдрома.
После проведенного лечения у данных пациентов была отмечена нормализация биоритмики мозга в виде увеличения влияния α-ритма в затылочных областях, уменьшения вспышек высокоамплитудных колебаний, улучшения зональности ритмов, а также снижения порога судорожной готовности (см. ЭЭГ пациентов до и после лечения) (рис. 4–7).
Выводы
Анализ результатов применения препарата Мексиприм методом эндоназального электрофореза показал его эффективность в периоде реабилитации пациентов с перенесенным травматическим повреждением мозга после ЧМТ, так как была отмечена нормализация вегетативных функций у больных в виде повышения адаптационных возможностей организма на 16 % (p < 0,05).
Тенденция к нормализации психовегетативных функций проявилась в виде достоверного уменьшения депрессивного синдрома у 20 % пациентов и регресси-рования тревожного синдрома у 22 % исследуемых.
Противосудорожное действие препарата Мексиприм на фоне его мембранопротекторного эффекта подтвердилось в виде нормализации биоритмики мозга, усиления влияния α-ритма, преимущественно в затылочных областях, уменьшения элементов эпилептиформности и тенденций к генерализации. После проведенного лечения судорожная готовность уменьшилась в 2 раза (p < 0,05).
Достаточно быстрый эффект действия препарата объясняется особенностью введения через слизистую оболочку по лимфатическим путям в ликвор субарахноидального пространства с непосредственным влиянием на гипоталамус и другие надсегментарные структуры вегетативной нервной системы, где возможно образование депо препарата. Лечение с применением методики эндоназального электрофореза не вызвало нежелательных (в том числе аллергических) реакций у пациентов. Отказов от лечения зарегистрировано не было.
С учетом вышесказанного можно рекомендовать методику эндоназального введения препарата Мексиприм как эффективный неинвазивный способ лечения психовегетативного синдрома в период реабилитации после перенесенного травматического повреждения мозга.
Конфликт интересов. Не заявлен.

/50-1.jpg)
/51-1.jpg)
/51-2.jpg)
/52-1.jpg)
/52-2.jpg)
/53-1.jpg)