Резюме
Актуальність. Легка паркінсонічна симптоматика (ЛПС) (mild parkinsonian sіgns) може бути проявом нейродегенеративного процесу, результатом дисциркуляторної енцефалопатії або проявлятися як наслідок цих двох процесів, що перебігають паралельно та посилюють один одного. Мета дослідження: виявити, чи існує взаємозв’язок між зміною магнітної сприйнятливості підкіркових структур головного мозку та наявністю легкої паркінсонічної симптоматики в пацієнтів із хронічною ішeмією мозку. Матеріали та методи. Для дослідження були відібрані 82 пацієнти, у яких було діагностовано дисциркуляторну енцефалопатію та виключено нейродегенеративні захворювання. Усім пацієнтам було виконано магнітно-резонансну томографію (МРТ) у послідовностях T1-WI, T2-WI, TIRM, DWI, SWI. Наявність MPS діагностувалася за допомогою третьої секції шкали UPDRS. Результати. За допомогою U-критерію Манна — Уїтні було виявлено, що пацієнти з ЛПС мали вірогідно вищі рівні магнітної сприйнятливості підкіркових структур і, як наслідок, більшу кількість гіпоінтенсивних вокселів на МРТ-зображеннях у SWI-послідовності. Програмне забезпечення 3D Slicer використовувалося для сегментації підкіркових структур за рівнями інтенсивності сигналу. У пацієнтів із ЛПС було виявлено більшу кількість гіпоінтенсивних вокселів у блідих кулях, шкаралупі та чорних субстанціях обох півкуль. Після врегулювання за віком та балом шкали Fazekas було виявлено, що ЛПС найбільше асоційована із збільшенням кількості вокселів вираженої гіпоінтенсивності (SI < 75) у правій блідій кулі (OR 1,29, CI 1,08–1,55). Висновки. Підвищення рівнів гіпоінтенсивності підкіркових структур, що виявляються на SWI МРТ-знімках, можуть бути асоційовані з ЛПС у пацієнтів із хворобою дрібних судин головного мозку.
Актуальность. Легкая паркинсоническая симптоматика (ЛПС) (mild parkinsonian sіgns) может быть проявлением нейродегенеративных заболеваний, результатом дисциркуляторной энцефалопатии или проявляться как следствие этих двух параллельно протекающих и взаимоусиливающих процессов. Цель исследования: выявить, существует ли взаимосвязь между изменением магнитной восприимчивости подкорковых структур головного мозга и наличием легкой паркинсонической симптоматики у пациентов с хронической ишемией мозга. Материалы и методы. Для исследования были отобраны 82 пациента, у которых была диагностирована дисциркуляторная энцефалопатия и исключены нейродегенеративные заболевания. Всем пациентам выполнена магнитно-резонансная томография (МРТ) в последовательностях T1-WI, T2-WI, TIRM, DWI, SWI. Наличие MPS диагностировалось с помощью третьей секции шкалы UPDRS. Результаты. С помощью U-критерия Манна — Уитни было обнаружено, что пациенты с ЛПС имели достоверно более высокие уровни магнитной восприимчивости подкорковых структур и, как следствие, большее количество гипоинтенсивных вокселей на МРТ-изображениях в SWI-последовательности. Программное обеспечение 3D Slicer использовалось для сегментации подкорковых структур по уровням интенсивности сигнала. У пациентов с ЛПС было выявлено большее количество гипоинтенсивных вокселей в бледных шарах, скорлупах и черных субстанциях обоих полушарий. После урегулирования по возрасту и баллу шкалы Fazekas было обнаружено, что ЛПС в наибольшей степени ассоциирована с увеличением количества вокселей выраженной гипоинтенсивности (SI < 75) в правом бледном шаре (OR 1,29, CI 1,08–1,55). Выводы. Повышение уровня гипоинтенсивности подкорковых структур, выявляемых на SWI МРТ-снимках, может быть ассоциировано с ЛПС у пациентов с болезнью мелких сосудов головного мозга.
Background. Mild parkinsonian signs (MPS) can occur as a result of neurodegenerative diseases, cerebral small vessel disease (SVD) or manifest as a consequence of these two processes that occur simultaneously. Objective of this study was to identify whether there is a correlation between changes in magnetic susceptibility of subcortical brain structures and the presence of mild parkinsonian signs in patients with SVD. Materials and methods. Eighty two elderly participants with SVD and without known neurodegenerative diseases were included in this analysis and underwent magnetic resonance imaging: T1-weighted imaging, T2-weighted imaging, turbo inversion recovery magnitude, diffusion-weighted imaging, susceptibility weighted
imaging (SWI) sequences. Presence of MPS was detected with the help of the third section of the Unified Parkinson’s Disease Rating Scale. Results. Using Mann-Whitney U test it was found that patients with MPS had statistically higher subcortical structure susceptibility rates and thus they had higher counts of hypointense voxels on the SWI. 3D Slicer Software was used to perform subcortical structure segmentation according to the signal intensity rates. In patients with MPS, more hypointense voxels were found in globus pallidus, putamen and substantia nigra of both hemispheres. After adjusting for age and the Fazekas score, MPS were most associated with an increased number of severe hypointensity voxels (signal intensity < 75) in right globus pallidus: odds ratio 1.29, confidence interval 1.08–1.55. Conclusions. Increased hypointensity of subcortical structures detected using SWI may be associated with MPS in patients with cerebral small vessel disease.
Вступ
Гіпертонічна хвороба та церебральний атеросклероз є одними з найчастіших причин розвитку хвороби дрібних судин (ХДС) головного мозку, що, зі свого боку, часто призводить до когнітивного зниження, порушень ходи та рівноваги, а також є фактором ризику для розвитку інсульту та інфаркту [1, 2].
Серед нейровізуалізаційних рис, характерних для ХДС, що зумовлена гіпертонією та церебральним атеросклерозом, найбільш досліджуваними є лакунарні інфаркти (ЛІ) та гіперінтенсивність білої речовини. Наявність перерахованих біомаркерів ХДС доведено корелює з імовірністю появи у хворого легкої паркінсонічної симптоматики (ЛПС) (mild parkinsonian signs — MPS) [3, 4].
У науковій літературі останнього часу використовується поняття ЛПС, що вважається більшістю авторів найбільш доцільним, оскільки характеризує природу явища i водночас не вказує на певну анатомічну структуру або патофізіологічний процес, що лежить в основі, оскільки вони є вірогідно невідомими [5].
Приблизно в 15–40 % популяції людей похилого віку розвивається ЛПС, що може бути асоційовано зі скороченням тривалості та якості життя [5].
ЛПС, що виявляється у хворих із ХДС, найчастіше проявляється симетричною брадикінезією, що виражена переважно в нижніх кінцівках, порушеннями ходи; тремор спокою спостерігається рідко, реакція на терапію препаратом леводопи також нижча, ніж у пацієнтів із хворобою Паркінсона [5]. Також ЛПС частіше асоційована з псевдобульбарними та мозочковими порушеннями, когнітивним зниженням [6].
Механізм розвитку ЛПС гетерогенний, остаточно не з’ясований i в даний час вважається результатом одночасного впливу вікових порушень дофамінергічної системи та судинної патології. Вплив останньої потенційно може бути зменшеним [3].
Найбільш статистично значущим ризик виникнення ЛПС виявляється у хворих віком понад 73 роки [3]. У цьому контексті поширеною є гіпотеза про те, що ділянки, які знаходяться в стані субклінічної гіпоперфузії, є більш вразливими для нейродегенеративного процесу [7, 8].
Суттєву діагностичну цінність при дослідженні патології, що супроводжується руховими порушеннями, має магнітно-резонансна томографія (МРТ), у режимі зображень, зважених за магнітною сприйнятливістю (SWI). В основі методу лежить виявлення залізовмісних молекул у тканині головного мозку, що є доведеним маркером нейродегенерації [9, 10]. При цьому визначається ступінь гіпоінтенсивності вибраної ділянки, значення вимірюється у SWI intensity units (одиницях SWI-інтенсивності), де 0 відповідає інтенсивності вен Галена, 200 — інтенсивністі цереброспінальної рідини [11].
Дослідження останніх років вказують на потенційно великі можливості даного методу як інструменту диференціальної діагностики захворювань, що супроводжуються зниженням інтелекту та руховими порушеннями. Дослідження зв’язку між SWI-інтенсивністю підкіркових ядер та ЛПС у пацієнтів із ХДС не наведені у вітчизняних та зарубіжних наукових дослідженнях.
Мета дослідження: виявлення зв’язку між SWI-інтенсивністю підкіркових ядер та ЛПС у групі пацієнтів із ХДС.
Матеріали та методи
Для дослідження були відібрані хворі, які перебували на лікуванні в КЛ «Феофанія» (м. Київ). Були відібрані 82 пацієнти. Усі пацієнти пройшли загальноклінічне обстеження з оцінкою неврологічного статусу та анамнезом захворювання. Усі пацієнти були правшами.
Критерії включення: 1) вік 65–90 років; 2) наявність лейкоареозу будь-якого ступеня вираженості та/або наявність одного лакунарного інфаркту або більше при нейровізуалізації; 3) наявність гострих (транзиторні ішемічні атаки в анамнезі) або підгострих (когнітивне зниження, ЛПС) ознак хвороби дрібних судин. Первинними критеріями були нейровізуалізаційні риси хвороби дрібних судин, оскільки клінічні прояви ХДС є дуже гетерогенними та слабковираженими на момент початку захворювання [12].
Критерії виключення: 1) клінічна деменція; 2) клінічний паркінсонізм; 3) внутрішньочерепний крововилив в анамнезі; 4) об’ємне новоутворення головного мозку; 5) діагностоване психіатричне захворювання, що впливає на когнітивну сферу; 6) використання препаратів, що інгібують ацетилхолінестеразу, використання препаратів леводопи, використання нейролептичних препаратів; 8) ураження білої речовини головного мозку, що не пов’язано з ХДС або діагностоване нейродегенеративне захворювання; 9) виражене зниження зору та слуху; 10) протипоказання до проведення МРТ-дослідження; 11) порушення ходи та рівноваги, що не пов’язані з ХДС (психогенні порушення ходи та рівноваги, гострі захворювання опорно-рухового апарату).
Пацієнти були розподілені на дві групи залежно від наявності ЛПС. ЛПС визначалася за допомогою моторної секції шкали UPDRSm. Методика оцінки була аналогічною до тих, що використовувалися в подібних дослідженнях останнього часу з високим рейтингом цитування [3, 13, 14].
ЛПС діагностувалися за наявності в пацієнта одного з таких критеріїв: 1) два або більше пункти шкали UPDRSm з оцінкою в один бал; 2) один пункт з оцінкою 2 або більше бали. Пацієнти, які мали клінічний паркінсонізм, виключалися; паркінсонізм визначався за наявності в пацієнта двох або більше пунктів з оцінкою 2 або більше бали щонайменше у двох різних категоріях (брадикінезія, тремор, ригідність, порушення ходи/рівноваги).
МРТ-знімки були отримані за допомогою сканера 1.5T Avanto (Siemens Medical Solutions, Ерланген, Німеччина). Бал за шкалою Fazekas визначався за T2-зваженими зображеннями. Для одержання SWI знімків використовувались такі парметри: TE/TR = 40/50 мс з кутом нахилу 25°, розмір вокселя — 0,5 × 0,5 × 2 мм, поле зору — 20,1 × 23,0 см.
За допомогою програми 3D Slicer 4.7.0-2017-06-06 із використанням плагінів segment editor та segment statistics проводилися вибір ділянки інтересу (ОІ) та оцінка рівня інтенсивності вибраних структур: права/ліва шкаралупа (PU), права/ліва бліда куля (GP), права/ліва чорна субстанція (SN), праве/ліве червоне ядро (NR). Під ча аналізу визначалася кількість вокселів у зазначених структурах, що мали низький рівень інтенсивності сигналу (SI). Градуювання гіпоінтенсивних ділянок прводилося за Gupta et al.: виражена гіпоінтенсивність (SI: 0–75); помірна гіпоінтенсивність (SI: 75–150); легка гіпоінтенсивність (SI: 150–200) [11].
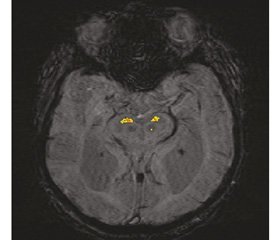
При аналізі знімків оминався край досліджуваної структури, для оцінки вибиралися зрізи з найбільш анатомічно чіткими контурами та з найбільшим ступенем гіпоінтенсивності [15–17] (рис. 1).
Статистична обробка даних. Для перевірки нормальності розподілу даних використовувався W-тест Шапіро — Уїлка. Для встановлення міжгрупових відмінностей пацієнтів із ЛПС та без ЛПС використовувався U-тест Манна — Уїтні для даних, що мали ненормальний розподіл, та двовибірковий t-тест для нормально розподілених даних. Ненормально розподілені дані були подані у вигляді медіани та міжквартильного інтервалу (Mdn; Iqr), нормально розподілені — у вигляді середнього значення та стандартного квадратичного відхилення (Mean ± SD). Моделі логістичної регресії скориговані за віком (модель А) та за віком і балом за шкалою Fazekas (модель Б) використовувались для визначення зв’язку між ЛПС та кількістю вокселів заданої гіпоінтенсивності в досліджуваних структурах.
Статистична обробка даних виконувалась із використанням програмного забезпечення SPSS 23.0 (IBM, Armonk, Нью-Йорк).
Дане дослідження було схвалено етичною комісією Національної медичної академії післядипломної освіти імені П.Л. Шупика. Письмова інформована згода була отримана від усіх пацієнтів, які брали участь у дослідженні.
Результати
За результатами аналізу групи з ЛПС та без неї не відрізнялися за гендерним складом. Пацієнти з ЛПС були вірогідно старшими та мали більш виражений ступінь атрофії білої речовини за шкалою Fazekas.
Групи в основному відрізнялися за кількістю гіпоінтенсивних вокселів вираженої та помірної гіпоінтенсивності в GP, PU та SN. Різниця у кількості вокселів легкої гіпоінтенсивності спостерігалася лише в правій PU (p = 0,013) та лівій PU (p = 0,029). Найбільш статистично вірогідною була різниця в кількості вокселів вираженої та помірної гіпоінтенсивності GP білатерально (p < 0,001). Високу статистичну вірогідність мали відмінності в кількості вокселів вираженої гіпоінтенсивності правої PU (p = 0,002).
Для SN групи найбільше статистично відрізнялися за кількістю вокселів вираженої гіпоінтенсивності справа (p = 0,001) та за кількістю вокселів помірної гіпоінтенсивності білатерально (p = 0,001) (табл. 1).
/64-1.jpg)
У моделі (A) логістичної регресії після врегулювання за віком шанси виявлення ЛПС були асоційовані із збільшенням кількості вокселів вираженої та помірної гіпоінтенсивності в обох GP та зростали в моделі Б (після врегулювання за віком та балом шкали Fazekas). Найбільше ЛПС була пов’язана зі збільшенням кількості вокселів вираженої гіпоінтенсивності правої GP (OR 1,29, CI 1,08–1,55). Модель мала високу статистичну значимість (p = 0,004) та пояснювала майже 60 % варіабельності в діагностиці ЛПС (R-квадрат Нейджелкерка = 0,570). Зв’язок гіпоінтенсивності PU із ЛПС після врегулювання за віком та балом Fzekas зникав. У моделі Б збільшення кількості вокселів помірної гіпоінтенсивності (але невираженої) у SN білатерально було статистично значимо пов’язане із ЛПС. Найбільш статистично значимий, хоча i суттєво менший, ніж для GP, зв’язок простежувався зі збільшенням кількості вокселів помірної гіпоінтенсивності лівої SN (OR 1,15, CI 1,04–1,27) (p = 0,004) (табл. 2).
Обговорення
Збільшення концентрації залізовмісних молекул у головному мозку характерне як для процесу нормального старіння, так i для низки нейродегенеративних та судинних захворювань головного мозку.
За даними останніх досліджень, особливості відкладання заліза можуть бути використані під час диференціальної діагностики хвороб, що супроводжуються руховими порушеннями та когнітивним зниженням [10, 15, 17]. Проте ізольоване використання таких рис має низьку діагностичну цінність через виражену гетерогенність характеру депонування заліза як у здорових людей, так i у пацієнтів із патологією.
Залізо є важливим нейрометаболітом, i закономірно, що найбільша його кількість визначається в метаболічно високоактивних підкіркових структурах головного мозку. З віком метаболічна активність може знижуватись, що призводить до накопичення надлишку заліза. Водночас не відомо, чи накопичення заліза є одним із пускових механізмів патологічного процесу або ж є його наслідком [18, 19].
На відміну від судинного паркінсонізму легка паркінсонічна симптоматика є набагато менш вираженою за своїми клінічними проявами та зазвичай не призводить до порушення самообслуговування [20].
Згідно з критеріями діагностики судинного паркінсонізму в його розвитку головну роль відіграє судинний фактор. Гострому розвитку клінічної картини судинного паркінсонізму повинно передувати гостре ішемічне ураження чорної субстанції або блідої кулі. При поступовому розвитку клінічної картини судинного паркінсонізму на МРТ-знімках виявляється масивна атрофія білої речовини. У такому разі захворювання проявляється білатерально та супроводжується ранньою появою шаркаючої ходи і раннім когнітивним зниженням [21].
На відміну від судинного паркінсонізму розвиток ЛПС може бути асоційований із набагато менше вираженими ознаками судинного ураження, такими як одиничні та множинні мікроінфаркти кіркової та підкіркової локалізації, до 30 % яких можуть не виявлятися при нейровізуалізації [20].
Також поряд із судинними чинниками у розвитку ЛПС може відігравати роль генетично детермінований дофамінергічний компонент [8].
У даному дослідженні групи пацієнтів із ХДС було виявлено зв’язок між характером депонування заліза в підкіркових ядрах та ЛПС. Оскільки i вік, i ступінь атрофії білої речовини є доведеними факторами ризику для розвитку ЛПС, була проведена оцінка з врегулюванням за віком та балом шкали Fazekas [22]. Найбільший зв’язок ЛПС простежувався з вираженою SWI-гіпоінтенсивністью правої та лівої GP, що, імовірно, пояснюється участю даної структури в контролі підсвідомої рухової активності. Зв’язок із гіпоінтенсивністью SN був значно меншим i виявлявся лише для вокселів помірної гіпоінтенсивності, що можна пояснити тим, що досліджувані пацієнти не мали нейродегенеративних захворювань, а для ХДС не характерне виражене ураження SN.
Висновки
Результати, що були отримані в даному дослідженні, свідчать про можливий зв’язок гіпоінтенсивності підкіркових ядер із легкою паркінсонічною симптоматикою. Збільшення кількості вокселів вираженої (SI < 75) та помірної (75 < SI < 150) гіпоінтенсивності, правої та лівої GP може бути пов’язане з ЛПС у пацієнтів із ХДС. Сила даного зв’язку збільшується після врегулювання моделі за віком та ступенем атрофії білої речовини, визначеної за шкалою Fazekas.
Після врегулювання за віком та ступенем атрофії білої речовини не було виявлено зв’язку між ЛПС та гіпоінтенсивністю PU та NR.
Збільшення кількості вокселів помірної (але невираженої) гіпоінтенсивності правої та лівої SN може бути пов’язане з ЛПС у пацієнтів із ХДС.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Pantoni L. Cerebral small vessel disease: from pathogenesis and clinical characteristics to therapeutic challenges // Lancet Neurol. — 2010. — Vol. 9, №7. — P. 689-701. — doi: 10.1016/S1474-4422(10)70104-6.
2. Свиридова Н.К. Когнітивні та емоційно-особистісні порушення у хворих на гіпертензивну енцефалопатію. Стан мозкового кровообігу при артеріальній гіпертензії (науковый огляд та особисті спостереження) / Н.К. Свиридова // Міжнародний неврологічний журнал. — 2016. — № 1. — С. 123-130.
3. Hatate J., Miwa K., Matsumoto M., Sasaki T., Yagita Y., Sakaguchi M., Kitagawa K., Mochizuki H. Association between cerebral small vessel diseases and mild parkinsonian signs in the elderly with vascular risk factors // Parkinsonism Relat. Di–sord. — 2016. — Vol. 26. — P. 29-34. — doi: 10.1016/j.parkreldis.2016.02.011.
4. de Laat K.F., van Norden A.G., Gons R.A., van Uden I.W., Zwiers M.P., Bloem B.R., van Dijk E.J., de Leeuw F.E. Cerebral white matter lesions and lacunar infarcts contribute to the presence of mild parkinsonian signs // Stroke. — 2012. — Vol. 43, № 10. — P. 2574-2579. — doi: 10.1161/STROKEAHA.112.657130.
5. Louis E.D., Bennett D.A. Mild Parkinsonian signs: An overview of an emerging concept // Mov. Disord. — 2007.— Vol. 22. — P. 1681-1688. — doi:10.1002/mds.21433.
6. Louis E.D., Schupf N., Manly J., Marder K., Tang M.X., Mayeux R. Association between mild parkinsonian signs and mild cognitive impairment in a community // Neurology. — 2005. — Vol. 64, № 7. — P. 1157-61. — doi: 10.1212/01.WNL.0000156157.97411.5E.
7. Van der Holst H.M., van Uden I.W.M., Tuladhar A.M. et al. Cerebral small vessel disease and incident parkinsonism: The RUN DMC study // Neurology. — 2015. — Vol. 85, № 18. — P. 1569-1577. — doi: 10.1212/WNL.0000000000002082.
8. Rosso, Andrea L. et al. Vascular and dopaminergic contributors to mild parkinsonian signs in older adults // Neuro–logy. — 2018. — Vol. 90, № 3. — P. 223-229. — doi: 10.1212/WNL.0000000000004842.
9. Acosta-Cabronero J., Betts M.J., Cardenas-Blanco A., Yang S., Nestor P.J. In vivo MRI mapping of brain iron deposition across the adult lifespan // J. Neurosci. — 2016. — Vol. 36, № 2. — P. 364-374. — doi: 10.1523/JNEUROSCI.1907-15.2016.
10. Liu C., Li C., Yang J., Gui L., Zhao L., Evans A. C. et al. Characterizing brain iron deposition in subcortical ischemic vascular dementia using susceptibility-weighted imaging: an in vivo MR study // Behav. Brain Res. — 2015. — Vol. 288. — P. 33-38. — doi: 10.1016/j.bbr.2015.04.003.
11. Gupta D., Saini J., Kesavadas C. et al. Utility of susceptibi–lity weighted MRI in differentiating Parkinson’s disease and atypical parkinsonian syndromes // Neuroradiology. — 2010. — Vol. 52. — P. 1087-94.
12. van Norden A.G., de Laat K.F., Gons R.A., van Dijk E.J. et al. Causes and consequences of cerebral small vessel disease. The RUN DMC study: a prospective cohort study. Study rationale and protocol // BMC Neurol. — 2011. — Vol. 11, № 1. — P. 29. — doi: 10.1186/1471-2377-11-29.
13. Mahlknecht P., Kiechl S., Stockner H., Willeit J., Gasperi A., Poewe W., Seppi K. Predictors for mild parkinsonian signs: A prospective population-based study // Parkinsonism and Related Disorders. — 2015. — Vol. 21, № 3. — P. 321-324.
14. de Laat K.F., van Norden A.G.W., van Oudheusden L.J.B., van Uden I.W.M., Norris D.G., Zwiers M.P., de Leeuw F.-E. Diffusion tensor imaging and mild parkinsonian signs in cerebral small vessel disease // Neurobiology of Aging. — 2013. — Vol. 33, № 9. — P. 2106-2112.
15. Haller S., Badoud S., Nguyen D. et al. Differentiation between Parkinson disease and other forms of Parkinsonism using support vector machine analysisof susceptibility-weighted imaging (SWI): initial results // Eur. Radiol. — 2013. — Vol. 23, № 1. — P. 12-19. — doi: 10.1007/s00330-012-2579-y.
16. He N., Ling H., Ding B., Huang J., Zhang Y., Zhang Z. et al. Region-specific disturbed iron distribution in early idiopathic Parkinson’s disease measured by quantitative susceptibility mapping // Hum. Brain Mapp. — 2015. — Vol. 36, № 11. — P. 4407-4420. — doi: 10.1002/hbm.22928.
17. Meijer F.J., van Rumund A., Fasen B.A., Titulaer I., Aerts M., Esselink R., Bloem B.R., Verbeek M.M., Goraj B. Susceptibility-Weighted Imaging Improves the Diagnostic Accuracy of 3T Brain MRI in the Work-Up of Parkinsonism // American Journal of Neuroradio–logy. — 2015. — Vol. 36, № 13. — P. 454-460. — doi: 10.3174/ajnr.A4140.
18. Rouault T.A. Iron metabolism in the CNS: implications for neurodegenerative diseases // Nat. Rev. Neurosci. — 2013. — Vol. 14. № 8. — P. 551-64. — doi: 10.1038/nrn3453.
19. Ward, Roberta J. et al. The role of iron in brain ageing and neurodegenerative disorders // The Lancet Neurology. — 2014. — Vol. 13, № 10. — P. 1045-1060. — doi:10.1016/S1474-4422(14)70117-6.
20. Buchman A., Leurgans E.S., Nag S., Bennett D., Schneider J. Cerebrovascular Disease Pathology and Parkinsonian Signs in Old Age // Stroke. — 2011. — Vol. 42, № 11. — P. 3183-9. — doi: 10.1161/STROKEAHA.111.623462.
21. Zijlmans J.C., Daniel S.E., Hughes A.J., Révész T., Lees A.J. Clinicopathological investigation of vascular parkinsonism, includingclinical criteria for diagnosis // Mov. Disord. —2004. — Vol. 19. — P. 630-640.
22. Louis E.D., Brickman A.M., DeCarli C., Small S.A., Mar–der K., Schupf N. et. al. Quantitative brain measurements in community dwelling elderly persons with mild parkinsonian signs // Arch. Neurol. — 2008. — Vol. 65, № 12. — P. 1649-1654. — doi: 10.1001/archneurol.2008.504.

/63-1.jpg)
/64-1.jpg)
/65-1.jpg)