Введение
Проблема исследования боли в нижней части спины (БНЧС) на современном этапе развития медицинской науки не ограничивается рамками узкой специализации и приобретает мультидисциплинарные масштабы, составляя сферу интересов ведущих ученых мирового уровня [1, 2]. БНЧС не является самостоятельной нозологической единицей, а представляет собой комплекс клинических симптомов, обусловленных повреждением костно-мышечной системы и соединительной ткани и локализующихся ниже края реберной дуги и выше ягодичной складки с возможной иррадиацией в ягодицы и нижние конечности. По Международной классификации болезней 10-го пересмотра (МКБ-10) синдрому БНЧС присвоен код М 54.5 [1–3].
По данным разных авторов, БНЧС хотя бы один раз в жизни испытывает 70–90 % населения, из которых только 20–30 % обращаются за медицинской помощью [1, 3, 4]. БНЧС развивается в возрасте 20 лет, пик жалоб приходится на трудоспособный возраст от 30 до 45 лет, а наиболее выраженная боль в спине отмечается у пациентов в возрасте 50 лет и старше, чаще болеют женщины. Следует отметить, что у 12–26 % детей и подростков также наблюдаются симптомы БНЧС [5].
На основании этиопатогенеза и клинических проявлений выделяют неспецифическую (первичную) и специфическую (вторичную) боль. Неспецифическая БНЧС, развивающаяся у 85–90 % пациентов, связана с развитием дегенеративно-дистрофических изменений мышечно-связочного аппарата, межпозвоночного диска, межпозвоночных суставов, невральных структур. Специфическая БНЧС, составляющая 5–10 %, является следствием метастатического поражения позвонков и оболочек спинного мозга, травмы позвонков, инфекционных и воспалительных заболеваний, нарушений метаболизма и гемодинамики, а также может носить характер отраженной боли при патологии внутренних органов [2, 6]. При проведении клинико-неврологической дифференциальной диагностики необходимо прежде всего выявлять признаки специфической БНЧС; для этого была разработана система «красных флажков», представляющая собой комплекс симптомов, указывающих на развитие серьезного, угрожающего жизни пациента состояния, требующего дальнейшего прицельного обследования с привлечением лабораторных и аппаратных средств, а также узкоспециализированных консультантов [6, 7].
К клиническим проявлениям неспецифической БНЧС относятся локальная боль, распространяющаяся в пределах пораженного позвоночно-двигательного сегмента; диффузная (рефлекторная) боль, ирради-ирующая за пределы пораженного позвоночно-двигательного сегмента в смежные области позвоночника или в конечности, и радикулярная (корешковая) боль, которая всегда локализована в зоне иннервации поврежденного нервного корешка и сопровождается корешковыми нарушениями [6–8].
Для выбора адекватной терапевтической тактики важным этапом диагностики является выделение вариантов острого и хронического течения болевого синдрома. По классификации, предложенной Международной ассоциацией по изучению боли, острая боль продолжается до 12 недель, а хроническая боль — свыше 12 недель. Некоторые авторы выделяют период –подострой боли — 6–12 недель [7, 9]. Отмечено, что у 15–20 % пациентов острый болевой синдром приобретает хроническое течение, сопровождающееся частыми рецидивами, оказывающими неблагоприятное влияние на качество жизни пациентов и провоцирующими формирование коморбидных расстройств, таких как тревога, депрессия, нарушение цикла «сон — бодрствование», что, в свою очередь, отягощает клиническое течение основного заболевания [2, 10, 11].
Патогенез хронической боли в настоящее время остается недостаточно изученным, что затрудняет выбор терапевтической тактики. У подавляющего большинства пациентов с хронической БНЧС очень сложно выявить источник болевой импульсации в силу сложности строения и функционирования структур пояснично-крестцовой области. Правильная диагностика возможна только у 15 % пациентов с хроническим скелетно-мышечным болевым синдромом. Клиническая картина хронической БНЧС гетерогенна, как правило, ее составляют различные варианты сочетания ноцицептивной, нейропатической и психогенной характеристики боли. С позиции развиваемой в настоящее время биопсихосоциальной концепции формирования хронической боли это объясняется существованием тесной связи между нарушением взаимодействия сложных многоуровневых ноцицептивных и антиноцицептивных механизмов с изменениями в психологической и социальной сферах человека, где любая составляющая модели может играть доминирующую роль в закреплении и усилении боли [2, 7, 12]. Многообразие клинических проявлений хронической БНЧС определяется удельным весом каждой составляющей боли. Так, психогенная боль связана с нарушением психологического восприятия болевых ощущений. Ноцицептивная боль всегда опосредована прямым повреждением периферических ноцицептивных рецепторов, она коррелирует со степенью повреждения и длительностью воздействия повреждающего фактора. В отличие от нее нейропатическая боль возникает вследствие патологии периферической или центральной соматосенсорной системы на разных уровнях ее организации при отсутствии непосредственного раздражения ноцицепторов [6, 12]. В то же время клинически обосновано, что длительно существующая ноцицептивная боль может приобретать нейропатический характер вследствие стойкой ноцицептивной афферентации, приводящей к развитию дисфункции ноцицептивных систем и центральной сенситизации с формированием вторичного нейропатического компонента боли. Именно наличие нейропатического компонента боли и определяет хронизацию заболевания со всеми вытекающими эмоционально-аффективными и социально-экономическими последствиями [13–15].
На сегодняшний день к препаратам первого выбора для лечения боли с нейропатическим компонентом относится прегабалин [16], проявляющий антиэпилептическое, анальгетическое и анксиолитическое действие. Прегабалин является производным гамма-аминомасляной кислоты (ГАМК) с высокой способностью проникать через гематоэнцефалический барьер. Являясь производным ГАМК, прегабалин не связывается с ГАМКА- и ГАМКВ-рецепторами и не влияет на обратный захват или распад ГАМК [17, 18]. Мишенью прегабалина в периферической и центральной нервной системе является альфа-2-дельта-субъединица потенциалзависимых Ca2+-каналов P- и Q-типов, расположенных в пресинаптической мембране нейронов. Прегабалин подавляет деполяризацию нейронов, вызванную избыточным током ионов Ca2+ в пресинаптические терминали, и тем самым блокирует чрезмерное высвобождение возбуждающих нейромедиаторов (моноаминов, глутамата, субстанции Р) из пресинаптической терминали [19]. Следует отметить способность прегабалина селективно связываться с альфа-2-дельта-субъединицей и модулировать активность Ca2+-каналов только в гипервозбудимых нейронах, что уменьшает возбудимость нервных центров и препятствует развитию процессов иррадиации, дивергенции и реверберации возбуждения в нервной системе [20].
Мы провели исследование эффективности и переносимости препарата Судорега (прегабалин, производитель Dr. Reddy’s, Индия) в составе комплексной терапии у пациентов с хронической болью в нижней части спины.
Цель исследования: изучение эффективности и безопасности терапии БНЧС с препаратом Судорега; изучение в динамике клинико-неврологических характеристик болевого синдрома, показателей коморбидных нарушений (тревоги, депрессии и инсомнии), изменений церебрального электрогенеза, а также оценка качества жизни и социального функционирования пациентов с БНЧС под влиянием терапии с прегабалином (Судорега).
Материалы и методы
Для решения поставленных целей были применены следующие методы: опросник нейропатической боли из 4 вопросов (Douleur neuropathique en 4 questions, DN-4); шкала «Пятибалльная оценка вертеброневрологической симптоматики»; визуальная аналоговая шкала боли (ВАШ) (Visual analog scale, VAS); опросник боли Мак-Гилла (McGill Pain Questionnaire); госпитальная шкала тревоги и депрессии (HADS); шкала оценки качества сна; шкала дневной сонливости Эпворса (Epworth sleepiness scale); анкета Освестри (Oswestry Disability Index, ODI); электроэнцефалография (ЭЭГ).
Регистрация ЭЭГ осуществлялась с помощью компьютерного комплекса «Нейрон-Спектр+» (фирма «Спектромед», Украина) с использованием 20 стандартных монополярных отведений по системе «10–20». Проводили качественный (визуальный) и количественный (спектральный) анализ фоновых ЭЭГ. Оценивались показатели интегральной нормированной (%) спектральной мощности биопотенциалов мозга для левого (s) и правого (d) полушарий в лобных (F), теменных (P), височных (T) и затылочных (O) отведениях для пяти частотных диапазонов, соответствующих дельта- (0,5–3,9 Гц), тета- (4,0–7,9 Гц), альфа- (8,0–12,9 Гц), бета1- (13,0–19,9 Гц) и бета2- (20,0–35,0 Гц) ритмам по четырем безартефактным эпохам длительностью 5,12 секунды каждая.
Эффективность применения препарата Судорега также оценивали по шкале общего клинического впечатления (Clinical Global Impression Scale, CGI), предусматривающей четыре степени градации терапевтического эффекта (отсутствие эффекта, минимальный, умеренный, заметный) и выраженности побочного эффекта (отсутствует, незначительный, значительный, нивелирующий терапевтический эффект). Оценка безопасности лекарственного средства проводилась на основании жалоб пациента и объективных данных, полученных исследователем в процессе лечения. Учитывались показатели лабораторных методов исследования, а также частота возникновения и характер побочных реакций.
Для статистического анализа были использованы программы Microsoft Excel и SPSS 17.0, достоверность межгрупповых различий определяли по непараметрическому критерию Манна — Уитни.
Критерии включения: возраст пациентов 18–60 лет; хроническая боль в нижней части спины, подтвержденная данными клинико-неврологического осмотра, рентгенографией позвоночника, КТ/МРТ позвоночника, лабораторными анализами. Критерии исключения: пациенты моложе 18 и старше 60 лет; острая боль в нижней части спины; отраженная боль; хроническая БНЧС, связанная с хирургической, онкологической, инфекционной и психиатрической патологиями; беременность и период лактации.
В исследовании приняли участие 60 пациентов обоих полов в возрасте от 18 до 60 лет с подтвержденным диагнозом хронической нейропатической боли в нижней части спины, соответствующих всем критериям включения/исключения. Средний возраст обследованных составил 44,9 ± 0,6 года, из них 37 (61,7 %) женщин и 23 (38,3 %) мужчины. Болевой синдром у 41 (68,3 %) пациента имел умеренную выраженность, а у 19 (31,7 %) больных характеризовался выраженной степенью. У 46 (76,7 %) пациентов отмечалось рецидивирующее течение и у 14 (23,3 %) — персистирующее течение заболевания. Длительность заболевания составляла 1–8 лет, в среднем 4,3 ± 0,3 года. Длительность текущего обострения от 2 до 4 месяцев, в среднем 3,1 ± 0,2 месяца. У всех обследованных на рентгенограмме был выявлен остеохондроз поясничного либо пояснично-крестцового отдела позвоночника. При КТ/МРТ-исследовании определялись протрузии дисков L4-L5, L5-S1. Все пациенты находились на стационарном или амбулаторном лечении в клинике ГУ «Институт неврологии, психиатрии и наркологии НАМН Украины».
Исследование продолжалось 30 суток и включало 6 визитов: 1-й визит — скрининг, 2-й визит — в 1-й день, 3-й визит — на 7-й день, 4-й визит — на 14-й день, 5-й визит — на 21-й день, 6-й визит — на 28–30-й день исследования.
В соответствии с дизайном исследования пациенты были разделены на контрольную и основную группу (по 30 человек в каждой). Выделенные группы были сопоставимы по возрасту, длительности заболевания, продолжительности текущего обострения и выраженности клинической симптоматики. Пациентам основной группы помимо базисной терапии, которая включала прием миорелаксантов, витаминов группы B, физиотерапевтические процедуры, мануальную и рефлексотерапию, был назначен исследуемый препарат Судорега. В первые трое суток исследования препарат Судорега назначался в дозе по 75 мг 1 раз в сутки. Начиная с четвертого дня исследования пациенты принимали препарат по 75 мг 2 раза в сутки. Прием препарата контролировался исследователями во время плановых визитов. Контроль эффективности терапии и переносимости препарата проводился на основании комплексного анализа динамики субъективных и объективных показателей на 3 (7-й день), 4 (14-й день), 5 (21-й день) и 6-м (28–30-й день) визитах.
Результаты и обсуждение
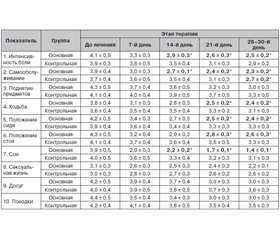
У всех обследованных пациентов результаты скрининга, проведенного во время 1-го визита, позволили выявить с помощью шкалы пятибалльной оценки вертеброневрологической симптоматики ограничение подвижности и наличие сколиоза в поясничном отделе позвоночника различной степени выраженности; проявление корешковой и нейродистрофической симптоматики (табл. 1). Показатели опросника DN-4 указывали на присутствие нейропатического компонента в структуре синдрома хронической БНЧС. По ВАШ интенсивность боли определялась пациентами как умеренная или выраженная. По сенсорной шкале Мак-Гилловского опросника пациенты чаще выбирали дескрипторы «дергающая», «сверлящая», «режущая», «давящая», «жгучая», «ломящая», реже «боль подобна сильному электрическому разряду» либо «подобна выстрелу»; по аффективной шкале — «боль изматывает», «вызывает чувство тревоги», «чувство страха», «обессиливает», «боль-страдание»; по эвалюативной шкале доминировал дескриптор «сильная».
Госпитальная шкала тревоги и депрессии HADS в обеих группах пациентов диагностировала субклиническую выраженность тревожно-депрессивной симптоматики с преобладанием симптомов тревожности. Все пациенты жаловались на плохой сон, отсутствие бодрости в дневное время. Показатели по шкале оценки качества сна у всех были ниже 19 баллов, что указывало на инсомнию, а по шкале Эпворса дневная сонливость трактовалась как выраженная. Хроническая БНЧС значительно ухудшала качество жизни пациентов как за счет физического, так и за счет психоэмоционального состояния, и это подтвердилось с помощью опросника Освестри. На ЭЭГ пациентов до начала лечения были выявлены различные изменения церебрального электрогенеза, обусловленные дезинтеграцией многоуровневых механизмов неспецифической регуляции в условиях продолжительной ноцицептивной афферентации.
/29.jpg)
Динамика основных вертеброневрологических синдромов в основной и контрольной группе под влиянием терапии представлена в табл. 2. Как видно из табл. 2, у пациентов основной группы, принимающих препарат Судорега, уже на 7-й день терапии отмечается заметное опережение позитивной динамики вертеброневрологических синдромов. К окончанию лечения в основной группе достоверно (р ≤ 0,05) увеличился объем движений в поясничном отделе позвоночника, уменьшился сколиоз, снизилась выраженность корешковой и нейродистрофической симптоматики. В контрольной группе достоверные (р ≤ 0,05) изменения к окончанию лечения получены только по показателю «объем движений в пораженном отделе позвоночника», а по остальным шкалам уровень статистической значимости р ≤ 0,05 не достигнут.
Интенсивность болевого синдрома по ВАШ на фоне применения препарата Судорега снизилась уже в первую неделю лечения, а статистическая значимость (р ≤ 0,05) анальгетического эффекта исследуемого препарата отмечалась на 14-й день терапии (табл. 3). Интенсивность боли в спине у пациентов основной группы во время лечения снижалась быстрее. К окончанию терапии оценка интенсивности боли по ВАШ у пациентов основной группы была менее 3 баллов.
Устойчивая позитивная динамика снижения выраженности сенсорной, эмоционально-аффективной и эвалюативной характеристик болевого синдрома у пациентов основной группы зафиксирована с помощью Мак-Гилловского опросника боли (табл. 4). Выявлено, что прием препарата Судорега на 28–30-й день достоверно (р ≤ 0,05) уменьшает количество выбранных дескрипторов и снижает ранговый индекс боли по сенсорной, аффективной и эвалюативной шкалам.
/30.jpg)
На этапе включения в исследование пациентов с хронической БНЧС физические проблемы негативно отражались на состоянии эмоциональной сферы, приводили к нарушению ночного сна, снижали активность в дневное время. Замыкался порочный круг взаимосвязанных и взаимоотягощающих проблем. Динамика психоэмоционального статуса пациентов с хронической БНЧС контролировалась с помощью шкалы тревоги и депрессии HADS (табл. 5). У пациентов, принимавших препарат Судорега, уровень тревоги уменьшился уже на первой неделе лечения, а статистически значимо (р ≤ 0,05) он снизился на 14-й день терапии. Выраженность депрессивной симптоматики также уменьшалась с первой недели лечения, а достоверные (р ≤ 0,05) изменения этого показателя отмечались на 21-й день терапии. Позитивная динамика показателей по шкале HADS в основной группе была устойчивой в течение всего курса лечения. К окончанию лечения у пациентов основной группы уровень тревоги и депрессии не превышал 7 баллов, что подтверждало анксиолитическое действие препарата Судорега. В контрольной группе изменения показателей тревоги и депрессии были недостоверными.
У пациентов основной группы позитивная динамика показателей качества сна коррелировала со снижением интенсивности боли по ВАШ и снижением уровня тревоги по шкале HADS, показывая к 14-му дню терапии препаратом Судорега статистически значимое (р ≤ 0,05) улучшение (табл. 6). Дневная активность у пациентов, принимавших препарат Судорега, достоверно (р ≤ 0,05) повысилась на 21-й день терапии. К окончанию лечения пациенты основной группы оценивали длительность засыпания, продолжительность ночного сна, число ночных пробуждений, количество сновидений, качество сна и утреннее самочувствие на 4–5 баллов. Улучшение ночного сна позволило справиться с дневной сонливостью, что существенно отразилось на повышении степени жизнедеятельности у пациентов основной группы.
Оценка степени нарушения жизнедеятельности проводилась с помощью анкеты Освестри. Как видно из табл. 7, у пациентов основной группы на 14-й день терапии достоверно (р ≤ 0,05) снизились показатели шкал «интенсивность боли», «самообслуживание» и «сон». На 21-й день приема исследуемого препарата присоединились значимые (р ≤ 0,05) улучшения по шкалам «ходьба», «положение сидя», «положение стоя». Важно отметить, что выраженная тенденция позитивных изменений по большинству шкал отмечалась уже в первую неделю приема препарата Судорега. У пациентов контрольной группы удалось зафиксировать достоверное (р ≤ 0,05) улучшение по шкале «самообслуживание» к окончанию лечения.
/31.jpg)
Анализ нейродинамических изменений по данным ЭЭГ был проведен в начале и в конце лечения у пациентов в обеих группах наблюдения. До лечения у 18 (59,4 %) пациентов основной группы и у 20 (66 %) пациентов контрольной группы наблюдалась дезорганизация биоэлектрической активности мозга с доминированием биопотенциалов альфа-диапазона. Синхронизированный заостренный высокоамплитудный альфа-ритм регистрировался у 3 (9,9 %) пациентов как в основной, так и в контрольной группе. У 6 (19,8 %) пациентов основной группы и у 5 (16,5 %) пациентов контрольной группы на ЭЭГ выявлена дезорганизация без четкого частотного доминирования. Доминирование на ЭЭГ низкоамплитудной полиморфной активности отмечалось у 3 (9,9 %) пациентов основной группы и у 2 (6,6 %) пациентов контрольной группы. У всех обследованных пациентов на ЭЭГ регистрировались билатерально-синхронная локальная либо диффузная пароксизмальная активность, острые волны, единичные комплексы «пик — волна», что свидетельствовало о разной степени выраженности напряжения регуляторных мозговых систем. Локальная биоэлектрическая активность ирритативного характера зарегистрирована в лобно-височных и центрально-теменных отведениях. Диффузные вспышки пароксизмальной активности наблюдались в диапазонах тета-, альфа- и бета-частот. Структура пароксизмальных вспышек могла быть как мономорфной, так и полиморфной. Дельта-диапазон был представлен нерегулярными низкоамплитудными колебаниями. Локальных изменений и вспышечной активности в диапазоне дельта-частот не выявлено. Динамика ЭЭГ-феноменов под влиянием терапии показана в табл. 8.
/32.jpg)
Как видно из табл. 8, к окончанию лечения в основной группе позитивные сдвиги на ЭЭГ были более отчетливыми, что проявлялось в регрессе полиморфных пароксизмальных вспышек, пиков, комплексов «пик — волна», значительном уменьшении представленности на ЭЭГ локальной и диффузной пароксизмальной активности, острых волн, что объективно отражало уменьшение выраженности восходящих ирритативных влияний на кору головного мозга и коррелировало с позитивной клинической симптоматикой.
Визуальную оценку ЭЭГ дополняют данные спектрального анализа, позволившего до начала терапии выявить высокие показатели нормированной спектральной мощности в тета-, бета1- и бета2-диапазонах, снижение спектральной мощности в альфа-диапазоне в обеих исследуемых группах (табл. 9).
/33.jpg)
Достоверные (р ≤ 0,05) нейродинамические изменения к окончанию лечения удалось зафиксировать только в основной группе. Позитивный нейрофизиологический эффект проявлялся в снижении нормированной спектральной мощности в бета1-, бета2-диапазонах в затылочных и височных отведениях, а в тета-диапазоне — в височных и теменных отведениях. При этом в диапазоне альфа-ритма нормированная спектральная мощность увеличивалась в затылочных отведениях правого и левого полушарий мозга. В дельта-диапазоне достоверных (р ≤ 0,05) различий не было. Отмеченные изменения биоэлектрической активности у пациентов, принимавших препарат Судорега, указывали на значимое (р ≤ 0,05) улучшение нейропластичности мозга на стволовом, диэнцефальном, медиобазальном и корковом уровнях.
Клинический эффект препарата Судорега по шкале общего клинического впечатления у 22 (73,3 %) пациентов оценивался как заметный, а у 8 (26,7 %) пациентов — как умеренный. В первую неделю приема препарата Судорега у двух пациентов отмечались незначительные побочные эффекты в виде легкого головокружения, эти изменения носили транзиторный характер, не потребовавший изменения дозы препарата либо его отмены. В дальнейшем вплоть до окончания лечения других побочных эффектов не зарегистрировано. На основании анализа субъективных и объективных данных, полученных в исследовании, переносимость препарата Судорега в дозе 75 мг по два раза в сутки у 27 (90,0 %) пациентов была хорошая, а у 3 (10,0 %) — удовлетворительная.
Выводы
1. Препарат Судорега в дозе 75 мг по два раза в сутки у пациентов с хронической БНЧС в комплексной терапии ускоряет купирование болевого синдрома, проявляя выраженный анальгетический эффект уже в первую неделю терапии с сохранением устойчивой позитивной динамики до конца лечения.
2. Добавление препарата Судорега к базисной терапии БНЧС обеспечивает достоверное улучшение уровня боли по ВАШ начиная с 14-го дня терапии.
3. Применение препарата Судорега при БНЧС достоверно снижает показатели по шкале HADS: тревоги — с 14-го дня терапии; депрессии — с 21-го дня терапии.
4. Использование препарата Судорега при БНЧС достоверно улучшает показатели по шкале Эпворса: качества сна — с 14-го дня терапии, сонливости — с 21-го дня терапии.
5. На фоне приема препарата Судорега выявлена взаимосвязь между степенью снижения интенсивности болевого синдрома и уменьшением выраженности тревожно-депрессивной симптоматики, нарушений ночного сна и дневного бодрствования, обеспечивающая значимое повышение показателей качества жизни и социального функционирования.
6. Препарат Судорега модулирует нейродинамические процессы, облегчая восприятие, анализ и интеграцию ноцицептивной информации в условиях хронической болевой афферентации.
7. Проведенное исследование показало хорошую переносимость (90,0 %) и безопасность препарата Судорега. Вышеперечисленные результаты позволяют рекомендовать его применение для лечения пациентов с хронической БНЧС.
Конфликт интересов. Не заявлен.
Список литературы
1. Поворознюк В.В. Боль в нижней части спины: распространенность, причины, механизмы развития и особенности диагностики // Боль, суставы, позвоночник. — 2011. — № 1 (01). — С. 13-22.
2. Мищенко Т.С., Дзяк Л.А. Механизм-обоснованный подход к выбору фармакотерапии хронической боли // Матеріали V Національного конгресу неврологів, психіатрів та наркологів України, 16–17 березня 2017 р., м. Харків // Здоров’я України. — 2017, 17 квітня.
3. Manek N., MacGregor A.J. Epidemiology of low back disorders // Curr. Opin. Rheumatol. — 2005. — Vol. 17 (2). — Р. 134-140.
4. Парфенов В.А. Причины, диагностика и лечение боли в нижней части спины // Неврология, нейропсихиатрия, психосоматика. — 2009. — № 1. — С. 19-22.
5. Матросов Д.Н., Галушко Е.А., Эрдес Ш.Ф. Эпидемиология болей в нижней части спины в амбулаторной практике // Боль. — 2009. — № 4. — С. 23-28.
6. Подчуфарова Е.В. Боль в спине: механизмы развития и лечение // Современная терапия в психиатрии и неврологии. — 2012. — № 3. — С. 47-54.
7. Яхно Н.Н., Кукушкин М.Л. Хроническая боль: медико-биологические и социально-экономические аспекты // Вестник РАМН. — 2012 — № 9 — С. 54-58.
8. Эpдес Ш.Ф., Дубинина Т.В., Галушко Е.А. Боли в нижней части спины в общеклинической практике // Терапевтический архив. — 2008. — № 5. — С. 59-61.
9. Itz C.J., Geurts J.W., Van Kleef M., Nelemans P. Clinical course of non-specific low back pain: A systematic review of prospective cohort studies set in primary care // Eur. J. Pain. — 2013. — № 17. — P. 5-15.
10. Парфенов В.А. Врачебная тактика при болях в нижней части спины // Медицинский совет. — 2016. — № 8. — C. 76-80.
11. Baron R., Binder A., Attal N. Neuropathic low back pain in clinical practice // Eur. J. Pain. — 2016. — № 20. — P. 861-873.
12. Кукушкин М.Л. Патофизиологические механизмы болевых синдромов // Боль. — 2003. — № 1. — С. 5-16.
13. Freynhagen R., Schiltenwolf M., Akbar M. Pseudoradicular and radicular low back pain — a disease continuum rather than different entities? Answers from quantitative sensory testing // Pain — 2008. — № 135. — Р. 65-74.
14. Katz J., Cooper E., Walther R. Acute pain in herpes zoster and its impact on healthrelated quality of life // Clin. Infect. Dis. — 2004. — Vol. 39. — P. 342-348.
15. Каракулова Ю.В. О патогенетических механизмах формирования головных болей напряжения // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2006. — № 7. — С. 52-56.
16. Chetty S., Baalbergen E., Bhigjee A.I. Clinical practice guidelines for management of neuropathic pain: expert panel recommendations for South Africa // S. Afr. Med. J. — 2012. — № 102. — P. 312-325.
17. Beydoun A., Nasreddine W., Atweh S. Efficacy and tolerability of pregabalin in partial epilepsy // Expert. Rev. Neurother. — 2008. — № 8 (7). — P. 1013-1024.
18. Arain A.M. Pregabalin in the management of partial epilepsy // Neuropsychiatr. Dis. Treat. — 2009. — № 5. — P. 407-413.
19. Belliotti T., Capiris T., Ekhato I. Structure-activity relationships of pregabalin and analogues that target the α(2)-δ protein // J. Med. Chem. — 2005. — № 48. — P. 2294-2307.
20. Manjushree N., Chakraborty A., Shashidhar K., Narayanaswamy S. A review of the drug pregabalin // Int. J. Basic Clin. Pharmacol. — 2015. — № 4. — P. 601-605.

/29.jpg)
/30.jpg)
/31.jpg)
/32.jpg)
/33.jpg)