Резюме
Мета роботи: оцінити частоту та клініко-морфологічні характеристики мікросателітно нестабільного варіанту (MSI) колоректального раку (КРР) в українській популяції. Матеріали та методи. Дослідження включало 351 пацієнта з діагнозом КРР. MSI визначали двома методами: 1) шляхом визначення нестабільності в локусах мікросателітів методом PCR; 2) імуногістохімічно шляхом детекції дефіциту білків системи ММR (MLH1, MSH2, MSH6, PMS2; Dako). Окрім цього, частині пацієнтів із КРР проведено визначення мутацій у генах KRAS, NRAS і BRAF методом PCR-RT. Результати. Показано, що частота виявлення MSI в українській популяції пацієнтів із КРР становила 14,2 %. Статус MSI-КРР частіше визначали у чоловіків, ніж у жінок (25,35 проти 10 %; P = 0,04), за наявності значущих гендерних розбіжностей за віком (P = 0,002). MSI була асоційована зі специфічними гістологічними типами КРР та більшою частотою BRAF-мутацій, хоча при цьому віддалені метастази зустрічалися менш часто (17,4 проти 52,9 %; Р = 0,001) незалежно від статі. Висновки. Скринінг хворих на КРР щодо MSI дозволить виявити додаткових кандидатів на проведення імунотерапії та може поліпшити ефективність лікування.
Цель работы: оценить частоту и клинико-морфологические характеристики микросателлитно нестабильного варианта (MSI) колоректального рака (КРР) в украинской популяции. Материалы и методы. В исследование был включен 351 пациент с диагнозом КРР. MSI определяли двумя методами: 1) путем определения нестабильности в локусах микросателлитов методом PCR и 2) иммуногистохимически путем детекции дефицита белков системы МMR (MLH1, MSH2, MSH6, PMS2; Dako). Помимо этого, части пациентов с КРР было проведено определение мутаций в генах KRAS, NRAS BRAF методом Real-time PCR с использованием соответствующих наборов (Entrogen). Результаты. Показано, что частота выявления MSI в украинской популяции пациентов с КРР составила 14,2 %. Статус MSI-КРР чаще определялся у мужчин, чем у женщин (25,35 против 10 %; P = 0,04), и был ассоциирован с более молодым возрастом (P = 0,002). Феномен MSI чаще был ассоциирован со специфическими гистологическими типами КРР и мутациями в гене BRAF (Р = 0,03). Несмотря на то что практически половина MSI-Н КРК демонстрировала низкий уровень дифференцировки (Grade 3), среди пациентов с MSI значительно реже были выявлены отдаленные метастазы (17,4 против 52,9 %; Р = 0,001) независимо от пола. Выводы. Скрининг пациентов с КРР на MSI позволит выявить дополнительных кандидатов на проведение иммунотерапии и поможет повысить эффективность лечения.
Background. The purpose was to evaluate the frequency, clinical and morphological features of microsatellite instability (MSI) in colorectal cancer (CRC) in the Ukrainian population. Materials and methods. The study included 351 patients with CRC. Two methods were used to diagnose MSI: 1) detection of the instability in the microsatellite loci using polymerase chain reaction; 2) immunohistochemically, by detecting the deficiency of the mismatch repair system proteins (MLH1, MSH2, MSH6, PMS2; Dako). In addition, some patients were tested for KRAS, NRAS and BRAF mutations by real-time polymerase chain reaction. Results. It was shown that the frequency of MSI among Ukrainian patients with CRC was 14.2 %. The frequency of MSI-H status was significantly higher in men (25.35 %) than in women (10 %) (P = 0.04). The MSI-H status was associated with younger age (P = 0.002) in men. In addition, MSI-H CRC was more often associated with special histological types of CRC, inflammatory infiltration and higher rate of BRAF mutation (P = 0.03). Although almost half of the MSI-H CRC showed high grade, distant metastases rate was significantly lower comparing with MSI (17.4 vs. 52.9 %, P = 0.001) regardless of gender. Conclusions. Screening of patients with CRC on MSI will allow the identification of additional candidates for immunotherapy in order to improve treatment efficacy and outcomes.
Введение
Колоректальный рак (КРР) является одним из наи–более распространенных злокачественных новообразований [4]. Согласно данным мировой статистики, КРР занимает 2-е место в структуре онкологической патологии среди женщин и 3-е место у мужчин [3, 6]. Ежегодно в мире регистрируется около 1,4 млн новых случаев КРР [4]. Несмотря на внедрение скрининговых программ и значительный прогресс в ранней диагностике КРР, ежегодно от данного вида новообразований умирает около 700 000 пациентов [6]. Исследования последних десятилетий позволили совершить прорыв в понимании молекулярных механизмов развития и прогрессирования КРР, что стало основой разработки стратегии персонализированной терапии [10, 15]. В основе данной стратегии лежит классификация КРР на молекулярные подтипы [7]. Особое место среди них занимает КРР с микросателлитной нестабильностью (MSI). Данный молекулярный подтип КРР насчитывает около 15 % КРР ранних стадий и порядка 3 % метастатических КРР [9]. Развитие феномена MSI связывают с дефицитом экспрессии одного или нескольких белков системы восстановления несоответствия ДНК (MMR-белками). Основная функция MMR заключается в сохранении корректной репликации ДНК. Ферменты данной системы обеспечивают распознавание и коррекцию ошибочных оснований, инсерций и делеций в новореплицированных нитях ДНК [17]. Система MMR включает 4 фермента: MLH1, MSH2, PMS2 и MSH6, которые благодаря своим биологическим –эффектам по праву относятся к супрессорам опухолевого роста [13]. Среди пациентов с MSI КРР в 75–80 % случаев дефекты MMR связаны с гиперметилированием промотора и нарушением экспрессии MLH1 [16]. Реже встречается эпигенетически обусловленный дефицит экспрессии других ферментов системы MMR. И только 2–3 % всех КРР сопряжены с наследственными мутациями одного из генов системы MMR, что приводит к развитию семейного КРР, известного также как наследственный неполипозный колоректальный рак, или синдром Линча [16]. Изначально основной целью оценки микросателлитной нестабильности было выявление наследственно обусловленного рака, при генетическом подтверждении которого обследованию подлежали родственники пациента [10]. На сегодня оценка MSI играет важную роль в выборе оптимальной терапии и оценки прогноза [3, 7, 9, 14]. Так, известно, что MSI, с одной стороны, определяет более «спокойное» биологическое поведение опухоли: показано, что пациенты со II стадией микросателлитно нестабильного КРР имеют более благоприятный прогноз [9, 14]. С другой стороны, наличие MSI сопряжено с отсутствием ответа на 5-фторурацил, и таким пациентам не показана адъювантная химиотерапия [15]. В то же время получены убедительные доказательства эффективности иммунотерапии для лечения MSI КРР [8]. Это связано с тем, что MSI КРР, как правило, сопряжена с изменением экспрессии PD-L1 и высокой мутационной нагрузкой опухоли (МНО) [11, 13]. Последнее обусловлено тем, что наличие MSI ведет к генерации неоантигенов. Это, в свою очередь, стимулирует рекрутинг лимфоцитов, инфильтрирующих опухоль. Действительно, в MSI КРР выявлено значительно более высокое количество лимфоцитов, в том числе CD8+ T-клеток [2, 10]. Благодаря этому MSI КРР считаются иммуносенситивными, что предопределяет интерес к новому потенциально эффективному вектору терапии — реактивации собственного противо–опухолевого иммунитета, или иммунотерапии [3, 5]. 23 мая 2017 года FDA одобрило данное применение пембролизумаба при любых солидных прогрессирующих опухолях с MSI и ниволумаба для лечения метастатических КРР [2, 7]. Регистрация новых показаний для иммунотерапии индуцировала всплеск исследований частоты встречаемости MSI практически при всех видах рака, и на сегодняшний день накоплены данные многотысячных подобных исследований.
Однако, несмотря на то что концепция молекулярных подтипов КРР получила широкое признание и активное применение в клинической практике всего мира, в Украине оценка MSI только внедряется в протоколы обследования и выбора терапии пациентов с КРР. Отчасти это связано с отсутствием систематизированной информации о частоте и клинико-морфологических характеристиках MSI вариантов КРР в украинской популяции.
Цель: оценить частоту КРР с MSI в украинской популяции. Проанализировать взаимосвязь статуса MSI с клиническими данными пациентов и биологическими характеристиками КРР.
Материалы и методы
В исследование был включен 351 пациент с диагнозом «колоректальная карцинома», которым было проведено определение микросателлитной нестабильности в лаборатории CSD Health Care (n = 311) или в лаборатории OncoDNA (n = 40) в рамках молекулярного профилирования опухоли. На сегодня используется два основных метода определения статуса MSI. Во-первых, это определение непосредственно нестабильности в локусах микросателлитов методом полимеразной цепной реакции (ПЦР) с последующим анализом длины фрагментов. Второй метод основан на определении дефицита белков системы репарации ДНК (MMR: MLH1, MSH2, MSH6, PMS2), потеря которых, в свою очередь, приводит к MSI. Принимая во внимание гетеродимерную природу белков MMR, следует учитывать, что потеря экспрессии одного из белков может по факту быть связана с дефектом его белка-партнера. Так, например, отсутствие экспрессии только PMS2 указывает на дефект самого PMS2, а потеря MLH1 и PMS2 связана с отсутствием MLH1, что приводит к нестабильности белка PMS2 и его деградации. То же относится к MSH6 и MSH2 соответственно (табл. 1).
/6-1.jpg)
Определение статуса микросателлитной нестабильности в лаборатории CSD Health Care проводилось с помощью иммуногистохимического исследования белков системы репарации ошибок комплиментарности с применением антител против MLH1 (Dako, Clone ES05), MSH2 (Dako, Clone FE11), MSH6 (Dako, Clone EP49) и PMS2 (Dako, Clone EP51). Иммуногистохимическое исследование проводили по стандартному протоколу с использованием системы детекции Dako FLEX. Опухоли с положительной ядерной реакцией ко всем 4 антителам классифицировались как микросателлитно стабильные (MSS) [12]. При отсутствии реакции в клетках опухоли с одним или несколькими антителами и сохраненной их экспрессией в нормальных клетках (внутренний положительный контроль) опухоль классифицировали как микросателлитно не–стабильную (MSI). В лаборатории OncoDNA определение статуса MSI проводилось ПЦР-методом с последующим фрагментным анализом с применением набора реактивов MSI Analysis System (Promega), который тестирует 5 мононуклеотидных (BAT-25, BAT-26, NR-21, NR-24 и MONO-27) и 2 пентануклеотидных маркера (Penta Cand Penta D). При отрицательном результате со всеми маркерами опухоль классифицировалась как MSS, при наличии нестабильности одного маркера — низкая MSI (MSI-low) и при наличии ≥ 2 нестабильных маркеров — высокая MSI (MSI-high). Помимо этого, части пациентов с колоректальным раком также было проведено исследование мутаций в генах KRAS, NRAS, BRAF. В лаборатории CSD Health Care тестирование проводилось методом Real-time PCR с использованием соответствующих наборов реактивов фирмы Entrogen. В лаборатории OncoDNA тестирование проводилось методом секвенирования следующего поколения (NGS) в рамках генной панели молекулярного профилирования. При анализе результатов исследования учитывали демографические данные, результаты клинико-инструментального и патогистологического исследования. При этом учитывали пол, возраст, локализацию, стадию опухолевого роста, гистологический тип и грейд.
Результаты и обсуждение
Среди 351 пациента с колоректальным раком MSI была обнаружена в 50 случаях, что составило 14,2 %. Клинические и биологические данные пациентов представлены в табл. 2.
Пациенты с MSI были в среднем моложе пациентов с микросателлитно стабильным КРР (табл. 1), среди них была выше частота развития КРР в возрасте до 50 лет (P = 0,031). Кроме того, мы обнаружили, что MSI-H-статус чаще определялся у мужчин, чем у женщин (25,3 против 10 %; P = 0,04). И у мужчин MSI-H КРР был ассоциирован с более молодым возрастом (P = 0,002). Как и описано в многочисленных исследованиях, для MSI-Н КРР характерной была локализация опухоли в правой половине кишечника (82,9 % при MSI против 16,4 % при MSS; P < 0,001) (рис. 1).
/8-1.jpg)
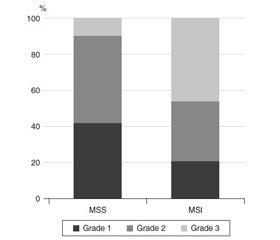
При анализе механизмов развития феномена MSI среди обследованных пациентов чаще всего обнаруживался дефицит MLH1 (65,3 %) и MSH2 (18,4 %). Реже наблюдалась потеря PMS2 (6,2 %) и MSH6 (4,1 %). Интересно, что в трех случаях результаты иммуногистохимического (ИГХ) исследования указывали на дефект сразу двух белков системы MMR (табл. 3). Дефицит MLH1 определялся чаще у мужчин, чем у женщин (70,6 против 50 %). У женщин чаще обнаруживался дефицит экспрессии MSH2 + MSH6 (37,5 против 11,8 % у мужчин). Потеря MSH2 и MSH6, а также изолированный блок экспрессии PMS2 были ассоциированы с более высоким грейдом КРР (P < 0,001). Хотя в большинстве случаев MSI-Н-опухоли чаще были низкодифференцированными (Grade 3; Р < 0,001) и имели муцинозную или медуллярную морфологию (22,4 против 7 %; Р < 0,001). Причем в большинстве случаев эти морфологические варианты были зарегистрированы у мужчин моложе 50 лет (P = 0,03). Несмотря на то что практически половина MSI-Н КРК демонстрировала низкий уровень дифференцировки (Grade 3), в группе пациентов с MSI значительно реже были выявлены отдаленные метастазы (17,4 против 52,9 %; Р = 0,001) независимо от пола.
/8-2.jpg)
Среди обследованных пациентов не было выявлено связи между статусом MSI и частотой мутаций генов KRAS и NRAS, однако при этом у пациентов с MSI существенно чаще обнаруживалась мутация в гене BRAF (40 против 6 %; Р = 0,03).
Полученные нами в украинской популяции пациентов с колоректальным раком результаты согласуются с данными исследований в других популяциях и свидетельствуют о том, что MSI чаще встречается в правой половине кишечника, данные опухоли чаще являются низкодифференцированными, однако чаще обнаруживаются на ранних стадиях, без отдаленных метастазов [1, 3, 14]. Данная группа опухолей чаще ассоциирована с муцинозной или медуллярной морфологией, и в них чаще выявляются мутации в гене BRAF [11].
Согласно данным национального канцер-реестра, в 2016 году было выявлено 16 196 случаев рака прямой кишки. Это значит, что около 2300 пациентов имели MSI, из которых, согласно нашим данным, около 17 % могли иметь отдаленные метастазы. Таким образом, только среди пациентов с колоректальным раком в год в Украине появляется около 400 пациентов, для которых иммунотерапия могла бы быть наиболее эффективным вариантом лечения. А если охватить скринингом на MSI все новые случаи метастатического рака, которых в Украине в 2016 году было диагностировано около 23 000, и предположить, что MSI будет обнаружена хотя бы в 2 % из них, то количество пациентов, для которых иммунотерапия является вариантом выбора, возрастает приблизительно до 860 в год (только из первичных пациентов). Это предопределяет важность информирования пациентов о тестировании на MSI и его значении для определения возможности проведения иммунотерапии. Кроме того, с учетом того факта, что MSI обнаруживается более чем в 20 видах опухолей и при этом независимо от локализации эффективно применение иммунотерапии пембролизумабом, актуальным является проведение тестирования на MSI пациентов с любым метастатическим раком, стандартные линии терапии которого были исчерпаны или неэффективны.
Выводы
1. Частота выявления MSI в украинской популяции пациентов с колоректальным раком составила 14,2 %.
2. MSI чаще встречалась в низкодифференцированных опухолях правой половины толстой кишки, имеет ряд гендерных особенностей и характеризуется меньшей частотой отдаленных метастазов.
3. КРР c MSI ассоциирован с большей частотой мутаций в гене BRAF.
4. Скрининг пациентов с КРР на MSI позволит выявить дополнительных кандидатов на проведение иммунотерапии и поможет повысить эффективность лечения.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Arakawa K., Hata K., Kawai K. et al. Predictors for High Microsatellite Instability in Patients with Colorectal Cancer Fulfil–ling the Revised Bethesda Guidelines // Anticancer. Res. — 2018. — 38 (8). — 4871-4876. doi: 10.21873/anticanres.12800.
2. Avendaño-Ortiz J., Casarrubios M., Montalbán-Hernández K. et al. PD-L1/PD-1 crosstalk in colorectal cancer: are we targeting the right cells? // BMC Cancer. — 2018. — 3, 18 (1). — 945. doi: 10.1186/s12885-018-4853-0.
3. Bhalla A., Zulfiqar M., Bluth M.H. Molecular Diagnostics in Colorectal Carcinoma: Advances and Applications for 2018 // Clin. Lab. Med. — 2018. — 38 (2). — 311-342. doi: 10.1016/j.cll.2018.02.008.
4. Brenner H., Chen C. The colorectal cancer epidemic: challenges and opportunities for primary, secondary and tertiary prevention // Br. J. Cancer. — 2018. doi: 10.1038/s41416-018-0264-x
5. Dawood S. The evolving role of immune oncology in colorectal cancer // Chin. Clin. Oncol. — 2018. — 7 (2). — 17. doi: 10.21037/cco.2018.04.07.
6. Díaz-Tasende J. Colorectal cancer screening and survi–val // Rev. Esp. Enferm. Dig. — 2018. — 4. — 110. doi: 10.17235/reed.2018.5870/2018.
7. Dienstmann R., Salazar R., Tabernero J. Molecular Subtypes and the Evolution of Treatment Decisions in Metastatic Colorectal Cancer // Am. Soc. Clin. Oncol. Educ. Book. — 2018. — 23 (38). — 231-238. doi: 10.1200/EDBK_200929.
8. Fabrizio D.A., George T.J. Jr, Dunne R.F. et al. Beyond microsatellite testing: assessment of tumor mutational burden identifies subsets of colorectal cancer who may respond to immune checkpoint inhibition // J. Gastrointest. Oncol. — 2018. — 9 (4). — 610-617. doi: 10.21037/jgo.2018.05.06.
9. Gupta R., Sinha S., Paul R.N. The impact of microsatellite stability status in colorectal cancer // Curr. Probl. Cancer. — 2018. — 18. pii: S0147-0272(17)30169-1. doi: 10.1016/j.currproblcancer.2018.06.010.
10. Nguyen H.T., Duong H.Q. The molecular characteristics of colorectal cancer: Implications for diagnosis and therapy // Oncol. Lett. — 2018. — 16 (1). — 9-18. doi: 10.3892/ol.2018.8679.
11. Patel S.A., Longacre T.A., Ladabaum U., Lebensohn A., Lin A.Y., Haraldsdottir S. Tumor Molecular Testing Guides Anti-PD-1 Therapy and Provides Evidence for Pathogenicity of Mismatch Repair Variants // Oncologist. — 2018. — 2. pii: theoncologist.2018-0108. doi: 10.1634/theoncologist.2018-0108.
12. Pearlman R., Markow M., Knight D. et al. Two-stain immunohistochemical screening for Lynch syndrome in colorectal cancer may fail to detect mismatch repair deficiency // Mod. Pathol. — 2018. — 2. doi: 10.1038/s41379-018-0058-y.
13. Salem M.E., Puccini A., Grothey A. et al. Landscape of Tumor Mutation Load, Mismatch Repair Deficiency, and PD-L1 Expression in a Large Patient Cohort of Gastrointestinal Cancers // Mol. Cancer. Res. — 2018. — 16 (5). — 805-812. doi: 10.1158/1541-7786.MCR-17-0735.
14. Trabelsi M., Farah F., Blel A., Jaafoura M.H., Kharrat M., Rammeh S. Prognostic values of detecting MSI phenotypes in colorectal carcinoma by immunohistochemical method compared to molecular investigation // Tunis Med. — 2017. — 95 (12). — 229-236.
15. Van der Jeught K., Xu H.C., Li Y.J., Lu X.B., Ji G. Drug resistance and new therapies in colorectal cancer // World J. Gastroenterol. — 2018. — 14, 24 (34). — 3834-3848. doi: 10.3748/wjg.v24.i34.3834.
16. Xiao X., Dong D., He W., Song L., Wang Q., Yue J., Xie L. Mismatch repair deficiency is associated with MSI phenotype, increased tumor-infiltrating lymphocytes and PD-L1 expression in immune cells in ovarian cancer // Gynecol. Oncol. — 2018. — 149 (1). — 146-154. doi: 10.1016/j.ygyno.2018.02.009.
17. Yamamoto H., Imai K. Microsatellite instability: an update // Arch. Toxicol. — 2015. — 89 (6). — 899-921. doi: 10.1007/s00204-015-1474-0.

/6-1.jpg)
/7-1.jpg)
/8-1.jpg)
/8-2.jpg)