Журнал «Медицина неотложных состояний» №3(98), 2019
Вернуться к номеру
Моніторинг нейром’язової провідності та глибини наркозу як основа керування етапами загальної анестезії при оперативних втручаннях на черевній порожнині
Авторы: Якобчук Х.Р., Тхоревський О.В.
Українська військово-медична академія, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
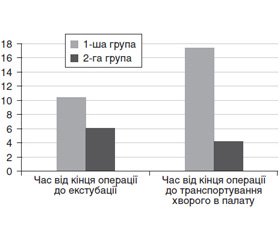
Метою даного дослідження було створити алгоритми безпечного керування глибиною анестезії і нейром’язової провідності (НМП) на етапах швидкої послідовної індукції і виходу з анестезії за допомогою інструментальних методів моніторингу НМП. Матеріали та методи. В дослідження були включені 30 пацієнтів. Пацієнти були розподілені на дві групи: 1-ша група — клінічні методи моніторингу рівня нейром’язової провідності (n = 15), 2-га група — апаратні методи моніторингу рівня нейром’язової провідності (n = 15) за допомогою апарата TOF-Watch SX в режимі TOF-стимуляції. Результати. Час від введення анестетика до введення міорелаксанту на 18 % більший в 2-й групі, спостерігається вірогідність різниці порівняно з 1-ю групою (p < 0,05). Час від введення анестетика до інтубації трахеї в 2-й групі на 32 % більший, ніж в 1-й групі (p < 0,05). У 1-й групі без додаткового моніторингу спостерігається не лише найменший час від введення міорелаксанту до інтубації трахеї (85,3 ± 4,9 с), але й гірші умови для інтубації за шкалою Cooper (7,8 ± 0,8, p < 0,05). А в 2-й групі спостерігається більший час від введення міорелаксанту до інтубації трахеї порівняно з контрольною групою (139,3 ± 4,5 проти 85,3 ± 4,9), а також відмінні умови для інтубації за шкалою Cooper (8,9 ± 0,1 проти 7,8 ± 0,8). Більш високі рівні середнього артеріального тиску і частоти серцевих скорочень у 1-й групі на етапах інтубації і через 5 хвилин після інтубації пов’язані з недостатнім рівнем анестезії порівняно з 2-ю групою. Час від закінчення операції до екстубації в 1-й групі на 4,4 хвилини (72 %) більший, ніж у 2-й групі. Також час від закінчення операції до транспортування пацієнта в палату в 1-й групі на 6,6 хвилини (62 %) більший, ніж у 2-й групі. Таким чином, використання додаткового моніторингу дозволяє зменшити час знаходження хворого в операційній на 6,6 хвилини. Витрати рокуронію були значно вищі у 1-й групі — 52,3 ± 1,0 мг порівняно з 2-ю групою — 42,3 ± 1,3 мг, що доводить вірогідність різниці порівняно з контрольною групою (p < 0,05). Висновки. Спираючись на статистичні дані наших досліджень, було встановлено, що TOF-моніторинг сприяє проведенню інтубації трахеї в максимально комфортних для пацієнта умовах, забезпеченню достатньої релаксації для штучної вентиляції легень і роботи хірургів, проведенню вчасної екстубації трахеї, зменшенню часу перебування пацієнтів в операційній.
Целью данного исследования было создать алгоритмы безопасного управления глубиной анестезии и нейромышечной проводимости (НМП) на этапах быстрой последовательной индукции и выхода из анестезии с помощью инструментальных методов мониторинга НМП. Материалы и методы. В исследование были включены 30 пациентов. Пациенты были разделены на две группы: 1-я группа — клинические методы мониторинга уровня нейромышечной проводимости (n = 15), 2-я группа — аппаратные методы мониторинга уровня нейромышечной проводимости (n = 15) с помощью аппарата TOF-Watch SX в режиме TOF-стимуляции. Результаты. Время от введения анестетика до введения миорелаксанта на 18 % больше во 2-й группе, наблюдается достоверность разницы по сравнению с 1-й группой (p < 0,05). Время от введения анестетика до интубации трахеи во 2-й группе на 32 % больше, чем в 1-й группе (p < 0,05). В 1-й группе без дополнительного мониторинга наблюдается не только наименьшее время от введения миорелаксанта до интубации трахеи (85,3 ± 4,9 с), но и хуже условия для интубации по шкале Cooper (7,8 ± 0,8, p < 0,05). А во 2-й группе наблюдается большее время от введения миорелаксанта до интубации трахеи по сравнению с контрольной группой (139,3 ± 4,5 против 85,3 ± 4,9), а также отличные условия для интубации по шкале Cooper (8,9 ± 0,1 против 7,8 ± 0,8). Более высокие уровни среднего артериального давления и частоты сердечных сокращений в 1-й группе на этапах интубации и через 5 минут после интубации связаны с недостаточным уровнем анестезии по сравнению со 2-й группой. Время от окончания операции до экстубации в 1-й группе на 4,4 минуты (72 %) больше, чем во 2-й группе. Также время от окончания операции до транспортировки пациента в палату в 1-й группе на 6,6 минуты (62 %) больше, чем во 2-й группе. Таким образом, использование дополнительного мониторинга позволяет уменьшить время нахождения больного в операционной на 6,6 минуты. Расход рокурония был значительно выше в 1-й группе — 52,3 ± 1,0 мг по сравнению со 2-й группой — 42,3 ± 1,3 мг, что доказывает достоверность разницы по сравнению с контрольной группой (p < 0,05). Выводы. Опираясь на статистические данные наших исследований, было установлено, что TOF-мониторинг способствует проведению интубации трахеи в максимально комфортных для пациента условиях, обеспечению достаточной релаксации для искусственной вентиляции легких и работы хирургов, проведению своевременной экстубации трахеи, уменьшению времени пребывания пациентов в операционной.
Background. The purpose of this study was to develop algorithms for the safe control of deep anesthesia and neuromuscular conduction at the stage of rapid sequential induction and anesthesia recovery using instrumental monitoring methods of NMC. Materials and methods. The study included 30 patients. The patients were divided into two groups (the same number of patients in each group): the clinical methods and hardware methods (TOF-Watch SX apparatus in TOF stimulation mode) for monitoring the level of neuromuscular conduction were used in group 1 and 2, respectively. Group 1, without additional monitoring, presented with not only the slightest time from a muscle relaxant introduction to tracheal intubation (85.3 ± 4.9 seconds), but also worse conditions for intubation by the Cooper scale (7.8 ± 0.8, p < 0.05). And in group 2, there is a greater time from a muscle relaxant introduction to tracheal intubation compared with the control group (139.3 ± 4.5), as well as excellent conditions for intubation by the Cooper scale (8.9 ± 0.1 vs. 7.8 ± 0.8). Higher levels of mean blood pressure and heart rate in the first group at the stages of intubation and 5 minutes after intubation were associated with an inadequate level of anesthesia compared with the second group. Results. The time from the end of the operation to the extubation in the 1st group was 4.4 minutes (72 %) more than in the 2nd group. In addition, the time from the end of the surgery to transporting the patient to the ward in the 1st group was 6.6 minutes (62 %) more than in the 2nd group. Thus, the use of additional monitoring can reduce the time of a patient’s staying in the operating room by 6.6 minutes. The consumption of rocuronium was significantly higher in the 1st group — 52.3 ± 1.0 mg, compared with the 2nd group — 42.3 ± 1.3 mg, that proves the significance of the difference compared with the control group (p < 0.05). Conclusions. The statistical results of our research have shown that TOF monitoring will help to conduct intubation under the most favorable conditions, provide adequate muscular relaxation for mechanical ventilation and surgery procedure, timely extubation of the trachea, as well as to reduce the period of patients staying in the operating room.
моніторинг нейром’язової провідності; нейром’язовий блок; ТОF-стимуляція; акцеломіографія; моніторування м’язового блока
мониторинг нейромышечной проводимости; нейромышечный блок; ТОF-стимуляция; акселеромиография; мониторирование мышечного блока
monitoring of neuromuscular conduction; neuromuscular block; TOF stimulation; myography; monitoring of muscular blockades
Вступ
Основний напрямок розвитку сучасної анестезіології — це створення максимально ефективної і водночас безпечної загальної анестезії. З іншого боку, сучасна планова хірургія з метою збільшення продуктивності роботи операційної потребує від анестезіолога проведення не тільки ефективної і безпечної анестезії, але і передбачуваної за часом анестезії з тенденцією до зменшення неоперативного часу. Для забезпечення своєчасного і безпечного виходу з анестезії і скорочення тривалості перебування хворого в операційній застосовується широкий арсенал сучасних анестетиків, міорелаксантів і методів інтраопераційного моніторингу. Комплексний моніторинг анестезії допомагає зменшити витрати та покращити результати лікування пацієнтів [1].
Загальноприйняті методики впливу анестетиків на хворого ґрунтуються на центральній і периферичній гемодинаміці, а також оцінка глибини нейром’язового блока (НМБ) за часом дії міорелаксанту або за реакцією хірурга часто виявляється малоінформативною, що призводить до залишкової кураризації і пов’язаних з цим дихальних ускладнень. Згідно з результатами G. Gammu і співавт. (2006), від 3,5 до 64 % пацієнтів мають ознаки залишкової кураризації при надходженні з операційної. Найбільш частими респіраторними ускладненнями, пов’язаними з залишковим нейром’язовим блоком при використанні міорелаксантів у відділенні інтенсивної терапії, є тяжка гіпоксемія (59 %) і обструкція верхніх дихальних шляхів (34,4 %) [2].
Інструментальні методи вимірювання глибини анестезії і акцелерометричний моніторинг нейром’язової провідності можуть значно покращити якість і безпеку анестезії за рахунок зниження ймовірності інтранаркозного пробудження, зменшення часу знаходження хворого в операційній, а також контролю залишкової кураризації.
Клінічні ознаки, такі як м’язовий тонус, зміна легеневого супротиву, об’єм дихання, здатність підняти голову, покашляти, висунути язик, потиснути руку, дають можливість оцінити рівень НМБ, проте вони не точні і не здатні забезпечити своєчасну корекцію дози релаксантів або взагалі неможливі в умовах загальної анестезії. Відсутність своєчасної корекції дози міорелаксантів може призвести або до передозування, або, навпаки, до недостатнього НМБ. Частота неадекватної анестезії на різних етапах операції коливається від 15 до 20 %. Рівень глибини НМБ в кінці оперативного втручання в 15 % випадків є неадекватним при потребах хірургів. Залишкова міоплегія, на думку хірургів, зустрічається в практиці в 28 % випадків, на думку анестезіологів — у 33% випадків [3]. Це необхідно розглядати як ризик розвитку у пацієнтів можливих ускладнень в післяопераційному періоді, пов’язаних з залишковою кураризацією. Використання сучасних релаксантів з більш коротким терміном дії не призвело до зникнення випадків залишкової кураризації.
На сьогодні використання міорелаксантів при проведенні оперативних втручань є невід’ємною частиною, що сприяє оптимальній роботі хірургів у глибині операційної рани. Розслаблення скелетних м’язів, що досягається за допомогою міорелаксантів, входить до складу основних компонентів комбінованої анестезії [4]. Застосування міорелаксантів дозволило проводити анестезію на адекватному рівні, також ефективно керувати газообміном під час операції і анестезії.
Головна заслуга міорелаксантів полягає в тому, що, викликаючи нервово-м’язовий блок, вони різко зменшують патологічну стимуляцію від м’язів в центральну нервову систему. Тому міорелаксація допомагає, як і інші компоненти анестезії, досягнути ефективного захисту хворого від операційного стресу [5].
Для міоплегії під час інтраабдомінальних операцій зазвичай застосовують недеполяруючі міорелаксанти тривалої і середньої дії. В процесі знеболювання анестезіолог вимушений вибирати між зменшенням дози релаксанту і необхідністю підтримання достатньої міоплегії. Рекомендовані інтервали між введеннями релаксантів залежать від ряду факторів: комбінації препаратів, віку пацієнтів, температури тіла, кислотно-основного стану, супутніх захворювань, індивідуальної чутливості до міорелаксантів [7]. Крім того, одним з побічних дій релаксантів є залишковий нервово-м’язовий блок [8]. Вважається, що застосування міорелаксантів потребує об’єктивного контролю. Ряд досліджень показує, що порівняльна оцінка релаксантів і створення рекомендацій щодо їх клінічного застосування неможливі без застосування об’єктивного методу дослідження нейром’язової провідності [7]. За даними різних джерел, за відсутності об’єктивного моніторингу нейром’язової провідності (НМП) на етапі пробудження на 45–60 % випадків анестезіолог-реаніматолог екстубує пацієнта, який перебуває ще в стані залишкової кураризації, що значно підвищує ризик розвитку післяопераційної гіпоксії і гіповентиляції, особливо у пацієнтів похилого і старечого віку.
Ще в 1954 р. H.K. Beecher і D.P. Todd виявили, що операції з використанням міорелаксантів супроводжувались більшою летальністю порівняно з оперативними втручаннями без використання міорелаксантів [9]. Було відмічено, що в 63 % випадків причиною летального наслідку були дихальні ускладнення після використання релаксантів. В 1979 р. J. Viby-Mogensen і співавт., використовуючи методику механоміографії, оцінили нервово-м’язову провідність у пацієнтів, яким інтраопераційно вводили міорелаксанти тривалої дії інгібітори ацетилхолінестерази. Порушення нейром’язової провідності при надходженні в палату пробудження спостерігалось в 42 % хворих [10]. За даними G.H. Beemer і P. Rozental (1986), частота кураризації в ранньому післяопераційному періоді становить 21–36 % [8].
Дослідження, які проводились з використанням релаксантів, показують, що проблема залишкової кураризації залишається актуальною до цього часу [7]. Дослідження P. Howardy-Hansen, що проводились в 1980-ті роки, продемонстрували, що навіть малі дози міорелаксанту мають клінічне значення. TOF становило 0,89, але більше 95 % всіх добровольців скаржились на «тяжкі повіки», в 1/3 всіх пацієнтів спостерігалось утруднене ковтання. В 1997 р. A.F. Kоpman і співавт. надали результати дослідження на добровольцях, яке показало, що TOF = 0,7 не може бути розцінене як рівень адекватної нервово-м’язової функції. Автори стверджували, що в окремих випадках, навіть при TOF = 0,9, клінічна оцінка нервово-м’язової функції викликає настороженість: у хворих відмічається диплопія і неможливість слідкувати за предметами, що рухаються. П’ятисекундний тест з утриманням голови розглядається як сприятлива клінічна ознака повного відновлення НМП. В більшості випадків цей тест може бути здійснений при TOF > 0,7, а сила стискання пальців кисті при цьому буде значно зниженою. Тому з усіх клінічних ознак залишкового НМБ тест на стискання найбільш ефективний, на відміну від тестів на піднімання і утримання голови протягом 5 секунд, можливий при TOF = 0,7, не дозволяє повністю виключити залишковий НМБ. TOF ≥ 0,9 — новий золотий стандарт для визначення адекватного відновлення нейром’язової функції [11], який дозволяє зняти з пацієнта післяопераційний нагляд. Периферичні м’язи менш чутливі до дії міорелаксантів, ніж гортанні, тому будь-яка м’язова слабкість, що виявлена в периферичній мускулатурі, майже завжди пов’язана з проблемами підтримання прохідності дихальних шляхів і утрудненням ковтання. Екстубація не повинна проводитись до повного відновлення НМП [7].
Залишковий нервово-м’язовий блок є фактором ризику розвитку ускладнень в післяопераційному періоді. Наприклад, рання екстубація трахеї за наявності залишкової кураризації може супроводжуватись порушенням координації глоткових м’язів, появою дихальної недостатності, що призводить до збільшення ризику аспірації, розвитку гіпоксемії, гіперкапнії і гіпоксії.
Об’єктивна оцінка глибини НМБ обов’язкова для прийняття рішення щодо тактики ведення пацієнта, підвищення ефективності і безпеки використання міорелаксантів під час анестезії [7].
Мета дослідження: проаналізувати ефективність і доцільність використання інструментального контролю НМП під час оперативних втручань і раннього післяопераційного періоду шляхом проспективного аналізу проведених оперативних втручань на базі Національного військово-медичного клінічного центру «Головний військовий клінічний госпіталь» за 2017–2018 роки.
Матеріали та методи
Дослідження проводились на базі НВМКЦ «Головний військовий клінічний госпіталь» у відділеннях гінекології та абдомінальної хірургії. Ми провели дослідження та проаналізували дані, отримані від 30 пацієнтів, яким виконувались планові оперативні втручання лапароскопічним шляхом на органах черевної порожнини під загальною багатокомпонентною анестезією з інтубацією трахеї і штучною вентиляцією легень (ШВЛ).
Пацієнти були розподілені на дві групи, які відрізнялись використанням клінічних і апаратних методів моніторингу рівня нейром’язової провідності: 1-ша група — клінічні методи моніторингу рівня нейром’язової провідності (n = 15), 2-га група — апаратні методи моніторингу рівня нейром’язової провідності (n = 15).
Пацієнт включався в дослідження, якщо він задовільняв наступним критеріям:
— вік від 18 до 69 років;
— відсутність гострих захворювань;
— компенсація хронічної патології (ступінь ризику ASA не більше ІІІ класу, передбачувана тривалість операції не більше 2 годин).
У 1-й групі 15 жінок віком від 20 до 58 років. Середній вік пацієнток 1-ї групи становив 36,0 ± 3,6 року. Середній індекс маси тіла (ІМТ) пацієнтів даної групи — 25,8 ± 2,3 кг/м2.
У 2-й групі 15 жінок віком від 20 до 58 років. Середній вік пацієнтів 2-ї групи становив 42,0 ± 5,1 року. Середній ІМТ пацієнтів 2-ї групи — 25,4 ± 3,4 кг/м2. Середній вік пацієнтів обох груп становив 39 років. Середній ІМТ пацієнтів обох груп — 25,64 кг/м2
Характеристика застосованих методів анестезіологічного забезпечення
Премедикація за 30 хвилин до оперативного втручання: Sol. Promedoli 0,3 мг/кг внутрішньом’язово.
Премедикація на столі: Sol. Phentanyli 1,6 мкг/кг, Sol. Atropini 0,01 мг/кг внутрішньовенно.
Ввідна анестезія: Sol. Tiopentali natrii 1% 150–350 мг, Sol. Propofoli 1% 100–200 мг з наступною інтубацією трахеї на фоні міоплегії Sol. Esmeroni 0,6 мг/кг маси тіла та прогнозуванням підтримання міоплегії в дозі 0,15 мг/кг маси тіла пацієнта під контролем приладу для визначення рівня нервово-м’язового блока — TOF-Watch SX.
Після інтубації всім пацієнтам проводили штучну вентиляцію легень апаратом «Бриз». Інтраопераційна інфузійна терапія становила 15–20 мл/кг/год розчинів кристалоїдів.
Методи дослідження
Усім пацієнтам безпосередньо перед оперативним втручанням «на столі», під час оперативного втручання та в ранньому післяопераційному періоді проводили неінвазивний моніторинг:
1. Електрокардіографія (ЕКГ), артеріальний тиск (АТ), частота серцевих скорочень (ЧСС), насичення крові киснем (SpO2).
2. Оцінка дихальних параметрів в апараті ШВЛ «Бриз» — РЕЕР, FiO2.
3. Контроль глибини нейром’язового блока — оцінювали методом акцелероміографії, за допомогою апарата TOF-Watch SX з m. adductor pollicis в режимі TOF-стимуляції (train-of-four): 4 супрамаксимальних (монофазних, низькочастотних (частота 2 Гц)) імпульси на ліктьовий нерв кожні 0,5 с, з повторенням стимуляції кожні 15 с. Контроль шкірної температури на периферії здійснювали за допомогою термістора — сенсора приладу TOF-Watch, фіксованого на підвищенні великого пальця.
У всіх пацієнтів вимірювали наступні параметри міоплегії:
— час початку дії — інтервал від моменту введення індукційної дози до розвитку максимального блоку TW1= 0 %, який слугував орієнтиром для виконання інтубації трахеї;
— рівень TOF-відношення в кінці операції. При TOF-відношенні > 90 % проводилась екстубація трахеї.
Методика статистичної обробки даних. Статистична обробка результатів дослідження проведена за допомогою статистичних програм Excel і Statistica 10.0 для Windows 10. Для порівняння середніх арифметичних показників досліджуваних груп використовували розрахунок параметричного t-критерію Student. Оцінка статистичної значимості показників і вірогідності різниці порівнюваних вибірок проводилась за критерієм Стьюдента при рівні значимості < 0,05.
Результати
Індукція
Параметри часових інтервалів і комплексного інтраопераційного моніторингу в групах на різних етапах індукції анестезії наведені нижче (табл. 1–3).
При порівнянні часових інтервалів під час індукції анестезії звертає на себе увагу вірогідна різниця в часі введення міорелаксантів в 2-й групі порівняно з 1-ю групою. Час введення міорелаксантів в групі 2 був на 18 % більший, ніж в 1-й групі (p < 0,05). Менший проміжок часу між введенням анестетика і введенням міорелаксанту в 1-й групі пов’язаний із тим, що міорелаксант починали вводити після зникнення рефлексів, а в групі з додатковим моніторингом орієнтувались перш за все на показник TOF.
Час інтубації в 2-й групі був більшим на 32 %, ніж в 1-й групі (p < 0,05). Час від введення міорелаксанту до інтубації трахеї в 1-й групі був вірогідно нижчим, ніж в 2-й групі (p < 0,05).
Отже, важливо відмітити, що в 1-й групі без додаткового моніторингу спостерігається не лише найменший час від введення міорелаксанту до інтубації трахеї, але й гірші умови для інтубації за шкалою Cooper (p < 0,05). А в 2-й групі спостерігається більший час від введення міорелаксанту до інтубації трахеї порівняно з контрольною групою, а також відмінні умови для інтубації за шкалою Cooper.
При порівнянні показників середнього артеріального тиску у двох групах виявлено, що вихідні показники суттєво не відрізнялись. Також не відмічено значної різниці на етапі введення міорелаксантів. Під час інтубації спостерігається вірогідна різниця в середніх показниках АТ між групами, оскільки на етапі інтубації середній АТ був вірогідно нижчий у 2-й групі, ніж в 1-й групі. Аналогічно через 5 хвилин після інтубації.
При порівнянні показників ЧСС на різних етапах індукції анестезії важливо відмітити, що різниця показників між групами на етапах початку анестезії і введення міорелаксанту була невірогідною. На етапах інтубації і через 5 хвилин після інтубації рівень ЧСС в групі 1 був вірогідно вищим, ніж в групі з додатковим моніторингом.
Більш високий рівень середнього АТ і ЧСС в 1-й групі на етапах інтубації і через 5 хвилин після інтубації пов’язаний з недостатнім рівнем анестезії порівняно з 2-ю групою.
Вихід з анестезії
При порівнянні часу знаходження хворого в операційній після закінчення операції звертає на себе увагу різниця між групами. Отже, час від закінчення операції до екстубації в 1-й групі на 4,4 хв (72 %) більший, ніж в 2-й групі. Також час від закінчення операції до виїзду пацієнта з операційної в 1-й групі на 6,6 хв (62 %) більший, ніж в 2-й групі.
Таким чином, використання TOF-моніторингу дозволяє зменшити час перебування хворого в операційній після операції на 6,6 хвилини.
Примітка: жирним шрифтом виділено показник, що має вірогідну різницю з контрольною групою (p < 0,05).
Витрати рокуронію був значно вищий в 1-й групі, ніж в 2-й групі, p > 0,05.
Спираючись на статистичні дані наших досліджень, при вивченні і порівнянні застосування TOF-моніторингу під час анестезіологічного забезпечення лапароскопічних оперативних втручань було встановлено, що TOF-моніторинг сприяє проведенню інтубації трахеї в максимально комфортних для пацієнта умовах, забезпеченню достатньої релаксації для ШВЛ і роботи хірургів, проведенню вчасної екстубації трахеї, зменшенню часу перебування пацієнтів в операційній, уникненню ускладнень, пов’язаних з залишковою релаксацією, а також дозволяє зменшити використання міорелаксанта при проведенні анестезії.
Обговорення
Сучасна концепція анестезіології базується на основному принципі — створенні максимально ефективної і в той же час безпечної моделі загальної анестезії. З іншого боку, сучасна планова хірургія в рамках збільшення продуктивності операційної потребує від анестезіолога проведення не лише ефективної і безпечної, але й передбачуваної за часом анестезії, з тенденцією до зменшення неоперативного часу. Для забезпечення своєчасного і безпечного виходу з анестезії і скорочення часу знаходження пацієнта в операційній застосовується широкий арсенал сучасних анестетиків, міорелаксантів і методів інтраопераційного моніторингу. Моніторинг нейром’язової провідності дозволяє виявити ступінь НМБ в кінці операції і прийняти рішення щодо використання препаратів для декураризації, екстубації хворого в максимально безпечних і комфортних для пацієнта умовах.
Загальноприйняті методики оцінки глибини НМБ за часом дії релаксанту чи за реакцією хірурга часто виявляються малоінформативними, що призводить до наявності у пацієнта залишкової кураризації і пов’язаних з цим дихальних ускладнень. За даними G. Cammu і співавт. (2006), від 3,5 до 6,4 % пацієнтів мають ознаки недостатнього відновлення НМП при надходженні з операційної. Найбільш часто зустрічаються респіраторні ускладнення, пов’язані з залишковим НМБ при використанні міорелаксантів у відділеннях інтенсивної терапії, тяжка гіпоксемія (59 %) і обструкція дихальних шляхів (34,4 %) [2]. Поєднання різних ускладнень автори спостерігали у 34,4 % випадків. H. Berg і співавт. (1997) відмітили формування легеневих інфільтратів і ателектазів у 6,7 % хворих із залишковим НМБ [10].
Метою даного дослідження було створити і відпрацювати алгоритми безпечного керування глибиною анестезії і нейром’язової провідності на етапах швидкої послідовної індукції і виходу з анестезії за допомогою інструментальних методів моніторингу НМП.
Менший проміжок часу між введенням анестетика і міорелаксанту в 1-й групі пов’язаний з тим, що міорелаксант починали вводити після зникнення рефлексів, а в 2-й групі, де використовувався TOF-моніторинг, орієнтувались на його показники.
У 1-й групі без додаткового моніторингу спостерігається не лише найменший час від введення міорелаксанту до інтубації трахеї (85,3 ± 4,9 с), але й гірші умови для інтубації за шкалою Cooper (7,8 ± 0,8, p < 0,05). А в 2-й групі спостерігається більший час від введення міорелаксанту до інтубації трахеї порівняно з контрольною групою (139,3 ± 4,5 проти 85,3 ± 4,9), а також відмінні умови для інтубації за шкалою Cooper (8,9 ± 0,1 проти 7,8 ± 0,8), в групі з TOF-моніторингом вірогідність різниці порівняно з 1-ю групою.
Під час інтубації і через 5 хвилин після інтубації спостерігалась вірогідна різниця в показниках середнього АТ в 2-й групі з додатковим TOF-моніторингом і 1-й групі, на етапі інтубації середній АТ в 2-й групі був вірогідно нижчим, ніж в 1-й групі (76,0 ± 6,3 мм рт.ст. проти 88,7 ± 5,1 мм рт.ст.) Також аналогічно через 5 хвилин після інтубації (71,5 ± 2,2 мм рт.ст. в 2-й групі проти 85,7 ± 6,1 мм рт.ст.).
На етапах інтубації і через 5 хвилин після інтубації рівень ЧСС в 1-й групі був вірогідно вищий, ніж в 2-й групі. ЧСС в першій групі під час інтубації і через 5 хвилин після інтубації становила 83,3 ± 5,8 уд/хв і 81,7 ± 3,9 уд/хв відповідно, в 2-й групі — 70,0 ± 5,7 уд/хв і 69,6 ± 5,1 уд/хв. Більш високі рівні середнього АТ і ЧСС в першій групі на етапах інтубації і через 5 хвилин після інтубації пов’язані з недостатнім рівнем анестезії порівняно з 2-ю групою.
Отримані нами дані можуть бути використані при оперативних втручаннях з використанням міорелаксантів. Розвиток питання моніторингу нейром’язової провідності має важливе практичне значення, оскільки його раціональне вирішення багато в чому визначає підвищення ефективності співпраці пацієнта, анестезіолога та хірурга.
Висновки
1. Використання моніторингу для визначення нейром’язової провідності дозволяє оптимізувати умови та безпеку під час оперативного втручання.
2. На основі даних глибини нейром’язової провідності досягається вірогідне покращання умов та безпеки для інтубації трахеї за шкалою Cooper з 8 до 9 балів.
3. Акселерометричний метод моніторингу дозволяє кількісно оцінювати нейром’язовий блок і вчасно проводити екстубацію трахеї.
4. Застосування нейромоніторингу при анестезії дозволяє зменшити час перебування пацієнтів в операційній та уникнути ускладнень, пов’язаних з залишковою релаксацією.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Bruhn J., Myles P.S., Sneyd R., Struys R.F. Depth of anaesthesia monitoring: what’s availabla, what’s validated and what’s next? // Br. J. Anaesth. — 2006. — 97(1). — Р. 85-94.
2. Murphy G.S., Szokol J.W., Marymont J.H. et al. Residual neuromuscular blocade and critical respiratory events in tne postanesthesia care unit // Anesth. Analg. — 2008. — 107(1). — Р. 130-7.
3. Грачев С.С. Повышение безопасности и эффективности применения мышечних релаксантов при анестезиологическом обеспечении интраабдоминальных оперативных вмешательств: Автореф. дис… канд. мед. наук: 14.01.20 / С.С. Грачев; БелМАПО. — Минск, 2011. — 22 с.
4. Морган Д.Е., Михаил М.С. Клиническая анестезиология. — М.: Бином, 2000.
5. Winstead P.S., Fahy B.G. Guide to Neuromuscular Blocking Anents // Anesthesiology News. — July 2004. — P. 29-31.
6. Мизиков В.М., Руденко М.В., Верещагина И.И., Ловцевич Н.В. Цисатракуриум (Нимбекс): фармакокинетика, фармакодинамика и применение у взрослых // Вестник интенсивной терапии. — 1999. — № 3. — С. 77-78.
7. Бутров А.В. Технология использования миорелаксантов на основе мониторинга нейромышечной проводимости / А.В. Бутров, М.Ф. Дробышев, В.Е. Кислевич. — М.: Изд-во НЦССХ им. А.Н. Бакулева РАМН, 2009. — 48 с.
8. Beecher G.H., Rozental P. Postoperative neuromuscular function // Anaesth. Intensive Care. — 2006. — 14. — Р. 41-5.
9. Beecher H.K., Todd D.P. A study of the deaths with anesthesia and surgery: based on a study of 599, 548 anesthesias in ten institutions 1948–1952, inclusive // Ann. Surg. — 1954. — 140. — Р. 2-35.
10. Viby-Mogensen J., Jorgensen B.C., Ording H. Residual curarization in the recovery room // Anesthesiology. — 1979. — 50. — Р. 539-41.
11. Murphy G.S. // Minerva Anestesiol. — 2006. — 72. — Р. 97-109.
12. Лекманов А.У. Сравнительное исследование двух видов мониторинга нервно-мышечной функции — электромиографии и акселеромиографии — во время анстезиологического пособия у детей / А.У. Лекманов, С.Г. Суворов // Анестезиология и реаниматология. — 2009. — № 4. — С. 18-22.
13. Hemmerling T.M. Neuromuscular Monitoring. A Rewiew and Update // Can. J. Anaesthesiol. — 2014. — 16. — Р. 195-9.
14. Donati F., Antzaka C., Bevan D.R. Potency of pancuronium at the diaphragm and the addcuctor pollicis muscle in humans // Anesthesiology. — 2016. — 65. — Р. 1-5.

/114-2.jpg)
/114-1.jpg)
/115-1.jpg)
/116-1.jpg)