Газета «Новости медицины и фармации» №7 (694), 2019
Вернуться к номеру
Микробиоценоз организма человека. Факторы, влияющие на его состояние, и коррекция
Авторы: Мамчур В.И., д.м.н., профессор кафедры фармакологии и клинической фармакологии, ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Харченко Ю.В., преподаватель кафедры фармакологии и клинической фармакологии, ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Жилюк В.И., д.м.н., профессор, заведующий кафедрой фармакологии и клинической фармакологии, ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Разделы: Клинические исследования
Версия для печати
Общие сведения о микробиоте
Микробиота человека — это совокупность микробиоценозов, занимающих многочисленные экологические ниши на коже и слизистых оболочках в местах контакта человеческого организма с окружающей средой.
Симбиотическая микробиота играет огромную роль в обеспечении здорового состояния нашего организма. Она защищает от патогенов, поддерживает иммунитет, обеспечивает производство важных компонентов питания. Микробиота человека включает тысячи видов грибов, эубактерий, архей и вирусов. Суммарное количество клеток только эубактерий в составе микробиоты превышает десять триллионов, что в сто раз больше числа собственных клеток организма человека. С развитием науки исследователи получили возможность очень точной и комплексной оценки всего микробного сообщества с глубиной до тысячных долей процента (по содержанию микроба). Это позволило выйти на новый уровень понимания взаимосвязи здоровья человека и состояния его микробиома.
Микробиота является весьма чувствительным индикатором, реагирующим количественными и качественными изменениями на любые сдвиги внешней и внутренней среды [9]. Изменение количественного и качественного состава того или иного вида микроорганизмов в биотопе служит сигналом об адаптивных или необратимых изменениях в соответствующем звене микроэкологической системы [3]. Существует множество факторов, оказывающих негативное воздействие на микробиоту организма, поэтому вопрос о ее восстановлении, коррекции и предупреждении дисбаланса является весьма актуальным.
Микробиота кишечника
Микробиота кишечника человека является одним из наиболее активно исследуемых микробных сообществ. Связано это со сложностью ее состава и изобилием ее взаимодействий с организмом человека. Формирование микробиоты кишечного тракта человека — многоэтапный процесс. Становление микробиоты начинается еще in utero за счет бактерий, проникающих из кишечника, ротовой полости и вагинальной микробиоты матери. Затем ребенок получает микроорганизмы при прохождении через родовые пути [13, 93], а также с грудным молоком, которое нестерильно и содержит значительные концентрации бактерий родов Streptococcus, Staphylococcus, Propionibacterium и Bifidobacterium [50]. Вскоре после рождения формируется типичный детский тип микробиоты кишечника, характеризующийся высокими концентрациями представителей рода Bifidobacterium [79], что в значительной степени определяется содержащимся в человеческом молоке набором олигосахаридов. К двум годам относительная численность Bifidobacterium постепенно снижается, и складывается окончательный вариант кишечной микробиоты [32]. У детей, рожденных с помощью кесарева сечения, в течение первых месяцев жизни наблюдаются отличия в содержании отдельных групп бактерий в составе микробиоты, что в определенной степени связано с отсутствием контакта с вагинальной микробиотой, приемом антибиотиков матерью и более поздним прикладыванием к груди. В состав микробиоты кишечника взрослых людей могут входить представители более 600 различных родов [27]. Около 90 % всей микробиоты суммарно составляют бактерии типов Firmicutes и Bacteroidetes, преимущественно представленные трудно–культивируемыми облигатными ана–эробами. В европейской популяции наиболее часто встречающимися и многочисленными представителями Firmicutes являются Faecalibacterium prausnitzii и бактерии родов Blautia, Dorea, Roseburia и Coprococcus, к основным представителям кишечных Bacteroidetes относятся бактерии родов Bacteroides, Parabacteroides, Prevotella, Odoribacter, Barnesiella и Alistipes [5, 47]. Единичные проценты в кишечной микробиоте взрослых людей составляют бактерии типов Actinobacteria и Proteobacteria [5], еще меньшую часть — Fusobacteria, Verrucombicrobia, а также метаногенные археи типа Euryarchaeota [5, 20]. Концентрации отдельных представителей в кишечной микробиоте не являются независимыми друг от друга — они связаны сложной сетью симбиотических и антагонистических взаимодействий. В результате пространство всех возможных составов микробиоты кишечника не заполнено равномерно — можно выделить устойчивые комбинации соотношений микроорганизмов (энтеротипы), которые встречаются чаще, чем переходные формы между этими комбинациями. Исследователи выделяют три основ–ных энтеро–типа, характеризующихся высокими концентрациями Bacteriodes, Prevotella и Ruminococcaceae соответственно [5, 23]. Однако такое деление не описывает все разнообразие качественных и количественных характеристик кишечной микробиоты.
На состав микробиоты оказывают влияние такие факторы, как возраст, прием антибиотиков, потребляемая пища, курение, индекс массы тела, концентрации гемоглобина и эритроцитов в крови [24]. Межпопуляционные различия также играют определенную роль и предположительно связаны с характером питания [25, 26].
Микробиота кишечника человека продуцирует множество различных веществ, способных поступать в системный крово–ток и оказывать воздействие на все органы и системы. Микробиоту даже называют виртуальным эндокринным органом [36]. К примеру, бактерии кишечной микробиоты способны секретировать в кровь такие сигнальные вещества, как гамма-аминомасляная кислота, ацетилхолин, гистамин, серотонин, дофамин и норадреналин [19, 27].
Важную роль в регуляции активности иммунной системы играют синтезируемые микроорганизмами лиганды рецепторов врожденного и адаптивного иммунитета: формилметионинсодержащие пептиды, флагеллин, липополисахарид, а также капсульные полисахариды, такие как полисахарид A Bacteroides fragilis [84]. Также одной из важных задач микробиоты кишечника является формирование колонизационной резистентности, предотвращающей заселение кишечника патогенными микроорганизмами, например за счет конкуренции за питательные вещества [96]. Определенную роль могут играть и производимые микроорганизмами специфические антимикробные белки и пептиды — бактериоцины, а также перекиси [32]. Антимикробным действием обладают вторичные желчные кислоты, образующиеся в результате дегидроксилирования первичных желчных кислот различными представителями нормальной микробиоты, такими как Clostridium scindens [18].
Микробиота ротовой полости
В ротовой полости происходит первый контакт организма человека с экзогенными микроорганизмами, она является своеобразными воротами, от состояния которых в той или иной мере зависит состояние всего организма. Так, ротовая полость содержит более 1000 различных видов эубактерий, архей, грибов и вирусов. Состояние микробиоты ротовой полости напрямую связано с широким спектром заболеваний человека, таких как болезни полости рта (кариес и заболевания пародонта), сахарный диабет, заболевания сердечно-сосудистой системы, онко–логические заболевания и другие.
Проведенные исследования мягкого зубного налета показывают вариативный состав основных представителей: 1,0–13,5 % Actinobacteria, 21,4–63,5 % Bacteroidetes, 14,6–30,8 % Firmicutes, 4,7–12,1 % Fusobacteria, 2,6–22,9 % Proteo-
bacteria, 0,04–12,9 % Spirochaetes, 0,0004–0,84 % Synergistetes [5, 49]. Установлено, что влияние микробиоты ротовой полости на развитие заболеваний является комплексным: решающую роль играет не наличие какого-то конкретного микроорганизма, а их сочетание.
Множество научных работ указывают на взаимосвязь состава микробиоты пародонтального кармана с развитием кариеса и пародонтита [2]. Также в ряде исследований показана связь состояния микробиоты пародонта и нижележащих отделов пищеварительной системы [7].
Микробиота дыхательных путей
Верхние дыхательные пути (ВДП) являются барьером между внешней средой, легкими и желудочно-кишечным трактом [85]. Внутриутробно легкие заполнены амниотической жидкостью, которая не является свободной от бактерий, типы этих бактерий больше похожи на таковые в ротовой полости, чем на других участках тела [31]. Сразу после родов микробиота новорожденного напоминает микробиоту его матери и зависит от способа родов [33]. Микробиота новорожденных относительно однородна по участкам органов, но очень быстро (в течение дней и недель) дифференцируется в органоспецифичные сообщества [21]. Микробиота кишечника детей раннего возраста обладает высокой динамикой, прежде чем стабилизируется в возрасте приблизительно 3 лет и будет напоминать таковую у взрослых [107], характер созревания сообщества которой повторяется в микробиоте верхних дыхательных путей [16, 97]. На микробиоту верхних дыхательных путей, как и на любую другую, оказывают влияние такие факторы, как кормление грудью [16], прием антибиотиков [97]. Микробиота носоглотки дифференцируется в возрасте 1 недели и стабилизируется через 6 недель с преобладанием Moraxella, Dolosigranulum и Corynebacterium, а присутствие доминантного гемофилуса/стрептококка в микробиоте носоглотки свидетельствует о высокой частоте респираторных инфекций [101].
Наиболее распространенными типами микробиоты ВДП являются Bacteroidetes и Firmicutes; доминирующие роды равномерно включают Prevotella, Veillonella и Streptococcus [30, 72, 90]. Таким образом, микробиота легких имеет схожий видовой состав с микробиотой ротовой полости (ее первичного источника) [15, 101]. В норме микробиота ВДП обеспечивает устойчивость колонизации к проникновению патогенных микроорганизмов и выполняет иммунную функцию [96, 108]. Липополисахарид (ЛПС) Prevotella противодействует ЛПС, продуцируемому Haemophilus influenzae, и ингибирует воспаление слизистой оболочки, опосредованное Toll-подобным рецептором 4 (TLR4) [69]. Таким образом, иммунный ответ Th17 активировался микробиотой ВДП и активными продуктами мета–болизма, которые, в свою очередь, повышали иммунитет слизистой оболочки ВДП против колонизации респираторным патогеном [105]. Например, уровень экспрессии интерлейкина-8 в клетках легочного эпителия увеличился после воздействия моракселлы [74]. Экспрессия интерлейкина-6 и интерферона g также повышена, чтобы ингибировать воспаление, связанное с вирусом [58, 106]. Все эти данные указывают на значительную роль микробиоты ВДП в иммунном –созревании, очистке от патогенов и –предупреждении развития таких заболеваний, как бронхиальная астма [97, 35], хроническое обструктивное заболевание легких [37, 44, 65, 70, 71, 94, 95], кистозный [28] и идиопатический легочный фиброз [82, 88], бронхоэктазии [66, 99], пневмонии [29, 98]. Таким образом, микробиота ВДП достаточно различна в зависимости от локализации и стадий развития [16, 22, 83, 108].
Микробиота кожи
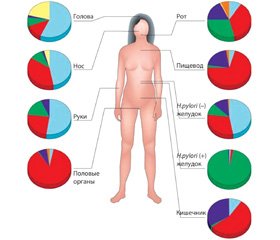
Бактериальные сообщества кожи значительно различаются в зависимости от локализации на теле, влияния температуры, pH фактора и содержания кислорода [26]. Несмотря на то, что поверхность кожи не оптимальна для микробного роста (является прохладной и кислой), на одном ее квадратном сантиметре обитает примерно 1 миллиард бактерий (рис. 1) [26, 42].
Эти разнообразные микробные сообщества создают определенные экологические ниши, которые могут помочь в профилактике болезней или способствовать их развитию [102, 103]. Например, некоторые бактерии ограничивают рост других микроорганизмов, гидролизуя липиды кожного жира в яд [68]. Такой механизм ограничивает развитие таких условно патогенных бактерий, как Staphylococcus aureus [81, 100]. В то же время значительные изменения в составе микробного сообщества кожи связаны с неинфекционными заболеваниями, например с атопическим дерматитом, псориазом и угревой сыпью [34, 38, 39, 46, 73, 75, 76, 78, 92]. Изменения в структуре бактериального сообщества в сочетании с эпителиальной дисфункцией, иммунной дисрегуляцией или чрезмерным ростом патогенных микроорганизмов лежат в осно–ве патологий кожи [54, 55].
После появления всех инструментов, необходимых для исследования микробиоты, охарактеризовали топографическое и временное разнообразие микробиоты кожи здорового взрослого человека [26]. Исследователи ожидали, что Staphylococcus будет преобладать, однако в результате исследования было обнаружено 19 основных типов, но на коже в основном представлены Actinobacteria (52 %), Firmicutes (24 %), Proteobacteria (17 %) и Bacteroidetes (7 %).
Было установлено, что разновидности Propionibacterium и Staphylococcus доминируют на участках кожи с большей жирностью (крыловидная складка, внешний слуховой канал, затылок). На более влажных участках преобладают разновидности Corynebacterium (подмышечная область, межпальцевое пространство, паховая область, подколенная ямка, подошвенная область, пяточная область, пупочная область), там же выявлены представители Staphylococcus. В сухих местах, таких как ладони, предплечье, ягодицы, обитает смешанная популяция бактерий [41]. Дополнительные исследования демонстрируют, что физиологически сопоставимые места населены подобными микробными сообществами: например, влажные подмышечные впадины и подколенные ямки имеют схожий микробный состав [26].
Микроорганизмы привязаны к текущему участку тела. Микроорганизмы, пересаженные из одной среды обитания в другую, например, с языка на лоб, не способны колонизировать новую территорию или изменить существующее в этой области микробное сообщество [26, 59]. Согласно ранним исследованиям, эмбрио–нальная кожа стерильна в утробе матери, и процесс ее колонизации начинается в момент рождения [27]. Вагинальные микроорганизмы, преимущественно видов Lactobacillus, Prevotella или Sneathia, немедленно покрывают кожу младенцев, рожденных естественным путем, в то время как микробиота кожи рожденных с применением кесарева сечения больше напоминает микробиоту взрослой кожи, содержащую Staphylococcus, Corynebacterium и Propionibacterium [78]. Независимо от способа доставки микробиота кожи новорожденных значительно уступает по составу микробиоте кожи взрослого человека.
Микробиота мочеполовой системы
Микробиота женского репродуктивного тракта очень разнообразна [8, 40, 61]. В нормальной микробиоте влагалища обычно доминируют лактобациллы [57], действующие как пробио–тики и ингибирующие размножение других видов бактерий. Считается, что наиболее благоприятными являются виды Lactobacilli, способные продуцировать высокие уровни H2O2. В фолликулярной жидкости были обнаружены микроорганизмы, являющиеся представителями нормальной флоры влагалища (Lactobacillus spp.), желудочно-кишечного тракта (Bifidobacterium spp., Enterobacteriaceae, Streptococcus agalactiae), кожи (Staphylococcus spp.) и слизистой оболочки полости рта (Streptococcus spp.) [80]. Микробиота мочеполовой системы мужчин и женщин имеет некоторые отличия. Так, в репродуктивном тракте мужчин выявлены Staphylococcus epidermidis, Corynebacterium spp., Lactobacilli, Haemo–philus vaginalis, alpha-hemolytic streptococci [40]. Таким образом, в отличие от женщин репродуктивного возраста, у которых доминирующей группой бактерий в норме являются представители рода Lactobacillus, у мужчин уретральная микробиота в норме не содержит какой-либо один доминирующий микроорганизм, а бактериальные сообщества нормальной микробиоты являются сложными [53].
Заболевания
Среди всех заболеваний человека наиболее тесно с нарушением состава микробиоты кишечника связана острая инфекционная диарея. Для лечения и профилактики как острой, так и хронической диареи различного генеза целесообразно назначать препараты, влияющие на состав микробиоты кишечника, — пробио–тики, т.е. микроорганизмы со специфическими терапевтическими свойствами, ингибирующие рост патогенных бактерий. Эти микроорганизмы при естественном способе введения оказывают положительное воздействие на физиологические и метаболические функции, а также биохимические и иммунные реакции организма хозяина через оптимизацию его микроэкологического статуса. Согласно данным исследований, доказана эффективность включения пробиотиков в схемы лечения диареи [79].
Еще в 1907 г. И.И. Мечников утверждал, что многочисленные ассоциации микроорганизмов, населяющих кишечник человека, в значительной мере определяют его духовное и физическое здо–ровье [67].
Одним из вариантов диарейного синдрома является диарея, ассоциированная с антибиотиками (ААД), которая может быть неинфекционной и инфекционной природы [52, 53]. Под воздействием антибиотиков существенно изменяется микробиота пищеварительного тракта. Уменьшение количества нормальной микробиоты приводит к увеличению нутриентов в толстой кишке, и патогенные микроорганизмы (наиболее часто это K.oxytoca, E.coli 0157:H7, метициллин-резистентные штаммы S.aureus, протей, –энтерококки) начинают активно питаться и размножаться [52]. Одним из наиболее изученных и часто встречающихся микроорганизмов, ассоциированных с ААД, является C.difficile [53]. Лечение ААД необходимо начинать с отмены антибактериального препарата, явившегося ее причиной, как при инфекционной, так и при идиопатической форме. Необходимым дополнением к лечению ААД являются различные методы воздействия на микробиоту кишечника. Эффективность применения пробиотиков в качестве средства для предупреждения ААД, согласно критериям доказательной медицины, имеет уровень доказательности А. Данные 22 метаанализов подтвердили, что пробиотики эффективны для –предупреждения ААД [53]. Согласно данным другого метаанализа [77], риск развития ААД при приеме пробиотиков снижен в 3 раза. Считается, что применение пробиотиков при ААД следует начинать как можно раньше, не дожидаясь лабораторного подтверждения диагноза [86, 87, 89, 91].
Число пробиотических препаратов, а также продуктов питания с добавлением пробиотиков постоянно растет. –Поэтому современные пробиотики должны соответствовать следующим требованиям:
► иметь натуральное происхождение;
► обладать устойчивостью к действию соляной кислоты и желчи;
► быть резистентными к антибиотикам;
► сохранять живую микрофлору в количестве не менее 107 микробных тел на прием;
► иметь антагонизм к патогенным бактериям;
► обладать подтвержденным клиническим эффектом;
► их безопасность не должна вызывать сомнений;
► микроорганизмы должны быть четко гено- и фенотипически классифицируемыми.
Одним из пробиотиков, который соответствует требованиям FDA (Food and Drug Administration), получившим знак одобрения GRAS (Generally Recognized as Safe)1, т.е. признанным безопасным продуктом, является Bacillus coagulans, входящий в состав Лактовит форте [109, 110].
Bacillus coagulans — спорообразующие бациллы, которые резистентны к протеолитическим ферментам и сохраняют жизнеспособность во всех звеньях пищеварительного тракта [8, 10, 11, 57]. В таком виде пробиотик хорошо переносит технологические процессы, хранится и не разрушается под влиянием желудочного сока и желчи.
Попадая в двенадцатиперстную кишку, споры Bacillus coagulans созревают и начинают быстро размножаться, восполняя дефицит микрофлоры [6, 12]. Bacillus coagulans относится к полурезидентным спорообразующим бактериям: выполнив в организме человека функцию пробиотика в тот момент, когда в этом была наибольшая необходимость (время болезни), она покидает организм в течение 7 дней после последнего применения, выделяясь с фекалиями в виде спор, что, не–сомненно, способствует восстановлению собственной микробиоты, без риска внедрения в нее генетически чужеродных штаммов [63].
Bacillus coagulans за счет продуцирования противомикробных белков (бактериоцины — коагулин и лактоспорин) способна восстанавливать экологический баланс кишечной микробиоты посредством подавления размножения патогенных микроорганизмов: Salmonella typhosa, Salmonella schottmuelleri, Shigella dysenteriae, Shigella paradysenteriae, Clostridium difficile, Streptococcus faecalis и др. [104].
Bacillus coagulans обладает многокомпонентным иммуностимулирующим действием. А именно — уменьшает соотношение Тh2/Тh1, увеличивая содержание Т-хелперов 1-го типа (Тh1), запускающих реакции клеточного иммунитета. Он активирует натуральные киллеры, что также усиливает клеточный иммунитет. Кроме того, Bacillus coagulans стимулирует превращение В-клеток в плазматические клетки, стимулирует синтез IgM, IgG1, IgG2a, IgG2b, IgA, снижает выброс IgE. Таким образом в присутствии Bacillus coagulans усиливается выраженность гуморального иммунитета в организме человека. При этом повышение секреции IgA способствует более эффективной борьбе с патогенными бактериями на поверхности слизистых оболочек, в то время как снижение выброса IgE помогает бороться с различными аллергическими заболеваниями [17, 78].
Исходя из вышеизложенных свойств Bacillus coagulans в желудочно-кишечном тракте, формируются показания к применению данного пробиотика.
Технологическая цепочка от получения биомассы бактерий до изготовления самого препарата, заключенного в капсулу, позволяет сохранять не менее 1,2 ´ 107 жизнеспособных бактериальных клеток на всем протяжении срока годности. Лакто–вит форте обладает антагонизмом к патогенной и условно-патогенной флоре и действует на протяжении всего кишечника. По результатам дезинтеграционного теста, препарат обладает высокой кислотоустойчивостью, позитивно влияя на количественный и качественный состав флоры кишечника. Bacillus coagulans, входящая в состав Лактовита форте, продуцирует антимикробные субстанции: перекиси, бактериоцины, обладающие прямым антибактериальным и противовирусным действием [14].
Фолиевая кислота (витамин В9), входящая в состав Лактовита форте, необходима для нормального лейко- и эритро–поэза, синтеза аминокислот и нуклеиновых кислот, пуринов и пиримидинов. Также в его состав входит витамин В12 (цианокобаламин), который принимает участие в процессах обмена углеводов, белков и липидов, в синтезе нуклеиновых кислот, способствует нормализации нарушенных функций нервной системы, стимулирует эритропоэз [14, 48, 64].
Пробиотик на основе спор Bacillus coagulans обладает высокой адгезией, в большей мере стимулирует рост индигенной флоры, оказывает иммуностимулирующее действие, способствует укреп–лению барьерных функций и формированию иммунологической толерантности [51, 56, 60]. Безусловным достоинством препарата Лактовит форте является его безопасность, обеспечивающаяся использованием в производстве запатентированного штамма Bacillus coagulans GBI-30, 6086, информация о геноме которого находится на сайте www.ncbi.nlm.nih.gov/
pmc/articles/PMC4223449/, а заключение FDA о безопасности данного штамма — на сайте www.fda.gov/grasnoticeinventory. Маркировка препарата B.coagulans GBI-30, 6086 соответствует микробному паспорту и заявленной дозе, что подтверждено молекулярными диагностическими процедурами [109, 110].
Так, безопасность и отсутствие побочных эффектов дают возможность его назначения при беременности и детям с 6 месяцев. Пробиотик устойчив к технологическим процессам его приготовления и хранению при комнатной температуре, не разрушается при воздействии желудочного сока и желчи, обладает способностью к быстрому размножению и не проявляет патогенные свойства в организме человека. После прекращения его приема медленно выводится из организма человека (в течение 7 дней), что способствует закреплению достигнутого терапевтического эффекта [63].
Назначение Bacillus coagulans имеет доказанную эффективность в лечении таких заболеваний, как диарея (вследствие инвазии патогенной микрофлоры, применения антибиотиков, нарушения пищеварения), запоры (у пациентов разных возрастных групп), неспецифический вагинит, аллергические поражения кожи, гиперлипидемия [1].
☼ Таким образом, большое число различных исследований, –активно проводящихся в мире и стране в последнее время, наглядно демонстрирует, что есть все основания для назначения пробиотических препаратов в целях лечения и профилактики ряда заболеваний различного генеза.

/u/14-1.jpg)