Резюме
Проаналізовані дані 232 хворих з медулярною карциномою щитоподібної залози, які лікувалися в хірургічному відділенні Інституту з 1979 по 2018 р. (включно). Встановлено, що когорта пацієнтів, яка підлягала аналізу, відповідає іншим вибіркам за такими характеристиками, як вік хворих та їх розподіл за формами хвороби (спорадична, родинна, у складі синдрому MEN-2В). В той же час показано, що чисельність хворих із спорадичною формою медулярної карциноми починаючи з кінця минулого століття суттєво збільшилась — в основному за рахунок приросту кількості хворих жінок. Аналіз розподілу хворих за місцем проживання засвідчив, що на частку 5 найбільш промислово забруднених областей України — Донецької, Дніпропетровської, Луганської, Запорізької, Київської (і м. Києва) — припадає більше третини осіб із спорадичною формою медyлярної карциноми з усіх хворих когорти, тоді як на частку найбільш «чистих» областей — Чернівецької, Рівненської, Волинської, Тернопільської та Житомирської — у 3,6 раза менше. Одночасно відмічено дещо більшу частку хворих із областей, що найбільше постраждали від наслідків Чорнобильської аварії. Зростання в останнє десятиліття кількості хворих із спорадичною формою медулярної карциноми щитоподібної залози та більша, ніж в інших вибірках, кількість хворих жінок свідчать про певні особливості причин виникнення цієї форми хвороби серед населення України і можуть бути пов’язані з негативним впливом чинників довкілля, насамперед на жіночий організм.
Проанализированы данные 232 больных с медуллярной карциномой щитовидной железы, которые лечились в хирургическом отделении Института с 1979 по 2018 г. (включительно). Установлено, что анализируемая когорта пациентов отвечает другим выборкам по таким характеристикам, как возраст больных и распределение по формам заболевания (спорадическая, семейная, в составе синдрома MEN-2В). В то же время показано, что численность больных со спорадической формой медуллярной карциномы начиная с конца прошлого столетия существенно увеличилась — в основном за счет прироста количества больных женщин. Анализ распределения больных по месту жительства свидетельствует, что на долю 5 наиболее промышленно загрязненных областей Украины — Донецкой, Днепропетровской, Луганской, Запорожской, Киевской (и г. Киева) — приходится более трети лиц со спорадической формой медуллярной карциномы из всех больных когорты, тогда как на долю наиболее «чистых» областей — Черновицкой, Ровенской, Волынской, Тернопольской и Житомирской — в 3,6 раза меньше. Одновременно отмечена несколько большая часть больных из областей, которые наиболее пострадали от последствий Чернобыльской аварии. Увеличение в последнее десятилетие количества больных спорадической формой медуллярной карциномы щитовидной железы и большее, чем в других выборках, количество больных женщин свидетельствуют о некоторых особенностях причин возникновения этой формы заболевания среди населения Украины и могут быть связаны с неблагоприятным влиянием факторов окружающей среды, прежде всего на женский организм.
The article analyzes the data from 232 patients with medullary thyroid carcinoma who were treated in the surgical department of the V.P. Komisarenko Institute of Endocrinology and Metabolism from 1979 to 2018 (inclusive). The analyzed cohort of patients was found to meet other samples in such characteristics as age of patients and the distribution of the forms of the disease (sporadic, familial, as a component of MEN-2B syndrome). At the same time, it was shown that the number of patients with sporadic medullary carcinoma from the end of the century has significantly increased, mainly due to the increase in the number of female patients. Analysis of the distribution of patients by the place of residence shows that more than a third of patients with the sporadic form of medullary carcinoma falls to the share of five most industrially contaminated regions of Ukraine — Donetsk, Dnipropetrovsk, Luhansk, Zaporizhzhia, Kyiv (and the city of Kyiv), whereas 3.6 times less quantity falls to the of the most “clean” areas — Chernivtsi, Rivne, Volyn, Ternopil and Zhytomyr. Concurrently, a little bit larger portion of patients was determined from the areas most affected during the Chernobyl accident. The increase of the number of patients with sporadic medullary thyroid carcinoma, and more than in other samples, the number of female patients showed some specific causes of this form of the disease among the population of Ukraine and can be due to the adverse impact of environmental factors, especially on the female body.
Вступ
Відомо, що медулярна карцинома (МК) щитоподібної залози (ЩЗ) розвивається з парафолікулярних С-клітин ЩЗ, які походять із неврального гребінця, є частиною APUD-системи та синтезують кальцитонін [1]. Захворюваність на МК ЩЗ становить приблизно 0,1–0,2 випадку на 100 тис. населення на рік; серед інших форм злоякісних пухлин ЩЗ на її частку припадає (за даними збірної статистики різних авторів, які включають свідчення про декілька десятків тисяч хворих) від 1 до 15 %. Така розбіжність даних пояснюється значним коливанням кількості хворих з різних географічних зон: в Японії поширеність МК ЩЗ становить 1,4 % [2], в США — 3,5 % [3], в Німеччині — 5 % [4], в Великобританії — 10 % [5], в Росії — до 12,6 % [6]. Дані про поширеність МК ЩЗ в Україні відсутні.
Розрізняють спорадичну і спадкову форми МК ЩЗ, перша становить 70–80 % від усіх її випадків [7, 8]. Ці форми суттєво відрізняються за особливостями біологічної поведінки пухлин, клінічними проявами та прогнозом [9, 10]. До 60 % хворих із спорадичною формою МК ЩЗ мають у соматичних клітинах мутації гена RET [11], що є практично у 100 % хворих із родинною формою хвороби (за сучасними уявленнями, ця форма розглядається як варіант синдрому МЕН-2А) та у пацієнтів, у яких МК ЩЗ є складовою синдрому MEN-2В [12, 13]. Якщо успадкування МК при спадкових формах відбувається за автосомно-домінантним типом, то природа соматичних мутацій при спорадичній МК ЩЗ залишається нез’ясованою.
У практичній діяльності ендокринолога і онкохірурга вкрай важливою є своєчасна диференціальна діагностика спорадичних та спадкових форм МК ЩЗ, зважаючи на необхідність ретельного скринінгу членів родини хворого з такими формами хвороби. Крім того, враховуючи часте виникнення рецидивів та високу смертність при спадкових формах МК ЩЗ, деякі дослідники вважають за необхідне збільшити хірургічну агресивність при лікуванні таких хворих, тоді як при спорадичних формах МК хірургічна тактика може бути менш радикальною. В той же час вагомих наукових доказів щодо вибору хірургічних підходів у кожному конкретному випадку все ще недостатньо. Для вирішення цього питання необхідне чітке уявлення щодо контингенту хворих, особливостей виявлення ознак хвороби, її перебігу, причин, частоти та часу виникнення післяопераційних рецидивів, смертності, особливо з урахуванням характеру пухлинного процесу, метастатичного й інвазійного потенціалу пухлини, а також об’єму оперативного втручання тощо.
В Україні вивчення різних аспектів МК ЩЗ не має систематичного характеру. Відомі лише поодинокі дослідження на невеликих вибірках хворих з недовгочасним спостереженням [14, 15]. ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (далі — Інститут) має багатолітній досвід діагностування, лікування і спостереження за понад 230 хворими на МК ЩЗ.
Метою цього дослідження є встановлення критеріїв, за якими можна визначити необхідний і достатній (з огляду на повноту одужання) об’єм оперативного втручання. Для цього на першому етапі був проведений аналіз особливостей розподілу за віком, статтю, місцем проживання, формами хвороби серед когорти пацієнтів, які були прооперовані в Інституті.
Матеріали та методи
Проаналізовані дані 232 хворих, які лікувалися в хірургічному відділенні Інституту в період з 1979 по 2018 р. (включно) і яким був поставлений діагноз МК ЩЗ. До 1998 року попередній діагноз МК ЩЗ встановлювали за комплексом даних клінічного обстеження, який в подальшому підтверджували при патоморфологічних дослідженнях видаленої пухлини за її характерними гістологічними особливостями і за наявності амілоїду у стромальних елементах. Після 1998 року при визначенні попереднього діагнозу МК ЩЗ, як правило, враховуються дані цитологічних досліджень аспіратів, що отримують при проведенні тонкоголкової аспіраційної біопсії, за наявності в клітинах кальцитоніну (імуноцитохімічний аналіз). При патоморфологічних дослідженнях реакцію на кальцитонін проводили в обов’язковому порядку. Останніми роками у хворих на етапі обстеження визначали також рівень кальцитоніну у крові.
При проведенні ретроспективного аналізу за даними, що наведені в історіях хвороби, 4 пацієнта були виключені з когорти у зв’язку з недостатністю інформації відносно доказів щодо МК ЩЗ. Усі вони були прооперовані в 1979–1992 роках. Отже, аналізу була піддана когорта з 228 хворих.
Вік пацієнтів на момент встановлення діагнозу коливався від 9 до 83 років, вони були мешканцями всіх регіонів України, за винятком Закарпатської області.
Результати та обговорення
Серед хворих при ретроспективному аналізі даних спадкову форму хвороби визначено у 41 пацієнта. Отже, відсоток осіб із спорадичною МК ЩЗ становив 82, що вкладається в діапазон, наведений у літературі [7, 14, 16]. Відомо, що серед спадкових МК переважаючою формою є синдром MEN-2, на частку якого припадає приблизно 60–65 % випадків [7, 9]. В наших дослідженнях хворі з діагностованим синдромом MEN-2 становили 56,1 % серед усіх спадкових МК ЩЗ. Отже, розподіл хворих з різними формами МК ЩЗ у досліджуваній вибірці цілком відповідає існуючим літературним даним.
Серед пацієнтів усієї когорти жінки становили 71,1 % (162 особи), співвідношення «чоловіки : жінки» — 1 : 2,5. Це співвідношення вище в групі хворих із спорадичною формою МК ЩЗ (1 : 2,7), ніж у групах пацієнтів із родинною формою хвороби (1 : 1,5) і синдромом MEN-2 (1 : 1,9). Вважають, що частка жінок серед хворих із спорадичною формою МК ЩЗ лише трохи переважає таку в чоловіків [17]; інші наполягають, що саме серед чоловіків порівняно з жінками МК зустрічається частіше, ніж при інших формах злоякісних пухлин ЩЗ [18]. Більш висока, ніж представлено в роботах дослідників з інших країн (1 : 1,5–1 : 1,9) [7, 19], частка жінок із спорадичною формою МК ЩЗ в когорті, що аналізується, поряд з різною частотою захворюваності на МК ЩЗ в різних країнах [2–6] підкреслюють можливість існування певних відмінностей у причинах виникнення хвороби серед населення різних регіонів Землі.
Вік пацієнтів, як жінок, так і чоловіків, із спорадичною формою хвороби вірогідно не відрізнявся — 51,2 ± 1,1 року і 49,3 ± 1,6 року відповідно. Це цілком відповідає сталому твердженню, що більшість випадків захворюваності на спорадичну форму МК припадає на п’яту декаду життя [9, 17]. Вік хворих із родинною формою становив 19,6 ± 4,0 року (жінки) і 18,9 ± 1,2 року (чоловіки), з синдромом MEN-2 —31,5 ± 3,7 року та 38,3 ± 4,5 року відповідно. Пухлини мозкового шару надниркових залоз (феохромоцитоми та фео–хромобластоми) у хворих останньої групи реєстрували, як правило, раніше, ніж МК, що, з одного боку, може вказувати на більшу пенетрантність катехоламінпродукуючих пухлин при синдромах МЕN, а з іншого — на більш маніфестну клінічну картину пухлин надниркових залоз порівняно з МК (що свідчить про недостатній скринінг МК у даної групи хворих).
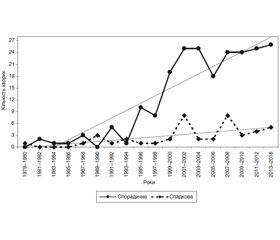
Як видно з даних, поданих на рис. 1, чисельність хворих із спорадичною формою МК ЩЗ починаючи з кінця минулого століття невпинно зростає, і кількість їх за останні 5 років (2013–2018 рр.) у 40 раз перевищує таку за перші 5 років спостереження (1979–1983 рр.). Така ж закономірність спостерігається щодо приросту кількості хворих жінок (рис. 2), тоді як число хворих чоловіків збільшується повільніше. Саме цим можна пояснити більше співвідношення між жінками та чоловіками із спорадичною формою хвороби, про що йшлося вище.
/12-1.jpg)
/13-1.jpg)
Динаміка збільшення числа хворих із спадковими формами МК ЩЗ, які прооперовані в Інституті, вказує на невелику швидкість приросту кількості таких хворих, про що свідчить характер лінії тренду (рис. 1). В літературі, проте, відмічено, що в останні два десятиліття збільшується кількість саме хворих із спадковими формами МК ЩЗ, і більшість дослідників пов’язують це з покращенням діагностики, що базується на молекулярно-генетичних дослідженнях, і поліпшенням системи реєстрації хворих [20].
В той же час низка авторів не виключають також роль негативних чинників довкілля, зокрема іонізуючої радіації, у збільшенні кількості хворих із МК ЩЗ [21, 22]. У зв’язку з цим ми провели аналіз розподілу хворих за місцем проживання, який показав, що розподіл за регіонами України для хворих із спадковими формами МК ЩЗ є рівномірним. Кількість хворих із спорадичною формою МК ЩЗ із східних, південних, північних та центральних областей у вибірці також є однаковою (18,9, 15,5, 18,9, 16,6 % відповідно), тоді як лише 4,8 % хворих із спорадичною формою МК ЩЗ є вихідцями із західних регіонів України. Найбільша кількість хворих, які знаходилися/знаходяться під наглядом у клініці Інституту, мешкали/мешкають у Києві (25,6 %).
Незважаючи на те, що ми не маємо виключно повної картини захворюваності на спорадичну форму МК ЩЗ в Україні, але враховуючи, що Інститут був і є основним осередком ендокринної хірургії в Україні, зокрема хірургічних втручань на ЩЗ, та має найбільшу вибірку хворих із МК ЩЗ, ми вважаємо, що маємо право зробити певні припущення щодо результатів проведеного аналізу. Відзначимо, що на частку 5 найбільш промислово забруднених (за даними Госкомстату України [23]) областей України — Донецької, Дніпропетровської, Луганської, Запорізької, Київської (і м. Києва) — припадає більше третини хворих із спорадичною формою МК ЩЗ з усіх хворих когорти (87 осіб, 38 %), тоді як на частку найбільш «чистих» областей — Чернівецької, Рівненської, Волинської, Тернопільської та Житомирської — у 3,6 раза менше (24 особи, 13,0 %; р < 0,0001 за χ2-критерієм). При цьому кількість хворих із перших чотирьох «чистих» областей становить 10 осіб, тоді як лише з п’ятої, Житомирської, що належить до регіонів, найбільш постраждалих від наслідків Чорнобильської аварії, — 14 осіб. З огляду на це зазначимо, що і серед найбільш забруднених областей України, які наведені вище, перше місце посідає Київська область (і м. Київ), що також належить до постраждалих від аварії регіонів (64 особи порівняно з 23 особами з чотирьох інших областей).
Останніми роками в літературі почали з’являтися роботи, присвячені з’ясуванню можливого канцерогенного впливу на організм людини інших (крім йоду) ізотопів, що містилися в аварійних викидах ЧАЕС [24]. Не маючи на сьогодні вагомих доказів впливу радіаційних чинників на виникнення МК ЩЗ, зауважимо, що при проведенні масштабних досліджень щодо з’ясування дії на організм цезію-137, який є одним із довгоживучих ізотопів, що потрапили в довкілля внаслідок аварії на ЧАЕС, показано певний зв’язок між накопиченням цього радіоелементу в організмі та підвищенням рівня у крові таких осіб деяких пухлинних маркерів. При цьому слід відзначити, що ці дослідження проведені на когорті саме мешканців Київської області, м. Києва та киян, які певний час знаходилися у 30-км зоні відчуження, а їх результати порівнювали з даними обстеження не тільки здорових осіб, але й осіб, які крім впливу цезію-137 мали також контакти (в рамках професійної діяльності) з різними шкідливими хімічними чинниками. Показано, що поряд з реєстрацією більшої частоти різних соматичних хвороб в осіб, які зазнали дії як хімічних чинників, так і іонізуючої радіації, має місце зниження функції ЩЗ одночасно зі збільшенням концентрації у крові тиреоглобуліну [25].
Крім того, при моделюванні різного дозового навантаження, яке створювали внаслідок тривалого аліментарного надходження в організм експериментальних щурів основних дозотвірних радіонуклідів чорнобильського викиду (134Cs, 137Cs, 137mBa) і зовнішнього низькоінтенсивного опромінення, були відмічені певні морфологічні зміни в тканині ЩЗ, зменшення маси залози та рівня вільного тироксину в крові, що вказує на зниження тиреоїдної функції у тварин обох статей [26].
З огляду на ці дані слід зазначити, що в літературі існує думка про можливий гальмівний вплив тиреоцитів на проліферацію С-клітин [27]. Отже, погіршення стану довкілля може бути однією з причин виникнення гіперплазії С-клітин і зростання в подальшому захворюваності на спорадичну форму МК ЩЗ. Ще раз підкреслимо, що причини виникнення соматичних мутацій гена RET у хворих із спорадичною формою МК ЩЗ невідомі.
Висновки
Таким чином, представлені дані свідчать про подібність когорти хворих із МК ЩЗ, що піддана аналізу, іншим вибіркам за такими характеристиками, як вік хворих і їх розподіл за формами хвороби [28, 29]. Зростання в останнє десятиліття кількості хворих із спорадичною формою МК ЩЗ і більша, ніж в інших вибірках, кількість хворих жінок свідчать про певні особливості причин виникнення цієї форми хвороби серед населення України і можуть бути пов’язаними з негативним впливом чинників довкілля, насамперед на жіночий організм.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Cakir М., Grossman A. Medullary thyroid cancer: molecular biology and novel molecular therapies // Neuroendocrinology. — 2009. — 90. — P. 323-348.
2. Esaki Y., Elihara S., Fujimoto Y. Analysis of thyroid carcinoma based on material registered in Jupan during 1977–1986 with special reference to predominance of papillary type // Cancer. — 1992. — 70. — P. 808-814.
3. Hundahl S., Fleming I., Fremgen A. et al. A National Cancer Data Base report on 53.856 cases of thyroid carcinoma treated in US 1985–1995 // Cancer. — 1998. — 83. — P. 2638-2648.
4. Thyroid cancer / Ed. by H. Biersack, F. Grunvald. — Berlin: Springer, 2001. — 300 p.
5. Paterson J., Greenlee R., Adams J. Thyroid cancer in Wales 1985–1996. A cancer registry-based study // Clin. Oncol. — 1999. — 11. — P. 245-251.
6. Романчишин А.Ф., Лисовенко О.В., Колосюк В.А. Медуллярный рак щитовидной железы // Современные аспекты хирургической эндокринологии. — СПб., 2003. — № 1. — С. 201-203.
7. Ильин А.А., Румянцев П.О., Исаев П.А. и др. Спорадический и семейный варианты медуллярного рака щитовидной железы // Проблемы эндокринологии. — 2003. — № 5. — С. 45-47.
8. Krysiak R., Marek B., Okopien B. Medullary thyroid cancer — the present state of art // Endokrynol. Pol. — 2008. — 59. — P. 446-455.
9. Рыбаков С.И. Рак щитовидной железы. — Полтава: ООО «АСМИ», 2012. — 572 с.
10. Pacini F., Castagna M., Cipri C., Schlumberger M. Medullary thyroid carcinoma // Clin. Oncol. — 2010. — 22. — P. 475-485.
11. Moura M., Cavaco B., Pinto A. et al. Correlation of RET somatic mutations with clinicopathological features in sporadic medullary thyroid carcinomas // Br. J. Cancer — 2009. — 100. — Р. 1777-1783.
12. Тонковид О.А., Коваленко А.Є. Медулярний рак щитоподібної залози: клініка, діагностика, лікування, прогноз (Огляд літератури та власні дослідження) // Ендокринологія. — 2007. — № 1. — С. 136-150.
13. Machens A., Brauckhoff M., Holzhausen H.-J. et al. Codon-specific development of pheochromocytoma in multiple endocrine neoplasia type 2 // J. Clin. Endocrinol. Metab. — 2005. — 90. — P. 3999-4003.
14. Черенько С.М., Ларин А.С., Нечай А.П. Медуллярный рак щитовидной железы: современное состояние проблемы и результаты собственных исследований // Проблеми ендокринної патології. — 2002. — № 1. — С. 10-15.
15. Кашин О.І., Дуда О.Р., Заставна Д.В., Бойко Н.І. Клінічно-діагностичні та генетичні аспекти медулярного раку щитоподібної залози // Львівський медичний часопис. — 2006. — № 1. — С. 187-190.
16. Bergholm V., Birstrom R., Ekbom A. et al. Long-term follow-up of patients with medullary thyroid carcinoma of the thyroid // Cancer. — 1997. — 79. — P. 132-138.
17. Matias-Guiu X., DeLellis R., Moley J. et al. Medullary thyroid carcinoma World Health Organization Classification of Tumours. Patho–logy and Genetics of Tumours of Endocrine Organs / Ed. by R. DeLellis, R. Lloyd, P. Heitz, C. Eng. — IARC Press: Lyon, 2004. — 8. — P. 86-91.
18. Пинский С.Б., Дворниченко В.В., Калинин А.П., Репета О.Р. Медуллярный рак щитовидной железы // Сибирский медицинский журнал. — 2008. — № 1. — С. 11-18.
19. Roman S., Lin R., Sosa J. Prognosis of medullary thyroid carcinoma: demographic, clinical, and pathologic predictors of survival in 1252 cases // Cancer. — 2006. — 107. — P. 2134-2142.
20. Schlumberger M. Familial medullary thyroid cartinoma // Thyroid international. — 2000. — 4. — P. 3-8.
21. Williams E., Dor P., Colon I. Prognostic factor in thyroid carcinoma // Arh. Endocr. — 1979. — 5. — P. 50-57.
22. Исаев П.А. Медуллярный рак щитовидной железы (комплексная лучевая диагностика и лечение): Автореф. дис. … канд. мед. наук. — Обнинск, 2004. — 21 с.
23. www.segodnya.ua/ukraine/ukraintsy-dyshat-khimiej-camye-zahrjaznennye-oblacti.html
24. Лушников Е.Ф. Взгляд патологоанатома на медицинские последствия Чернобыльской аварии: новообразования // Радиационная медицина. — 2008. — № 1. — С. 11-21.
25. Шишкина В.В., Чеботарева Э.Д., Замятин С.С. и др. Влияние некоторых факторов окружающей среды на концентрацию в сыворотке крови опухолевых маркеров и показатели, характеризующие состояние щитовидной железы // Лікарська справа. — 1994. — № 7–8. — С. 31-35.
26. Богданова Т.І., Мишуніна Т.М., Алесіна М.Ю. та ін. Морфофункціональні характеристики стану щитоподібної залози щурів, що зазнавали тривалої дії інкорпорованих радіонуклідів і зовнішнього опромінення // Вплив радіаційного фактора Чорнобильської зони відчуження на організм тварин. — К.: Атіка, 2006. — С. 58-75.
27. Архипенко В.И., Федченко Н.П., Гербильский Л.В. Морфогенез медуллярного рака щитовидной железы // Экспериментальная онкология. — 1982. — № 1. — С. 14-17.
28. Кваченюк А.М. Хлодитанотерапія адренокортикального раку // Лікарська справа. — 2004. — № 8. — С. 64-67.
29. Castinetti F., Maia A.L., Peczkowska M., Barontini M., Hasse-Lazar K., Links T.P., Toledo R.A., Dvorakova S., Mian C., Bugalho M.J., Zovato S., Alevizaki M., Kvachenyuk A., Bausch B., Loli P., Bergmann S.R., Patocs A., Pfeifer M., Costa J.B., Dobschuetz E., Letizia C., Valk G., Barczynski V., Czetwertynska M., Plukker J.T.M., Sartorato P., Zelinka T., Vlcek P., Yaremchuk S., Weryha G., Canu L., Wohllk N., Sebag F., Walz M.K., Eng C., Neumann H.P.H. The penetrance of MEN2 pheochromocytoma is not only determined by RET mutations // Endocrine-Related Cancer. — 2017. — 24 (8). — L63-L67.

/12-1.jpg)
/13-1.jpg)