Вступ
Визначення способів підвищення чутливості й подолання резистентності пухлинних клітин до хіміотерапевтичного лікування є одним з основних напрямів сучасних фундаментальних і клінічних досліджень. Патогенетично одним з важливих факторів, що впливають на загибель пухлинних клітин, є стан окисно-відновної рівноваги (редокс-стан, редокс-гомеостаз). Глутатіон є одним з основних клітинних окислювально-відновних компонентів завдяки низькому стандартному окислювально-відновному потенціалу й високій внутрішньоклітинній концентрації в клітинах еукаріотів.
Глутатіон (γ-L-глутаміл-L-цистеїніл-гліцин) — трипептид, який є найбільш поширеним непротеїновим тіолом, що міститься у живих організмах і виконує численні функції. Глутатіон існує у двох формах — відновленій (GSH) та окисленій (дисульфід глутатіону, GSSG) і міститься в усіх клітинних компартментах. Найбільша його частка (85 %) знаходиться в цитоплазмі, менша (10–15 %) — у мітохондріях та ендоплазматичному ретикулумі [1]. Основним резервуаром GSH у ссавців є печінка, звідки він виділяється в значній кількості в кров і жовч [9].
Система глутатіону, що включає власне глутатіон і ще три ферменти (глутатіонпероксидазу, глутатіонтрансферазу й глутатіонредуктазу), є єдиною в організмі, що задіяна в трьох лініях антиоксидантного захисту з чотирьох існуючих.
Контроль внутрішньоклітинного гомеостазу глутатіону є складним процесом, що відбувається за рахунок його синтезу, споживання й деградації. Клітинний GSH синтезується de novo з прекурсорів (амінокислот глутамату, цистеїну, гліцину), відбувається відновлення GSSH глутатіонредуктазою і поглинання клітиною екстрацелюлярного глутатіону.
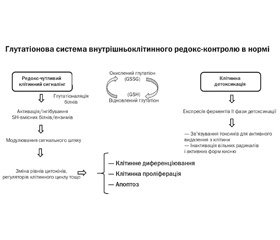
Глутатіоновий статус — співвідношення GSH/GSSG — є одним з ключових компонентів підтримки редокс-гомеостазу в клітині. Відношення концентрацій відновленого й окисленого глутатіону в нормі становить 10 : 1, а зменшення співвідношення є маркером оксидативного стресу. Системі глутатіону належить основна роль у підтримці клітковинного редокс-гомеостазу за рахунок участі в тіол-дисульфідному обміні, що обумовлює не тільки його антиоксидантні властивості, але й участь у регуляції генної експресії, активності деяких ензимів, метаболічних процесах тощо.
Найбільш здатною до реакції є окислена форма глутатіону, що активує ферменти глутатіонової системи в цитозолі, мікросомах й мітохондріях (рис. 1).
Підвищені рівні GSH спостерігаються у багатьох пухлинах, що робить їх більш резистентними до хіміотерапії [10]. GSH діє як антиоксидант завдяки наявності активної тіолової групи в цистеїновому залишку. Іншим варіантом дії GSH є безпосередня взаємодія з активними формами кисню чи азоту та інших електрофілів. Окрім цього, GSH виступає як кофактор для різноманітних ензимів.
Активні форми кисню (H2O2, O2–, OH– та інші) розглядаються як один з основних тригерів ініціації та прогресування пухлинного процесу завдяки їх здатності до промоції нестабільності геному й активації сигнальних шляхів [4, 5]. Вироблення активних форм кисню є фізіологічним процесом для аеробних клітин. Дія ушкоджувальних факторів на клітину призводить до збільшення їх продукції. Фізіологічні рівні активних форм кисню є медіаторами важливих міжклітинних сигнальних шляхів. Проте надмірне утворення активних форм кисню призводить до ушкодження клітини та її смерті.
Оксидантний стрес відіграє роль у виникненні й прогресуванні злоякісних новоутворень, що дає підстави розглядати антиоксидантне лікування як профілактичний захід щодо їх виникнення. З іншого боку, прооксидантна терапія, включаючи іонізуючу радіацію і хіміотерапевтичні сполуки, широко використовується в клінічній практиці й ґрунтується на погляді, що додатковий оксидантний вплив має призводити до колапсу антиоксидантної системи й клітинної загибелі. Проте цей підхід дав незадовільний результат щодо багатьох пухлин, які мають надмірну експресію антиоксидантів, що призводить до їх резистентності [10].
Для запобігання цьому існує адаптивний механізм відповіді, що полягає в компенсаторній відповіді антиоксидантних систем і досягненні окисно-відновного гомеостазу. Глутатіон відіграє важливу захисну роль щодо різних форм клітинної загибелі, включаючи апоптоз, некроз, фероптоз і автофагію [6].
Метаболізм глутатіону в пухлинних клітинах порушується. Рівень внутрішньоклітинного глутатіону в них значно вищий порівняно з нормальними клітинами. Показана сильна кореляція між підвищеним рівнем внутрішньоклітинного глутатіону й резистентністю до прооксидантної хіміотерапії [2, 3].
У наукових публікаціях роль активних форм кисню в онкогенезі часто порівнюється з двосічним мечем. Активні форми кисню є промоторами ініціації пухлинного процесу через індукцію мутагенезу і, можливо, активацію сигнальних шляхів, що є промоторами проліферації, виживаності й стійкості до стресових факторів. З іншого боку, активні форми кисню стримують ріст пухлинних клітин, спричинюючи летальний оксидативний стрес. Отже, антиоксиданти, у тому числі GSH, можуть відігравати подвійну роль через знешкодження активних форм кисню і/або регуляцію окисно-відновних процесів [6].
Теоретично обґрунтованою стратегією для запобігання злоякісним новоутворенням вважається застосування антиоксидантів або стимуляція клітинної антиоксидантної активності. Проте результати експериментальних досліджень даного питання є неодно–значними. Встановлено, що підвищення рівня глутатіону асоційоване з проліферацією як нормальних, так і злоякісних клітин.
Іншим важливим механізмом впливу глутатіону й глутатіон-S-трансферази (GST) є участь у детоксикації ксенобіотиків. Роль GST полягає в каталізації кон’югації GSH з іншими речовинами і, як наслідок, їх подальшому виведенні з організму. Ряд широко застосовуваних в онкологічній практиці хіміотерапевтичних речовин (кармустин, бусульфан, бросталіцин, карбоплатин, цисплатин, оксаліплатин, мелфалан, хлорамбуцил, доксорубіцин, паклітаксел, доцетаксел, циклофосфамід, етопозид, тіотепа та інші) є субстратом для GST [6–8, 18].
Окрім безпосереднього впливу на процеси детоксикації, GST взаємодіє з численними сигнальними шляхами (JNK1, MAPK, TRAF2-ASK1, p38, р53, Trx та інші). Варіанти їх взаємодії на молекулярному рівні на сьогодні є достатньо вивченими, їх детальний опис поданий у численних публікаціях. Система глутатіону продовжує привертати увагу дослідників як потенційна мішень для пригнічення пухлинної прогресії та подолання резистентності пухлин до хіміотерапевтичного лікування [6, 10].
Терапевтичний потенціал GSH і GSH-модулюючих агентів продовжує активно досліджуватись. Як окрема діюча речовина GSH не може призначатися в клінічній практиці. Тому розроблено ряд прекурсорів і хімічно модифікованих аналогів з метою імітації численних фізіологічних і фармакологічних ефектів глутатіону. Розглянемо наявні в науковій періодиці дані щодо клінічного застосування в онкологічних хворих препаратів, що впливають на систему глутатіону.
Етакринова кислота та її аналоги були одними з перших досліджуваних інгібіторів GST. Вони робили пухлинні клітини більш чутливими до цитотоксичного впливу алкілуючих агентів, проте для них були характерні виражені побічні явища. Більш перспективними були результати досліджень етакраплатини, молекули цисплатини, що містила два ліганди етакринової кислоти, й етакраплатин-вмісних міцел. Ці препарати, а також ауранофін дозволяли повернути чутливість до препаратів платини при надмірній експресії пухлинними клітинами GST [18].
Telintra (TLK199) — інший інгібітор GST-P1-1, що був розроблений із метою профілактики мієлосупресії при захворюваннях крові, а саме при мієлодиспластичному синдромі, ефективність якого доведена за результатами дослідження ІІ фази [14, 19, 22].
З відомих і широко застосовуваних у клінічній практиці препаратів інгібіторний вплив на GST мають α-токоферол (вітамін Е), омепразол, метформін і рифампіцин. Описаний інгібіторний ефект щодо GST низки біологічно активних речовин рослинного походження (алое-емодин, бенастатини, флавоноїди, рослинні поліфеноли й алкалоїди). Проте вираженість їх ефекту в стандартних дозах є недостатньою для досягнення терапевтичного впливу на GST [18].
N-ацетилцистеїн є раннім аналогом GSH, на той час як YM737, що є моноестером GSH, має ряд переваг порівняно зі своїм попередником [11]. Іншим GSH аналогом є цистеїн-заміщений S-нітрозоглутатіон [12].
Telcyta (TLK-286) є аналогом GSH, що застосовується в комбінації з такими хіміотерапевтичними препаратами, як препарати платини, таксани, антрацикліни, при різних видах злоякісних пухлин (рак яєчника, рак фаллопієвих труб, недрібноклітинний рак легені), для яких характерна підвищена експресія гена GST-P1-1 [13, 20].
Інгібітори γ-глутамілтранспептидази були розроблені з метою зниження рівня внутрішньоклітинного GSH і пригнічення позаклітинного знешкодження препаратів. Ця група препаратів виявилась занадто токсичною для використання в людини.
Імексон знижує рівні окисленого й відновленого глутатіону в онкологічних хворих. Проте за результатами дослідження ІІ фази препарат не впливає на виживаність пацієнтів із раком підшлункової залози [21].
Триоксид миш’яку (As2O3) є прооксидантною речовиною, що дозволяє зменшувати рівень внутрішньоклітинного GSH. Препарат отримав підтвердження Управління продовольства й медикаментів США (FDA) у 2000 р. для лікування негострої промієлоцитарної лейкемії в пацієнтів, які мають рецидив захворювання або є рефрактерними щодо першої лінії терапії з використанням антрациклінів і ретиноїдів [17, 20].
Дисульфірам не спричиняє виснаження загального GSH, проте впливає на співвідношення його окисленої й відновленої форм у бік окислення [10]. За результатами дослідження ІІ фази, препарат у комбінації із цисплатином і вінорельбіном дозволяє покращити показники виживаності пацієнтів з метастатичним недрібноклітинним раком легені й задовільно переноситься [23].
Як інша мішень впливу розглядався процес S-глутатіонування, що має прямий зв’язок з розвитком і перебігом пухлинного процесу, оскільки він характерний для численних сигнальних шляхів. Найбільш дослідженим представником цієї групи препаратів є NOV-002 (disodium glutathione disulfide), у якого була встановлена можливість впливати на співвідношення відновленого/оксиленого глутатіону за рахунок підвищення концентрації GSSG, генерації швидкоплинного помірного внутрішньоклітинного сигналу, що індукує S-глутатіонування.
У дослідженнях in vitro NOV-002 чинив інгібіторну дію на інвазивну спроможність пухлинних клітин, проліферацію клітин раку яєчника й меланоми і протилежну дію — на культури клітин мієломи.
Досліджено взаємодію Глутоксиму з маркером множинної медикаментозної резистентності Р-глікопротеїном (Pgp), а також вплив Глутоксиму на внутрішньоклітинне накопичення доксорубіцину.
Вважають, що препарат Глутоксим може розглядатися як інгібітор множинної медикаментозної резистентності, асоційованої з функцією Pgp [30].
Було встановлено також імуномодулюючі властивості, зокрема підвищення рівня циркулюючих Т-клітин і вплив на супресорні клітини мієлоїдного походження (Myeloid Derived Suppressor Cell, MDSC) в онкологічних хворих, які отримували хіміотерапію [24, 25].
Такі результати лабораторних досліджень стали підґрунтям для проведення клінічних досліджень.
У дослідженні NEO-NOVO оцінювали клінічний ефект при додаванні NOV-002 до неоад’ювантної хіміотерапії (доксорубіцин + циклофосфамід з подальшим призначенням доцетакселу) первинного HER-2-негативного раку молочної залози II–IIIс стадій. У дослідження було залучено 41 пацієнтку, кінцевими його точками були: частота повної морфологічної відповіді, визначення показників профілю токсичності, кореляції між рівнем супресорних клітин мієлоїдного походження і рівнем морфологічної відповіді або її відсутністю. Рівень повної морфологічної відповіді в групі пацієнток, які отримували NOV-002, був удвічі вищим (32 проти 16 % (α = 0,05, β = 80 %)). Додавання NOV-002 до програми хіміотерапії добре переносилось і, вочевидь, не збільшувало токсичність, пов’язану з основним протипухлинним лікуванням за програмою AC→T. З огляду на дані попередніх досліджень щодо імуномодулюючої активності NOV-002 була висунута гіпотеза про ефективність лікування за програмою, що вивчалась, у пацієнток з високим рівнем MDSC до лікування. Це припущення знайшло підтвердження: у пацієнток із повною морфологічною ремісією після хіміотерапії, які отримували NOV-002, були низькі рівні MDSC як до, так і після хіміотерапії. Автори доходять думки про доцільність більш масштабних досліджень 3-ї фази [27].
Наступне клінічне дослідження ІІІ, яке проводилось у 2006–2010 рр., — відкрите рандомізоване контрольоване дослідження, у якому порівнювалось застосування NOV-002 у комбінації з хіміотерапією 1-ї лінії (паклітаксел + карбоплатин) і тільки хіміотерапії в пацієнтів із поширеним недрібноклітинним раком легень. Первинною кінцевою точкою була загальна виживаність, вторинні — виживаність без прогресування, рівень відповіді на лікування та її тривалість, якість життя, гематологічна токсичність. Планувалось залучення понад 800 пацієнтів. На сьогодні дані, отримані в цьому дослідженні, перебувають на розгляді Національної лабораторії медицини і перевірці контролю якості (згідно з даними сайту https://clinicaltrials.gov) [15, 26].
З огляду на те, що серед механізмів резистентності до препаратів платини є вплив на редокс-потенціал пухлинної клітини, в одному з перших клінічних досліджень NOV-002 вивчались переносимість, рівень об’єктивної відповіді й виживаність без прогресування (PFS) у 15 жінок із платинорезистентним раком яєчника, маткової труби або перитонеальним раком, які вже отримували 3 лінії хіміотерапії. NOV-002 щоденно вводили з карбоплатином. Необхідно зазначити, що ефективність сальважної терапії в цієї категорії пацієнток коливається в межах 10–20 % при PFS, що не перевищує 8 тижнів у 4-й лінії хіміотерапії. У дослідженні не було зареєстровано небажаних ефектів 4-го ступеня токсичності, жодного випадку фебрильної нейтропенії. Найчастіше небажаними ефектами були нудота і слабкість, проте біль у животі й кишкова непрохідність були зазвичай обумовлені проявами ракової хвороби. Повну ремісію зареєстрували в 1 випадку, часткову — у 7 осіб, прогресування хвороби — у 5. Час без проявів прогресування становив 14 тижнів. Останні результати дослідження були повідомлені у 2015 р.: середня PFS становила 19,4 тижня (з коливаннями від 4 до 38 тижнів) [16].
Застосування Глутоксиму у хворих на рак шийки матки, які отримували поєднану променеву терапію, і пацієнтів із місцево-поширеним раком шлунка на етапах хіміотерапевтичного лікування дозволяло зменшити вираженість небажаних ефектів спеціального лікування [28, 29].
NOV-002 під торговою назвою Глутоксим дозволений для використання і входить до методичних рекомендацій з лікування дисплазії шийки матки в жінок фертильного віку в Україні. У Російській Федерації Глутоксим включений до методичних рекомендацій як терапія супроводу при антибактеріальній, противірусній і протипухлинній терапії. Управління продовольства і медикаментів США дозволяє застосування –NOV-002 у межах клінічних випробувань [20]. Глутоксим є першим лікарським засобом диференційованої дії, що чинить позитивний комплексний вплив на нормальні клітини організму, з одного боку, а з іншого — ініціює процес елімінації з організму генетично дефектних клітин (пухлинних, уражених вірусами), що реалізується за участю Ras-сигнального каскаду протеїнкіназ як р53-залежним, так і р53-незалежним шляхом [31].
Іншими потенційно терапевтичними агентами щодо системи глутатіону вважаються фенольні антиоксиданти (α-нафтофлавон, бутильований гідроксіанізол, трет-бутилгідрохінон), синтетичні антиоксиданти (етоксихін, олтипраз, естери форболу), тритерпеноїдні аналоги (похідні олеанолової кислоти, сесквітерпени), ізотіоціанати (сульфорафан). Проте, незважаючи на теоретичну їх перспективність і наявність низки результатів фундаментальних досліджень, результати клінічних випробувань цих препаратів на сьогодні невідомі.
Висновки
1. Система глутатіону в контексті лікування онкологічних хворих активно досліджується вже понад три десятиліття. Встановлено численні її взаємозв’язки з розвитком і прогресуванням злоякісних новоутворень. Водночас її функціонування є життєво необхідним для підтримання окисно-відновного гомеостазу нормальних клітин організму людини. З огляду на важливу роль глутатіону в клітинній загибелі й розвитку резистентності до хіміотерапевтичних сполук перспективним є подальший пошук важелів впливу на глутатіон-опосередковані механізми.
2. Маючи унікальну здатність індукувати р53-залежний і р53-незалежний шляхи апоптозу тільки в трансформованих клітинах, Глутоксим принципово підвищує чутливість уражених клітин до хіміотерапії. Активуючи процеси метаболізму, проліферації та диференціювання нормальних клітин, Глутоксим одночасно підвищує стійкість інтактних клітин до впливу хіміопрепаратів, запобігаючи тим самим розвитку гепато-, нефро-, кардіо- й нейротоксичності.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Lu S.C. Glutathione synthesis. Biochim Biophys Acta. 2013. 1830. 3143–3153.
2. Balendiran G.K., Dabur R., Fraser D. The role of glutathione in cancer. Cell Biochem Funct. 2004. 22. 343–352.
3. Estrela J.M., Ortega A., Obrador E. Glutathione in cancer biology and therapy. Crit. Rev. Clin. Lab. Sci. 2006. 43. 143–181.
4. Hussain S.P., Hofseth L.J., Harris C.C. Radical causes of cancer. Nat. Rev. Cancer. 2003. 3. 276–285.
5. Tafani M., Sansone L., Limana F., Arcangeli T., De Santis E., Polese M., Fini M., Russo M.A. The interplay of reactive oxygen species, hypoxia, inflammation, and sirtuins in cancer initiation and progression. Oxid Med. Cell Longev. 2016. 3907147. 2016.
6. Hatem E., El Banna N., Huang M.E. Multifaceted Roles of Glutathione and Glutathione–Based Systems in Carcinogenesis and Anticancer Drug Resistance. Antioxid Redox Signal. 2017 Nov 20. 27(15). 1217–1234.
7. Di Pietro G., Magno L.A., Rios–Santos F. Glutathione S–transferases: an overview in cancer research. Expert Opin. Drug Metab. Toxicol. 2010. 6. 153–170.
8. Hayes J.D., Flanagan J.U., Jowsey I.R. Glutathione transferases. Ann. Rev. Pharmacol. Toxicol. 2005. 45. 51–88.
9. Bartoli G.M., Sies H. Reduced and oxidized glutathione efflux from liver. FEBS Lett. 1978. 86(1). 89–91.
10. Traverso N., Ricciarelli R., Nitti M., Marengo B., Furfaro A.L., Pronzato M.A., Marinari U.M., Domenicotti C. Role of glutathione in cancer progression and chemoresistance. Oxid Med. Cell Longev. 2013. 2013. 972913.
11. Shibata S., Tominaga K., Watanabe S. Glutathione protects against hypoxic/hypoglycemic decreases in 2–deoxyglucose uptake and presynaptic spikes in hippocampal slices. Eur. J. Pharmacol. 1995 Jan 24. 273(1–2). 191–5.
12. Chakrapani H., Kalathur R.C., Maciag A.E., Citro M.L., Ji X., Keefer L.K., Saavedra J.E. Synthesis, mechanistic studies, and anti–proliferative activity of glutathione/glutathione S–transferase–activated nitric oxide prodrugs. Bioorg Med. Chem. 2008 Nov 15. 16(22). 9764–71.
13. Wu J.H., Miao W., Hu L.G., Batist G. Identification and characterization of novel Nrf2 inducers designed to target the intervening region of Keap1. Chem. Biol. Drug Des. 2010 May. 75(5). 475–80.
14. Hamilton D., Batist G. TLK–199 Telik. IDrugs. 2005 Aug. 8(8). 662–9.
15. Fidias P., Novello S. Strategies for prolonged therapy in patients with advanced non–small–cell lung cancer. J. Clin. Oncol. 2010 Dec 1. 28(34). 5116–23.
16. Matulonis U.A., Horowitz N.S., Campos S.M., Lee H., Lee J, Krasner C.N., Berlin S., Roche M.R., Duska L.R., Pereira L., Ken–dall D., Penson R.T. Phase II study of carboplatin and pemetrexed for the treatment of platinum–sensitive recurrent ovarian cancer. J. Clin. Oncol. 2008 Dec 10. 26(35). 5761–6.
17. Fruehauf J.P., Meyskens F.L. Jr. Reactive oxygen species: a breath of life or death? Clin. Cancer Res. 2007 Feb 1. 13(3). 789–94.
18. Pljesa–Ercegovac M., Savic–Radojevic, Matic M., Coric V., Djukic T., Radic T., Simic T. Glutathione Transferases: Potential Targets to Overcome Chemoresistance in Solid Tumors. Int. J. Mol. Sci. 2018 Nov 28. 19(12). pii: E3785.
19. Singh S. Cytoprotective and regulatory functions of glutathione S–transferases in cancer cell proliferation and cell death. Cancer Chemother. Pharmacol. 2015. 75. 1–15.
20. Corso C.R., Acco A. Glutathione system in animal model of solid tumors: From regulation to therapeutic target. Crit. Rev. Oncol. Hematol. 2018 Aug. 128. 43–57.
21. Cohen S.J., Zalupski M.M., Conkling P., Nugent F., Ma W.W., Modiano M., Pascual R., Lee F.C., Wong L., Hersh E. A phase 2 randomized, double–blind, multicenter trial of imexon plus gemcitabine versus gemcitabine plus placebo in patients with metastatic chemotherapy–naïve pancreatic adenocarcinoma. Am. J. Clin. Oncol. 2018 Mar. 41(3). 230–235.
22. Raza A., Galili N., Smith S.E., Godwin J., Boccia R.V., Myint H., Mahadevan D., Mulford D., Rarick M., Brown G.L., Schaar D., Faderl S., Komrokji R.S., List A.F., Sekeres M. A phase 2 randomized multicenter study of 2 extended dosing schedules of oral ezatiostat in low to intermediate–1 risk myelodysplastic syndrome. Cancer. 2012 Apr 15. 118(8). 2138–47.
23. Nechushtan H., Hamamreh Y., Nidal S., Gotfried M., Ba–ron A., Shalev Y., Nisman B., Peretz T., Peylan–Ramu N. A phase IIb trial assessing the addition of disulfiram to chemotherapy for the treatment of metastatic non–small cell lung cancer. Oncologist. 2015 Apr. 20(4). 366–7.
24. Townsend D.M., He L., Hutchens S., Garrett T.E., Pazoles C.J., Tew K.D. NOV–002, a glutathione disulfide mimetic, as a modulator of cellular redox balance. Cancer research. 2008. 68(8). 2870–2877.
25.Townsend D.M., Pazoles C.J., Tew K.D. NOV–002, a mimetic of glutathione disulfide. Expert opinion on investigational drugs. 2008. 17(7). 1075–1083.
26. https://clinicaltrials.gov/ct2/show/results/NCT00347412? term=NOV–002&rank=3
27. Montero A.J., Diaz–Montero C.M., Deutsch Y.E. et al. Phase 2 study of neoadjuvant treatment with NOV–002 in combination with doxorubicin and cyclophosphamide followed by docetaxel in patients with HER–2 negative clinical stage II–IIIc breast cancer. Breast Cancer Res Treat. 2012 Feb. 132(1). 215–23. doi: 10.1007/s10549–011–1889–0. Epub 2011 Dec.
28. Манихас Г.М., Филатова Е.И., Антонов В.Г. Применение препарата глутоксима при сочетанной лучевой терапии местно–распространенного рака шейки матки. Российский онкологический журнал. 2008. 1. 23–28.
29. Манихас Г.М., Жукова Н.В. Качество жизни больных местнораспространенным оперированным раком желудка на этапах химиотерапевтического лечения. Вопросы онкологии. 2012. 5. 679–683.
30. Богуш Т.А., Дудко Е.А., Богуш Е.А., Кирсанов В.Ю., Антонов В.Г. Глутоксим как ингибитор фенотипа множественной лекарственной резистентности, ассоциированной с экспрессией Рgp. Антибиотики и химиотерапия. 2010. 55. 5–6.
31. Kozhemyakin L., Ketlinskaya O., Romanova S. et al. New Generation Drugs at Treatment of Viral Hepatitis: Differentiated Effect on Normal and Virus–Infected Cells. ExConsilio. 1999. 1. 59–65.

/17-1.jpg)