Международный неврологический журнал №5 (107), 2019
Вернуться к номеру
Клініка і діагностика наслідків травматичних ушкоджень лицевого нерва
Авторы: Цимбалюк Я.В. (1), Третяк І.Б. (1), Цимбалюк В.І. (2), Третьякова А.І. (1), Гацький О.О. (1)
1 - ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України», м. Київ, Україна
2 - Національний медичний університет ім. О.О. Богомольця, м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Актуальність. Наслідки ушкодження лицевого нерва (ЛН) є серйозною медичною та соціальною проблемою, оскільки руйнівно впливають на низку важливих аспектів людського життя (економічні, психологічні, естетичні), що значно знижує якість життя хворих. Мета дослідження: поліпшити результати хірургічного лікування хворих з ушкодженнями лицевого нерва шляхом оптимізації діагностики функціонального стану ЛН залежно від клінічного симптомокомплексу й оптимізації хірургічних методів лікування. Матеріали та методи. Додаткові інструментальні методи дослідження, а саме клініко-нейрофізіологічні (НФ), було проведено в 67 пацієнтів із наслідками ушкодження ЛН за період із 2012 по 2017 р. Ступінь порушення функції лицевого нерва оцінювали за шкалою House — Brackmann. Додатково застосовували такі нейровізуалізуючі методи, як комп’ютерна томографія, магнітно-резонансна томографія, рентгенологічне та аудіометричне дослідження. Серед методів НФ-діагностики було використано: стимуляційну електроміографію, реєстрацію мигального рефлексу та голкову стимуляційну електроміографію. Комплекс нейрофізіологічної діагностики здійснювався на обладнанні «Нейро-МВП-4» («Нейрософт», РФ). Результати. Середні показники відновлення функції ЛН за шкалою House — Brackmann дорівнювали 2,94 ± 0,12 бала у групі хворих, яким проводили хірургічне лікування після 6 місяців після травми, і 2,45 ± 0,10 бала в групі хворих, які були прооперовані в терміни до 6 місяців після ушкодження ЛН. Між групами отримано відмінність на рівні значимості p = 0,017. Тобто кращі показники відновлення функції ЛН були в пацієнтів, у яких хірургічне втручання було проведено у більш ранньому періоді після травми (р < 0,05). У нашому дослідженні кількість пацієнтів, у яких отримано високі показники відновлення (за шкалою House — Brackmann ІІ–ІІІ ст.) у терміни після 12 міс. після операції становила 60 із 67 (89,55 %), серед них максимальні показники відновлення до II ст. ми спостерігали у 27 пацієнтів (40,3 %). Гірші показники відновлення функції мімічних м’язів (до IV–V ст. за шкалою House — Brackmann) спостерігалися в 7 хворих (10,45 %). На результат лікування останньої категорії хворих негативно впливали значні терміни проведення хірургічного лікування після отримання травми і неповне дотримання рекомендацій із приводу реабілітаційного лікування в післяопераційному періоді. Показники різниці клінічних результатів відновлення залежно від етіології ушкодження не є статистично значущими. Висновки. Рання діагностика ушкодження лицевого нерва із застосуванням загальноприйнятих шкал та додаткових інструментальних методів важлива для визначення подальшої тактики ведення хворого, визначення ефективності проведеної реіннервації і прогнозу відновлення функції ЛН.
Актуальность. Последствия повреждения лицевого нерва (ЛН) являются серьезной медицинской и социальной проблемой, поскольку оказывают разрушительное воздействие на ряд важных аспектов человеческой жизни (экономические, психологические, эстетические), что значительно снижает качество жизни больных. Цель исследования: улучшить результаты хирургического лечения больных с повреждениями лицевого нерва путем оптимизации диагностики функционального состояния ЛН в зависимости от клинического симптомокомплекса и оптимизации хирургических методов лечения. Материалы и методы. Дополнительные инструментальные методы исследования, а именно клинико-нейрофизиологические, были проведены у 67 пациентов с последствиями повреждения ЛН за период с 2012 по 2017 г. Степень нарушения функции лицевого нерва оценивали по шкале House — Brackmann. Дополнительно применяли такие нейровизуализирующие методы, как компьютерная томография, магнитно-резонансная томография, рентгенологические и аудиометрические исследования. Среди методов НФ-диагностики были использованы: стимуляционная электромиография, регистрация мигательного рефлекса и игольчатая стимуляционная электромиография. Комплекс нейрофизиологической диагностики осуществлялся на оборудовании «Нейро-МВП-4» («Нейрософт», РФ). Результаты. Средние показатели восстановления функции ЛН по шкале House — Brackmann составили 2,94 ± 0,12 балла в группе больных, которым проводили хирургическое лечение после 6 месяцев после травмы и 2,45 ± 0,10 балла в группе больных, которые были прооперированы в сроки до 6 месяцев после повреждения ЛН. Между группами получено отличие на уровне значимости p = 0,017. То есть лучшие показатели восстановления функции ЛН были у пациентов, у которых хирургическое вмешательство было проведено в более раннем периоде после травмы (р < 0,05). В нашем исследовании количество пациентов, у которых получены высокие показатели восстановления (по шкале House — Brackmann II–III ст.) в сроки после 12 мес. после операции, составило 60 из 67 (89,55 %), среди них максимальные показатели восстановления до II ст. мы наблюдали у 27 пациентов (40,3 %). Худшие показатели восстановления функции мимических мышц (к IV–V ст. по шкале House — Brackmann) наблюдались у 7 больных (10,45 %). На результат лечения последней категории больных негативно влияли значительные сроки проведения хирургического лечения после получения травмы и неполное соблюдение рекомендаций по поводу реабилитационного лечения в послеоперационном периоде. Показатели разницы клинических результатов восстановления в зависимости от этиологии повреждения не являются статистически значимыми. Выводы. Ранняя диагностика повреждения лицевого нерва с применением общепринятых шкал и дополнительных инструментальных методов важна для определения дальнейшей тактики ведения больного, определения эффективности проведенной реиннервации и прогноза восстановления функции ЛН.
Background. The consequences of damage to the facial nerve (FN) is a serious medical and social problem, since they have a devastating impact on a number of important aspects of human life (economic, psychological, aesthetic), which significantly reduces the quality of patients’ life. The aim of the study is to improve the results of surgical treatment of patients with FN damage by optimizing the diagnosis of the FN functional state depending on the clinical signs and optimizing the surgical treatment me-thods. Materials and methods. Additional instrumental methods of research, namely, clinical and neurophysiological, were used in 67 patients with consequences of FN damage from 2012 to 2017. The degree of facial nerve dysfunction was assessed using House-Brackmann scale. Additionally, the following neuroimaging methods were used: computed tomography, magnetic resonance imaging, X-ray and audiometric. Among the methods of neurophysiological diagnosis, we used: stimulation electromyography (EMG), re-gistration of blink reflex and needle EMG. Neurophysiological diagnosis made on the Neuro-MVP-4 equipment (Neurosoft, RF). Results. The average recovery rate of FN function on the House-Brackmann scale was 2.94 ± 0.12 points in the group of patients who underwent surgical treatment later than 6 months after the injury, and 2.45 ± 0.10 points in the group of patients who were operated on within 6 months after FN injury. The difference between the groups was obtained at a significance level of p = 0.017. That is, better indicators of the FN function recovery were in patients in whom surgery was performed earlier in the post-injury period (p < 0.05). In our study, the number of patients with high recovery rates (on the scale of House-Brackmann II–III) within 12 months after the surgery was 60 out of 67 (89.55 %), among them the maximum recovery rates to level II we observed in 27 patients (40.3 %). The worst indicators of the restoration of the facial muscles function (to level IV–V on the House-Brackmann scale) were observed in 7 patients (10.45 %). Treatment outcome in the latter category of patients was negatively influenced by both the significant timing of surgical treatment after injury, and incomplete compliance with the recommendations for rehabilitation treatment in the postoperative period. Indicators of the difference in clinical outcomes of recovery depending on the etiology of the damage are not statistically significant. Conclusions. Early diagnosis of facial nerve damage with the use of generally accepted scales and additional instrumental methods is important for determining the further management of the patient, the effectiveness of the reinnervation and the prediction of the FN function recovery.
травма; лицевий нерв; діагностика; електронейроміографія; мімічні м’язи
травма; лицевой нерв; диагностика; электронейромиография; мимические мышцы
trauma; facial nerve; diagnosis; electroneuromyography; facial muscles
Вступ
Наслідки ушкодження лицевого нерва є серйозною медичною та соціальною проблемою, оскільки мають руйнівний вплив на низку важливих аспектів людського життя (економічні, психологічні, естетичні), що значно знижує якість життя хворих.
Серед усіх черепних нервів лицевий нерв (ЛН) посідає перше місце за частотою ураження. Частота периферичного паралічу м’язів обличчя становить 23–35 випадків на 100 тис. населення [1–3]. Найчастіше страждають від даного захворювання особи працездатного віку, а частка хворих віком від 10 до 30 років становить 60–70 % [4, 5].
Лицевий нерв може бути ушкоджений як внаслідок дії травматичних факторів, так і при низці хірургічних втручань. Такі травматичні чинники, як черепно–мозкова травма (ЧМТ) із переломом піраміди скроневої кістки, вогнепальне поранення, дорожньо–транспортна пригода, відкрита травма м’яких тканин обличчя, можуть супроводжуватися тяжким ушкодженням лицевого нерва з випадінням його функції. Інтраопераційне ушкодження лицевого нерва найчастіше спостерігається при видаленні неврином слухового нерва, при втручанні на привушній залозі, після втручання на структурах середнього вуха з приводу запальних і пухлинних захворювань, після видалення базальних пухлин, при естетичних операціях тощо.
Клініка. Клінічна картина є різною залежно від місця ушкодження нерва. Різноманіття симптомів і про–явів ознак ушкодження ЛН пов’язане з тим, що сам нерв несе рухові волокна, в тому числі до m. stapedius. Він також забезпечує автономну іннервацію слізної залози, піднижньощелепної слинної залози, відповідальний за чутливість частини вуха та смакову чутливість передніх 2/3 язика [7]. Серед досліджених та пролікованих нами пацієнтів у всіх спостерігалося повне порушення провідності ЛН. При синдромі повного порушення провідності розвиваються атрофія і параліч мімічних м’язів іпсилатеральної половини обличчя. Клінічно наявна виражена асиметрія м’язів обличчя в спокої, спостерігається згладжування зморшок на ураженій стороні обличчя, порушуються акти жування і ковтання. Спостерігається відсутність рухів нижньої повіки, порушується сльозовиділення, при вимові приголосних і надуванні щік щока сторони ураження коливається подібно до вітрила («парусить»), з кута рота виливається рідка їжа. Також можуть спостерігатися порушення смакової чутливості, сухість у роті, порушення слуху, чутливості частини вуха. Синдром часткового порушення провідності проявляється парезом мімічних м’язів відповідної половини обличчя та наявністю вищевказаних симптомів, що наявні меншою мірою.
Діагностика. Висока якість діагностики прозоплегій (паралічів м’язів обличчя) з визначенням рівня і ступеня ушкодження нерва є важливою складовою успішного лікування. Ступінь травматизації нерва насамперед визначається рівнем дисфункції мімічних м’язів, для оцінки яких використовують клініко–неврологічні та інструментальні методи дослідження. Першою візуальною ознакою порушення функції лицевого нерва є асиметрія обличчя, і визначення її ступеня є важливим для оцінки як функціонального стану м’язів, так і післяопераційних результатів [8, 9]. Асиметрію обличчя визначають так: здійснюється відмічення контрольних точок на обличчі, між якими вимірюють відстані як на паралізованій, так і на інтактній стороні обличчя. Далі обчислюють відстань між усіма точками кожної сторони. Саме різниця між ними є ступенем асиметрії обличчя. При парезах мімічних м’язів або паралічах показники ступеня асиметрії обличчя хворих варіюють від 0,5 до 2,5 см. Дані показники відповідають легкому ступеню асиметрії. При застарілих паралічах, особливо в осіб похилого віку, величини показників асиметрії становлять 2,5–4,5 см. Даний ступінь асиметрії відносять до середньої тяжкості. Тяжка форма асиметрії, коли показник відстані між точками перевищує 4,5 см, спостерігається нечасто і супроводжується виворотом нижньої повіки і наявністю патологічної складки в нижніх відділах щічної ділянки. Також для оцінки ступеня вираженості ушкодження ЛН користуються низкою шкал, а однією з найбільш зручних у практичному застосуванні є шкала House — Brackmann [10], яку ми застосовували у власному дослідженні. Оцінювання локального статусу починають із визначення тонусу шкіри, потім хворого просять посміхнутися, закрити очі, наморщити лоб, ніс, підняти брови, нахмурити їх, показати зуби, надути щоки, зібрати губи «в трубочку». Для визначення стану окорухових м’язів оцінюють симптом Белла (при заплющуванні очне яблуко закочується латерально, медіально або догори) і визначають ступінь паралітичного лагофтальму.
При ранніх ознаках ушкодження мімічних м’язів, що прогресує, і при залишкових явищах застосовують такі діагностичні тести: тест мигання, тест вібрації повік, тест дослідження підшкірного м’яза шиї, тест надутих щік.
Важливим етапом діагностики є визначення рівня ушкодження нерва, що проводять за допомогою топографічних тестів. Особливе значення цей етап має в пацієнтів, у яких не вдається зібрати детальний анамнез щодо виникнення клініки ушкодження ЛН. Ознаками пошкодження нерва на рівні основного стовбура (позаканальна частина ЛН) є повна відсутність рухів відповідної сторони обличчя, лагофтальм, патологічна сльозотеча (за рахунок порушення дренажу сльози), симптом Белла, можливе порушення носового дихання. При ушкодженні нерва вище від відходження барабанної струни (у піраміді скроневої кістки) до перелічених вище ознак приєднуються ксеростомія (сухість у роті), порушення смакової чутливості язика. Ушкодження нерва ще вище характеризується усіма перерахованими ознаками на додаток з гіперакузією. При ушкодженні нерва на рівні колінчастого вузла до всіх перечислень ознак приєднується ксерофтальмія (сухість ока за рахунок порушення продукції сльози), можливе виникнення хронічного кон’юнктивіту. Ураження нерва на ядерному рівні характеризується двосторонніми руховими розладами м’язів обличчя за периферичним типом. Ушкодження саме на центральному рівні (на рівні моторного центру кори великого мозку) характеризується порушенням рухів нижньої зони обличчя на протилежній стороні. При ксеростомії досліджують функцію піднижньощелепних і під’язикових слинних залоз шляхом катетеризації і кількісного аналізу отриманої слини на здоровій і паралізованій стороні в процентних співвідношеннях.
З хірургічної точки зору доцільною є оцінка стану інших нервів, які можуть бути використані при проведенні автопластики: великого вушного (чутливість нижньої половини вушної раковини) і литкового (чутливість латеральної поверхні стопи).
З об’єктивних методів діагностики використовують такі: електроміографію (ЕМГ), тест максимальної стимуляції нерва й електронейроміографію. У пацієнтів, у яких причиною виникнення паралічу ЛН було видалення пухлини задньої черепної ямки (ЗЧЯ) або інші неопластичні процеси, застосовують КТ– і МРТ–діагностику.
Проведення міографічного дослідження із записом викликаних потенціалів дозволяє визначити рівень денервації м’язів тільки через 2 тижні після початку паралічу (час початку дегенеративних змін дистальної частини нерва). Сумарну електроактивність м’язів визначають у трьох станах: у спокої, при тонічних реакціях і активному скороченні. Запис електричної активності проводять з обох боків. Рівень патологічних змін оцінюється за ступенем різниці форми, амплітуди і тривалості потенціалів дії однойменних м’язів на здоровій і паралізованій стороні. Зниження амплітуди інтерференційної ЕМГ означає наявність аксонального ушкодження нерва. При центральних ураженнях лицевого нерва спостерігаються рідкісні коливання і різке зниження амплітуди, що свідчить про зменшення числа функціонуючих м’язових волокон. При паралічах м’язів спостерігається «електричне мовчання», що свідчить про функціональний блок передачі нервових імпульсів (до одного року після початку паралічу) або повну атрофію мімічних м’язів (при паралічах давністю більше ніж один рік).
Варто зазначити, що частота випадків неефективного лікування ураження ЛН є достатньо високою і значною мірою пов’язана з недостатнім приділенням уваги лікарів об’єктивізації і контролю функціонального стану ЛН на етапах лікування [6]. Саме такий конт–роль за допомогою додаткових інструментальних методів дослідження, на нашу думку, повинен стати медичним стандартом при цій патології.
Мета дослідження: поліпшити результати хірургічного лікування хворих з ушкодженнями лицевого нерва шляхом оптимізації діагностики функціонального стану ЛН залежно від клінічного симптомокомплексу у хворих із паралічем або парезом мімічних м’язів та оптимізації хірургічних методів лікування.
Матеріали та методи
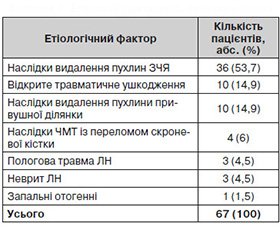
Додаткові інструментальні методи дослідження, а саме клініко–нейрофізіологічні (НФ), було проведено в 67 пацієнтів із наслідками ушкодження ЛН за період із 2012 по 2017 р. Найбільш частим етіологічним фактором ушкодження ЛН було видалення новоутворення ЗЧЯ, у тому числі невриноми VIII пари черепних нервів у 36 хворих (53,7 %). Рідше відмічалися такі етіологічні чинники: відкрите травматичне ушкодження — у 10 хворих (14,9 %), наслідки видалення пухлини привушної ділянки — у 10 хворих (14,9 %), наслідки ЧМТ із переломом скроневої кістки — у 4 хворих (6 %), пологова травма ЛН — у 3 хворих (4,5 %), неврит ЛН — у 3 хворих (4,5 %), запальні отогенні — в 1 хворого (1,5 %) (табл. 1). Вік хворих — від 3 до 73 років, у середньому 37,7 ± 2,2 року; статевий розподіл був таким: чоловіки становили 55,2 %, жінки — 44,8 %. Ступінь порушення функції лицевого нерва оцінювали за шкалою, що є найбільш поширеною в нейрохірургічній практиці і зручною у використанні [10], — шкалою House — Brackmann. Додатково застосовували такі нейровізуалізуючі методи: КТ — у 41 хворого, МРТ — у 37 хворих, рентгенологічне — у 24 хворих й аудіометричне дослідження — у 36 хворих. Усі перераховані вище методи застосовували за показаннями переважно в пацієнтів із наслідками видалення неврином VIII пари черепних нервів. Серед методів НФ–діагностики було використано такі: стимуляційну електроміографію (ЕМГ) з метою оцінювання провідності окремих гілок ЛН, реєстрацію мигального рефлексу, голкову ЕМГ для кількісного відображення параметрів, що вказують на функціональний стан рухових одиниць та показників денервації м’язів обличчя. Комплекс нейрофізіологічної діагностики здійснювався на обладнанні «Нейро–МВП–4» («Нейрософт», РФ).
Статистичну обробку отриманих результатів дослідження проводили з використанням пакета прикладних програм MedStat, EZR. Для статистичного аналізу результатів використовували: вибіркову середню, похибку середньої; для оцінювання вірогідності відмінності між групами — непараметричні методи: Т–критерій Вілкоксона; для порівняння двох незалежних груп — метод Манна — Уїтні; для визначення кореляційного зв’язку — таблицю рангової кореляції Спірмена. Різницю вважали вірогідною при p ≤ 0,05.
Результати та обговорення
Було проведено ретроспективний аналіз клінічних і нейрофізіологічних показників функції ЛН до хірургічного лікування та в післяопераційному періоді (ранньому і пізньому). У 52 (77,6 %) із 67 обстежених хворих були виявлені клініко–ЕМГ–ознаки повного випадіння функції ЛН (VI балів за шкалою House — Brackmann). Терміни від моменту ушкодження ЛН до проведення хірургічного лікування були в межах від 28 днів до 132 місяців. Окремо виділено пацієнтів із наслідками пологової травми ЛН, у яких терміни проведення хірургічного втручання становили і до 276 місяців (23 роки), проте функція ЛН була частково збереженою. Оскільки пацієнти потрапляли на спеціалізоване лікування в більш пізні терміни (53,7 % — більше 6 місяців), то проведення ранньої НФ–діагностики не було можливим. Поки що існують певні особливості проведення ЕМГ у різні терміни після ушкодження ЛН. Голкову ЕМГ проводили пізніше 14–ї доби після травми, тому що тривалість періоду «біоелектричного мовчання» становить 1,5–2 тижні, залежно від протяжності ділянки ушкодження нерва: чим локалізація ушкодження нерва ближча до м’яза, тим раніше виявляють ознаки денервації м’язових волокон у вигляді потенціалів фібриляцій [6]. Необхідність проведення хірургічного втручання визначалася згідно з клінічними даними і результатами ЕМГ. При проведенні першого ЕМГ–дослідження в ранньому післятравматичному періоді дуже складно зробити висновок про повне порушення провідності гілками ЛН і прогнозувати відновлення. Зазнечене вище підтверджується як нашим досвідом, так і даними інших дослідників [11].
Незважаючи на відсутність клінічних даних про відновлення функції ЛН, контроль у динаміці дозволяв виявити появу ранніх ЕМГ–ознак реіннервації м’язових волокон: низькоамплітудних поліфазних потенціалів (рис. 1), «рухових одиниць, що зароджуються» [6], а згодом появу низькоамплітудних М–відповідей (міографічних ознак часткового відновлення провідності імпульсу моторними волокнами ЛН). Якщо наведені вище НФ–феномени були відсутні, то прогноз відновлення функцій ЛН був несприятливим. За несприятливого прогнозу щодо відновлення функції ЛН і при діагностиці невротмезису результати ЕМГ–дослідження вказували на безперспективність проведення консервативного лікування та були вагомим аргументом на користь застосування хірургічного методу лікування.
Після опрацювання результатів ЕМГ–досліджень хворих у динаміці можливо надати рекомендації щодо оптимальних термінів проведення повторних ЕМГ–досліджень.
Хірургічне лікування проведено в 67 пацієнтів за період 2012–2017 рр. Застосовані такі хірургічні втручання: невроліз ЛН — 10 випадків (у тому числі з встановленням вітчизняних електростимулюючих систем (ЕСС) у 5 хворих); шов нерва — у 2 випадках, автопластика ЛН — в 1 пацієнта, невротизація ЛН різними нервами–донорами (гілкою додаткового нерва до кивального м’яза — у 44 хворих, невротизація1/2 під’язикового нерва — в 1 хворого, поєднання обох методик — у 2 хворих, імплантація ЕСС після невротизації — у 2 хворих); статичні методи корекції обличчя — у 5 хворих. Велике значення для відновлення функції ЛН мають вибір адекватного методу лікування та своєчасність хірургічного втручання, а також повноцінне відновне лікування в післяопераційному періоді. Впливають на вибір методу хірургічного лікування такі чинники: тривалість між періодами після травми ЛН і реіннервацією, стан хворого з урахуванням характеру і тяжкості супутніх уражень, неефективність попереднього лікування; вік, стать, тургор й еластичність м’яких тканин обличчя.
Раннім післяопераційним періодом вважали проміжок часу, що становить близько 2–3 міс. від дня проведення оперативного втручання, коли ще відсутні клінічні ознаки регенерації ЛН і при проведенні ЕМГ–контролю виявляли початкові ознаки реіннервації. Найбільш інформативним інструментальним методом для оцінки відновлення провідності ЛН у ранній післяопераційний період ми вважаємо внутрішньом’язову голкову ЕМГ. Для визначення стану рухових волокон — стимуляційна ЕМГ, у тому числі з реєстрацією ПД м’язів із застосуванням голкових електродів. Дані методи сприяють об’єктивній оцінці результату проведеного хірургічного втручання, дають можливість адекватно прогнозувати відновлення функції ЛН.
У термін від 3 до 6 міс. післяопераційного періоду процес відновлення функції м’язів обличчя супроводжувався специфічними НФ–феноменами, які вказували на формування потенціалів рухових одиниць (рис. 2). Спостерігали кількісне зростання їх числа, укрупнення території — за показниками амплітуди і тривалості потенціалів, появу М–відповіді на стимуляцію нерва, наявні поліфазії амплітуди. При порівнянні з клінічними даними та на основі аналізу НФ–показників можливо надати оцінку ефективності реіннервації. Задовільні показники відновлення функції ЛН висвітлювалися на фоні зниження інтенсивності (частоти й кількості) спонтанних потенціалів м’язових волокон, а саме фібриляцій, тобто в процесі реіннервації м’язів знижувалися показники спонтанної активності м’язових волокон.
Оцінювання даних щодо ефективності хірургічного лікування базувалося на таких ознаках: відновлення функції мімічних м’язів не нижче ІІІ ступеня за шкалою House — Brackmann (достатня сила скорочення при довільному напруженні); отримання ЕМГ–ознак ефективної реіннервації м’язів обличчя, які проявлялися формуванням рухових одиниць в достатній кількості, з амплітудою, що наростає. При наведених вище показниках клінічний ефект після хірургічного лікування можливо очікувати протягом 3,5–4 міс. [6].
Середні показники відновлення функції ЛН за шкалою House — Brackmann дорівнювали 2,94 ± 0,12 бала у групі хворих, яким проводили хірургічне лікування після 6 місяців після травми, і 2,45 ± 0,10 бала в групі хворих, які були прооперовані в терміни до 6 місяців після ушкодження ЛН. Між групами отримано відмінність на рівні значимості p = 0,017. Тобто можна зробити висновок, що кращі показники відновлення функції ЛН були в пацієнтів, у яких хірургічне втручання було проведено в більш ранньому періоді після травми (р < 0,05). Гірший прогноз щодо відновлення функції ЛН і ММ спостерігався в пацієнтів із задавненою травмою. Отримані результати збігаються з даними літератури [11–14].
Також нами було досліджено наявність кореляційного зв’язку між віком пацієнтів, термінами проведення хірургічного втручання та ступенем відновлення ЛН. Згідно з таблицею рангової кореляції Спірмена отримано кореляційний зв’язок між віком хворих та ступенем відновлення ЛН за шкалою House — Brackmann на рівні r = 0,31 з р < 0,05 та між термінами проведеного хірургічного лікування і ступенем відновлення ЛН на рівні r = 0,46 з р < 0,05. Тобто з вказаного вище випливає, що вік хворих і терміни проведення операції на ЛН впливають на ступінь відновлення останнього з рівнем вірогідності р < 0,05. Тобто чим більші вік хворих і термін від моменту травми до хірургічного лікування, тим гірші результати відновлення ЛН.
Згідно з проведеним аналізом літературних даних, є неоднозначні дані з приводу відновлення функції ЛН залежно від термінів проведеного хірургічного втручання. За результатами [5, 9], у хворих, яким було неможливо провести хірургічне лікування в ранньому посттравматичному періоді й у яких було більше 90 % дегенерації нервових волокон та відмічалися НФ–ознаки денервації, можливо сподіватися на досягнення позитивного ефекту від операції в термін більше 3 міс. За даними N. Hato, J. Nota, N. Hakuba et al. (2011) [15] досягнення задовільних результатів відновлення за шкалою House — Brackmann до ІІ ступеня можливе, якщо хірургічне втручання проведено протягом 14 днів після ушкодження ЛН у 92,9 % хворих. У нашому дослідженні кількість пацієнтів, у яких отримано високі показники відновлення (за шкалою House — Brackmann ІІ–ІІІ ст.) у термін після 12 міс. після операції, становила 60 із 67 (89,55 %), серед яких максимальні показники відновлення до ІІ ст. ми спостерігали в 27 пацієнтів (у 40,3 %). Гірші показники відновлення функції мімічних м’язів (до IV–V ст. за шкалою House — Brackmann) спостерігалися в 7 хворих (10,45 %). На результат лікування останньої категорії хворих негативно впливали і значні терміни проведення хірургічного лікування після отримання травми, і неповне дотримання рекомендацій із приводу реабілітаційного лікування в післяопераційному періоді. Показники різниці клінічних результатів відновлення залежно від етіології ушкодження не є статистично значущими.
Проте важливо відзначити і суб’єктивні критерії оцінки власного стану хворими, для яких насамперед важливий естетичний аспект відновлення симетрії обличчя, а не НФ–показники відновлення провідності функції ЛН.
Висновки
1. Рання діагностика ушкодження лицевого нерва із застосуванням загальноприйнятих шкал та додаткових інструментальних методів важлива для визначення подальшої тактики ведення хворого, визначення ефективності проведеної реіннервації і прогнозу відновлення функції ЛН.
2. Кращі результати відновлення функції лицевого нерва спостерігались у хворих, яким було проведено хірургічне лікування якомога раніше після ушкодження.
3. Залежно від об’єктивної клінічної картини та даних додаткових методів дослідження визначаються як показання до проведення хірургічного лікування, так і безперспективність консервативного лікування.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Lee D.H. Clinical Efficacy of Electroneurography in Acute Facial Paralysis. J Audiol Otol. 2016 Apr. 20(1). Р. 8–12. doi: 10.7874/jao.2016.20.1.8. Epub 2016 Apr 21. PubMed PMID: 27144227; PubMed Central PMCID: PMC4853888.
2. Цимбалюк В.І., Цимбалюк Ю.В., Дем’янов М.А., Тре–тяк І.Б. Електростимуляція у відновному лікуванні наслідків ушкодження лицьового нерва. Шпитальна хірургія. 2014. № 1. С. 58–60. http://nbuv.gov.ua/UJRN/shpkhir_2014_1_18.
3. Yetiser S. Total facial nerve decompression for severe traumatic facial nerve paralysis: a review of 10 cases. Int. J. Otolaryngol. 2012. 2012. 607359. doi: 10.1155/2012/607359. Epub 2011 Nov 20. PubMed PMID: 22164173; PubMed Central PMCID: PMC3228390.
4. Неробеев А.И., Гришняк Д. Диагностика и лечение лицевых параличей. Врач. 2000. 12. С. 32–37.
5. Takushima A., Harii K., Asato H. Endoscopic dissection of recipient facial nerve for vascularized muscle transfer in the treatment of facial paralysis. Br. J. Plast. Surg. 2003 Mar. 56(2). Р. 110–3. PubMed PMID: 12791352.
6. Третяк І.Б., Третьякова А.І., Дем’янов М.А. Клініко–нейрофізіологічна діагностика в динаміці нейрохірургічного лікування травматичного ушкодження лицьового нерва. Зб. наук. праць співробіт. НМАПО імені П.Л. Шупика. 2013. 22(1). С. 232–238. http://nbuv.gov.ua/UJRN/Znpsnmapo_2013_22(1)__38.
7. Finsterer J. Management of peripheral facial nerve palsy. Eur. Arch. Otorhinolaryngol. 2008. 265(7). Р. 743–752. doi:10.1007/s00405–008–0646–4.
8. Reitzen S.D., Babb J.S., Lalwani A.K. Significance and reliability of the House–Brackmann grading system for regional facial nerve function. Otolaryngol Head Neck Surg. 2009. 140(2). Р. 154–8. PMid: 19201280. http://dx.doi.org/10.1016/j.otohns.2008.11.021.
9. Danner C.J. Facial nerve paralysis. Otolaryngol Clin North Am. 2008. 41(3). Р. 619–32. PMid:18436002. http://dx.doi.org/10.1016/j.otc.2008.01.008.
10. House J.W., Brackmann D.E. Facial nerve grading system. Otolaryngol. Head Neck Surg. 1985. 93. Р. 146–147. DOI: 10.1177/019459988509300202.
11. Ulug T., Arif Ulubil S. Management of facial paralysis in temporal bone fractures: a prospective study analyzing 11 operated fractures. Am. J. Otolaryngol. 2005. 26(4). Р. 230–8. http://dx.doi.org/10.1016/j.amjoto.2005.01.004.
12. Kim J., Moon I.S., Shim D.B. et al. The effect of surgical timing on functional outcomes of traumatic facial nerve paralysis. J.Trauma. 2010. 68(4). Р. 924–929. doi: 10.1097/TA.0b013e3181a8b2d9.
13. Darrouzet V., Duclos J.Y., Liguoro D., Truilhe Y., De Bonfils C., Bebear J.P. Management of facial paralysis resulting from temporal bone fractures: our experience in 115 cases. Otolaryngol. Head Neck Surg. 2001. 125(1). Р. 77–84. PMid: 11458219. http://dx.doi.org/10.1067/mhn.2001.116182.
14. Hohman, M.H., Hadlock T.A. Etiology, diagnosis, and ma–nagement of facial palsy: 2000 patients at a facial nerve center. The Laryngoscope. 2014. 124. Р. 283–293. doi:10.1002/lary.24542.
15. Hato N., Nota J., Hakuba N., Gyo K., Yanagihara N. Facial nerve decompression surgery in patients with temporal bone trauma: analysis of 66 cases. J. Trauma. 2011. 71(6). Р. 1789–93. http://dx.doi.org/10.1097/TA.0b013e318236b21f.

/24-1.jpg)
/25-1.jpg)