Международный неврологический журнал №5 (107), 2019
Вернуться к номеру
Влияние интерлейкина-10 на факторы иммунной системы и антиоксидантной защиты головного мозга, функцию тимуса и поведение мышей с купризоновой моделью демиелинизации
Авторы: Лабунец И.Ф., Родниченко А.Е., Утко Н.А., Похоленко Я.А.
ГУ «Институт генетической и регенеративной медицины НАМН Украины», г. Киев, Украина
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Актуальність. Відома участь макрофагів, Т-лімфоцитів і факторів оксидативного стресу в ушкодженні нервових клітин, що може призвести до порушення їх функціонування. Гормон тимуса тимулін виявляє імуномодулюючі властивості, а інтерлейкін-10 (IL-10) — протизапальні та нейротропні властивості. Мета: дослідити зміни вмісту макрофагів, Т-лімфоцитів, малонового діальдегіду (МDА) та активності антиоксидантних ферментів у головному мозку, рівня тимуліну в крові, а також поведінкових реакцій у мишей, яким вводили нейротоксин купризон і рекомбінантний IL-10 людини (rhIL-10). Матеріали та методи. Дорослі миші лінії 129/Sv отримували з їжею купризон щоденно впродовж 3 тижнів, а з 7-ї доби купризонової дієти — ін’єкції rhIL-10 у дозі 5 мкг/кг (3 ін’єкції з інтервалом 3 доби). Результати. Встановлено, що у мишей під впливом купризону в головному мозку підвищувався вміст СD3+ Т-клітин, що фагоцитують латекс макрофагів і МDА, тоді як активність антиоксидантних ферментів знижувалась. Після ін’єкцій rhIL-10 спостерігалось зменшення числа СD3+ Т-клітин і функціональної активності макрофагів; активність супероксиддисмутази, каталази і глутатіонпероксидази ставала значно вищою. Під впливом цитокіну зростав також у крові рівень тимуліну. При оцінці поведінкових реакцій встановлено значне зниження горизонтальної рухової, емоційної та дослідницької активності мишей, які отримували купризон, тоді як після введення цитокіну значення досліджуваних показників суттєво підвищувались. Висновок. При вивченні рухової, емоційної та дослідницької активності показано, що rhIL-10 поліпшував функціонування центральної нервової системи у мишей, що отримували купризон. Ефекти rhIL-10 у мишей з купризоновою моделлю демієлінізації були в основному пов’язані зі змінами кількості Т-лімфоцитів головного мозку, активності макрофагів і антиоксидантних ферментів, а також ендокринної функції тимуса. Інтерлейкін-10 або речовини/методи, що підсилюють його синтез у центральній нервовій системі, можуть бути перспективними при лікуванні демієлінізуючої патології.
Актуальность. Известно участие макрофагов, Т-лимфоцитов и факторов оксидативного стресса в повреждении нервных клеток, что может привести к нарушению их функционирования. Гормон тимуса тимулин проявляет иммуномодулирующие свойства, а интерлейкин-10 (IL-10) — противовоспалительные и нейротропные свойства. Цель: исследовать изменения содержания макрофагов, Т-лимфоцитов, малонового диальдегида (МDА) и активности антиоксидантных ферментов в головном мозге, уровня тимулина в крови, а также поведенческих реакций у мышей, получавших нейротоксин купризон и рекомбинантный IL-10 человека (rhIL-10). Материалы и методы. Взрослые мыши линии 129/Sv получали с пищей купризон ежедневно в течение 3 недель, а с 7-го дня купризоновой диеты — инъекции rhIL-10 в дозе 5 мкг/кг (3 инъекции с интервалом 3 дня). Результаты. Установлено, что у мышей под влиянием купризона в головном мозге повышалось число СD3+ Т-клеток, фагоцитирующих латекс макрофагов и содержание МDА, тогда как активность антиоксидантных ферментов снижалась. После инъекций rhIL-10 наблюдалось снижение числа СD3+ Т-клеток и функциональной активности макрофагов, а активность супероксиддисмутазы, каталазы и глутатионпероксидазы становилась существенно выше. Под влиянием цитокина повышался также уровень в крови тимулина. При оценке поведенческих реакций установлено значительное снижение горизонтальной двигательной, эмоциональной и исследовательской активности мышей, получавших купризон, тогда как после введения цитокина значения исследованных показателей существенно увеличивались. Выводы. При изучении двигательной, эмоциональной и исследовательской активности показано, что rhIL-10 улучшал функционирование центральной нервной системы у мышей, получавших купризон. Эффекты rhIL-10 у мышей с купризоновой моделью демиелинизации были в основном связаны с изменениями количества Т-лимфоцитов головного мозга, активности макрофагов и антиоксидантных ферментов, а также эндокринной функции тимуса. Интерлейкин-10 или вещества/методы, усиливающие его синтез в центральной нервной системе, могут быть перспективными при лечении демиелинизирующей патологии.
Background. The role of macrophages, T-lymphocytes and factors of oxidative stress in damage to the nerve cells of the brain leading to disruption of their functioning is known. Thymic hormone thymulin exhibits immunomodulating properties whereas interleukin-10 possesses pronounced anti-inflammatory properties and affects neurogenesis. This work aimed to study changes in the content of macrophages, T-lymphocytes, malondialdehyde, activi-ty of antioxidant enzymes in the brain, blood thymulin levels, and behavioral reactions in mice with cuprizone demyelination model treated with recombinant human IL-10 (rhIL-10). Materials and methods. Adult 129/Sv mice received cuprizone daily with food for 3 weeks. Starting from day 7 of cuprizone diet, rhIL-10 was admini-stered intraperitoneally at a dose of 5 μg/kg (total of 3 injections, with an interval of 3 days). Results. The number of latex-phagocyting macrophages, CD3+ T-cells and malondialdehyde content increased while the activity of antioxidant enzymes decreased in the brain of cuprizone-treated mice. Following rhIL-10 injections, we observed a decrease in the number of CD3+ T-cells and macrophage activity and an increase in the superoxide dismutase, catalase and glutathione peroxidase activities. Besides, the thymulin blood level increased. Interestingly, after cytokine injection we observed an increase in the horizontal locomotor, emotional and exploratory acti-vities, being decreased by cuprizone. Conclusions. Locomotor, emotional and exploratory activity tests showed that rhIL-10 improved the central nervous system functioning in the cuprizone-treated mice. RhIL-10 effect in mice on cuprizone diet was mainly associated with changes in the number of brain T-lymphocytes, the acti-vity of macrophages and antioxidant enzymes, as well as the endocrine function of the thymus. Interleukin-10 or agents/approaches enhancing its synthesis in the central nervous system might be promising in the demyelinating pathology treatment schemes.
нейротоксин купризон; інтерлейкін-10; макрофаги; Т-лімфоцити й антиоксидантні ферменти головного мозку; тимулін; поведенкові реакції
нейротоксин купризон; интерлейкин-10; макрофаги; Т-лимфоциты и антиоксидантные ферменты головного мозга; тимулин; поведенческие реакции
neurotoxin cuprizone; interleukin-10; macrophages, T-cells and antioxidant enzymes of the brain; thymulin; behavioral reactions
Введение
Повреждение нервных клеток головного мозга при демиелинизирующей патологии в значительной степени обусловлено развитием воспалительной реакции и оксидативного стресса. Важными составляющими таких процессов являются Т-лимфоциты и макрофаги/клетки микроглии, образующие реактивные радикалы и провоспалительные цитокины [1, 2]. Вместе с тем в головном мозге в динамике развития воспалительной реакции усиливается экспрессия противовоспалительных цитокинов, среди которых привлекает внимание интерлейкин-10 (IL-10). Существует мнение, что повышение экспрессии IL-10 при патологии центральной нервной системы (ЦНС) необходимо для защиты нервных клеток от повреждений [3]. Так, IL-10 снижает продукцию провоспалительных цитокинов и хемокинов, пролиферацию активированной микроглии/макрофагов, активность Т-хелперов 1-го типа при патологии ЦНС, в том числе у животных с моделью нейровоспаления [4, 5]. В свою очередь показано, что дифференцировка и активность Т-лимфоцитов, функционирование макрофагов находятся под контролем высокоактивного гормона тимуса тимулина [6, 7]. Есть данные о том, что IL-10 влияет на нейрогенез в головном мозге, выступая в качестве ростового фактора для нейрональных стволовых клеток (НСК) [8].
Представляется перспективным изучение возможных путей противовоспалительного влияния IL-10 на такой экспериментальной модели демиелинизации, как токсическая купризоновая модель. Это связано с тем, что в головном мозге молодых мышей, получавших нейротоксин купризон, наблюдается активация макрофагов с усилением синтеза провоспалительных цитокинов, накопление Т-лимфоцитов, оксидативный стресс и морфофункциональные нарушения ЦНС [9–12]. В результате исследований, проведенных ранее в лаборатории экспериментального моделирования института, показано, что под влиянием рекомбинантного IL-10 человека (rhIL-10) в головном мозге мышей с купризоновой диетой снижается число патологически измененных нейронов и, напротив, повышается число нейронов с неизмененной структурой [13].
Цель: исследовать изменения содержания макрофагов, Т-лимфоцитов, малонового диальдегида (МDА) и активности антиоксидантных ферментов в головном мозге, уровня в крови тимулина и поведенческие реакции у мышей, получавших нейротоксин купризон и рекомбинантный IL-10 человека.
Материалы и методы
Животные. В эксперименте использовали мышей-самцов линии 129/Sv в возрасте 4–7 месяцев стадной разводки вивария ГУ «Институт генетической и регенеративной медицины НАМН Украины». Мыши содержались в стандартных условиях вивария при фиксированном световом режиме 12 : 12.
Биологический материал для исследований получали от животных в утренние часы под эфирным наркозом. Все работы выполняли с соблюдением Закона Украины «О защите животных от жестокого обращения» от 21.02.2006 г., «Европейской Конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Страсбург, 1986).
Модели. В эксперименте использовали токсическую купризоновую модель демиелинизации, подробная характеристика которой была нами представлена ранее [9, 14]. Нейротоксин купризон (Sigma, США) давали мышам с пищей из расчета 0,2 % от суточного корма ежедневно в течение трех недель. Группа интактных мышей находилась на обычном рационе вивария.
RhIL-10 получали путем его синтеза в клетках выделенного ранее штамма-продуцента E. coli BL21(DE3)/pET24-hIL-10 [15]. Содержание целевого белка в лизате клеток E. coli и хроматографических фракциях оценивали методом денситометрии электрофореграмм с последующим анализом с помощью программы Total Lab (США). RhIL-10 вводили мышам с 7-го дня купризоновой диеты внутрибрюшинно, из расчета 5,0 мкг/кг массы, в 100 мкл фосфатного буфера, всего 3 инъекции с интервалом 3 дня.
Экспериментальные группы. 1-я — мыши, получавшие стандартную диету без купризона (интактные); 2-я — мыши, получавшие с едой купризон в течение 3 недель и инъекции фосфатного буфера (контрольная группа); 3-я — мыши, получавшие с едой купризон и инъекции rhIL-10. Каждая группа включала 12 мышей. Исследования проводили на следующий день после завершения приема купризона.
Методы. Факторы иммунной системы. При оценке функциональной активности макрофагов суспензию клеток головного мозга, адгезированных к пластику, культивировали с суспензией латекса (2,5 × 108 мл) [9, 11]. Затем клетки фиксировали и окрашивали по Романовскому — Гимзе. В световом микроскопе подсчитывали не менее 200 макрофагов и определяли фагоцитарный индекс — процент фагоцитирующих клеток, фагоцитарное число — количество частиц латекса, поглощенное одним макрофагом.
При фенотипировании клеток головного мозга использовали моноклональные антитела (МАТ) к CD3, конъюгированные с флюорохромом (фикоэритрин) (Becton Dickinson, США). К гомогенату головного мозга (2 × 105 клеток/50 мкл) добавляли соответствующие МАТ в разведении 1 : 50. Измерения проводили на лазерном проточном цитофлуориметре-сортере BD FACS Aria (Becton Dickinson, США) с помощью программы BD FACS Diva 6.1.
Эндокринную функцию тимуса исследовали по уровню тимулина (log2) в сыворотке крови [6, 9].
Лейкоцитарную формулу периферической крови оценивали общепринятым методом.
Факторы оксидативного стресса и антиоксидантной защиты. Содержание малонового диальдегида (МDА) в головном (переднем) мозге определяли по интенсивности окраски триметинового комплекса, образующегося между МDА и тиобарбитуровой кислотой [16]. Активность антиоксидантных ферментов оценивали в супернатантах гомогенатов головного (переднего) мозга экспериментальных мышей спектрофотометрическим методом (спектрофотометр µQuant, Bio-Tek, США) [17]. Активность супероксиддисмутазы выражали в условных единицах на 1 мг белка за 1 мин, каталазы — в микромолях на 1 мг белка за 1 мин, глутатионпероксидазы — в наномолях на 1 мг белка за 1 мин. Содержание белка в ткани измеряли методом Лоури.
Поведенческие реакции у мышей изучали в тесте «открытого поля», который является одним из адекватных критериев оценки показателей их поведения [18]. Горизонтальную двигательную активность оценивали по количеству пересеченных квадратов, исследовательскую активность — по числу вертикальных стоек (вертикальная двигательная активность) и заглядываний в норки (норковый рефлекс), эмоциональную активность — по количеству фекальных болюсов. Тестирование экспериментальных мышей проводили в течение 3 минут.
Статистический анализ результатов проводили с помощью t-критерия Стьюдента. Различие между исследованными показателями считали статистически достоверным при значении p < 0,05.
Результаты
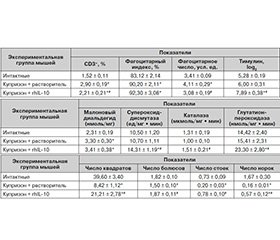
Влияние введения rhIL-10 на иммунные факторы у мышей с купризоновой диетой. Установлено, что повышенное количество СD3+-клеток в головном мозге мышей с купризоновой диетой снижается после инъекций rhIL-10, но не достигает значений интактных животных (табл. 1). Число макрофагов в головном мозге опытных мышей остается повышенным и после введения rhIL-10, однако фагоцитарная активность макрофагов значительно снижается (табл. 1). Уровень тимулина в крови мышей, получавших цитокин, существенно превышает таковой у мышей интактной и контрольной групп (табл. 1).
Через 3 недели приема купризона количество моноцитов в периферической крови мышей меньше, чем в интактной группе, и составляет соответственно 2,5 ± 0,8 и 7,0 ± 1,3 %; p < 0,05). Известно [19], что при повреждениях головного мозга одним из источников макрофагов могут быть моноциты периферической крови. Об этом может свидетельствовать снижение количества моноцитов в периферической крови после приема купризона. После инъекций rhIL-10 значения показателя повышаются до уровня интактной группы (6,5 ± 1,2 %).
Влияние введения rhIL-10 на показатели оксидативного стресса и антиоксидантной защиты головного мозга мышей с купризоновой диетой. В головном мозге мышей, получавших купризон, наблюдается существенное повышение содержания MDA, которое не изменилось после инъекций rhIL-10 (табл. 2). Под влиянием rhIL-10 активность всех исследованных ферментов увеличивалась, при этом превышая значения показателей в интактной группе и группе контроля (табл. 2).
Влияние введения rhIL-10 на показатели поведения у мышей с купризоновой диетой. У мышей прием купризона приводит к существенному уменьшению показателей двигательной, эмоциональной и исследовательской активности (табл. 3). После инъекций rhIL-10 значения всех показателей существенно повышаются, причем число болюсов и вертикальных стоек — до уровня интактных животных.
Таким образом, в результате экспериментальных исследований установлены положительные изменения в головном мозге числа Т-лимфоцитов, активности макрофагов и антиоксидантных ферментов, а также уровня тимулина в крови мышей с купризоновой диетой, получавших инъекции rhIL-10. У таких мышей выявленные изменения иммунных факторов и антиоксидантной защиты сочетаются с улучшением функционального состояния ЦНС, оцениваемого по показателям поведенческих реакций.
Обсуждение
Из данных литературы известна важная роль IL-10 в патогенезе демиелинизирующей патологии, в частности рассеянного склероза [20, 21]. На модели экспериментального аллергического энцефаломиелита (ЭАЭ) показаны выраженные противовоспалительные свойства IL-10 в ЦНС, проявляющиеся в снижении синтеза провоспалительных цитокинов (тумор-некротический фактор (TNF-α), интерферон (IFN-γ), IL-1β), уменьшении экспрессии рецепторов к цитокинам и ингибировании их активации, угнетении активности Т-хелперов 1-го типа, клеток микроглии и т.д. [3, 4]. Такие эффекты цитокина коррелируют с течением ЭАЭ [21]. Более того, при развитии демиелинизирующей патологии концентрация в крови IL-10 снижается и, наоборот, повышается при ремиссии этого заболева-ния [20].
В связи с указанными выше данными заслуживает внимания установленный нами эффект rhIL-10 на макрофаги и Т-лимфоциты головного мозга мышей с купризоновой диетой. Как известно, макрофаги и Т-лимфоциты являются источником провоспалительных цитокинов и активных форм кислорода, повреждающих нервные клетки [1, 10, 22]. В условиях приема купризона содержание Т-лимфоцитов и макрофагов в головном мозге мышей существенно повышается.
В то же время уменьшение числа Т-лимфоцитов в головном мозге мышей, получавших купризон совместно с rhIL-10, может быть связано со снижением усиленной действием нейротоксина миграции этих клеток через гематоэнцефалический барьер [12]. Возможен апоптоз Т-лимфоцитов у таких мышей, так как в патологических условиях клетки активированной микроглии могут экспрессировать Fas ligand, который во-влекается в этот процесс [1]. Не исключается также развитие под влиянием цитокина анергии в Т-лимфоцитах головного мозга в результате ингибирования в этих клетках костимуляторных клеточных сигналов СD28, СD80 и СD86 [3].
Хотя после инъекций rhIL-10 число макрофагов в головном мозге опытных мышей остается все-таки выше, чем в интактной группе, их функциональная активность значительно снижается. Поскольку у таких мышей одновременно повышается количество структурно не измененных нейронов в ЦНС [13], можно предположить наличие у макрофагов противовоспалительного/регенераторного фенотипа. Возможность переключения фенотипа макрофагов с провоспалительного М1 на противовоспалительный М2 у мышей с купризоновой моделью демиелинизации показана исследованиями Gudi и соавт. [22].
Мы полагаем, что для изменений Т-лимфоцитов и макрофагов под влиянием rhIL-10 имеет значение усиление у животных эндокринной функции ти–муса. Известно влияние тимулина на активность макрофагов, дифференцировку Т-лимфоцитов и миграцию последних в организме [6, 7]. У животных с моделью нейровоспаления тимулин проявляет противовоспалительные свойства, снижая в головном мозге синтез провоспалительных цитокинов (TNF-α и IL-1β) и повышая синтез противовоспалительных цитокинов (IL-10) [23].
Не исключено, что повышение уровня тимулина в крови мышей после инъекций rhIL-10 может быть связано с изменением у таких животных функции коры надпочечников. Так, установлено, что уровень кортикостерона в крови мышей, получавших купризон, существенно повышается, а IL-10 снижает синтез глюкокортикоидов в коре надпочечников, действуя через рецепторы (IL-10R1) [24, 25]. В свою очередь, показано, что у мышей глюкокортикоиды угнетают образование гормонов в тимусе, а также изменяют в головном мозге фенотип микроглии на провоспалительный в условиях приема купризона [26, 27].
Нами установлен эффект rhIL-10 на факторы антиоксидантной защиты в головном мозге мышей с купризоновой диетой. Другими авторами также показано, что IL-10 путем частичного восстановления активности антиоксидантных ферментов уменьшает прооксидантный повреждающий эффект провоспалительных цитокинов (TNF-α) на клетки организма [28]. В нашей работе мы не обнаружили снижения содержания МDА в головном мозге мышей с купризоновой диетой, получавших rhIL-10. Однако возможно снижение под влиянием IL-10 продукции Н2О2 и NO макрофагами, которые были предварительно активированы провоспалительными цитокинами (IF-γ и TNF-α) [29].
Наряду с изменением иммунных факторов и антиоксидантной защиты эффекты rhIL-10 у мышей с купризоновой моделью демиелинизации можно объяснить его влиянием на нейрогенез в ЦНС. Так, показано, что IL-10 через свои рецепторы в НСК субвентрикулярной зоны головного мозга изменяет пролиферацию этих клеток [8]. При этом после инъекции rhIL-10 (50 мкг/кг) у животных как с купризоновой моделью демиелинизации, так и с ее другими экспериментальными моделями увеличение доли структурно не измененных нейронов (кора, гиппокамп, мозжечок головного мозга, поясничный отдел спинного мозга) сочетается со значительным повышением двигательной, эмоциональной и исследовательской активности [13, 30].
Вместе с тем в настоящем исследовании мы получили выраженный положительный эффект rhIL-10 на поведенческие реакции у мышей с купризоновой диетой уже в дозе цитокина 0,1 мкг/живот-ное, хотя структурные изменения нейронов ЦНС при такой дозе были незначительными [13]. Наши результаты подтверждают мнение Serra [25] о том, что нарушение поведенческих реакций при демиелинизирующей патологии может быть связано с развитием воспаления и повышенной экспрессией провоспалительных цитокинов в ЦНС, тогда как усиление таких реакций — со снижением проявлений воспаления. В последнем случае имеет также значение улучшение взаимодействий между функционированием отдельных структур ЦНС, которые были нарушены под влиянием купризона [25]. При этом мы не исключаем возможности получения отдаленного нейропротекторного эффекта rhIL-10 в дозе 5 мкг/кг у мышей с купризоновой моделью демиелинизации. Подобный эффект у мышей с этой моделью мы уже наблюдали у цитокина с нейротропными свойствами — лейкемия ингибиторного фактора [31].
Полученные нами результаты на купризоновой модели демиелинизации могут быть полезными при изучении эффектов rhIL-10 в комбинации с клеточной терапией этой патологии, в частности мультипотентными мезенхимальными стромальными клетками (ММСК). В литературе уже представлены данные о повышении эффективности использования ММСК пуповины в сочетании с инъекциями rhIL-10 у животных с моделью ЭАЭ [30]. Предметом наших дальнейших исследований будет оценка эффективности влияния rhIL-10 на нейропротекторное действие ММСК костного мозга у мышей с купризоновой моделью демиелинизации.
Выводы
1. Инъекции rhIL-10 мышам с купризоновой моделью демиелинизации улучшают функциональное состояние ЦНС, оцениваемое по показателям двигательной, эмоциональной и исследовательской активности.
2. Эффект rhIL-10 у мышей с купризоновой диетой в значительной степени реализуется через изменение в головном мозге числа Т-лимфоцитов, активности макрофагов и антиоксидантных ферментов, а также эндокринной функции тимуса.
3. IL-10 или средства/подходы, повышающие его синтез в ЦНС, могут быть перспективными в схемах терапии демиелинизирующей патологии.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Информация о финансировании: исследования выполнены по бюджетной теме № 0116U000139 при финансовой поддержке НАМНУ.
1. Abdurasulova I.N. The role of immune and glial cells in neurodegenerative processes. Med. akadem. zhurnal. 2011. Vol. 11. № 1. P. 12-29.
2. Gonzalez H. T-cell-mediated regulation of neuroinflammation involved in neurodegenerative diseases. J. Neuroinflammation. 2014. Vol. 11. № 201. 11 p. doi: 10.1186/s12974-014-0201-8.
3. Strle K. Interleukin-10 in the brain. Crit. Rev. Immunol. 2001. Vol. 21. № 5. P. 427-449. doi: 10.1615/CritRevImmunol.v21.i5.20.
4. Klose J. Suppression of experimental autoimmune encephalomyelitis by interleukin-10 transduced neural stem/progenitor cells. J. Neuroinflammation. 2013. Vol. 10. P. 117. doi: 10.1186/1742-2094-10-117.
5. Meng J. The Critical Role of IL-10 in the Antineuroinflammatory and Antioxidative Effects of Rheum tanguticum on Activated Microglia. Oxidative medicine and cellular longevity. 2018. Vol. 6. P. 1-12. doi: 10.1155/2018/1083596.
6. Labunets I.F. Capacity of bone marrow granylocyte and macrophage precursors in mice of different strains for in vitro colony formation under changes thymuline level in the organism and cell cultures. Genes & Cells. 2017. Vol. 12. № 2. P. 97-103. doi: 10.23868/201707021. [In Russian].
7. Csaba G. The immunoendocrine thymus as a pacemaker of lifespan. Acta Microbiol. Immunol. Hung. 2016. Vol. 63. № 2. Р. 139-158. doi: 10.1556/030.63.2016.2.1.
8. Perez-Asensio F.J. Interleukin-10 regulates progenitor differentiation and modulates neurogenesis in adult brain. J. Cell. Sci. 2013. Vol. 126. P. 4208-4219. doi: 10.1242/jcs.127803.
9. Labunets I.F. Changes of thymic endocrine function, brain macrophages and T-lymphocytes in mice of different age after admini-stration of neurotoxin cuprizone and cytokine. International Neurogical Journal. 2018. № 4(98). Р. 155-161. doi: 10.22141/2224-0713.4.98.2018.139434. [In Russian].
10. Kang Z. IL-17-induced Act1-mediated signaling is critical for cuprizone-induced demyelination. J. Neurosci. 2012. Vol. 32. № 4. P. 8284-8292. doi: 10.1523/JNEUROSCI.0841-12.2012.
11. Labunets I.F. Cuprizone-Induced Disorders of Central Nervous System Neurons, Behavioral Reactions, Brain Activity of Macrophages and Antioxidant Enzymes in the Mice of Different Ages: Role of Leukemia Inhibitory Factor in their Improvement. J. Aging Geriatr. Med. 2017. Vol. 1. № 2. 8 p. doi: 10.4172/AGM.1000104.
12. Praet J. Cellular and molecular neuropathology of the cuprizone mouse model: Clinical relevance for multiple sclerosis. J. Neubiorev. 2014. Vol. 47. P. 485-505. doi.org/10.1016/j.neubiorev.2014.10.004.
13. Labunets І.F., Mel'nik N.O., Rodnіchenko A.Є. ta іn. Influence of recombinant human interleukin-10 on structure of central nervous system neurons and behavioral reactions in mice with cuprizone model of multiple sclerosis. Conference abstracts. Innovative trends in genetic and regenerative medicine (November 9-10, 2017, Кyiv, Ukraine). Klіtinna ta organna transplantologіja Dodatok 2017. Vol. 5. № 2. P. 240-241.
14. Labunets I.F. Possibilities and prospects of the application of the in vivo and in vitro toxic cuprizone model for demyelination in experimental and clinical neurology (literature review and own research results). Ukrai'ns'kiy nevrologichniy zhurnal. Ukrainian Neurological Journal. 2018. № 2. P. 63-68. ISSN 1998-4235 (print), ISSN 2522-1183 (online); doi: https://doi.org/10.30978/UNZ2018263.
15. Walker J.M. The Protein Protocols Handbook. Totowa, New Jersey: Humana Press Inc. 2002. 1139 p.
16. Uchiyama M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal. Biochem. 1978. Vol. 86. № 1. P. 271-278.
17. Labunets I.F. Thymic hormones, antioxidant enzymes and neurogenesis of bulbus olfactorius in rats with parkinsonism: the effect of melatonin. Int. J. Phys. Pathophys. 2016. Vol. 7. № 4. P. 285-298.
18. Amikishieva A.V. Behavioral phenothyping: up-to date me-thods and equipment. Vestnik VOGiS. 2009. Vol.13. № 3. P. 529-542.
19. Guillemin G.J., Brew B.J. Microglial, macrophages, perivascular macrophages, and pericytes: a review of function and identification. Brew. Biol. 2004. Vol. 75. P. 288-239. doi: 10.1189/jlb.03.03114.
20. Ozenci V. Multiple sclerosis:levels of interleukin-10-secreting blood mononuclear cells are low in untreated patients but augmen-ted during interferon-beta-1b treatment. Scand. J. Immunol. 1999. Vol. 49. № 5. P. 554-61. PMID: 10320650.
21. Pichkur L.D. Influence of transplantation of mesenchymal stem cells and interleukin-10 on experimental allergic encephalomyelitis course. Ukrai'ns'kyj nevrologichnyj zhurnal. 2018. № 1. P. 56-63.
22. Gudi V. Glial response during cuprizon-induced de- and remyelination in the CNS: lessons learned. Front. Cell. Neurosci. 2014. 8 (Article 73). 24 p. doi: 10.3389/fncel.2014.00073.
23. Haddad J.J. The anti-inflammatory and immunomodulatory activity of thymulin peptide is NF-kB dependent and involves the downregulation of I kB-α. Am. J. Med. Biol. Res. 2013. Vol. 1. № 2. Р. 41-49. doi: 10.12691/ajmbr-1-2-2.
24. Koldric-Zivanovic N. Regulation of adrenal glucocorticoid synthesis by interleukin-10: a preponderance of IL-10 receptor in the adrenal zone fasciculate. Brain Behave Immun. 2006. Vol. 20. № 5. P. 460-468. doi: 10.1016/j.bbi.2005.09.003
25. Serra-de-Oliveira N. Behavioural changes observed in demyelination model shares similarities with white matter abnormalities in humans. Behav. Brain Res. 2015. Vol. 287. P. 265-275. doi: 10.1016/j.bbr.2015.03.038.
26. Labunets I.F. The thymus and adaptive changes of the function of the immune system in aging: the role of pineal gland factors. Bukov. med. visnyk. 2009. Vol. 13. № 4. P. 186-190.
27. Noorzehi G. Microglia polarization by methylprednizolone acetate accelerates cuprizone induced demyelination. J. Mol Histol. 2018. Vol. 49. № 5. P. 471-479. doi: 10.1007/s10735-018-9786-z.
28. Latorre E. IL-10 counteracts proinflammatory mediator evoked oxidative stress in Caco-2 cells. Mediators of Inflammation. 2014. Vol. 2014. Article ID 982639, 6 p. http://dx.doi.org/10.1155/2014/98.
29. Morreira A.P. Interleukin-10 but not transforming growth factor beta inhibits murine activated macrophages Paracoccidioides brasiliensis killing: effect on H2О2 and NO production. Cellular Immunology. 2010. Vol. 263. № 2. P. 196-203. doi: 10.1016/j.cellimm.2010.03.016.
30. Cymbaljuk V.І. Effects of human Wharton’s jelly-derived mesenchymal stem cells and interleukin-10 on behavioural responses of rats with experimental allergic encephalomyelitis. Klitynna ta organna transplantologija. 2015. Vol. 3. № 1. P. 40-45.
31. Labunets I.F. Neuroprotective effect of the recombinant human leukemia inhibitory factor in mice with an experimental cuprizone model of multiple sclerosis: possible mechanisms. Biopolymers and Cell. 2018. Vol. 34. № 5. P. 350-360. doi: http://dx.doi:org/10.7124/bc.000989.

/44-1.jpg)