Международный неврологический журнал №5 (107), 2019
Вернуться к номеру
Використання препарату Прамістар для корекції післяінсультних когнітивних порушень
Авторы: Пулик О.Р. (1), Рішко Г.В. (1), Студеняк Т.О. (1), Тимченко Н.Д. (2), Смоланка В.І. (1)
1 - ДВНЗ «Ужгородський національний університет», м. Ужгород, Україна
2 - Ужгородська центральна міська клінічна лікарня, м. Ужгород, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
У статті наводяться результати дослідження з вивчення ефективності та безпечності препарату Прамістар при корекції післяінсультних когнітивних порушень. У дослідженні взяли участь 46 пацієнтів, які перенесли інсульт. Пацієнти основної групи після перенесеного інсульту протягом трьох місяців приймали Прамістар. Пацієнти контрольної групи під час реабілітації після інсульту приймали інші препарати. Перед початком реабілітації та через три місяці всім пацієнтам, які взяли участь у дослідженні, було проведено нейропсихологічне тестування, визначення емоційного стану та електроенцефалограму. Пацієнти основної групи відзначали, що на тлі прийому препарату їх розумова активність покращилася, вони стали спокійнішими і в них нормалізувався сон. При порівнянні результатів їх нейропсихологічного тестування з результатами пацієнтів контрольної групи виявлено вірогідне покращення довільної уваги та короткострокової пам’яті, встановлено високий шанс на поліпшення результатів MMSE та батареї тестів лобної дисфункції, доведено вірогідне покращення емоційного стану.
В статье приводятся результаты исследования по изучению эффективности и безопасности препарата Прамистар при коррекции постинсультных когнитивных нарушений. В исследовании приняло участие 46 пациентов, перенесших инсульт. Пациенты основной группы после перенесенного инсульта в течение трех месяцев принимали Прамистар. Пациенты контрольной группы при реабилитации после инсульта принимали другие препараты. Перед началом реабилитации и через три месяца всем пациентам, которые приняли участие в исследовании, было проведено нейропсихологическое тестирование, определение эмоционального состояния и электроэнцефалограмма. Пациенты основной группы отмечали, что на фоне приема препарата их умственная активность улучшилась, они стали спокойнее и у них нормализовался сон. При сравнении результатов их нейропсихологического тестирования с результатами пациентов контрольной группы выявлено достоверное улучшение произвольного внимания и краткосрочной памяти, установлен высокий шанс на улучшение результатов MMSE и батареи тестов лобной дисфункции, доказано достоверное улучшение эмоционального состояния.
The article presents the results of a study on the efficacy and safety of Pramistar in correction of post-stroke cognitive impairment. The study involved 46 patients who underwent stroke. Patients of the treatment group received Pramistar for 3 months after suffering a stroke. Patients in the control group took other drugs during rehabilitation after a stroke. Before the rehabilitation and after three months, all patients involved in the study underwent neuropsychological tests, determining the emotional state and the electroencephalography. Patients of the treatment group noted that on the background of drug administration, their mental activity improved, they became calmer and their sleep normalized. When comparing the results of neuropsychological testing with the results of patients in the control group, a significant improvement of voluntary attention and short-term memory has been revealed, a high chance to improve results by MMSE and batteries of tests of frontal dysfunction has been noted, a probable improvement inemotional state has been proved.
інсульт; когнітивні порушення; Прамістар
инсульт; когнитивные нарушения; Прамистар
stroke; cognitive impairment; Pramistar
Вступ
Порушення когнітивної діяльності, що розвиваються на фоні судинно-мозкової патології, посідають друге місце після хвороби Альцгеймера [1]. Протягом останніх 10 років кількість хворих на судинно-мозкові захворювання в Україні зросла вдвічі [2]. Розвиток судинних когнітивних порушень (СКП) спричинюють серцево-судинні захворювання, що є факторами ризику гострих порушень мозкового кровообігу та хронічної ішемії головного мозку [3]. Клінічно СКП можуть проявлятися легкою когнітивною недостатністю, а також судинною деменцією, тобто вираженими порушеннями в декількох когнітивних доменах, у тому числі і пам’яті, що призводить до порушення повсякденної життєдіяльності [4].
Частота післяінсультних когнітивних порушень (ПІКП) у хворих може досягати 80 %. Когнітивні порушення є одним із найбільш значимих факторів для прогнозування наслідків інсульту, оскільки вони визначають ефективність реабілітаційних заходів та якість життя пацієнта. До післяінсультних когнітивних порушень належать усі когнітивні порушення (погіршення пам’яті, уваги, розумової працездатності, зниження інтелекту), що виникли і досягли клінічного рівня в перші три місяці після інсульту чи в більш пізні строки, але не більше року після інсульту [5].
Вплив інсульту на когнітивні функції (КФ) визначається його локалізацією, кількістю вогнищ та їх розмірами. Особливо високий ризик розвитку тяжких ПІКП у хворого після повторного інсульту [6]. Одним із ключових факторів, що визначають тяжкість ПІКП, можуть бути передуючі інсульту нейродегенеративні зміни. Розвиток і прогресування хвороби Альцгеймера можливі і після перенесеного інсульту [7]. У численних клінічних та лабораторних дослідженнях показано, що структури гіпокампа вкрай чутливі до ішемії внаслідок церебральної гіпоперфузії [8]. Все більшого підтвердження отримує концепція, що судинно-мозкова і нейро–дегенеративна патологія на КФ впливають синергічно. Проспективні дослідження продемонстрували збільшення ризику розвитку деменції після інсульту приблизно в 10 разів [9].
Важливою складовою клінічної картини у пацієнтів із ПІКП є емоційно-вольові та інші нервово-психічні розлади, що є не лише реакцією пацієнта на хворобу та пов’язану з нею інвалідність, але й наслідком ішемічного ураження підкіркових та лімбічних структур. Показано, що післяінсультна депресія розвивається майже у третини пацієнтів та підвищує ризик грубої інвалідизації та смертності [10].
Лікування ПІКП є надзвичайно важливим та водночас складним завданням. У цій статті ми б хотіли поділитися своїм досвідом використання ноотропних препаратів для корекції післяінсультного когнітивного дефіциту. Серед них на особливу увагу заслуговує група піролідонових похідних, що впливають на основ–ні синаптичні системи — холінергічну, адренергічну, дофамінергічну. Прамістар — ноотропний препарат із групи піролідонових ноотропів. Особливості механізму дії Прамістару полягають у збільшенні синтезу та накопиченні ацетилхоліну в пресинаптичних холінергічних субкортикальних структурах головного мозку, зокрема в гіпокампі — основному елементі переробки інформації в ЦНС, що дозволяє говорити про цілеспрямований вплив цього ноотропного препарату на тонкі процеси різноманітних видів пам’яті. Зв’язування ацетилхоліну з постсинаптичними рецепторами підвищує активність оксиду азоту, що призводить до підвищення його вмісту в постсинаптичному нейроні. Оксид азоту, у свою чергу, відіграє важливу роль у процесах навчання і пам’яті, особливо короткотривалої. Слід відзначити, що препарат підвищує активність оксиду азоту в гіпокампі — специфічній зоні формування мнестичних процесів. Крім того, оксид азоту має пряму судинорозширювальну дію. Виділяють ще один важливий ефект Прамістару, який полягає в інгібуванні церебральних ендо–пептидаз, у першу чергу пролілендопептидази, унаслідок чого підвищується концентрація нейропептидів вазопресину та кортикостерону, що залучені в процеси запам’ятовування та довготривалого зберігання інформації. Прамістар має також і антидепресивну дію. Даний ефект пов’язують зі стимуляцією дії метамфетаміну та активацією адренергічної нейромедіації.
Ефективність та безпечність Прамістару широко вивчена та доведена в низці європейських досліджень. Прамістар не метаболізується в організмі й виводиться в незміненому вигляді, а також не взаємодіє з іншими препаратами. Відсутність активних метаболітів у процесі біотрансформації в організмі та перехресної міжмедикаментозної взаємодії є достатньо рідкісними властивостями й разом із тим найважливішими факторами, що забезпечують високий ступінь безпечності лікарського засобу [11–14].
Мета дослідження: вивчити ефективність та безпечність препарату Прамістар при корекції після–інсультних когнітивних порушень.
Матеріали та методи
Дослідження проводилось на базі відділення судинної неврології Ужгородської центральної міської клінічної лікарні. У дослідження було включено 46 пацієнтів, які перенесли мозковий інсульт (МІ). Критеріями включення в дослідження були верифікований клінічно та за допомогою нейровізуалізації МІ, відсутність тяжких супутніх соматичних захворювань, збережена функція мовлення та письма, вік від 40 до 60 років, коли вікові зміни когнітивних функцій мінімальні. Для ретроспективної оцінки когнітивного стану пацієнтів використовували спеціальний опитувальник IQCODE [15].
Хворих було розподілено на дві групи: основну (26 осіб), які приймали Прамістар, та контрольну (20 осіб), пацієнтам якої для покращення когнітивних здібностей призначались препарати інших груп. У групі хворих, які приймали Прамістар, середній вік становив 55,40 ± 1,31 року, у групі контролю — 56,2 ± 0,4 року. Хворі обох груп мали достатній рівень освіти, що становив не менше 12 років (табл. 1).
Пацієнти, які брали участь у дослідженні, не одержували седативні, снодійні засоби, транквілізатори, стимулятори ЦНС, інгібітори ацетилхолінестерази, модулятори NMDA-рецепторів, антидепресанти.
На основі співбесіди з хворим проводили аналіз суб’єктивної оцінки самопочуття за допомогою 4-бальної рейтингової шкали самооцінки з критерієм оцінки кожного симптому від 0 (немає скарг) до 3 (значно виражені скарги).
Для визначення рівня когнітивних здібностей в обох групах пацієнтів до та після лікування використовували батарею нейропсихологічних тестів, що включала коротку шкалу психічного статусу — MMSE (Folstein M., Folstein S., 1975), батарею тестів на визначення лобної дисфункції — БТЛД (FAB), запропоновану французьким неврологом B. Dubois у 1999 році, тест на запам’ятовування 10 слів за методикою О.Р. Лурії та графічний і візуальний тест малювання годинника [16–19]. Тестування в обох групах хворих проводили двічі — на початку дослідження та через три місяці.
З метою визначення наявності чи відсутності депресивних розладів застосовували шкалу Гамільтона, відповідно до якої 0–13 балів вказували на відсутність депресії, 14–17 балів — на легку депресію, 18–25 балів — на помірну депресію, > 25 балів — на тяжку депресію [20].
Запис електроенцефалограми виконали на апараті для відеоелектроенцефалографії компанії VIASYS NicoletOne. Для її запису використовували хлор-срібні електроди. Накладання електродів проводили згідно з міжнародною системою «10–20», тривалість запису — не менше 30 хвилин, із проведенням гіпервентиляції та фотостимуляції. Для оцінки біоелектричної активності головного мозку та визначення ефективності медикаментозної корекції вивчалась відносна потужність спектра окремих ритмів та спектральні коефіцієнти основних ритмів [21, 22].
Статистичну обробку проводили з використанням стандартного статистичного пакета Microsoft Excel 2007, а також середовища для статистичних обчислень R 3.0.1. Розрахунки проводилися за сучасними методами й алгоритмами [23]. Вибір методу статистичного дослідження ґрунтувався на природі висунутих гіпотез та розподілі досліджуваних величин. Відмінності вважалися вірогідними при р < 0,05.
Результати та обговорення
На початку дослідження хворі обох груп скаржились на погіршення загального самопочуття (100 %), пам’яті (100 %), зниження рівня уваги (90 %), надмірну втомлюваність (89 %), загальну слабкість (91 %), дратівливість (83 %), підвищений рівень тривожності (75 %), біль голови (80 %), головокружіння (65 %), шум у вухах (60 %), погіршення сну (60 %).
Терапія препаратом Прамістар вірогідно не вплинула на показники артеріального тиску, як систолічного, так і діастолічного (мм рт.ст.). Після завершення терапії препаратом Прамістар не виявлено негативних відхилень на ЕКГ та показників лабораторних тестів.
Когнітивний статус в обох групах хворих до початку лікування відповідав початковій стадії деменції. У першій групі, яка отримувала Прамістар, за даними тесту MMSE, загальний бал становив 20,31 ± 0,65, у групі контролю — 20,15 ± 0,43.
Встановлено, що після завершення курсу лікування самопочуття хворих обох груп вірогідно покращилось за всіма пунктами шкали самооцінки (р < 0,05). Хворі, які приймали Прамістар, порівняно з групою конт-ролю мали більш високу позитивну оцінку загального самопочуття та пам’яті, констатували нижчий рівень тривожності та дратівливості (рис. 1).
На фоні покращення показників самооцінки у хворих обох груп після завершення лікування встановлено зростання загального бала за тестом MMSE. У пацієнтів основної групи спостерігалося вірогідне покращення КФ за всіма субтестами MMSE: орієнтація в часі, орієнтація в просторі, сприйняття, довільна увага, пам’ять та покращення перцепційно-гностичних функцій, р < 0,01 (рис. 2).
Порівняння результатів MMSE у пацієнтів основної та контрольної груп через три місяці показало вірогідно кращий результат у пацієнтів основної групи (26,54 ± ± 0,22 бала), ніж у пацієнтів контрольної групи (24,75 ± ± 0,63 бала). Порівняльний аналіз параметрів субтестів MMSE показав, що у хворих основної групи вірогідно вищі порівняно з пацієнтами контрольної групи значення за субтестами «Довільна увага» та «Короткострокова пам’ять» (р < 0,05) (рис. 3).
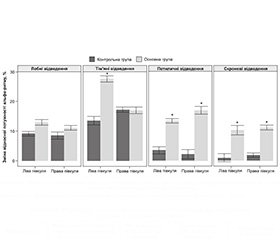
Про покращення когнітивних функцій у пацієнтів основної та контрольної груп свідчить і зменшення симптомів лобної дисфункції. У пацієнтів основної групи спостерігалося вірогідне покращення КФ за всіма субтестами БТЛД (рис. 4).
До початку терапії загальний показник тесту на лобну дисфункцію становив в основній групі 11,35 ± 1,12 бала, після курсу лікування — 15,2 ± 0,81 бала (р < 0,05). У групі контролю — відповідно 11,47 ± 1,01 та 14,40 ± 0,93 бала (р < 0,05). Встановлено, що хворі основної групи через три місяці порівняно з групою контролю назвали вірогідно більшу кількість слів за даними субтесту «Швидкість мовлення». Визначена тенденція до покращення результату в основній групі порівняно з контрольною за субтестом «Ускладнена реакція вибору» (рис. 5).
За результатами дослідження вербальної пам’яті за методикою 10 слів О.Р. Лурії у пацієнтів основної групи встановлено вищі показники після завершення терапії. Проведене дослідження показало, що пацієнти основ–ної групи після закінчення лікування відтворили з першої спроби більше слів на рівні тенденції, ніж пацієнти групи контролю: відповідно 4,27 ± 0,24 та 3,85 ± 0,20 бала (р < 0,07). В обох групах хворих вірогідно зріс показник за тестом малювання годинника — відповідно 9,17 ± 0,43 та 9,07 ± 0,61 бала.
У хворих із МІ в основній та контрольній групах середній показник шкали депресії Гамільтона становив відповідно 14,02 ± 0,99 та 13,87 ± 0,29 бала. Отже, рівень депресивності був невисоким. Максимальні порушення в пацієнтів обох груп, які перенесли інсульт, були відзначені за такими пунктами шкали Гамільтона: пригнічений настрій, відчуття провини, знижена працездатність та активність, безсоння, соматична та психічна тривога, загальні соматичні симптоми, генітальні симптоми. Після закінчення даного етапу терапії отримали такі показники шкали по групах: відповідно 10,21 ± 0,27 та 11,76 ± 0,77 бала. У пацієнтів основної групи, які приймали Прамістар, встановлена позитивна динаміка відновлення емоційного стану після завершення лікування на рівні позитивної тенденції, р < 0,07.
На основі вищенаведених даних можна зробити висновок про те, що пацієнти обох груп успішно завершили курс лікування. Встановлено, що хворі обох груп після проведеної реабілітації мали більш позитивну самооцінку, вищий рівень уваги, покращення здатності до запам’ятовування, збереження та відтворення нового матеріалу, покращення зорово-конструктивного праксису, зменшення симптомів лобної дисфункції та зниження рівня депресивності.
Нами встановлено, що в пацієнтів основної групи, які приймали протягом трьох місяців Прамістар, шанс досягнути кращого результату за шкалою ММSE у 13 разів вищий, ніж у пацієнтів контрольної групи (р = 0,00002), а шанс покращити результати тесту БТЛД вищий у 5 разів (р = 0,001). Щодо субтестів MMSE, то шанс покращити «Орієнтацію в часі» у пацієнтів основної групи вищий у 3 рази (р = 0,007) порівняно з пацієнтами контрольної групи, а шанс покращити «Перцепційно-гностичні функції» вищий у 15 разів (р = 0,0002). Порівняння субтестів БТЛД показало, що в пацієнтів основної групи шанс покращити результати субтесту «Концептуалізація» у 8 разів вищий (р = 0,002), а в домені «Швидкість мовлення» — у 10 разів вищий (р = 0,002) порівняно з пацієнтами контрольної групи.
Дослідження біоелектричної активності головного мозку в пацієнтів основної та контрольної груп показало, що в переважної більшості пацієнтів після перенесеного МІ зміни біоелектричної активності головного мозку можна охарактеризувати як поліморфні, з переважанням дизритмії та домінуванням повільнохвильової активності. Після проведеного курсового лікування у пацієнтів обох груп спостерігалося відновлення зональних відмінностей біоелектричної активності головного мозку. У пацієнтів основної групи встановлено вірогідне зростання відносної потужності спектра (ВПС) альфа-ритму в скроневих та потиличних відведеннях (рис. 6).
Одночасно в пацієнтів обох груп встановлено зменшення проявів міжпівкульної асиметрії. У пацієнтів основної групи виявлено вірогідне зменшення ВПС повільнохвильової активності. Вірогідно зменшилася ВПС хвиль тета-діапазону в лобних відведеннях зліва на 8,3 % (р = 0,0001) та справа на 7,0 % (р = 0,002). Аналіз змін ВПС дельта-ритму встановив її зменшення у всіх пацієнтів основної групи. Доведено, що ВПС дельта-ритму у пацієнтів основної групи зменшується у всіх відведеннях більше, ніж у пацієнтів контрольної групи.
Для підтвердження вищенаведених результатів ми порівняли спектральні коефіцієнти альфа-/тета-ритмів у пацієнтів основної та контрольної груп. Встановлено, що вони вірогідно зросли в лобних та потиличних відведеннях у хворих, які приймали Прамістар (табл. 2).
Подібна тенденція спостерігалась і при порівнянні спектральних коефіцієнтів альфа/дельта, альфа/(тета ++ дельта), а також (альфа + бета)/(тета + дельта) ритмів.
Виявлена здатність Прамістару до нормалізації біоелектричної активності головного мозку може свідчити про позитивний вплив препарату на інтегральні властивості головного мозку та активний вплив на таку важливу когнітивну функцію, як пам’ять.
Всі 26 пацієнтів основної групи закінчили медикаментозну тримісячну корекцію з використанням препарату Прамістар. У жодного пацієнта не спостерігалося погіршення стану або інших небажаних дій препарату. Зважаючи на це, можна стверджувати, що препарат Прамістар доцільно використовувати у пацієнтів із когнітивними порушеннями після перенесеного мозкового інсульту.
Висновки
1. Прамістар є ефективним та безпечним засобом для відновлення когнітивних здібностей пацієнтів після перенесеного мозкового інсульту.
2. Використання Прамістару у хворих після інсульту вірогідно покращує емоційний стан.
3. Терапія Прамістаром підвищує шанс на досягнення кращих результатів за шкалою ММSE та бата–реєю тестів для лобної дисфункції.
4. Прийом Прамістару сприяє нормалізації біоелектричної активності головного мозку, що може свідчити про позитивний вплив препарату на інтегральні властивості головного мозку та активний вплив на таку важливу когнітивну функцію, як пам’ять.
Конфлікт інтересів. Не заявлений.
1. Hachinski V. Stroke: a global agenda (Victor and Clara Soriano Awward Lecture). Jornal of the Neurological Sciences. 2009. Vol. 285 (suppl. 1). Р. 1.
2. Мищенко Т.С., Лапшина И.А., Мищенко В.Н. Хроническая ишемия мозга (критерии диагностики, новые возможности лечения). Український медичний часопис. 2010. № 6 (80), XI–XII. C. 110-114.
3. Захаров В.В., Яхно Н.Н. Когнитивные расстройства в пожилом и старческом возрасте: метод. пособие для врачей. М., 2005. 71 с.
4. Diagnostic and Statistical Manual Disoders. 4th edition: DSM-IV. Washington, DC: American Psychiatric Association, 1994.
5. Rasquim S.M., Lodder J., Ponds R.W. et al. Cognitive functioning after stroke: a one-year follow-up study. Dement. Geriatr. Cogn. Disord. 2004. Vol. 18. P. 138-134.
6. Desmond D.W., Moroney J.T., Paik M.C. et al. Frequency and clinical determinants of dementia after ischemic stroke. Neuro–logy. 2000. Vol. 54 (5). P. 1124-1131.
7. Mackowiak-Cordoliani M.A., Bombois S., Memin A. Postsroke dementia in the eldery. Drugs Aging. 2005. Vol. 22, № 6. P. 483-493.
8. Чердак М.А., Парфенов В.А. Когнитивные расстройства у пациентов, перенесших ишемический инсульт: обзор. Неврологический журнал. 2011. Т. 16. № 6. С. 37-44.
9. Bejot Y., Aboa-Eboule C., Jeome Durier et al. Prevalence of earle dementia after first-ever stroke: a 24-year population-based study. Stroke. 2011. Vol. 42. P. 607-612.
10. Вознесенская Т.Г. Некогнитивные нервно-психические расстройства при когнитивных нарушениях в пожилом возрасте. Неврологический журнал. 2010. № 2. С. 4-18.
11. Marriny G., Caratty C., Peluffo F. et al. Placebo-controlled double-blind study of pramiracetam (CI-879) in the treatment of –elderly subjects with memory impairment. Adv. Ther. 1992. Vol. 9 (3). P. 136-146.
12. Nappi G., Rebasseda X., Mealy N. Pramiracetam: a nootropic agent with improved efficacy in patient with senile or presenile cognitive impairment. Drugs of today. 1994. Vol. 30(6). P. 469-482.
13. Дзяк Л.А., Голик В.А., Мизякина Е.В. Опыт применения нового ноотропного препарата Прамистар в лечении мнестических расстройств у больных с цереброваскулярной патологией. Лікарська справа. 2003. № 6. С. 67-72.
14. Бачинська Н.Ю., Демченко О.В., Полєтаєва К.М., Холін В.О. Особливості синдрому помірних когнітивних порушень у хворих на гіпертонічну дисциркуляторну енцефалопатію та можливості корекції когнітивних змін препаратом Прамістар. Міжнар. неврол. журнал. 2012. № 2 (48). С. 99-106.
15. Jorm A. The informant questionnare on cognitive decline in the elderly (IQCODE): a review. Int. Psychogeriatrics. 2004. Vol. 16 (3). Р. 1-19.
16. Folstein M., Folstein S., McHugh P.R. Mini-mental state: a practical method for grading the cognitive state of patients for the clinicial. J. Psychiatr. Res. 1975. Vol. 12. P. 189-198.
17. Dubois В., Slachevsky A. et al. The FAB. A frontal assessment battery at bedside. Neurology. 2000. Vol. 55. R. 1621-1626.
18. Блейхер В.М., Крук И.В. Патопсихологическая диа–гностика. Київ: Здоров’я, 1986. 280 с.
19. Sunderland Т., Hill J.L., Mellow A.M. et al. Clock drawing in Alzheimer’s disease. A novel measure of dementia severity. J. Am. Geriatr. Soc. 1989. Vol. 37 (8). P. 725-729.
20. Hamilton M. A rating scale for depression. J. Neurol. Neurosurg. Psychiatry. 1960. 23. P. 56-62.
21. Зенков Л.Р. Клиническая электроэнцефалография (с элементами эпилептологии): Руководство для врачей. 3-е изд. М.: МЕДпресс-информ, 2004. 368 с.
22. Кропотов Ю.Д. Количественная ЭЭГ, когнитивные потенциалы мозга человека и нейротерапия. Донецк: Издатель Заславский А.Ю., 2010. 512 с.
23. Bender R., Grouven U. Ordinal logistic regression in medical research. Journal of the Royal College of Physicians of London. 1997. Vol. 31, № 5. P. 546-551.

/51-1-m.jpg)
/52-1-m.jpg)
/52-2-m.jpg)
/52-3-m.jpg)
/53-1-m.jpg)
/54-1-m.jpg)