Журнал «Практическая онкология» Том 2, №4, 2019
Вернуться к номеру
Сучасні методи медичної візуалізації в діагностиці й скринінгу раку молочної залози
Авторы: Божок Є.М.(1), Зотов О.С.(2)
(1) — ДУ «Інститут ядерної медицини та променевої діагностики НАМН України», м. Київ, Україна
(2) — Національний медичний університет ім. О.О. Богомольця, м. Київ, Україна
Рубрики: Онкология
Разделы: Клинические исследования
Версия для печати
На сьогодні рак молочної залози (РМЗ) — значна медична й соціальна проблема, оскільки для нього характерні висока захворюваність і смертність. Шляхами зменшення цих показників є рання діагностика й ефективне лікування. Сучасні методи медичної візуалізації посідають важливе місце як інструмент своєчасної і точної діагностики РМЗ. У статті описані діагностичні можливості, переваги й недоліки візуалізаційних методик, що використовуються в сучасній клінічній практиці. Висвітлено питання застосування променевих методів діагностики у вторинній профілактиці РМЗ, тобто для раннього його виявлення. Проаналізовано традиційний скринінговий метод — рентгенівську мамографію щодо ефективності в запобіганні смерті від РМЗ, а також економічної ефективності. Обговорено можливості скорочення навантаження скринінгових методик на бюджет: від застосування статистичних моделей до використання менш дорогих новітніх методик прескринінгу для формування груп підвищеного ризику розвитку РМЗ, які б мали проходити дорогі скринінгові процедури частіше.
На сегодня рак молочной железы (РМЖ) — значительная медицинская и социальная проблема, поскольку для него характерны высокая заболеваемость и смертность. Путями уменьшения этих показателей являются ранняя диагностика и эффективное лечение. Современные методы медицинской визуализации занимают важное место как инструмент своевременной и точной диагностики РМЖ. В статье описаны диагностические возможности, преимущества и недостатки визуализационных методик, используемых в клинической практике. Освещены вопросы применения лучевых методов диагностики во вторичной профилактике РМЖ, то есть для раннего его выявления. Проанализирован традиционный скрининговый метод — рентгеновская маммография с точки зрения эффективности предотвращения смерти от РМЖ, а также экономической эффективности. Обсуждены возможности сокращения нагрузки скрининговых методик на бюджет: от применения статистических моделей до использования менее дорогих новейших методик прескрининга для формирования групп повышенного риска развития РМЖ, которые должны проходить дорогостоящие скрининговые процедуры чаще.
Today, breast cancer is a significant medical and social problem because it has high morbidity and mortality rates. Ways to reduce these indicators are early diagnosis and effective treatment. Modern methods of medical imaging have an important place as a tool for timely and accurate diagnosis of breast cancer. The article describes the diagnostic possibilities, advantages and disadvantages of imaging techniques used in modern clinical practice. The issues of radiation diagnostic methods in the secondary prevention of breast cancer, that is, its early detection, are covered. The traditional screening method — X-ray mammography is analyzed in terms of effectiveness in preventing death from breast cancer, as well as cost effectiveness. The possibilities of reducing the burden of screening methods on the budget are discussed: from the application of statistical models to the use of less expensive newest screening techniques for the formation of groups at high risk of developing breast cancer, whoich should undergo expensive screening procedures more often.
рак молочної залози; медична візуалізація; скринінг
рак молочной железы; медицинская визуализация; скрининг
breast cancer; medical imaging; screening
Рак молочної залози (РМЗ) залишається лідером у структурі захворюваності й смертності від злоякісних новоутворень як у цілому світі, так і в Україні. Щорічно у світі реєструють близько 1,3 млн випадків захворювань на РМЗ, близько 500 тис. жінок вмирають від цієї недуги. За даними Всесвітньої агенції з вивчення раку (IARC), у 2012 р. у європейських країнах РМЗ становив 29 % від всіх злоякісних новоутворень у жінок. Проте всупереч твердженню, яке зустрічається подекуди, що РМЗ є хворобою економічно розвинених країн, більшість випадків (близько 70 %) припадає на країни, що розвиваються [1, 2, 7].
Показники виживаності варіюють від 85 % і вище в Північний Америці, Швеції і Японії до приблизно 60 % в країнах із середнім рівнем доходу й не досягають 40 % у країнах із низьким доходом. Низькі показники виживаності в таких країнах пояснюються відсутністю програм раннього виявлення раку, що призводить до появи значної кількості занедбаних випадків, а також браком засобів і ресурсів для сучасної діагностики й лікування.
За даними Національного канцер-реєстру України, у 2012 р. рак молочної залози посідав провідну позицію у структурі смертності від онкологічних захворювань серед жінок усіх вікових груп (рис. 1).
Натомість, наприклад, у Канаді, де РМЗ у молодих жінок у вимірі на потенційно втрачені роки життя становить майже 137 000 років, уже вдалося уникнути 32 000 смертей, починаючи з піку рівня смертності від РМЗ у 1988 році. Такий результат був досягнутий завдяки скринінгу й імплементації досягнень у лікуванні цієї патології [3–5].
За даними ВООЗ, наявність РМЗ у родинному анамнезі збільшує ризик у 2–5 разів. Деякі мутації, зокрема BRCA1, BRCA2 і p53, мають здатність підвищувати ризик РМЗ до десятикратного. Репродуктивні фактори, пов’язані з тривалим впливом ендогенних естрогенів, — рання поява менструацій, пізнє їх завершення, пізні перші й останні пологи, відсутність пологів — також входять до числа найбільш важливих факторів ризику розвитку РМЗ. Жінки, які отримують замісну гормонотерапію в менопаузі, також належать до групи високого ризику.
Сьогодні серед методів сучасної інструментальної діагностики найбільшу діагностичну цінність мають рентгенівська мамографія (РМ), ультразвукове дослідження (УЗД) і магнітно-резонансна томографія (МРТ) із внутрішньовенним контрастуванням. Кожен із цих методів потребує застосування сучасного якісного медичного обладнання, наявності підготовленого персоналу й обов’язкових регламентних заходів із контролю якості. Правильне й своєчасне використання цих діагностичних інструментів дозволяє виявляти доклінічні форми раку молочної залози з позитивним прогностичним значенням у 96–99 %, що позитивно корелює з результатами лікування [22].
УЗД молочних залоз є ефективним методом диференціальної діагностики солідних і кістозних новоутворень, а подекуди — першим інструментальним методом діагностики раку молочної залози в жінок репродуктивного віку (рис. 2–4). Допплерівське картування кровотоку дозволяє оцінити особливості васкуляризації утворення, а ехоеластографія — визначити щільність вузлів, що полегшує диференціальну діагностику підозрілих на карциному знахідок і знижує відсоток виконання біопсій при доброякісних станах.
Нешкідливість і простота УЗД дозволяють застосовувати його як перший діагностичний метод при захворюваннях молочної залози при значній щільності тканини органа, у молодих, вагітних жінок і під час лактації. Проте скринінгові можливості методу часто обмежені неспецифічністю низки ехографічних ознак раку й багато в чому залежать від кваліфікації і досвіду лікаря променевої діагностики, що спричиняє складнощі з визначенням неінвазивних карцином, непальпованих інвазивних карцином розміром менше за один сантиметр, а також у пацієнток із великим розміром молочної залози й інволютивним типом її структури [16].
За останні 10 років МРТ з контрастним підсиленням (рис. 5) стала одним з найбільш цінних методів інструментальної діагностики захворювань молочних залоз із загальною чутливістю щодо виявлення РМЗ у групах високого ризику від 71 до 100 % порівняно із 40–50 % для мамографії [8]. Виявляємість вогнищ при мультицентричному рості РМЗ сягає 80 % усіх фокусів. Водночас при дуктальній карциномі in situ МРТ демонструє низьку чутливість. У цілому чутливість МРТ становить 96–98 %, специфічність — 74–76,5 %.
На сьогодні існують переконливі докази цінності щорічного МРТ-скринінгу в жінок — носіїв мутації генів BRCA, у жінок зі спадковим анамнезом РМЗ, тих, які отримували значні дози променевої терапії на грудну клітку (найчастіше — з приводу лімфоми), а також у жінок зі синдромами Лі — Фраумені й Каудена [9].
МРТ не є рутинним методом діагностики РМЗ, її проведення доцільно розглянути в таких клінічних ситуаціях:
— діагностика рецидиву пухлини в ділянці післяопераційного рубця;
— діагностика окультного первинного раку за наявності односторонньої аксилярної аденопатії;
— оцінка результатів неоад’ювантної хіміотерапії;
— скринінг жінок із високим довічним ризиком розвитку РМЗ;
— оцінка стану імплантів після ендопротезування.
У той же час МРТ-мамографія не є методом першої лінії діагностики в таких випадках:
— для диференціальної діагностики змін категорії ВI RADS3 і ВI RADS4;
— для вирішення питання про проведення біопсії;
— замість рентгенівської мамографії та УЗД.
Для отримання максимально інформативного дослідження необхідно використовувати системи МРТ з напруженістю магнітного поля не нижче від 1,5 Т, обов’язково застосовувати контрастні речовини й враховувати такі рекомендації щодо часу дослідження:
— у першу фазу менструального циклу в жінок репродуктивного віку;
— у жінок, які отримують замісну гормональну терапію, — через 2 місяці після паузи в прийомі препаратів;
— після хірургічної біопсії — через 6 місяців;
— після закінчення променевої терапії — через 12–18 місяців.
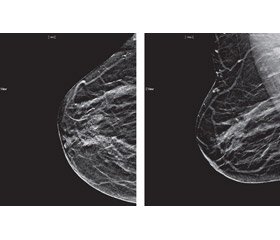
Рентгенівська мамографія (РМГ) є методом променевої діагностики, застосування якого як інструменту скринінгу РМЗ дозволяє знизити показник смертності від цієї хвороби на 40 % [17]. Візуалізація тканин із порівняно малою різницею поглинаючих характеристик, таких як жирова клітковина й фіброгландулярні структури, вимагає зображень високої якості з високою чіткістю й контрастністю, що стало можливим завдяки впровадженню цифрових технологій (рис. 6).
Цифрова РМГ отримала свій подальший розвиток як 3D-мамографія або цифровий томосинтез, який надає можливість пошарового аналізу зображення молочної залози й значно полегшує аналіз. У комбінованому застосуванні з цифровою РМГ томосинтез об’єднує скринінг із діагностичною мамографією, що знижує частоту повторних додаткових експозицій і підвищує якість і кількість виявлених випадків раку в так званих щільних залозах, коли чутливість простої РМГ знижується до 50 %, і при цьому без істотного збільшення променевого навантаження на орган [14, 15]. У 2015 р. були опубліковані перші результати великого дослідження із США щодо впровадження томосинтезу як інструмента скринінгу: повідомляється про скорочення кількості інтервального раку з 0,7 до 0,5 випадку на 100 обстежених жінок [13]. Подальші дослідження щодо удосконалення технології РМ були втілені в рентген-контрастній мамографії з використанням субтракції зображення [24, 25].
Скринінгова РМГ — це основний метод виявлення РМЗ у безсимптомних жінок. Основна мета скринінгу полягає у виявленні захворювання на ранній стадії, що дозволяє знизити число випадків місцево-поширеного раку й розвитку метастатичної хвороби й покращити віддалені результати лікування. Жінки з помірним довічним ризиком розвитку РМЗ є основною цільовою групою дослідження і становлять 80 % від тих, кому був поставлений діагноз РМЗ.
Проте скринінгова РМГ не позбавлена й деяких недоліків, одним з яких є гіпердіагностика, або псевдопозитивні результати тесту [18, 19]. Гіпердіагностика має місце в 1–10 % випадків, про що свідчать довгострокові дослідження, проведені у Швеції [29]. У 80 % випадків хибнопозитивна підозра на РМЗ буде знята в межах подальшої неінвазивної візуалізації, інші 20 % жінок потребують діагностичної біопсії, очікувана частота карциноми серед них становить менше від 50 % [20, 21].
/17-2.jpg )
У 2014 році в Міжнародній агенції з дослідження раку була створена робоча група у складі 29 експертів з епідеміології, хірургічної і клінічної онкології, радіології, патології, фізики й генетики з 16 країн світу з метою проведення повторної оцінки розвитку РМЗ, профілактичних і несприятливих ефектів застосування різних методів скринінгу [6].
До досягнення консенсусу цією групою були оцінені всі доступні високоякісні когортні дослідження обсервацій і дослідження «випадок — контроль» із 1989 по 2014 рік (приблизно 40 публікацій). Отримані результати показали, що серед жінок, які були запрошені на РМГ-скринінг у віці 50–69 років, зниження ризику смерті від РМЗ було на рівні 23 %, а серед жінок — учасниць скринінгу досягало 40 %. Ефективність скринінгу в жінок віком 40–49 років у цих дослідженнях була меншою. Панканадське обсерваційне дослідження 2014 року вивчало вплив РМГ-скринінгу на смертність від РМЗ з урахуванням мінливості результатів досліджень у різних країнах, де проводився скринінг [26]. З 12 канадських програм скринінгу РМЗ у дослідженні взяли участь 7 програм, які об’єднали 85 % жіночої популяції Канади. Були отримані дані щодо скринінгу, діагностики й смертності від РМЗ за період з 1990 по 2009 рік для 2,8 млн учасниць скринінгу (усього 20,2 млн людино-років спостереження). Середня смертність від РМЗ серед учасників становила 40 % (від 33 до 48 %), що нижче за смертність серед жінок, які не брали участь у скринінгу. При цьому вік на початок обстеження (40 замість 50 років), обізнаність населення щодо РМЗ і тенденцій стосовно ефективності лікування цієї хвороби на ці результати не вплинули. Дослідження дійшло висновку, що участь у програмах скринінгової РМГ у Канаді привела до значного зниження смертності від РМЗ для жінок віком 40–74 роки. Аналогічний результат зниження смертності на 40 %, який ґрунтується на дослідженні скринінгу 462 жінок віком 50–59 років, був досягнутий в США (ACS) за 15 років спостереження.
Для оцінки результатів скринінгових досліджень дуже важливим є використання довгострокових спостережень [28].
Неінвазивна протокова карцинома (DCIS) може бути розглянута як приклад пухлини, щодо якої найчастіше має місце гіпердіагностика. У світовій літературі й досі точиться багато суперечок щодо значення скринінгу для діагностики DCIS і подальшого її лікування. До широкого впровадження скринінгової РМГ у США щорічно фіксували 6 випадків DCIS на 100 000 жінок, а після того, як було введено скринінг, — 37 [30]. За даними American Cancer Society (АСS), неінвазивна карцинома становить 20 % усіх нових випадків РМЗ, переважна більшість (83 %) з яких є не обов’язковим попередником інвазивного раку.
Мамографічно DCIS найчастіше представлена кластерами мікрокальцинатів. Інколи такий рак як мамографічно, так і клінічно є окультним. У таких випадках методом вибору в його діагностиці є МРТ з конт–растним підсиленням, оскільки цей метод діагностики має більш високу чутливість (97 %), ніж РМГ (80 %), особливо для високодиференційованої DCIS.
Псевдонегативні результати скринінгу найбільш вірогідні в пацієнтів зі щільним типом паренхіми молочної залози, з деякими часточковими карциномами, які не призводять до порушення звичайної нормальної архітектури паренхіми, що ускладнює їх виявлення [31]. Цифровий томосинтез має потенціал для одночасного збільшення виявлення раку й зниження рівня псевдопозитивних результатів.
Важливою перевагою скринінгу в розвинених країнах є зниження витрат на лікування хворих на РМЗ, оскільки лікування на більш ранній стадії є менш агресивним і не таким дорогим, що також позитивно відбивається на якості життя пацієнток і покращує довгостроковий прогноз одужання. Величезними перевагами доклінічної діагностики з позиції пацієнтки є можливість проведення органозберігаючої або онкопластичної операції замість мастектомії, зниження потреби в хіміо- і променевій терапії, зменшення кількості ускладнень лікування, а отже, і скорочення тривалості перебування в стаціонарі. Назагал наслідком цього є більша задоволеність жінок результатами й скорочення витрат на лікування.
Епідеміологічні показники в США свідчать про те, що в жінок віком до 40 років частка РМЗ становить менше за 5 %; 18 % припадає на жінок віком 40–49 років, 23 % — 50–59 років, 26 % — 60–69 років і 28 % — 70 років і старших. Тому більшість національних комітетів зі скринінгу припускають, що РМГ-скринінг найбільше значення має для жінок віком від 40 років. Американська спілка American Cancer Society рекомендує щорічну скринінгову РМГ для жінок віком від 45 до 54 років, що обумовлено більш високою швидкістю канцерогенезу в жінок репродуктивного періоду. Утім, навіть у США різні професійні організації рекомендують різні терміни початку й завершення скринінгу й інтервали його проведення (табл. 1).
Попри те, що максимальна вигода досягається при щорічному скринінгу, жінки в постменопаузі (від 55 років і старші) мають перейти на дворічний скринінг для максимальної економічної ефективності, та й додаткова вигода від щорічного скринінгу в цій групі нижча. З-поміж 10 % випадків скринінгової гіпердіагностики, що переважно обумовлені наявністю DCIS, у 8 % знадобиться додаткове мамографічне або ультра–звукове обстеження. У решті 2 % випадків ситуація буде потребувати проведення біопсії, після якої тільки в однієї з трьох пацієнтів буде верифікований рак.
Розглядаючи питання РМГ-скринінгу, неможливо залишити поза увагою радіаційну безпеку дослідження. Спровоковані мамографією карциноми були оцінені на основі моделей, що включають різні чинники. Встановлено один випадок смерті від РМЗ на 100 000 жінок, які брали участь в скринінгу у віці 50–69 років упродовж 10 років з променевим навантаженням в 2,5 мГр за один раунд скринінгу. Ймовірність розвитку РМЗ унаслідок мамографії як мінімум у 100 разів нижча за ймовірність померти від РМЗ [6]. З урахуванням коефіцієнта зниження смертності 43 % РМГ, що проводиться один раз на два роки, рятує 350 життів на 100 000 жінок [11]. Важливо зазначити й те, що більшість пацієнток із діагностованим РМЗ, розвиток якого, ймовірно, став наслідком мамографії, будуть успішно вилікувані [12].
Незважаючи на доведену ефективність у запобіганні смертям від РМЗ і відносну безпечність, суттєвою проблемою організації мамологічного скринінгу є навантаження на бюджет. Зауважимо, що йдеться про популяційний скринінг, який охоплює не менше від 70–80 % жінок, на відміну від опортуністичного (або спорадичного) скринінгу, який жінки здійснюють на власний розсуд і власним коштом. Існують дані, що для запобігання 1 смерті від РМЗ необхідно обстежувати приблизно 200 жінок протягом 10 років.
Вивченню проблеми економічної ефективності РМГ-скринінгу присвячені десятки публікацій за останні 5–7 років [31–33]. Уникаючи наведення складних для пересічного лікаря економічних розрахунків, маємо зауважити, що комплексна оцінка показника «вартість — ефективність» щодо РМГ-скринінгу доводить значне його навантаження на бюджет. Узагальнення результатів скринінгу, а також аналіз економічних моделей доводить необхідність зменшення витрат шляхом, наприклад, збільшення інтервалів скринінгу або визначення окремих груп з особливими потребами щодо скринінгу.
У лютому 2014 р. був опублікований звіт незалежної установи з оцінки технологій охорони здоров’я Швейцарії Swiss Medical Board щодо ефективності мамографічного скринінгу [34]. Команда експертів включала епідеміолога, фармаколога, онкохірурга, спеціалістів з догляду за хворими, з медичної етики, економіста, юриста.
Звіт здійняв бурю серед медичної спільноти, позаяк ставив під сумнів доцільність проведення РМГ-скринінгу. Аргументи назагал зводились до 3 пунктів:
1. Існуючі дані щодо ефективності РМГ-скринінгу щодо запобігання смертям від РМЗ отримані багато років тому. Перше дослідження, присвячене цій проблемі, проведене більше ніж 50 років тому, останнє — у 1991 р. Проте за останні десятиріччя з’явилось багато новітніх методів лікування, яких не існувало до того. Отже, на сьогодні невідомо, який саме внесок у покращення виживаності вносить виявлення РМЗ при скринінговому дослідженні, а який — високоефективне лікування.
2. Співвідношення потенційної користі й шкоди РМГ-скринінгу не завжди схиляється в бік переваг користі. Автори звіту при цьому посилаються на ґрунтовні результати канадського дослідження, у якому встановлено, що 106 із 44 925 жінок, що зазнали скринінгових РМГ (22 %), мали хибнопозитивні результати й отримали зайві діагностичні й лікувальні процедури [35]. Зокрема, у звіті наведена цитата з кокрейнівського огляду [36]: «Якщо припустити, що скринінг зменшує смертність від РМЗ на 15 %, а гіпердіагностика й зайве лікування становлять до 30 %, то це значить, що на кожні 2000 жінок, яких запросили на скринінг протягом 10 років, одна уникає смерті від РМЗ і 10 здорових жінок отримують непотрібне лікування, яке б не проводилося, якби не було скринінгу».
3. Автори звіту були збентежені глибокою невідповідністю очікувань жінок відносно ефективності РМГ-скринінгу реальним показникам його ефективності. При опитуванні жінки вважали, що РМГ-скринінг зменшує ризик смерті від РМЗ на 50 % і запобігає щонайменше 80 смертям на 1000 жінок, які були на скринінгу. Проте в реальності в кращому випадку мамографічний скринінг зменшує ризик смерті на 20 % і запобігає одній смерті від РМЗ на 10 тисяч учасниць скринінгової програми. Невідомо, чи погоджувались би жінки на участь у РМГ-скринінгу, якби усвідомлювали реальні дані щодо його ефективності й безпеки. Особливо це стосується жінок із рентгенологічно щільними молочними залозами, у яких ефективність РМГ-скринінгу мінімальна, і носіїв BRCA 1/2 мутацій у зв’язку з більшою чутливістю до канцерогенної дії рентгенівського опромінення.
Викладені вище аргументи не є невразливими для критики, проте в підсумку від програми державного РМГ-скринінгу в Швейцарії відмовились.
Отже, перспективним вектором розвитку РМГ-скринінгу, який дозволив би не втратити переваг щодо запобігання смертей від РМЗ і водночас максимально зменшити навантаження на бюджет, є виокремлення популяційних груп із підвищеним ризиком РМЗ (які потребують менших інтервалів скринінгу і, можливо, раннього його початку) із загальної популяції, у якій частота скринінгових досліджень може бути меншою.
Один з найперспективніших шляхів досягнення такої мети — застосування статистичних моделей, що дозволяють оцінити ризик розвитку РМЗ, а отже, планувати заходи скринінгу/спостереження і ризик-знижуючого лікування. Прикладом є BRCAPRO — статистична модель (із відповідним програмним забезпеченням), що дозволяє оцінити ризик наявності мутації BRCA 1/2, вона ґрунтується на обтяженості спадкового анамнезу (рак молочної залози, яєчника, рак грудної залози в чоловіків тощо). Аналогічними моделями є BOADICEA, модель Tyrer — Cuzick. Жінки з підвищеним генетичним ризиком РМЗ, які не бажають вдаватися до заходів профілактичного лікування, мають спостерігатися згідно з певним протоколом (наприклад, NCCN Clinical Practice Guidelines in Oncology. Breast Cancer Risk Reduction).
Інший підхід до формування окремих груп ризику — застосування принципово інших методів масової діагностики. Зрозуміло, що вартість цих методів має бути нижчою за РМГ (а отже, МРТ і томосинтезу).
Значні сподівання покладались на термографію (ТГ), яку почали вивчати як метод діагностики захворювань молочних залоз ще з 70-х рр. минулого сторіччя. У 1982 р. FDA дозволила використання цього методу, але не як самодостатнього, а тільки як додаткового до стандартних візуалізуючих методик. Проте в більшості досліджень була встановлена недостатня чутливість методу й велика кількість хибнопозитивних результатів порівняно з РМГ. Серед причин, які обумовлювали низьку ефективність термографії в дослідженнях, згадувались низька чутливість термографічних плівок, недостатня відтворюваність, відсутність стандартів для тлумачення термограм і досвіду фахівців [37].
Згідно з результатами цих робіт, підсумованими в систематичних оглядах [37], на сьогодні немає ґрунтовних наукових даних, які б дозволяли рекомендувати ТГ як самостійний метод скринінгу чи діагностики. Попри це ТГ застосовується в низці приватних клінік Південної Америки. У лютому 2019 р. FDA опублікувала лист-застереження, у якому наголошується на неприпустимості застосування ТГ замість скринінгової РМГ [38].
Нову хвилю вивчення можливостей ТГ зумовила поява нових методологічних підходів до реєстрації і аналізу інформації щодо термальних градієнтів в органі. До них належать:
— використання високочутливих рідкокристалічних матриць для реєстрації;
— контактний, а не дистанційний метод реєстрації;
— індивідуальний підбор матриць (з трьох), відкаліброваних у різних режимах, з урахуванням вихідної температури тіла;
— проведення дослідження в 3–5 проєкціях по 15 знімків у кожній (залежно від розміру молочної залози);
— використання для обробки інформації спеціальних програмних продуктів.
Дослідження не потребує особливих умов і багато часу, може проводитись підготовленим середнім медичним персоналом. Отримані під час дослідження зображення пересилаються в центр телемедицини й аналізуються штучним інтелектом за стандартизованим алгоритмом. Серед обмежень потрібно згадати неінформативність при вагітності, лактації і впродовж певного часу після інвазивних процедур на молочній залозі. Результати перших пілотних досліджень такого прибору Braster Pro в рамках дослідження TermaAlg (Observational Study evaluating the diagnostic efficacy and clinical relevance of the Braster interpretation algorithm for the detection of female breast pathology) є достатньо обнадійливими. Клінічні випробування тривають, і, можливо, згодом, за наявності вірогідних даних, такі методи можуть зайняти нішу доступних і швидких методів скринінгового спостереження пацієнток. Серед можливих місць у клінічний діагностиці, які могли б посісти методи реєстрації термальних градієнтів молочної залози, згадують їх застосування як доповнення до клінічного обстеження лікарем першого контакту, а також для формування груп пацієнток, які будуть вимагати інших методів медичної візуалізації і більш дорогого скринінгу.
Рак молочної залози лишається значною медичною і соціальною проблемою, обумовлюючи значні показники смертності жінок усіх вікових груп. Зменшення соціального й демографічного тиску цього захворювання на суспільство полягає, зокрема, у ранній діагностиці й ефективному лікуванні. Сучасні методи медичної візуалізації посідають важливе місце як інструмент своєчасної і точної діагностики РМЗ. Кожний з них має свої діагностичні можливості, переваги й недоліки, і тільки досвід і знання лікаря дозволяють обрати в конкретної пацієнтки найбільш інформативні методи, будуючи діагностичний алгоритм дій. Доведена користь променевих методів діагностики полягає у вторинній профілактиці РМЗ, тобто в ранньому його виявленні. Основний скринінговий метод — рентгенівська мамографія — має безперечні докази ефективності в цьому сенсі, проте його широке використання суттєво обмежує значне навантаження на бюджет, чутливе навіть в економічно успішних країнах. Це стало приводом для пошуку методів скорочення витрат, серед яких важливу роль відіграє формування груп підвищеного ризику розвитку РМЗ, які б мали проходити дорогі скринінгові процедури частіше. Такими перспективними методами є застосування статистичних моделей для оцінки ризику й використання менш дорогих (хоча, можливо, і менш точних) «попередніх» діагностичних процедур. З огляду на стрімкий науково-технічний прогрес ці завдання не виглядають нереалістичними, і досвід провідних країн світу, що вже тепер демонструють поступове зниження смертності від РМЗ, налаштовує нас на оптимізм.
Конфлікт інтересів. Не заявлений.
1. Ferlay J., Soerjomataram I., Dikshit R. et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in globocan 2012. Int. J. Cancer. 2015. 136. E359-86.
2. Bray F., Ren J.S., Masuyer E., Ferlay J. Estimates of global cancer prevalence for 27 sites in the adult population in 2008. Int. J. Cancer. 2013. 132. 1133-45.
3. Pisani P., Parkin D.M., Bray F., Ferlay J. Estimates of the worldwide mortality from 25 cancers in 1990. Int. J. Cancer. 1999. 83. 18-29. Erratum in: Int. J. Cancer. 1999. 83. 870-3.
4. Canadian Cancer Society’s Advisory Committee on Cancer Statistics. Canadian Cancer Statistics 2016. Toronto: Canadian Cancer Society, 2016.
5. Independent UK Panel on Breast Cancer Screening. The be–nefits and harms of breast cancer screening: an independent review. Lacet. 12. 380. 1778-86.
6. Lauby-Secretan B., Scoccianti C., Loomis D., International Agency for Research on Cancer Handbook Working Group et al. Breast Cancer Screening — Viewpoint of the IARC Working Group. N. Engl. J. Med. 2015. 372(24). 2353-2358.
7. Broeders M., Moss S., Nystrom L. et al. on behalf of the euroscreen Working Group. The impact of mammographic screening on breast cancer mortality in Europe: a review of observational studies. J. Med. Screen. 2012. 19 (suppl. 1). 14-25.
8. Kuhl C.K., Schrading S., Bieling H.B. et al. MRI for diagnosis of pure ductal carcinoma in situ: a prospective observational study. Lancet. 2007. 370. 485-92.
9. Kuhl C.K., Strobel K., Bieling H., Leutner C. et al. Supplemental breast MR imaging screening of women with average risk of breast cancer. Radiology. 2017. 283. 361-70.
10. Gagnon J., Levesque E., Borduas F. et al. on behalf of the Clinical Advisory Committee on Breast Cancer Screening and Prevention. Recommendations on breast cancer screening and prevention in the context of implementing risk stratification: impending changes to current policies. Curr. Oncol. 2016. 23. 615-25.
11. Hauge I.H., Pedersen K., Olerud H.M., Hole E.O., Hofvind S. The risk of radiation-induced breast cancers due to biennial mammographic screening in women aged 50–69 years is minimal. Acta Radiol. 2014. 55(10). 1174-1179.
12. Yaffe M.J., Mainprize J.G. Risk of radiation-induced breast cancer from mammographic screening. Radiology. 2011. 258(1). 98-105.
13. Houssami N. Digital breast tomosynthesis (3D-mammography) screening: data and implications for population screening. Expert Rev. Med. Devices. 2015. 12(4). 377-379.
14. Friedewald S.M., Rafferty E.A., Rose S.L. et al. Breast cancer screening using tomosynthesis in combination with digital mammography. JAMA. 2014. 311. 2499-507.
15. Skaane P., Bandos A.I., Gullien R. et al. Comparison of digital mammography alone and digital mammography plus tomosynthesis in a population-based screening program. Radiology. 2013. 267. 47-56.
16. Tagliafico A.S., Calabrese M., Mariscotti G. et al. Adjunct screening with tomosynthesis or ultrasound in women with mammo–graphy-negative dense breasts: interim report of a prospective comparative trial. J. Clin. Oncol. 2016.
17. Friedewald S.M., Rafferty E.A., Rose S.L. et al. Breast cancer screening using tomosynthesis in combination with digital mammography. JAMA. 2014. 311. 2499-507.
18. Breast screening: the facts — or maybe not. BMJ. 2009. 338. b86.
19. Paci E., Duffy S. Overdiagnosis and overtreatment of breast cancer: overdiagnosis and overtreatment in service screening. Breast Cancer Res. 2005. 7. 266-70.
20. Kopans D.B., Smith R.A., Duffy S.W. Mammographic screening and “overdiagnosis”. Radiology. 2011. 260. 616-20.
21. Gotzsche P.C., Hartling O.J., Nielsen M., Brodersen J., Jorgensen K.J., Welch H.G., Black W.C. Overdiagnosis in cancer. J. Natl Cancer Inst. 2010. 102. 605-13.
22. Helvie M.A., Chang J.T., Hendrick R.E., Banerjee M. Reduction in late-stage breast cancer incidence in the mammography era: implications for overdiagnosis of invasive cancer. Cancer. 2014. 120. 2649-56.
23. Lewin J.M., Isaacs P.K., Vance V., Larke F.J. Dual-energy contrastenhanced digital subtraction mammography: feasibility. Radiology. 2003. 229. 261-8.
24. Covington M.F., Pizzitola V.J., Lorans R. et al. The future of contrast-enhanced mammography. AJR Am. J. Roentgenol. 2018. 210. 292-30.
25. Coldman A., Phillips N., Wilson C. et al. Pan-Canadian study of mammography screening and mortality from breast cancer. J. Natl Cancer Inst. 2014. 106. 261.
26. Oeffinger K.C., Fontham E.T., Etzioni R. et al. on behalf of the American Cancer Society. Breast cancer screening for women at average risk: 2015 guideline update from the American Cancer Society. JAMA. 2015. 314. 1599-614.
27. Tabar L., Vitak B., Yen M.F., Chen H.H., Smith R.A., Duffy S.W. Number needed to screen: lives saved over 20 years of follow-up in mammographic screening. J. Med. Screen. 2004. 11.
126-9.
28. Zackrisson S., Andersson I., Janzon L., Manjer J., Garne J.P. Rate of over-diagnosis of breast cancer 15 years after end of Malmo mammographic screening trial: follow-up study. BMJ. 2006. 332. 689-92.
29. Ward E.M., DeSantis C.E., Lin C.C. et al. Cancer statistics: breast cancer in situ. CA Cancer J. Clin. 2015. 65. 481-95.
30. Duffy S.W., Dibden A., Michalopoulos D. et al. Screen detection of ductal carcinoma in situ and subsequent incidence of invasive interval breast cancers: a retrospective population-based study. Lancet Oncol. 2016. 17. 109-14.
31. Mittmann N., Stout N.K., Lee P. et al. Total cost-effectiveness of mammography screening strategies. Health Rep. 2015 Dec. 26(12). 16-25. PMID: 26676235.
32. Pataki R., Ismail Z., Coldman A.J. et al. Cost-effectiveness of annual versus biennial screening mammography for women with high mammographic breast density Journal of Medical Screening. Dec. 2014. Vol. 21. № 4. Р. 180-188.
33. Tina Shih Y.C., Dong W., Xu Y., Shen Y. Assessing the Cost-Effectiveness of Updated Breast Cancer Screening Guidelines for Average-Risk Women Value Health. 2019 Feb. 22(2). 185-193. doi: 10.1016/j.jval.2018.07.880. Epub 2018 Sep.
34. Biller-Andorno N., Jüni P. Abolishing Mammography Screening Programs? A View from the Swiss Medical Board. N. Engl. J. Med. 2014. 370. 1965-1967. DOI: 10.1056/NEJMp1401875.
35. Miller A.B., Wall C., Baines C.J. et al. Twenty five year follow-up for breast cancer incidence and mortality of the Canadian National Breast Screening Study: randomised screening trial. BMJ. 2014 Feb 11. 348. g366. doi: 10.1136/bmj.g366.
36. Gøtzsche P.C., Jørgensen K.J. Screening for breast cancer with mammography. Cochrane Database Syst Rev. 2013 Jun 4. (6). CD001877. doi: 10.1002/14651858.CD001877.pub5
37. Brennan M., Houssami N. Thermography in breast cancer diagnosis, screening and risk assessment: systematic review. Breast cancer management. Feb 2013. Vol. 2. № 2. URL: https://doi.org/10.2217/bmt.13.4

/15-1.jpg )
/16-1.jpg )
/16-2.jpg )
/17-1.jpg )
/19-1.jpg)