Международный неврологический журнал Том 16, №2, 2020
Вернуться к номеру
Вплив протиепілептичних лікарських засобів на когнітивне функціонування підлітків, хворих на епілепсію
Авторы: Марценковський І.А., Марценковська І.І., Скрипник Т.О., Макаренко Г.В.
ДУ «Науково-дослідний інститут психіатрії МОЗ України», м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
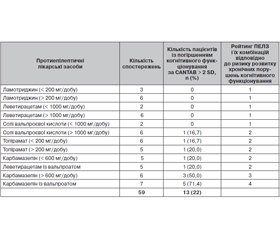
Актуальність. Наукові дані вказують на те, що протиепілептичні лікарські засоби, такі як фенобарбітал, фенітоїн, карбамазепін, викликають значні когнітивні побічні ефекти, тоді як у дослідженнях топірамату й вальпроату отримані суперечливі результати. У той же час повідомляється про позитивний вплив на когнітивне функціонування у хворих на епілепсію підлітків ламотриджину й леветирацетаму. Мета дослідження: оцінити вплив найбільш часто застосовуваних протиепілептичних лікарських засобів на когнітивне функціонування в підлітків з епілепсією. Матеріали та методи. На початковому етапі 160 українських лікарів, які працюють з підлітками з епілепсією, попросили описати досвід застосування протиепілептичних лікарських засобів і їх можливий вплив на когнітивне функціонування підлітків з епілепсією. На другому етапі було проведено проспективне дослідження, у яке були включені 58 підлітків з уперше діагностованою епілепсією та призначеною монотерапією (карбамазепіном, вальпроатом, топіраматом, леветирацетамом, ламотриджином) і 11 підлітків із неконт-рольованими монотерапією карбамазепіном і солями вальпроєвої кислоти епілептичними нападами, яким була призначена політерапія (карбамазепін з вальпроатом або вальпроат з леветирацетамом). Рандомізовані підлітки оцінювались за допомогою Кембриджської автоматизованої батареї нейропсихологічних тестів (CANTAB) до і через кожні десять днів протягом двох місяців після початку терапії для оцінки гострих когнітивних побічних ефектів. Крім того, на початку дослідження, через 2 місяці й кожний місяць терапії протягом 10 місяців після повторної рандомізації в підлітків оцінювали хронічні когнітивні побічні ефекти призначених протиепілептичних лікарських засобів із використанням автоматизованої батареї тестів Cogtest. Результати. Не виявлено гострих порушень когнітивного функціонування в підлітків, які отримували ламотриджин і леветирацетам у середніх терапевтичних дозах. У кожного другого підлітка, який лікувався вальпроатами в дозі понад 1000 мг на добу, і тих хворих, які отримували карбамазепін, виявлене значне порушення когнітивного функціонування. Найчастіше гостре порушення когнітивного функціонування спостерігалося в підлітків, які отримували карбамазепін у дозі понад 600 мг на добу, і тих, хто отримував комбіновану терапію карбамазепіном і вальпроатами. Підлітки, які отримували нові протиепілептичні лікарські засоби (ламотриджин і леветирацетам) у широкому діапазоні доз, не продемонстрували когнітивних порушень після 12 місяців лікування, у той час як монотерапія топіраматом супроводжувалася порушеннями когнітивних функцій в окремих пацієнтів. Більше ніж половина підлітків, які отримували комбіновану терапію (карбамазепін + вальпроат), продемонстрували тривалі порушення когнітивного функціонування. Хронічні порушення когнітивного функціонування в підлітків, які отримували терапію карбамазепіном або вальпроєвою кислотою, залежали від дози. Висновки. Підлітки з епілепсією, які отримували лікування карбамазепіном, вальпроатами або терапію комбінацією цих лікарських засобів, потребують ретельного моніторингу можливих гострих і хронічних порушень когнітивного функціонування. Підлітки, які отримують терапію топіраматом, потребують моніторингу когнітивних побічних ефектів на етапі титрування доз. Терапія леветирацетамом і ламотриджином не потребує контролю когнітивних побічних ефектів.
Актуальность. Научные данные указывают на то, что противоэпилептические лекарственные средства, такие как фенобарбитал, фенитоин, карбамазепин, вызывают значительные когнитивные побочные эффекты, тогда как по результатам исследований топирамата и вальпроата получены противоречивые результаты. В то же время сообщается о положительном влиянии на когнитивное функционирование у больных эпилепсией подростков ламотриджина и леветирацетама. Цель исследования: оценить влияния наиболее часто применяемых противоэпилептических лекарственных средств на когнитивное функционирование у подростков с эпилепсией. Материалы и методы. На начальном этапе 160 украинских врачей, работающих с подростками с эпилепсией, попросили описать их опыт применения противоэпилептических лекарственных средств и их возможное влияние на когнитивное функционирование подростков с эпилепсией. На втором этапе было проведено проспективное исследование, в которое были включены 58 подростков с впервые диагностированной эпилепсией и назначенной монотерапией (карбамазепином, вальпроатом, топираматом, леветирацетамом, ламотриджином) и 11 подростков с неконтролируемыми на монотерапии карбамазепином и солями вальпроевой кислоты эпилептическими припадками, которым была назначена политерапия (карбамазепин с вальпроатом или вальпроат с леветирацетамом). Рандомизированные подростки оценивались с помощью Кембриджской автоматизированной батареи нейропсихологических тестов (CANTAB) до и через каждые десять дней в течение двух месяцев после начала терапии для оценки острых когнитивных побочных эффектов. Кроме того, в начале исследования, через 2 месяца и через каждый месяц терапии в течение 10 месяцев после повторной рандомизации у подростков оценивали хронические когнитивные побочные эффекты назначенных противоэпилептических лекарственных средств с использованием автоматизированной батареи тестов Cogtest. Результаты. Не выявлено острых нарушений когнитивного функционирования у подростков, получавших ламотриджин и леветирацетам в средних терапевтических дозах. У каждого второго подростка, получавшего терапию вальпроатами в дозе выше 1000 мг в сутки, и тех, которые получали карбамазепин, выявлены значительные нарушения когнитивного функционирования. Чаще всего острые нарушения когнитивного функционирования наблюдались у подростков, получавших карбамазепин в дозе 600 мг в сутки, и у тех, кто получал комбинированную терапию карбамазепином и вальпроатами. Подростки, которые получали новые противоэпилептические лекарственные средства (ламотриджин и леветирацетам) в широком диапазоне доз, не продемонстрировали когнитивных нарушений после 12 месяцев лечения, в то время как монотерапия топираматом сопровождалась нарушениями когнитивных функций у отдельных пациентов. Более половины подростков, получавших комбинированную терапию (карбамазепин + вальпроат), продемонстрировали длительные нарушения когнитивного функционирования. Хронические нарушения когнитивного функционирования у подростков, получавших терапию карбамазепином или вальпроевой кислотой, зависели от дозы. Выводы. Подростки с эпилепсией, которые получали лечение карбамазепином, вальпроатами или терапию комбинацией этих лекарственных средств, требуют тщательного мониторинга возможных острых и хронических нарушений когнитивного функционирования. Подростки, которые получают терапию топираматом, требуют мониторинга когнитивных побочных эффектов на этапе титрования доз. Терапия леветирацетамом и ламотриджином не требует контроля когнитивных побочных эффектов.
Background. Current data suggest that antiepileptic medications such as phenobarbital, phenytoin, carbamazepine are associated with significant adverse cognitive effects, while stu-dies of topiramate and valproate showed conflicting results. At the same time, the positive effects of lamotrigine and levetiracetam on cognitive functioning in patients with epilepsy have been reported. The study purposed to evaluate the effects of the most commonly used antiepileptic drugs on cognitive functioning in adolescents with epilepsy. Materials and methods. Initially, 160 Ukrainian doctors working with adolescents suffering from epilepsy were interviewed in terms of their experience of using antiepileptic medications and possible associated effects on the cognitive functioning of adolescents with epilepsy. A prospective study was conducted in 58 adolescents with newly diagnosed epilepsy and prescribed monotherapy (carbamazepine, valproate, topiramate, levetiracetam, lamotrigine) and 11 adolescents with epileptic seizures uncontrolled by monotherapy with carbamazepine and valproate, who were prescribed polytherapy (carbamazepine with valproate or valproate with levetiracetam). All randomized adolescents were examined using Cambridge Neuropsychological Test Automated Battery before and every ten days after initiation of therapy with antiepileptic drugs in order to assess acute adverse cognitive effects. Additionally, Cogtest automated battery was used at the baseline, in 2 months of the study and after every month during 10 months since re-randomization to assess long-term cognitive impairment. Results. No acute disorders of cognitive functioning were found in adolescents treated with lamotrigine and levetiracetam in average therapeutic doses. One in two adolescents treated with valproate at a dose of 1,000 mg per day and those treated with carbamazepine demonstrated a significant impairment of cognitive functioning. The most frequent acute cognitive functioning impairment was observed in adolescents treated with carbamazepine at a dose of more than 600 mg per day and those on combined carbamazepine and valproate therapy. Adolescents treated with new antiepileptic drugs (lamotrigine and levetiracetam) in a wide range of doses did not demonstrate cognitive impairment after 12 months of treatment, while topiramate monotherapy was associated with cognitive impairment in certain patients. More than a half of adolescents treated with combined therapy (carbamazepine + valproate) demonstrated long-term cognitive functioning impairment. Long-term cognitive functioning impairment in adolescents treated with carbamazepine or valproate was dosage-dependent. Conclusions. Adolescents with epilepsy who received carba-mazepine, valproate or combined therapy of these drugs need to be closely monitored for possible short- and long-term cognitive functioning impairment. Adolescents on topiramate therapy need to be monitored for possible cognitive side effects at the dose titration stage. Therapy with levetiracetam and lamotrigine does not require monitoring of cognitive side effects.
протиепілептичні лікарські засоби; гострі когнітивні побічні ефекти; хронічні когнітивні побічні ефекти; вальпроати; карбамазепін; леветирацетам; ламотриджин; топірамат
противоэпилептические лекарственные средства; острые когнитивные побочные эффекты; хронические когнитивные побочные эффекты; вальпроаты; карбамазепин; леветирацетам; ламотриджин; топирамат
antiepileptic drugs; acute cognitive functioning impairment; long-term cognitive functioning impairment; valproates; carbamazepine; levetiracetam; lamotrigine; topiramate
Матеріали та методи
Результати
Висновки
1. Baker G.A., Jacoby A. (ed.). Quality of Life in Epilepsy: Beyond Seizure Counts in Assessment and Treatment. Psychology Press, 2013. 237 p.
2. Afafzalaghaee M., Dehghani M. et al. Predictors of quality of life in patients with epilepsy. 2015. P. 11-18.
3. Nikolić D.M., Željka R. Quality of life in children with epilepsy. Scripta Medica. 2019. Vol. 50. Р. 134-137.
4 Aguirre C., Quintas S. et al. Do people with epilepsy have a different lifestyle? Epilepsy & Behavior. 2017. Vol. 74. С. 27-32.
5. Helmstaedter C., Witt J.A. Anticonvulsant Drugs and Cognition. NeuroPsychopharmacotherapy. 2020. P. 1-12.
6. Гагара Д.А., Евтушенко С.К. Психические расстройства у детей с труднокурабельными формами эпилепсии как проявления насильственной нормализации электроэнцефалограммы (синдром Ландольта). Русский журнал детской неврологии. 2018. Т. 13. № 4. С. 70-73.
7. Loganathan M.A., Enja M., Lippmann S. Forced normalization: epilepsy and psychosis interaction. Innovations in clinical neuroscience. 2015. Vol. 12. № 5–6. P. 38-41.
8. Helmstaedter C., Witt J.A. Anticonvulsant Drugs and Cognition. NeuroPsychopharmacotherapy. 2020. Р. 1-12.
9. Goldberg J.F., Burdick K.E. Cognitive side effects of anticonvulsants. The Journal of clinical psychiatry. 2001. Vol. 62. P. 27-33.
10. Aldenkamp A.P. Cognitive side-effects of antiepileptic drugs. Neuropsychology of Childhood Epilepsy. Boston, MA: Springer, 2001. P. 257-267.
11. Ijff D.M., Aldenkamp A.P. Cognitive side-effects of antiepileptic drugs in children. Handbook of clinical neurology. Vol. 111. Elsevier, 2013. P. 707-718.
12. Карлов В.А. Эпилепсия у детей и взрослых, женщин и мужчин. Москва, 2010. 720 c.
13. Calandre E.P., Dominguez-Granados R., Gomez-Rubio M. et al. Cognitive effects of long-term treatment with phenobarbital and valproic acid in school children. Acta Neurologica Scandinavica. 1990. Vol. 81. № 6. P. 504-506.
14. Farwell J.R., Lee Y.J., Hirtz D.G. et al. Phenobarbital for febrile seizures — effects on intelligence and on seizure recurrence. New England Journal of Medicine. 1990. Vol. 322. № 6. P. 364-369.
15. Sabers A., Møller A., Dam M. et al. Cognitive function and anticonvulsant therapy: effect of monotherapy in epilepsy. Acta Neurologica Scandinavica. 1995. Vol. 92. № 1. P. 19-27.
16. Seidel W.T., Mitchell W.G. Cognitive and behavioral effects of carbamazepine in children: data from benign rolandic epilepsy. Journal of child neurology. 1999. Vol. 14. № 11. P. 716-723.
17. Stores G., Williams P.L., Styles E. et al. Psychological effects of sodium valproate and carbamazepine in epilepsy. Archives of disease in childhood. 1992. Vol. 67. № 11. P. 1330-1337.
18. Blennow G., Heijbel J., Sandstedt P. et al. Discontinuation of antiepileptic drugs in children who have outgrown epilepsy: Effects on cognitive function. Epilepsia. 1990. Vol. 31. P. S50-S53.
19. Hanci F., Canpolat M., Per H. et al. The relation between antiepileptic drug type and cognitive functions in childhood epilepsy: a prospective observational study. Experimental Biomedical Research. 2019. Vol. 2. № 2. P. 62-68.
20. Chambers R.M., Morrison-Levy N., Chang S. et al. Cognition, academic achievement, and epilepsy in school-age children: a case-control study in a developing country. Epilepsy & Behavior. 2014. Vol. 33. P. 39-44.
21. Sogawa Y., Masur D., O’Dell C. et al. Cognitive outcomes in children who present with a first unprovoked seizure. Epilepsia. 2010. Vol. 51. № 12. P. 2432-2439.
22. Moavero R., Santarone M.E., Galasso С. et al. Cognitive and behavioral effects of new antiepileptic drugs in pediatric epilepsy. Brain and Development. 2017. Vol. 39. № 6. P. 464-469.
23. Verrotti A., Moavero R. et al. The challenge of pharmacotherapy in children and adolescents with epilepsy-ADHD comorbidity. Clinical Drug Investigation. 2018. Vol. 38. № 1. Р. 1-8.
24. Han S.A., Yang E.J. et al. Effects of lamotrigine on attention-deficit hyperactivity disorder in pediatric epilepsy patients. Korean journal of pediatrics. 2017. Vol. 60. № 6. Р. 189-193.
25. Wang M., Zhao Q. et al. Attention deficit hyperactivity disorder (ADHD) in children with epilepsy. Irish Journal of Medical Science. 2020. Vol. 189. № 1. Р. 305-313.
26. Gomer B., Wagner, K. et al. The influence of antiepileptic drugs on cognition: a comparison of levetiracetam with topiramate. Epilepsy & Behavior. 2007. Vol. 10. № 3. Р. 486-494.
27. Meador K.J. Effects of topiramate on cognition. Journal of Neurology, Neurosurgery & Psychiatry. 2001. Vol. 71. № 1. Р. 134-135.
28. Meador K.J., Loring D.W. et al. Cognitive and behavioral effects of lamotrigine and topiramate in healthy volunteers. Neurology. 2005. Vol. 64. № 12. Р. 2108-2114.
29. Ayano G., Maravilla J.C., Alati R. Risk of autistic spectrum disorder in offspring with parental mood disorders: A systematic review and meta-analysis. Journal of affective disorders. 2019. Vol. 248. P. 185-197.
30. Veroniki A.A., Rios P., Cogo E. et al. Comparative safety of antiepileptic drugs for neurological development in children exposed during pregnancy and breast feeding: a systematic review and network meta-analysis. BMJ Оpen. 2017. Vol. 7. № 7. P. e017248.
31. Brodie M.J. Drug interactions in epilepsy. Epilepsia. 1992. Vol. 33(1). P. 13-22.
32. Patsalos P.N. Antiepileptic drug interactions: a clinical guide. Springer, 2016. 340 p.
33. Verrotti A., Iapadre, G. et al. Pharmacokinetic considerations for anti-epileptic drugs in children. Expert opinion on drug metabolism & toxicology. 2019. Vol. 15. № 3. Р. 199-211.
34. Spina E., Pisani F., de Leon J. Clinically significant pharmacokinetic drug interactions of antiepileptic drugs with new antidepressants and new antipsychotics. Pharmacological research. 2016. Vol. 106. P. 72-86.
35. Bruun E., Virta L.J. et al. Co-morbidity and clinically significant interactions between antiepileptic drugs and other drugs in elderly patients with newly diagnosed epilepsy. Epilepsy & Behavior. 2017. Vol. 73. P. 71-76.
36. Luciana M. Practitioner review: computerized assessment of neuropsychological function in children: clinical and research applications of the Cambridge Neuropsychological Testing Automated Battery (CANTAB). Journal of Child Psychology and Psychiatry. 2003. Vol. 44. № 5. P. 649-663.
37. Claesdotter E. Auditory Brainstem Response (ABR) and Cambridge Neuropsychological Test Automated Battery (CANTAB) as Objective Support in Diagnosing Childhood ADHD and ASD. Lund University, 2017. 236 p.
38. Sharma T., Bilder R. Standardisation and cross validation study of Cogtest — an automated neurocognitive battery for use in clinical trials. European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology. 2008. Vol. 14. № 3. P. 386-394.
39. Sharma T., Bilder R. Standardisation and cross validation study of Cogtest — an automated neurocognitive battery for use in clinical trials. Journal of the Neurological Sciences. 2006. Vol. 248. № 1–2. Р. 292-293.
40. Elison S., Shears D. et al. Neuropsychological function in children following admission to paediatric intensive care: a pilot investigation. Intensive care medicine. 2008. Vol. 34. №. 7. Р. 1289-1293.
41. Gold A., Danguecan A. et al. Neurocognitive functioning in early school-age children with intestinal failure. Journal of pediatric gastroenterology and nutrition. 2020. Vol. 70. №. 2. Р. 225-231.

/55.jpg)
/56.jpg)
/57.jpg)