Международный неврологический журнал Том 16, №3, 2020
Вернуться к номеру
Изменения структуры нейронов черной субстанции, показателей антиоксидантной защиты головного мозга и поведения у мышей разного возраста с МФТП моделью паркинсонизма
Авторы: Лабунец И.Ф., Утко Н.А., Савосько С.И., Пантелеймонова Т.Н., Бутенко Г.М.
ГУ «Институт генетической и регенеративной медицины НАМН Украины», г. Киев, Украина
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
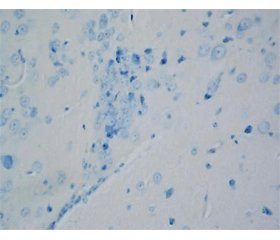
Актуальність. При хворобі Паркінсона масова загибель дофамінергічних нейронів чорної субстанції головного мозку призводить до появи характерних рухових порушень. Показано вплив віку й оксидативного стресу на її розвиток. Мета: оцінити вплив нейротоксину 1-метил-4-фенил-1,2,3,6-тетрагідропіридину (МФТП) на зміни структури нейронів чорної субстанції, факторів оксидативного стресу й антиоксидантного захисту головного мозку, а також поведінки в мишей різного віку. Матеріали та методи. Мишам лінії FVB/N і 129/Sv віком 6–7 міс. вводили МФТП у дозі 12 мг/кг 4 рази через 2 год або 30 мг/кг 1 раз; мишам віком 15–16 міс. нейротоксин вводили в дозі 30 мг/кг 1 раз. Результати. У дорослих мишей обох ліній і статей МФТП у дозі 12 мг/кг, 4 ін’єкції, ушкоджує структуру від 48 до 60 % нейронів компактної частини чорної субстанції, а після однієї ін’єкції в дозі 30 мг/кг — від 71 до 98 % нейронів. Введення МФТП 1 раз у дозі 30 мг/кг старіючим мишам обох ліній і статей ушкоджує структуру до 30 % нейронів компактної частини чорної субстанції. Під впливом однакової дози нейротоксину у дорослих мишей спостерігається порушення моторної та немоторної активності, а у старіючих — переважно рухової активності, які оцінювались у тестах «відкрите поле», на ригідність та у ротарод-тесті. Вміст малонового діальдегіду суттєво зростає у головному мозку піддослідних дорослих і старіючих мишей, тоді як зміни активності супероксиддисмутази, каталази і глутатіонредуктази (зменшення та зростання) залежать від віку та лінії тварин. Висновки. Таким чином, існують вікові особливості впливу МФТП на структуру нейронів чорної субстанції, активність антиоксидантних ферментів головного мозку й поведінку мишей. Результати можуть бути корисними при вивченні патогенезу паркінсонізму й розробці індивідуалізованих підходів до його терапії.
Актуальность. При болезни Паркинсона массовая гибель дофаминергических нейронов черной субстанции головного мозга приводит к появлению характерных двигательных нарушений. Показано влияние возраста и оксидативного стресса на ее развитие. Цель: оценить влияние нейротоксина 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МФТП) на изменения структуры нейронов черной субстанции, факторов оксидативного стресса и антиоксидантной защиты головного мозга, а также поведения у мышей разного возраста. Материалы и методы. Мышам линии FVB/N и 129/Sv в возрасте 6–7 мес. вводили МФТП в дозе 12 мг/кг 4 раза через 2 ч или 30 мг/кг 1 раз; мышам в возрасте 15–16 мес. нейротоксин вводили в дозе 30 мг/кг 1 раз. Результаты. У взрослых мышей обеих линий и обоих полов МФТП в дозе 12 мг/кг, 4 инъекции, повреждает структуру от 48 до 60 % нейронов компактной части черной субстанции, а после одной инъекции в дозе 30 мг/кг — от 71 до 98 % нейронов. Введение МФТП 1 раз в дозе 30 мг/кг стареющим мышам обеих линий и обоих полов повреждает структуру до 30 % нейронов компактной части черной субстанции. Под влиянием одинаковой дозы нейротоксина у взрослых мышей наблюдается нарушение двигательной и недвигательной активности, а у стареющих — преимущественно двигательной активности, оцененных в тестах «открытое поле», на ригидность и в ротарод-тесте. Содержание малонового диальдегида существенно повышается в головном мозге опытных взрослых и стареющих мышей, тогда как изменения активности супероксиддисмутазы, каталазы и глутатионредуктазы (снижение и повышение) зависят от возраста и линии животных. Выводы. Таким образом, существуют возрастные различия влияния МФТП на структуру нейронов черной субстанции, активность антиоксидантных ферментов головного мозга и поведение мышей. Результаты могут быть полезными при изучении патогенеза паркинсонизма и разработке индивидуализированных подходов к его терапии.
Background. Mass death of the nigral dopaminergic neurons of the brain at Parkinson’s disease leads to the appearance of typical motor disorders. The effect of age and oxidative stress in its development is shown. This study aimed at the assessment of the effects of neurotoxin 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) on changes in the structure of nigral neurons, oxidative stress and antioxidant protection of the brain, as well as the behavior of the mice of various age. Materials and methods. FVB/N and 129/Sv male and female mice aged 6–7 months were injected with MPTP at the dose of 12 mg/kg 4 times every two hours or at the dose of 30 mg/kg once per day. Mice aged 15–16 months were injected once with neurotoxin at a dose of 30 mg/kg. Results. Four injections (12 mg/kg) and one injection (30 mg/kg) of MPTP resulted in the damage to the structure in 48–60 % and 71–98 % of neurons of the compact part of substatia nigra in adult mice of both strains and sex, respectively. A single injection of MPTP at the dose of 30 mg/kg to aging mice damaged to the structure of about 30 % of the neurons in the compact part of substantia nigra. The results of open field tests, rigidity and the rotarod tests showed that the same dose of neurotoxin resulted in the impairment of motor and non-motor activities and mainly in the motor activity in adult and aging mice, respectively. The content of malondialdehyde significantly increases in the brain of experimental adults and aging mice, while changes in the activity of superoxide dismutase, catalase and glutathione reductase (decrease and increase) depend on the age and strain. Conclusions. There are age-related differences in the effect of MPTP on the structure of nigral neurons, on the activity of antioxidant enzymes in the brain and on the behavior of mice. The results may be useful in studying parkinsonism pathogenesis and developing individua-lized approaches to its therapy.
нейротоксин МФТП; паркінсонізм; нейрони чорної субстанції; малоновий діальдегід та антиоксидантні ферменти головного мозку; поведінкові реакції
нейротоксин МФТП; паркинсонизм; нейроны черной субстанции; малоновый диальдегид и антиоксидантные ферменты головного мозга; поведенческие реакции
neurotoxin MPTP; parkinsonism; nigral neurons; malondialdehyde and antioxidant enzymes of the brain; behavioral reactions
Введение
Материалы и методы
Результаты
Обсуждение
Выводы
1. Karaban I.N., Karaban N.V., Karasevych N.V. The ways of neuroprotection in Parkinson’s disease International neurogical journal. 2011. № 6(44). P. 95-99.
2. Sulzev D., Surmeiter D.J. Neuronal vulnerability, pathogenests and Parkinson’s disease. Mov. Disord. 2013. Vol. 28. P. 715-724. doi: 10.1002/mds.25095.
3. Zagni E., Simoni L., Colombo D. Sex and gender differences in central nervous system-related disorders. NeuroSci J. 2016. Article ID 2827090. 13 p. http://dx.doi. org/10.1155/2016/2827090.
4. Guo J.-D., Zhao X., Li Y., Li G.-R., Liu X-L. Damage to dopaminergic neurons by oxidative stress in Parkinson’s disease (Review). Int. J. of molecular medicine. 2018. Vol. 41. P. 1817-1825. doi: 10.3892/ijmm.2018.3406.
5. Labunets I.F., Talanov S.A., Vasilyev R.G., Rodnichenko A.E., Utko N.A., Kyzminova I.A. et al. Thymic hormones, antioxidant enzymes and neurogenesis in bulbus olfactorius of rats with hemiparkinsonism: effect of melatonin. Int. J. Phys. Pathophys. 2016. Vol. 7. № 4. P. 285-298. DOI: 10.1615/IntJPhysPathophys.v7.i4.10.
6. Hwang O. Role of oxidative stress in Parkinson’s dise-ase. Exp. Neurobiol. 2013. Vol. 22. № 1. P. 11-17. doi: 10.5607/en.2013.22.1.11.
7. Gonchar O., Mankovska I., Rozova K., Bratus L., Karaban I. Novel approaches to correction of mitochondrial dysfunction and oxidative disorders in Parkinson’s desease. Fiziol. Zh. 2019. Vol. 65. № 3. P. 61-72. https://doi.org/10.15407/12.65.03.06.
8. Zeng X.S., Geng W.Sh., Jia J.J. Neurotoxin-induced animal models of Parkinson disease: pathogenic mechanism and assessment. ASN Neuro. 2018. Vol. 10. P. 1-15. doi: 10.1177/175909/418777438.
9. Ugrumov M.V., Khaindrava V.G., Kozina E.A., Kkucheryanu V.G., Bocharov E.V., Kryzhanovsky G.N. et al. Modeling of precliniical and clinical stages of Parkinson’s disease in mice. Neuroscience. 2011. Vol. 181. P. 175-188. doi: 10.1016/j.neuroscience.2011.03.007.
10. Labunets I.F. Possibilities and prospects of the application of the in vivo and in vitro toxic cuprizone model for demyelination in experimental and clinical neurology (literature review and own research results). Ukrai’ns’kiy nevrologichniy zhurnal. Ukrainian Neurological Journal. 2018. № 2. P. 63-68. https://doi.org/10.30978/UNZ2018263.
11. Jackson-Lewis V., Przedborski S. Protocol for the MPTP mouse model of Parkinson’s disease. Nature Protocols. 2007. Vol. 2. № 1. P. 141-151. doi: 10.1038/nprot.2006.342.
12. Franklin K. The mouse brain in stereotaxic coordinates. Gulf Professional Publishing. 2004. 101 р.
13. Amikishieva A.V. Behavioral phenothyping: up-to date me-thods and equipment. Vestnik VOGiS. 2009. Vol. 13. № 3. Р. 529-542.
14. Fernagut P.O., Diguet E., Labattu B., Tison F. A simple method to measure stride length as an index of nigrostrial dysfunction in mice. J. Neurosci. Methods. 2002. Vol. 113. № 2. Р. 123-130. DOI: 10.1016/s0165-0270(01)00485-x.
15. Uchiyama M., Mihara M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal. Biochem. 1978. Vol. 86. № 1. P. 271-278. DOI: 10.1016/0003-2697(78)90342-1.
16. Labunets I.F. Behavioral features in the mice of various strains and sex with model of parkinsonism. Fiziol. Zh. 2020. Vol. 66. № 1. Р. 18-24. ISSN 0201-8489. DOI: https://doi.org/10.15407/fz. ISSN 0201-8489.
17. Torres E.R., Akinyeke T., Stagaman K., Duvoisin R.M., Meshul Ch.K., Sharpton Th.J. et al. Effects of sub-chronic MPTP exposure on behavioral and cognitive performance and the microbiome of wild-type and mGlu8 knockout female and male mice. Front. Behav. Neurosci. 2018. Vol. 12. Article 140. 15 p. doi: 10.3389/fnbeh.2018.00140. eCollection 2018.
18. Mathai A., Ma Y., Pare J.-F., Villalba R.M., Wichmann Th., Smith Y. Reduced cortical innervation of the subthalamic nucleus in MPTP-treated parkinsonian monkeys. Brain. 2015. Vol. 138. P. 946-952. doi: 10.1093/brain/awv018.
19. Meredith G.E., Rademacher D.J. MPTP mouse models of Parkinson’s disease: an update. J. Parkinsons Dis. 2011. Vol. 1. № 1. P. 19-33. doi: 10.3233/JPD-2011-11023.
20. Huang D., Xu J., Wang J., Tong J., Bai X, Li H. et al. Dynamic changes in the nigrostrial pathway in the MPTP mouse model of Parinson’s disease. Parkinson disease. 2017. Article ID 9349487. 7 p. https://doi.org/10.1155/2017/9349487.
21. Labunets I.F. Changes of thymic endocrine function, brain macrophages and T-lymphocytes in mice of different ages after administration of neurotoxin cuprizone and cytokine. International Neurogical Journal. 2018. № 4(98). Р. 114-120. DOI: 10.22141/2224-0713.4.98.2018.139434.
22. Freitas H.R., Ferreira G.D.C., Trevenzoli I.H., Oliveira K.J., de Melo Reis R.A. Fatty acids, amtioxidants and physical activity in brain aging. Nutrients. 2017. Vol. 9. № 11. P. E1263. doi: 10.3390/nu9111263.
23. Guo L., Xiong H., Kim J.-I., Wu Y.-W., Laichandani R.R., Cui Y. et al. Dynamic re-wiring of neural circuits in the motor cortex in mouse models of Parkinson’s disease. Nat. Neurosci. 2015. Vol. 18. № 9. P. 1299-1309. doi: 10.1038/nn.4082.
24. Mathai A., Ma Y., Pare J.-F., Villalba R.M., Wichmann Th., Smith Y. Reduced cortical innervation of the subthalamic nucleus in MPTP-treated parkinsonian monkeys. Brain. 2015. Vol. 138. P. 946-962. doi: 10.1093/brain/awv018.

/17.jpg)
/16.jpg)
/18.jpg)
/19.jpg)