Международный неврологический журнал Том 16, №3, 2020
Вернуться к номеру
Дослідження процесів глікозилювання антитіл у сироватці крові й цереброспінальній рідині хворих на розсіяний склероз як біомаркер при цьому захворюванні
Авторы: Гичка К.М., Негрич Т.І., Білий Р.О.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Метою роботи було вдосконалення діагностики розсіяного склерозу (РС) та визначення нових біомаркерів цього захворювання. Матеріали та методи. Дослідили зміни глікозильних детермінант людини при розсіяному склерозі, які раніше не досліджували. Сконцентрувалися на двох головних напрямках — дослідження глікозилювання антитіл у цереброспінальній рідині (ЦСР), його порівняння з антитілами сироватки крові хворих на РС та визначення природи останніх. Проаналізували клінічний перебіг розсіяного склерозу у пацієнтів з метою виявлення можливих кореляційних зв’язків з імунологічними показниками. Результати. У результаті проведених досліджень отримали дані, що свідчать про зростання експонування фукозильних залишків — мішеней лектину AAL на імуноглобулінах IgG, виділених із ЦСР, а також зростання рівня експонування мішеней лектину LCA (специфічного до корових залишків N-гліканів IgG). Водночас у ЦСР спостерігали значно менший рівень зв’язування сіалоспецифічних лектинів SNA та PSqL, що свідчить про меншу ступінь сіалування молекул імуноглобулінів IgG у ЦСР. Отже, імуноглобуліни IgG у ЦСР мають більш виражені прозапальні властивості порівняно з імуноглобулінами IgG сироватки крові пацієнтів. Висновки. Дослідження процесів глікозилювання антитіл у ЦСР та сироватці крові пацієнтів із РС є надзвичайно важливим як з позиції розгляду їх як ключової ланки в патогенезі цього захворювання, так і як надійного біомаркера вказаного патологічного стану.
Целью работы было совершенствование диагностики рассеянного склероза (РС) и определения новых биомаркеров этого заболевания. Материалы и методы. Исследовали изменения гликозильных детерминант человека при рассеянном склерозе, которые ранее не исследовали. Сконцентрировались на двух главных направлениях — исследование гликозилирования антител в цереброспинальной жидкости (ЦСЖ), его сравнение с антителами сыворотки крови больных РС и определение природы последних. Проанализировали клиническое течение рассеянного склероза у пациентов с целью выявления возможных корреляционных связей с иммунологическими показателями. Результаты. В результате проведенных исследований получили данные, свидетельствующие о росте экспонирования фукозильних остатков — мишеней лектина AAL на иммуноглобулинах IgG, выделенных из ЦСЖ, а также рост уровня экспонирования мишеней лектина LCA (специфического к коревым остаткам N-гликанов IgG). В то же время в ЦСЖ наблюдали значительно меньший уровень связывания сиалоспецифичных лектинов SNA и PSqL, что свидетельствует о меньшей степени сиалирования молекул иммуноглобулинов IgG в ЦСЖ. Итак, иммуноглобулины IgG в ЦСЖ обладают более выраженными провоспалительными свойствами по сравнению с иммуноглобулинами IgG сыворотки крови пациентов. Выводы. Исследование процессов гликозилирования антител в ЦСР и сыворотке крови пациентов с РС является чрезвычайно важным как с точки зрения рассмотрения их как ключевого звена в патогенезе этого заболевания, так и в качестве надежного биомаркера указанного патологического состояния.
Background. The purpose of this work was to improve the diagnosis of multiple sclerosis (MS) and determination of new biomarkers of this disease. Materials and methods. In this work, we are investigating the aspects of changes of human glycosyl determinants in multiple sclerosis that have not been previously investigated. Therefore, we have focused on two main areas — studies of antibody glycosylation in cerebrospinal fluid (CSF) and its comparison with the serum antibodies in patients with MS and determination of their nature. It was important for us to analyze the clinical course of multiple sclerosis in patients to identify possible clinical patterns. Therefore, we carried out a thorough analysis of clinical records of 7 patients; we have taken a serum and cerebrospinal fluid for immunological studies in these patients. The paper presents the results of the analysis. Results. The results of these studies showed an increase of exposure of fucosyl residue — targets of AAL on immunoglobulins G (IgG) isolated from CSF, as well as an increase of exposure level of targets of LCA (specific to cerebral cortex residues of IgG N-glycans). At the same time, we observed a significantly lower binding level of sialospecific lectins SNA and PSqL in the CSF that indicates a lower degree of sialylation of IgG molecules in the CSF. Therefore, immunoglobulins G in CSF have more pronounced pro-inflammatory effects compared to IgG in patients’ blood serum. Conclusions. The study of antibody glycosylation in the CSF and serum of patients with MS is extremely important as a key link in the pathogenesis of the disease and as a reliable biomarker of this pathological condition.
розсіяний склероз; біомаркер; глікозилювання; імуноглобуліни; спинномозкова рідина
рассеянный склероз; биомаркер; гликозилирование; иммуноглобулины; спинномозговая жидкость
multiple sclerosis; biomarker; glycosylation; immunoglobulins; cerebrospinal fluid
Вступ
Матеріали та методи
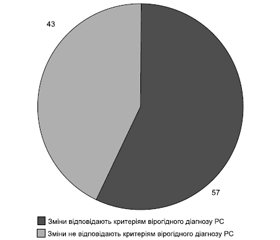
Результати та обговорення
/32.jpg)
Висновки
1. Мяловицька О.А., Хижняк Ю.В. Прогностична оцінка розвитку когнітивних та емоційних порушень у хворих на розсіяний склероз залежно від локалізації вогнищ демієлінізації в головному мозку. Український неврологічний журнал. 2017. 3. 33-37.
2. Чуприна Г.М. Розсіяний склероз: клініко-патогенетичні характеристики та терапевтичні підходи з урахуванням коморбідності. Східно-європейський неврологічний журнал. 2018. 4. 10-25.
3. Conway D., Cohen J.A. Emerging oral therapies in multiple sclerosis. Current neurology and neuroscience reports. 2010. 10(5). 381-388.
4. Compston A., Coles A. Multiple sclerosis. Lancet. 2002. 359. 1221-1231.
5. D’Ambrosio A., Pontecorvo S., Colasanti T., Zamboni S., Francia A., Margutti P. Peripheral blood biomarkers in multiple sclerosis. Autoimmun. Rev. 2015. 14(12). 1097-1110.
6. Teunissen C.E., Malekzadeh A., Leurs C., Bridel C., Killestein J. Body fluid biomarkers for multiple sclerosis — the long road to clinical application. Nat. Rev. Neurol. 2015. 11(10). 585.
7. Негрич Н.О., Негрич Т.І. Алгоритм використання комплексу лабораторних біомаркерів у хворих на розсіяний склероз з діагностичною та прогностичною метою. Міжнародний неврологічний журнал. 2018. 3. 27-35.
8. Tejera-Alhambra M., Casrouge A., de Andrés C., Seyfferth A., Ramos-Medina R., Alonso B. et al. Plasma biomarkers discriminate clinical forms of multiple sclerosis. PloS One. 2015. 10(6). Е0128952.
9. Chen S., Lu C., Gu H., Mehta A., Li J., Romano P.B., Block T. Aleuria Aurantia Lectin (AAL)-reactive immunoglobulin G rapidly appears in sera of animals following antigen exposure. PloS one. 2012. 7(9). https://doi.org/10.1371/journal.pone.0044422.
10. Compston A., Coles A. Multiple sclerosis. Lancet (Lond., Engl.). 2008. 372. 1502-1517. https://doi.org/10.1016/S0140-6736(08)61620-7.
11. De Haan N., Reiding K.R., Krištić J., Hipgrave Ederveen A.L., Lauc G., Wuhrer M. The N-glycosylation of mouse immunoglobulin G (IgG)-fragment crystallizable differs between IgG subclasses and strains. Frontiers in immunology. 2017. 8. 608. https://doi.org/10.3389/fimmu.2017.00608.
12. Deisenhammer F., Zetterberg H., Fitzner B., Zettl U.K. The cerebrospinal fluid in multiple sclerosis. Frontiers in Immunology. 2019. 10. https://doi.org/10.3389/fimmu.2019.00726.
13. McDonald W.I., Compston A., Edan G., Goodkin D., Hartung H.-P., Lublin F.D., Wolinsky J.S. Recommended diagnostic criteria for multiple sclerosis: Guidelines from the international panel on the diagnosis of multiple sclerosis. Annals of Neurology. 2001. 50(1). 121-127. https://doi.org/10.1002/ana.1032.
14. Polman C.H., Reingold S.C., Banwell B., Clanet M., Cohen J.A., Filippi M., Wolinsky J.S. Diagnostic criteria for multiple sclerosis: 2010 Revisions to the McDonald criteria. Annals of Neurology. 2011. 69(2). 292-302. https://doi.org/10.1002/ana.2236.
15. Thompson A.J., Banwell B.L., Barkhof F., Carroll W.M., Coetzee T., Comi G., Cohen J.A. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. The Lancet Neuro-logy. 2018. 17(2). 162-173. https://doi.org/10.1016/S1474-4422(17)30470-2.
16. Tumani H., Deisenhammer F., Giovannoni G., Gold R., Hartung H.-P., Hemmer B., Zettl U.K. Revised McDonald criteria: The persisting importance of cerebrospinal fluid analysis. Annals of Neuro-logy. 2011. 70(3). 520-520. https://doi.org/10.1002/ana.22508.
17. Keir G., Thompson E.J. Immunoglobulins in CSF. In Immunoglobulins in Health and Disease. 1986. 173-187. https://doi.org/10.1007/978-94-009-4169-4_10.

/30.jpg)
/31.jpg)
/32_2.jpg)
/33.jpg)
/34.jpg)