Резюме
Актуальність. Дитячий церебральний параліч (ДЦП) — збірний термін, який об’єднує численні тяжкі захворювання нервової системи. 80 % дітей з ДЦП страждають від спастичних форм, основним симптомом яких є підвищення м’язового тонусу — спастичність. Об’єктивізацію стану м’язового тонусу та контроль за динамікою спастичності можна проводити за допомогою методів біомеханіки та електронейроміографічного (ЕНМГ) дослідження, що дає змогу якісно та кількісно вивчити стан нервово-м’язової системи. Мета: встановити клінічно-нейрофізіологічні особливості спастичного синдрому в дітей з ДЦП залежно від вираженості моторних порушень. Матеріали та методи. Обстежені 122 дитини з ДЦП (середній вік 8,8 ± 3,7 року), що були розподілені на групи згідно з результатами шкали великих моторних функцій, розширеної та доповненої (Gross Motor Function Classification (GMFCS E&R)). Усім пацієнтам проведене ретельне неврологічне обстеження та було здійснене ЕНМГ-дослідження. Для оцінки надсегментарного (верхнього мотонейрона) та сегментарних (α-мотонейронів спинного мозку й периферичних нервів) рівнів ураження аналізували параметри Н-рефлексу і F-хвилі. Результати. У більшості обстежених дітей були діагностовані спастичні форми ДЦП: у 40 (32,8 %) дітей — спастична диплегія, у 25 (20,5 %) — геміпаретична форма, у 6 (4,9 %) — спастичний трипарез, у 34 (27,9 %) — спастичний тетрапарез. У дітей з ДЦП з вираженими моторними порушеннями значно частіше спостерігалася ортопедична патологія, а саме еквіновальгусна установка та плосковальгусні деформації стоп. За даними ЕНМГ-параметрів у хворих з ДЦП реєструвалися порушення надсегментарних впливів, що проявлялися підвищенням амплітуди М-відповіді, особливо при тестуванні великогомілкового нерва, збільшенням співвідношення Нmах/Мmах, підвищенням амплітуди Н-рефлексу та F-хвилі. Висновки. Зі збільшенням вираженості рухових порушень за шкалою великих моторних функцій (GMFCS E&R) у дітей з дитячим церебральним паралічем вірогідно поглиблювалися нейрофізіологічні зміни.
Актуальность. Детский церебральный паралич (ДЦП) — собирательный термин, объединяющий многочисленные тяжелые заболевания нервной системы. 80 % детей с ДЦП страдают спастическими формами, основным симптомом которых является повышение мышечного тонуса — спастичность. Объективизацию состояния мышечного тонуса и контроль за динамикой спастичности можно проводить с помощью методов биомеханики и электронейромиографического (ЭНМГ) исследования, что дает возможность качественно и количественно изучить состояние нервно-мышечной системы. Цель: установить клинико-нейрофизиологические особенности спастического синдрома у детей с ДЦП в зависимости от выраженности моторных нарушений. Материалы и методы. Обследовано 122 ребенка с ДЦП (средний возраст 8,8 ± 3,7 года), которые были распределены на группы согласно шкале больших моторных функций, расширенной и дополненной (Gross Motor Function Classification (GMFCS E&R)). Всем пациентам проведено тщательное неврологическое обследование и осуществлялось ЭНМГ-исследование. Для оценки надсегментарного (верхнего мотонейрона) и сегментарных (α-мотонейронов спинного мозга и периферических нервов) уровней поражения анализировали параметры Н-рефлекса и F-волны. Результаты. У большинства обследованных детей были диагностированы спастические формы ДЦП: у 40 (32,8 %) детей — спастическая диплегия, у 25 (20,5 %) — гемипаретическая форма, у 6 (4,9 %) — спастический трипарез, у 34 (27,9 %) — спастический тетрапарез. У детей с ДЦП с выраженными моторными нарушениями значительно чаще наблюдалась ортопедическая патология, а именно эквиновальгусная установка и плосковальгусные деформации стоп. По данным ЭНМГ у больных с ДЦП регистрировались нарушения надсегментарных влияний, проявлявшиеся повышением амплитуды М-ответа, особенно при тестировании большеберцового нерва, увеличением соотношения Нмах/Ммах, повышением амплитуды Н-рефлекса и F-волны. Выводы. С увеличением выраженности двигательных нарушений по шкале больших моторных функций (GMFCS E&R) у детей с детским церебральным параличом достоверно усугублялись нейрофизиологические изменения.
Background. Infantile cerebral palsy is a collective term that combines numerous severe diseases of the nervous system. Eighty percent of children with cerebral palsy suffer from spastic forms, the main symptom of which is an increase in muscle tone — spasticity. Objectification of the state of muscle tone and control over the dynamics of spasticity can be carried out using methods of biomechanics and electroneuromyographic (ENMG) research, which makes it possible to qualitatively and quantitatively study the state of the neuromuscular system. The purpose is to establish the clinical and neurophysiological features of spastic syndrome in children with infantile cerebral palsy, depending on the severity of motor disorders. Materials and methods. We examined 122 children with cerebral palsy (average age 8.8 ± 3.7 years), who were divided into groups according to the values of the Gross Motor Function Classification (GMFCS E&R). All patients underwent a thorough neurological examination and ENMG studies. To assess the suprasegmental (upper motor neuron) and segmental (α-motor neurons of the spinal cord and peripheral nerves) levels of damage, the parameters of the H-reflex and F-wave were analyzed. Results. The majority of the examined children were diagnosed with spastic forms of cerebral palsy: 40 (32.8 %) children — spastic diplegia, 25 (20.5 %) — hemiparetic form, 6 (4.9 %) — spastic triparesis, 34 (27.9 %) — spastic tetraparesis. Children with cerebral palsy with severe motor disorders were significantly more likely to have orthopedic pathology, namely equino-valgus installations and flat-valgus deformities of the feet. Based on ENMG parameters in patients with cerebral palsy, there were recorded suprasegmental violations, manifested in the increase of the amplitude of M-response, especially when testing the tibial nerve, the increased ratio of Hmax/Mmax, increased amplitude of H-reflex and F-wave. Conclusions. With an increase in the severity of motor disorders on the Gross Motor Function Classification Scale (GMFCS E&R) in children with cerebral palsy, neurophysiological changes significantly worsened.
Вступ
Дитячий церебральний параліч (ДЦП) — збірний термін, який об’єднує численні тяжкі захворювання нервової системи, із найбільш частим ураженням структур головного мозку, що відповідають за довільні рухи [2, 3, 6]. Ключову роль у патогенезі ДЦП відіграють гіпоксичні та ішемічні зміни, особливо в перивентрикулярній ділянці головного мозку, що призводять до патологічних процесів та лейкомаляції з необоротними наслідками [1, 7, 11, 16].
Основним клінічним проявом при ДЦП є непрогресуючі порушення рухової функції та пози. 80 % дітей з ДЦП страждають від спастичних форм, основним симптомом яких є підвищення м’язового тонусу — спастичність, що формується як наслідок комбінованого ураження пірамідних та екстрапірамідних структур на рівні головного та спинного мозку [4, 8, 14].
Спастичність при ДЦП має низку особливостей: наявність патологічних тонічних рефлексів, появу патологічної синкінетичної активності при виконанні довільних рухів, порушення координаторних взаємодій м’язів синергістів та антагоністів (феномен коконтракції), підвищення загальної рефлекторної збудливості (наявність вираженого старт-рефлексу). Спастичність у дітей із ДЦП призводить до формування патологічного рухового стереотипу від мінімального підвищеного м’язового тонусу в ранньому віці до формування контрактур у пізній резидуальній стадії захворювання [9, 15, 17]
Ступінь вираженості спастичності значно варіює у пацієнтів з ДЦП відповідно до порушення мозкового кровообігу та залежить переважно від локалізації вогнища ураження, глибини парезу та симптомів, які поєднуються з парезом (чутливі порушення на боці парезу, мозочкові симптоми). Спастичність по-різному впливає на рухові можливості хворих: легка спастичність погіршує функцію ходьби, підвищуючись із здійсненням пересування хворого та обмежуючи відстань, яку може пройти хворий без зупинки. Помірний ступінь спастичності, особливо в нозі, може бути корисний пацієнту, оскільки дає йому змогу використовувати ногу як опору при ходьбі. Виражена спастичність нівелює м’язову силу, що залишилася, спричиняючи розвиток контрактур і деформацій кінцівки, появу болючих флексорних спазмів, тяжку інвалідизацію пацієнтів [10, 13].
У той же час дослідження пірамідного центрального мотонейрона показало його функціональну не-однорідність на всьому протязі. Звідки випливає, що при ураженні будь-якої його ділянки виникає різна картина спастичності, що визначає й різний ступінь тяжкості клінічної картини ДЦП. Об’єктивізацію стану м’язового тонусу та контроль за динамікою спастичності можна проводити за допомогою методів біомеханіки та електронейроміографічного (ЕНМГ) дослідження, що дає змогу якісно та кількісно вивчити стан нервово-м’язової системи [12] та на цій основі призначати хворим відповідні процедури, конт-ролювати їх ефективність і прогнозувати перспективи реабілітації в кожному конкретному випадку.
Мета дослідження: встановлення клініко-нейрофізіологічних особливостей спастичного синдрому у дітей із ДЦП залежно від вираженості моторних порушень.
Матеріали та методи
Обстежені 122 дитини з ДЦП (середній вік 8,8 ± 3,7 року), що перебували на лікуванні в Обласному центрі медико-соціальної реабілітації дітей з органічним ураженням нервової системи (м. Чернівці). Діти з ДЦП були розподілені на групи згідно зі шкалою великих моторних функцій, розширеною та допов-неною (Gross motor function classification (GMFCS E&R)) (табл. 1). Для оцінки довільної рухової активності в даний час найбільше міжнародне визнання отримала система класифікації великих моторних функцій GMFCS, що являє собою інструмент, за допомогою якого забезпечується розподіл дітей із ДЦП за чіткими критеріями на п’ять груп відповідно до розвитку великої моторики. Класифікація GMFCS дозволяє визначити функціональні можливості дитини, потреби у допоміжних засобах та можливості пересування. Встановлено, що ця шкала є вірогідним, надійним та відтворюваним методом клінічної оцінки у дітей з ДЦП [5].
/26.jpg)
Усім пацієнтам проведено ретельне неврологічне обстеження та здійснювалося ЕНМГ-дослідження. У неврологічному статусі хворих із ДЦП особлива увага зверталася на порушення тонусу м’язів нижніх та верхніх кінцівок, підвищення сухожильних і періостальних рефлексів та їх асиметрію, вираженість спастичного синдрому, порушення рухової активності в розгиначах та згиначах стопи та кисті, зміну м’язової сили в різних групах м’язів ніг та рук, можливість самостійної ходьби, наявність порушень сечовипускання і дефекації.
ЕНМГ-обстеження проводилося на комп’ютери-зованому програмному комплексі М-ТEST («DX-системи», м. Харків, Україна). За стимуляційною методикою досліджували 3 нерви (серединний, малогомілковий та великогомілковий), оцінювали швидкість проведення збудження моторними волокнами, амплітуду і форму М-відповіді за стандартною методикою. Для оцінки надсегментарного (верхнього мотонейрона) та сегментарних (α-мотонейронів спинного мозку й периферичних нервів) рівнів ураження аналізували параметри Н-рефлексу і F-хвилі. Параметри F-хвилі великогомілкових та серединних нервів оцінювали за показниками середньої амплітуди (серАF, мкВ); параметри Н-рефлексу визначали за показниками амплітуди Н-рефлексу (мВ); також обчислювали співвідношення максимальної амплітуди Н-рефлексу та М-відповіді у відсотках (Нmах/Мmах) [13].
Статистична обробка здійснювалася з використанням прикладних програм із застосуванням парного та непарного t-критеріїв Стьюдента.
Результати та обговорення
У більшості обстежених дітей було діагностовано спастичні форми ДЦП: у 40 (32,8 %) дітей — спастичну диплегію, у 25 (20,5 %) — геміпаретичну форму, у 6 (4,9 %) — спастичний трипарез, у 34 (27,9 %) — спастичний тетрапарез, гіперкінези спостерігались у 10 дітей (8,2 %) та атактичний синдром — у 7 (5,7 %) дітей.
Більшість дітей зі спастичними формами ДЦП розвивалися із затримкою статокінетичного та психомовленнєвого розвитку: 108 (88,5 %) пацієнтів пізніше стали тримати голову, перевертатися зі спини на живіт, сидіти. 49 (40,2 %) дітей пізніше за інших опановували самостійне стояння і ходьбу, 41,8 % дітей починали ходити до 2–7-річного віку та тільки з підтримкою. 18,0 % хворих пересуваються лише за допомогою інших в інвалідному візку. Порушення функціональних можливостей рук мали різний ступінь тяжкості: від легких порушень дрібної моторики до грубих пронаторно-згинальних установок у руках із різким обмеженням довільних рухів. М’язовий тонус у більшості хворих був підвищений за спастичним типом, у частини пацієнтів — з гіперкінезами (8,2 %); відзначалася м’язова дистонія на фоні підвищеного тонусу.
У неврологічному статусі у 67 (54,9 %) дітей із ДЦП, частіше у формі спастичного тетрапарезу, відзначались симптоми ураження черепних нервів, обумовлені порушенням кортико-нуклеарних шляхів. У 7 (5,7 %) випадках спостерігались ознаки ураження стовбурових структур головного мозку. У 14 (11,4 %) хворих 5-ї групи був діагностований псевдобульбарний синдром із формуванням спастико-паретичної дизартрії, порушенням артикуляції та функції ковтання.
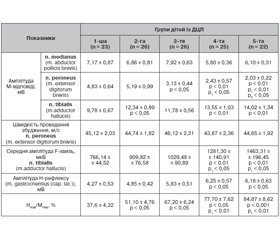
При проведенні ЕНМГ-дослідження у хворих із ДЦП були виявлені нейрофізіологічні ознаки надсегментарних порушень, що корелювали з вираженістю спастичного синдрому та моторними порушеннями (табл. 2).
За даними нашого дослідження (табл. 2), параметри ЕНМГ у дітей із ДЦП прогредієнтно змінювались залежно від рухової активності за шкалою GMFCS E&R. Найбільш виражені значення показників ЕНМГ спостерігали у 4-й та 5-й групах дітей із значними моторними порушеннями: при тестуванні малогомілкових нервів визначалося вірогідне зниження їх амплітуди моторної відповіді (на 49,6 та 57,9 % відповідно) порівняно із хворими 1-ї групи, що вказує на значне зниження сили скорочення відповідних м’язів та наявність аксонального збіднення в дистальних сегментах малогомілкового нерва. Це пояснюється тим, що у дітей 4-ї та 5-ї груп значно частіше спостерігалася ортопедична патологія, а саме еквіновальгусні установки та плосковальгусні деформації стоп. Клінічна картина у цих хворих мала деякі відмінності у вигляді розладів чутливості в зоні іннервації малогомілкових нервів, зниження або відсутності захисних рефлексів та інших ознак пірамідної недостатності, гіпотрофії м’язів-розгиначів стопи, наявності трофічних порушень на тлі дисгідрозу, мармуровості та змін температури шкіри стоп. При дослідженні швидкості проведення збудження руховими волокнами малогомілкових нервів вірогідних відмінностей у всіх досліджених групах пацієнтів не спостерігали. Зазначені порушення мають, ймовірно, вторинний характер, оскільки дані зміни формуються поступово при наростанні ортопедичної патології у дітей із ДЦП з вираженими моторними порушеннями. У свою чергу, амплітуда М-відповіді при тестуванні великогомілкового нерва була вірогідно підвищена у дітей 4-ї та 5-ї груп (діти з вираженими моторними порушеннями), що вказує на значне підвищення тонусу в згиначах стопи та пальців.
/27.jpg)
При дослідженні Н-рефлексу під час тестування литкового м’яза в усіх хворих спостерігались вірогідні зміни порівняно із контролем, що вказувало на порушення надсегментарної іннервації. Встановлено значне зниження порогу появи Н-рефлексу (при 2 мА), що свідчить про підвищену збудливість спінальних мотонейронів. Поріг появи М-відповіді також був знижений, тому відносний поріг Н-рефлексу істотно не збільшувався. На значне зниження порогу рефлекторної збудливості вказує також поява Н-рефлексу при тестуванні сере-динного нерва.
У 4-й та 5-й групах також реєструвалося вірогідне збільшення амплітуди Н-відповіді: на 31,6 % у дітей 4-ї групи та на 30,9 % — 5-ї групи, що вказує на наявність вираженого ступеня спастичності в обстежених цих груп. Відмічали вірогідне прогредієнтне зростання співвідношення Нmах/Мmах із вираженістю моторних порушень за шкалою GMFCS E&R та найвищі показники спостерігали у дітей, що самостійно не могли пересуватися (на 57,1 %), порівняно із пацієнтами, що пересувались самостійно.
При аналізі параметрів F-хвилі у хворих зі спастичними формами ДЦП виявлено вірогідне збільшення амплітуди F-хвиль, особливо при стимуляції великогомілкового нерва. Найвищі значення спостерігали у дітей 4-ї (на 40,1 %) та 5-ї (на 47,6 %) груп порівняно із 1-ю групою, що вказує на значне підвищення синхронної збудливості α-мотонейронів попереково-крижових сегментів спинного мозку та виражені нейрофізіологічні ознаки провідникової (пірамідної) недостатності з ураженням кортико-цервікальних та кортико-люмбальних шляхів.
Таким чином, важливим у діагностиці порушень м’язового тонусу у дітей із ДЦП є проведення комплексного клініко-інструментального обстеження, що повинно включати ретельну оцінку неврологічного статусу, ортопедичний огляд та ЕНМГ-дослідження із обов’язковим застосуванням пізнього феномену F-хвилі та Н-рефлексу. Останні ЕНМГ-параметри визначають ступінь вираженості спастичного синдрому, що дає можливість встановлення віддаленого прогнозу рухових порушень та вибору лікувально-реабілітаційних заходів.
Висновки
1. Провідникові надсегментарні порушення у дітей із дитячим церебральним паралічем проявлялися вірогідними змінами нейроміографічних параметрів: підвищенням амплітуди М-відповіді, особливо при тестуванні великогомілкового нерва, збільшенням співвідношення Нmах/Мmах, підвищенням амплітуди Н-рефлексу та амплітуди F-хвилі.
2. У 4-й та 5-й групах дітей із ДЦП за шкалою GMFCS E&R, що мали грубу вальгусну деформацію стоп, спостерігалося аксональне ураження малогомілкового нерва в дистальних сегментах стимуляції та парез екстензорів стопи й пальців.
3. У 4-й та 5-й групах дітей із ДЦП за шкалою GMFCS E&R збільшувався ступінь вираженості спастичного синдрому за електроміографічними параметрами при тестуванні великогомілкового нерва.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Абраменко В.В., Коваленко О.Є. Чинники ризику виникнення спастичних форм дитячого церебрального паралічу залежно від гестаційного віку немовляти. Укр. неврол. журн. 2017. № 2. С. 45-49.
2. Аліфанова С.В., Харитонова О.Н. Особливості спостереження за дітьми, які народилися недоношеними з дуже низькою масою тіла. Здоровье ребенка. 2015. № 7. С. 37-40.
3. Евтушенко С.К. Этиология и патогенез церебрального паралича у детей (новый взгляд на старую проблему) (лекция). Международный неврологический журнал. 2014. № 3 (65). С. 117-123.
4. Клиточенко Г.В., Тонконоженко Н.Л., Кривоножкина П.С., Малюжинская Н.В. Клиника и диагностика детского церебрального паралича. Лекарственный вестник. 2015. Т. 9. №1 (57). С. 21-25.
5. Козявкін В.І., Качмар О.О., Волошин Т.Б. Система класифікацій великих моторних функцій у дітей з церебральним паралічем. Розширина та уточнена. Соціальна педіатрія та реабілітологія. 2012. № 2(3). С. 74-82.
6. Мартинюк В.Ю. Дитячий церебральний параліч. Соцiальна педiатрiя та реабiлiтологiя. 2012. № 1. С. 18-23.
7. Моісеенко Р.О., Гойда Н.Г., Дудіна О.О. Дитяча інвалідність та питання розбудови системи медико-соціальної реабілітації дітей в Україні. Соціальна педіатрія та реабілітологія. 2018. № 3-4. С. 10-19.
8. Холодов С.А. Морфофункціональні особливості порушень сили м’язів нижніх кінцівок у дітей з ДЦП з різним рівнем локомоторних можливостей. Вісн. Черкас. ун-ту. Сер. «Біол. науки». 2015. № 2. С. 121-127.
9. Яценко К.В. Дитячий церебральний параліч: етіопатогенез, клініконейрофізіологічні аспекти та можливості неврологічної реабілітації. Український неврологічний журнал. 2015. № 2. С. 19-24.
10. Freire G., Shevell M., Oskoui M. Cerebral palsy: Phenotypes and risk factors in term singletons born small for gestational age. Eur. J. Paediatric Neurol. 2015. Vol. 19. № 2. Р. 218-225.
11. Jones M.W., Morgan E., Shelton J.E. Primary care of the child with cerebral palsy: a review of system (Part II). J. Pediatr. Health Care. 2007. № 21. Р. 226-237.
12. Lee H.J., DeLisa J.A. Manual of nerve conduction study and surface anatomy for needle electromyography. Philadelphia: Lippincott Williams & Wilkins, 2004. 301 p.
13. Liveson J.A., Dong M.M. Laboratory reference for clinical neurophysiology. Philadelphia: F.A. Davis Company, 1992. 514 p.
14. Mandal A. Cerebral Palsy Prevalence Medical News. Life Sciences and Medicine. 2015. Available from: http://www.news-medical.net/health/Cerebral-Palsy-Prevalence.aspx.
15. Novak I., Morgan C., Adde L., Blackman J., Boyd R.N. et al. Early, Accurate Diagnosis and Early Intervention in Cerebral Palsy: Advances in Diagnosis and Treatment. JAMA Pediatr. 2017. № 171. Р. 897-907.
16. Spittle A.J., Morgan C., Olsen J.E., Novak I., Cheong J.L.Y. Early Diagnosis and Treatment of Cerebral Palsy in Children with a History of Preterm Birth. Clin. Perinatol. 2018. № 45. Р. 409-420.
17. Willerslev-Olsen M., Choe Lund M., Lorentzen J., Barber L., Kofoed-Hansen M. et al. Impaired muscle growth precedes development of increased stiffness of the triceps surae musculotendinous unit in children with cerebral palsy. Dev. Med. Child Neurol. 2018. 60. Р. 672-679.

/26.jpg)
/27.jpg)