Международный неврологический журнал Том 16, №5, 2020
Вернуться к номеру
Прогностичне значення дослідження експонування глікозильних детермінант на молекулах IgG у сироватці крові хворих на розсіяний склероз залежно від проведеної медикаментозної терапії
Авторы: Бойчук М.О., Негрич Т.І., Білий Р.О
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Актуальність. Вагоме значення в автоімунних процесах при розсіяному склерозі має визначення антитіл до власних антигенів організму. Функції імуноглобулінів (Ig) визначаються складом біомолекул гліканових залишків, приєднаних до N-глікозилюючого домену в кристалізуючому фрагменті (Fc-ділянці) тяжких ланцюгів Ig. Вважають, що зміни в структурі гліканів здатні впливати на функціонування Ig. Так, наявність або відсутність певних залишків вуглеводів у складі антитіл пов’язана з їх про- або протизапальними властивостями. В свою чергу, це модифікує перебіг запальних реакцій при автоімунних захворюваннях і може визначати активність розсіяного склерозу. Тому дослідження структурних змін Ig сироватки крові хворих на розсіяний склероз має важливе клінічне значення. Матеріали та методи. Було проведено дослідження сироваток 6 когорт хворих на розсіяний склероз залежно від групи препарату хворобомодифікуючої терапії, яку пацієнти приймають, а саме: 17 пацієнтів до моменту забору крові для вказаних досліджень ніколи не отримували жодної терапії; 15 хворих на розсіяний склероз, які отримували хворобомодифікуючу терапію препаратами з групи інтерферонів β-1b; 12 осіб після пульс-терапії метилпреднізолоном дозою 1000 мг упродовж 5–7 днів; 12 хворих на розсіяний склероз різної статі та віку, які отримували терапію препаратами з групи моноклональних антитіл, а саме окрелізумаб у дозі 600 мг внутрішньовенно, частотою 1 раз на 6 місяців; 9 осіб — на препараті глатирамеру ацетат дозою 40 мг тричі на тиждень; 10 хворих на розсіяний склероз, які отримували лікування препаратом терифлуномід у дозі 14 мг при прийомі 1 раз на добу; а також 23 практично здорові особи. Результати. У результаті проведених досліджень виявлено, що різні види терапії впливають на зміну глікозильних детермінант імуноглобулінів. Висновки. Гліканові маркери можна використовувати як високочутливі й специфічні біомаркери для діагностики розсіяного склерозу та прогнозування його перебігу.
Актуальность. Большое значение в аутоиммунных процессах при рассеянном склерозе имеет определение антител к собственным антигенам организма. Функции иммуноглобулинов (Ig) определяются составом биомолекул гликановых остатков, присоединенных к N-гликозирующему домену в кристаллизирующем фрагменте (Fc-области) тяжелых цепей Ig. Считают, что изменения в структуре гликанов способны влиять на функционирование Ig. Так, наличие или отсутствие определенных остатков углеводов в составе антител связано с их про- или противовоспалительными свойствами. В свою очередь, это модифицирует протекание воспалительных реакций при аутоиммунных заболеваниях и может определять активность рассеянного склероза. Поэтому исследования структурных изменений Ig сыворотки крови больных рассеянным склерозом имеет важное клиническое значение. Материалы и методы. Было проведено исследование сывороток 6 когорт больных рассеянным склерозом в зависимости от группы препарата болезнемодифицирующей терапии, которую пациенты принимают, а именно: 17 пациентов до момента забора крови для указанных исследований никогда не получали никакой терапии; 15 больных рассеянным склерозом, получавших болезнемодифицирующую терапию препаратами из группы интерферонов β-1b; 12 человек после пульс-терапии метилпреднизолоном в дозе 1000 мг в течение 5–7 дней; 12 больных рассеянным склерозом разного пола и возраста, получавших терапию препаратами из группы моноклональных антител, а именно окрелизумаб в дозе 600 мг, частотой 1 раз в 6 месяцев; 9 человек — на препарате глатирамера ацетат дозой 40 мг трижды в неделю; 10 больных рассеянным склерозом, получавших лечение препаратом терифлуномид в дозе 14 мг при приеме один раз в сутки; а также 23 практически здоровых лиц. Результаты. В результате проведенных исследований выявлено, что различные виды терапии влияют на изменение гликозильных детерминант иммуноглобулинов. Выводы. Гликановые маркеры можно использовать как высокочувствительные и специфичные биомаркеры для диагностики рассеянного склероза и прогнозирования его течения.
Background. The definition of antibodies to the body’s own antigens is of great importance in autoimmune processes in multiple sclerosis. The functions of immunoglobulins (Ig) are determined by the composition of the biomolecules of glycan residues attached to the N-glycosylated domain in the crystallizing fragment (Fc region) of the immunoglobulin heavy chains. The changes in the structure of glycans are believed to be able to affect the functioning of Ig. So, the presence or absence of certain carbohydrate residues in the composition of antibodies is associated with their pro- or anti-inflammatory properties. In turn, this modifies the course of inflammatory reactions in autoimmune diseases and can determine the activity of multiple sclerosis. Therefore, studies of structural changes in the blood serum Ig of patients with multiple sclerosis is of great clinical importance. Materials and methods. The serum samples of 6 cohorts of patients with multiple sclerosis was sdudied depending on the group of the drug of the disease-modifying therapy that the patients were taking. Namely, 17 patients, prior to the time of blood sampling for these studies, had never received any therapy; 15 patients with multiple sclerosis received disease-modifying therapy with drugs from the interferon group β-1b; 12 people received pulse therapy with methylpredni-solone at a dose of 1000 mg for 5–7 days; 12 patients with multiple sclerosis of different sexes and ages received therapy with drugs from the group of monoclonal antibodies, namely ocrelizumab at a dose of 600 mg once per 6 months; 9 people received glatiramer acetate at a dose of 40 mg three times a week; 10 patients with multiple sclerosis were treated with teriflunomide at a dose of 14 mg once a day; there were 23 healthy individuals. Results. The results of the studies demonstrated that various types of therapy impact the change in the immunoglobulins glycosyl determinants. Conclusions. Glycan markers can be used as high-sensitive and specific biomarkers for diagnosing multiple sclerosis and predicting its course.
розсіяний склероз; IgG; глікозилювання
рассеянный склероз; IgG; гликозилирование
multiple sclerosis; IgG; glycosylation
Вступ
Матеріали та методи
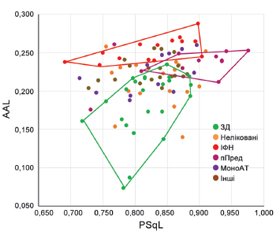
Результати та обговорення
/14_2.jpg)
Висновки
1. Begum F. Immunology. Immunology. 2014. 71-82.
2. Jefferis R., Lund J., Mizutani H. et al. A comparative study of the N-linked oligosaccharide structures of human IgG subclass proteins. Biochem. J. 1990. 268. 529-537. Available from: http://www.ncbi.nlm.nih.gov/pubmed/2363690.
3. Wormald M.R., Rudd P.M., Harvey D.J. et al. Variations in oligosaccharide-protein interactions in immunoglobulin G determine the site-specific glycosylation profiles and modulate the dynamic motion of the Fc oligosaccharides. Biochemistry. 1997. 36. 1370-1380. Available from: http://www.ncbi.nlm.nih.gov/pubmed/9063885.
4. Stadlmann J., Pabst M., Altmann F. Analytical and Functional Aspects of Antibody Sialylation. J. Clin. Immunol. 2010. 30. 15-19. Available from: http://dx.doi.org/10.1007/s10875-010-9409-2.
5. Kaneko Y., Nimmerjahn F., Ravetch J.V. Anti-inflammatory activity of immunoglobulin G resulting from Fc sialylation. Science. 2006. 313. 670-673. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=16888140.
6. Nimmerjahn F., Anthony R.M., Ravetch J.V. Agalactosylated IgG antibodies depend on cellular Fc receptors for in vivo activity. Proc. Natl. Acad. Sci. USA. 2007. 104. 8433-8437. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=17485663.
7. Nimmerjahn F., Ravetch J.V. Antibody-mediated modulation of immune responses. Immunol. Rev. 2010. 236. 265-275. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20636822.
8. Lux A., Nimmerjahn F. Impact of differential glycosylation on IgG activity. Adv. Exp. Med. Biol. 2011. 780. 113-124. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=21842369.
9. Nimmerjahn F., Gordan S., Lux A. FcγR dependent mechanisms of cytotoxic, agonistic, and neutralizing antibody activities. Trends Immunol. 2015. 36. 325-336.
10. Jefferis R. Glycosylation as a strategy to improve antibody-based therapeutics. Nat. Rev. Drug Discov. 2009. 8. 226-234. Avai-lable from: http://www.nature.com/doifinder/10.1038/nrd2804.
11. Wahl A., van den Akker E., Klaric L. et al. Genome-Wide Association Study on Immunoglobulin G Glycosylation Patterns. Front. Immunol. 2018. 9. 277. Available from: http://www.ncbi.nlm.nih.gov/pubmed/29535710.
12. Lauc G., Vučković F., Bondt A. et al. Trace N-glycans inclu-ding sulphated species may originate from various plasma glycoproteins and not necessarily IgG. Nat. Commun. 2018. 9. 2916. Available from: http://www.nature.com/articles/s41467-018-05173-w.
13. Trbojević-Akmačić I., Vilaj M., Lauc G. High-throughput analysis of immunoglobulin G glycosylation. Expert Rev. Proteomics. 2016. 13. 523-534. Available from: http://www.ncbi.nlm.nih.gov/pubmed/27043342.
14. Dubé R., Rook G.A.W., Steele J. et al. Agalactosyl IgG in inflammatory bowel disease: Correlation with C-reactive protein. Gut. 1990. 31. 431-434.
15. Mehta A.S., Long R.E., Comunale M.A. et al. Increased Le-vels of Galactose-Deficient Anti-Gal Immunoglobulin G in the Sera of Hepatitis C Virus-Infected Individuals with Fibrosis and Cirrhosis. J. Virol. 2008. 82. 1259-1270. Available from: http://jvi.asm.org/cgi/doi/10.1128/JVI.01600-07.
16. Parekh R., Roitt I., Isenber D. et al. Age-Related Galactosylation of the N-Linked Oligosaccharides of Human Serum IgG. J. Exp. Med. 2015. 212. 457-467. Available from: www.jem.org/cgi/doi/10.1084/jem.20142182.
17. Van de Geijn F.E., Wuhrer M., Selman M.H.J. et al. Immunoglobulin G galactosylation and sialylation are associated with pregnancy-induced improvement of rheumatoid arthritis and the postpartum flare: Results from a large prospective cohort study. Arthritis Res. Ther. 2009. 11. R193.
18. Biermann M.H.C., Griffante G., Podolska M.J. et al. Sweet but dangerous — the role of immunoglobulin G glycosylation in autoimmunity and inflammation. Lupus. 2016. 25. 934-942. Available from: http://journals.sagepub.com/doi/10.1177/0961203316640368.
19. Магорівська І.Б., Томін А.М., Думич Т.І. и др. Спосіб оцінки параметрів молекул імуноглобуліну класу IgG у зразках сироватки крові. UA, UA: Патент України на корисну модель 95297. 2014. 1-6.
20. Tateno H., Winter H.C., Goldstein I.J. Cloning, expression in Escherichia coli and characterization of the recombinant Neu5Acalpha2,6Galbeta1,4GlcNAc-specific high-affinity lectin and its mutants from the mushroom Polyporus squamosus. Biochem. J. 2004. 382. 667-675.
21. Baumann I., Kolowos W., Voll R.E. et al. Impaired uptake of apoptotic cells into tingible body macrophages in germinal centers of patients with systemic lupus erythematosus. Arthritis Rheum. 2002. 46. 191-201. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=11817590.
22. Scherer H.U., van der Woude D., Ioan-Facsinay A. et al. Glycan profiling of anti-citrullinated protein antibodies isolated from human serum and synovial fluid. Arthritis Rheum. 2010. 62. 1620-1629. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20178128.
23. Blauth K., Owens G.P., Bennett J.L. The Ins and Outs of B Cells in Multiple Sclerosis. Front. Immunol. 2015. 6. 1-7. Avai-lable from: http://journal.frontiersin.org/Article/10.3389/fimmu.2015.00565/abstract.

/13.jpg)
/14.jpg)
/15.jpg)