Резюме
Актуальність. Відновлення молочної залози після онкологічного втручання є потужним фактором впливу на якість життя пацієнток. Використання ацелюлярного дермального матриксу (АДМ) при реконструктивних операціях дозволяє спростити втручання і досягти кращого функціонального та естетичного результату, особливо у пацієнток із значним розміром молочних залоз, за рахунок механічних і біологічних властивостей АДМ. Мета: надання першого досвіду використання АДМ в реконструктивній хірургії молочної залози в Україні з аналізом технічних аспектів операцій, ранніх і віддалених хірургічних, онкологічних та функціональних результатів. Матеріали та методи. Робота є ретроспективним аналізом використання АДМ в Центрі сучасної мамології Лікарні ізраїльської онкології LISOD. Було прооперовано 27 пацієнток з виконанням одномоментних і відтермінованих реконструкцій молочних залоз після мастектомії за допомогою імплантатів та АДМ. Результати. Середній вік пацієнток становив 44 (30–71) роки. Виконано 35 операцій: 34 одномоментних та одна відтермінована реконструкція. Терапевтичні втручання мали місце в 25 (73,5 %) випадках, профілактичні — в 4 (11,8 %), симетризуючі — в 5 (14,7 %). Більшість мастектомій — 18 (52,9 %) — були сосокзберігаючими. Середній термін спостереження становив 46 (6–84) місяців. Ранні післяопераційні ускладнення — ішемія та некроз шкіри, інфекція, гематома — спостерігались в 11 (31,4 %) випадках. Пізні ускладнення — інфекція та пізні сероми — у 4 (11,4 %) випадках. Виконано 5 (14,3 %) ревізій, видалено 3 (8,6 %) імплантати. Капсулярну контрактуру 3-го ступеня виявлено в 5 реконструйованих залозах (14,3 %). Системний рецидив виник у 6 пацієнтів, 5 із них померли. Проведене анкетування 21 (77,8 %) пацієнтки щодо естетичного результату оперованих грудей: 19 (90,5 %) були дуже задоволені, 2 (9,5 %) — скоріше задоволені, незадоволених не виявилось. Висновки. Незважаючи на певний рівень ускладнень, АДМ завдяки своїм механічним і біологічним властивостям дозволяє проводити одномоментну одноетапну реконструкцію молочної залози навіть середнього та великого розміру, створює передумови для ліпографтингу і забезпечує хороші естетичні та функціональні результати операцій.
Актуальность. Восстановление формы молочной железы после онкологического вмешательства является важным фактором, влияющим на качество жизни пациенток. Использование ацеллюлярного дермального матрикса (АДМ) позволяет сделать вмешательство технически проще и достичь лучшего функционального и эстетического результата, особенно у пациенток со значительным размером молочных желез, за счет механических и биологических свойств АДМ. Цель: представить первый опыт использования АДМ в реконструктивной хирургии молочной железы в Украине с анализом технических аспектов операций, ранних и отдаленных хирургических, онкологических и функциональных результатов. Материалы и методы. Работа является ретроспективным анализом использования АДМ в Центре современной маммологии Больницы израильской онкологии LISOD. Были прооперированы 27 пациенток с выполнением одномоментных и отдаленных реконструкций молочной железы после мастэктомии с использованием имплантатов и АДМ. Результаты. Средний возраст пациенток составил 44 (30–71) года. Выполнено 35 операций: 34 одномоментных и одна отсроченная реконструкция. Терапевтические вмешательства выполнены в 25 (73,5 %) случаях, профилактические — в 4 (11,8 %), симметризирующие — в 5 (14,7 %). Большинство мастэктомий — 18 (52,9 %) — были сосоксохраняющими. Средний срок наблюдения составил 46 (6–84) месяцев. Ранние послеоперационные осложнения — ишемия и некроз кожи, инфекция, гематома — наблюдались в 11 (31,4 %) случаях. Поздние осложнения — инфекция и поздние серомы — в 4 (11,4 %) случаях. Выполнено 5 (14,3 %) ревизионных вмешательств, удалено 3 (8,6 %) имплантата. Капсулярная контрактура 3-й степени выявлена в 5 (14,3 %) реконструированных железах. Системный рецидив возник у 6 пациенток, 5 из которых умерли. Проведено анкетирование 21 (77,8 %) пациентки относительно эстетического результата лечения: 19 (90,5 %) оказались очень довольны, 2 (9,5 %) — скорее довольны, недовольных не выявлено. Выводы. Несмотря на определенный уровень осложнений, АДМ благодаря своим механическим и биологическим свойствам позволяет выполнять одноэтапную реконструкцию молочной железы среднего и большого размера, создает условия для липографтинга и способствует хорошим эстетическим и функциональным результатам операций.
Background. Breast reconstruction after mastectomy is an important factor affecting patient’s quality of life. Mechanical and biological features of acellular dermal matrix (ADM) allows simplifying the breast reconstruction and achieving better functional and aesthetic results, especially for women with medium and large breast size. Objective: to present the first experience of breast reconstruction with ADM in Ukraine with the analysis of the technical aspects of surgeries, early and delayed surgical, oncological and functional results. Materials and methods. This work is the retrospective analysis of implant-based breast reconstruction with ADM in the Breast Unit of LISOD Hospital of Israeli Oncology. Results. Thirty-five operations were performed for 27 patients, 34 of them were immediate and one — delayed reconstruction. The average age of women was 44 (30–71) years. Therapeutic procedures were performed in 25 (73.5 %) cases, prophylactic — in 4 (11.8 %), symmetrised — in 5 (14.7 %). Eighteen (52.9 %) mastectomies were nipple-sparing. The average time of follow-up was 46 (6–84) months. Early complications such as ischemia and skin necrosis, infection, hematoma were detected in 11 (31.4 %) cases. Late complications such as infections and late seromas were observed in 4 (11.4 %) cases. Five (14.3 %) revisions were performed, 3 (8.6 %) implants were lost. Grade 3 capsular contracture was found in 5 (14.3 %) reconstructed breasts. Systemic recurrence occurred in 6 patients, 5 of them died. We had performed a survey about aesthetic and functional results in 21 (77.8 %) patients: 19 (90.5 %) were very satisfied and 2 (9.5 %) — were rather satisfied. No patients were unsatisfied. Conclusions. Despite the certain complications rate, the mechanical and biological features of ADM allow us to make an effective breast reconstruction even in patients with medium and large breasts. It provides for the further lipografting, and promotes good aesthetic and functional results after breast reconstruction.
Вступ
Лікування пацієнток з раком молочної залози (РМЗ) є не тільки медичною, але і соціальною проблемою, оскільки саме ця патологія є найпоширенішим онкологічним захворюванням серед жінок [1, 2]. Всі етапи лікування РМЗ повинні враховувати якість життя пацієнток і забезпечувати максимальну фізичну, психологічну та соціальну реабілітацію, особливо коли йдеться про жінок працездатного віку. Хірургічний етап лікування є вкрай важливим у цьому плані, оскільки саме з ним пов’язана небезпека деформації або навіть втрати залози, що призводить до значного стресу для кожної пацієнтки. При необхідності виконання мастектомії одномоментна або відтермінована реконструкція стає серйозним фактором реабілітації хворих на РМЗ. Не даремно одномоментна реконструкція молочної залози увійшла до міжнародних і національних стандартів лікування пацієнток з РМЗ [3–5]. Як відомо, більшість реконструктивних операцій на молочній залозі виконуються за допомогою імплантатів [6], і це розпочалось фактично одразу після впровадження їх в клінічну практику в 60-х роках минулого століття [7, 8]. Але, зважаючи на онкологічні перестороги, тоді відновні операції виконувались зазвичай у відтермінованому режимі [9]. Встановлення імплантату під шкіру призводило до великої кількості ускладнень і формування капсулярних контрактур [10]. Удосконаленням техніки операцій стало розташування імплантатів під великим грудним м’язом, запропоноване Dempsey і Lathern (1968) для аугментаційної мамопластики і успішно впроваджене в реконструктивну хірургію [10, 11]. Очевидно, що це обмежувало об’єм імплантату через відсутність адекватного простору за грудним м’язом і тиск останнього на імплантат, що підвищувало ризик його зміщення. Для розв’язання цієї проблеми в 1971 році Radovan запропонував використовувати експандери та проводити двохетапні реконструкції [12]. Наступним проривом у техніці реконструктивної хірургії молочної залози стало впровадження шкірнозберігаючих мастектомій з одномоментною реконструкцією. Спочатку це були шкірноредукційні мастектомії доступом за Wise [13], запропоновані Toth і Lappert (1991), але вони могли бути застосовані у пацієнток з великими грудьми і надлишком шкіри. При необхідності повного збереження шкірного конверта та розташуванні імплантату ретропекторально виникала необхідність перетинання великого грудного м’яза для звільнення нижнього полюса імплантату і забезпечення природної проєкції та форми реконструйованої залози. Це ставило питання про стабілізацію нижнього краю м’яза, що скорочувався і зміщувався догори при перетинанні, а також про підтримку нижнього полюсо імплантату з реконструкцією субмамарної складки та профілактику тиску імплантату на нижній шкірний клапоть. Технічним вирішенням проблеми став ацелюлярний дермальний матрикс (АДМ), що чудово вирішував ці завдання. АДМ — це трансплантат м’якої сполучної тканини людини або тварини (найчастіше — шкіри), що утворюється внаслідок видалення з нього клітин зі збереженням неушкодженим позаклітинного колагенового матриксу. Після імплантації в організм людини ця структура служить каркасом для клітин реципієнта, що активно заселяють його та реваскуляризують [14]. Саме впровадження цієї технології дало потужний поштовх розвитку одномоментної реконструкції молочної залози, оскільки не тільки дозволяло створити оптимальну кишеню для імплантату, але й використовувало біоінтеграційні властивості АДМ, збільшувало товщину покривних тканин і готувало оптимальні умови для подальшого ліпографтингу. В результаті якість покривних тканин в зоні імплантату і функціонально-естетичні результати операцій значно покращувались. Цей метод отримав широке впровадження в хірургію молочної залози в усьому світі [15, 16].
Мета: надати перший досвід використання АДМ в реконструктивній хірургії молочної залози в Україні з аналізом технічних аспектів операцій, ранніх і віддалених хірургічних, онкологічних та функціональних результатів.
Матеріали та методи
Наша робота є ретроспективним аналізом використання біологічних імплантатів АДМ в Центрі сучасної мамології Лікарні ізраїльської онкології LISOD. В період з 2011 по 2016 р. в лікарні LISOD було прооперовано 27 пацієнток з РМЗ з використанням АДМ. Всі пацієнтки проходили первинне обстеження, зокрема з гістологічним та імуногістохімічним дослідженням пухлини, згідно з міжнародними та національними стандартами [3–5]. Тактика та програма лікування з урахуванням всіх онкологічних, технічних та анатомічних особливостей пацієнтки, а також якості її життя та побажань формувалась для кожної хворої на регулярному мультидисциплінарному консиліумі в складі клінічного онколога, хірурга-мамолога, радіаційного онколога, радіолога, патолога, медичного психолога. Пацієнтки до 45 років та з тричі негативними пухлинами обстежувались на наявність мутацій генів BRCA 1/2. Мутацію гена BRCA 1 було виявлено у 5 (18,5 %) хворих. Середній вік пацієнток становив 44 (30–71) роки. Розподіл за стадіями хвороби та біологічні характеристики пухлин подані в табл. 1. Передопераційну хіміотерапію отримали 11 (40,7 %) пацієнток, і така сама кількість — 11 (40,7 %) — отримали ад’ювантну променеву терапію на ділянку реконструйованої залози та шляхи лімфовідтоку в сумарній вогнищевій дозі 50 Гр/25 фракцій. Ад’ювантну хіміотерапію отримали 4 (14,8 %) пацієнтки.
/16.jpg)
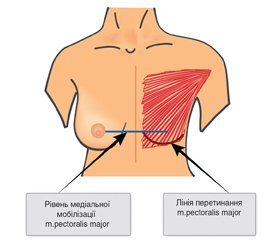
Ми використовували АДМ двох типів: Permacol™ (Medtronic, Covidien, США) і SurgiMend (TEI Biosciences, Inc., Бостон, Массачусетс) розміром 20 × 25 та 10 × 15 см, товщиною від 1 до 1,5 мм. Для реконструкції використовувались імплантати й експандери компанії Allergan, що підбирались згідно з анатомічними параметрами пацієнток. Показанням до шкірно-/сосокзберігаючої мастектомії з одномоментною реконструкцію імплантатом та АДМ вважали мультицентричний поширений характер пухлини без ураження шкіри (неможливість адекватного виконання органозберігаючої операції), поширений неінвазивний компонент (мікрокальцифікати за даними мамографії), наявність мутацій генів BRCA 1/2 та бажання пацієнтки. Технічними показаннями до використання АДМ при реконструктивному етапі вважали середній розмір залози (C, D) з помірним птозом 2–3-го ступеня або його відсутністю, адекватну перфузію шкірного клаптя, що оцінювалась інтраопераційно за клінічними ознаками (колір шкіри, капілярний тест) після видалення паренхіми залози. Протипоказаннями вважали інфільтративно-набрякову форму РМЗ (сТ4d), виражену супутню судинну патологію, активне паління. Перевага надавалась сосокзберігаючим мастектоміям з інтраопераційним дослідженням ретроареолярної ділянки. В такому випадку використовувався нижньолатеральний доступ в зоні субмамарної складки та бокового контуру залози. При необхідності видалення сосково-ареолярного комплексу (САК) використовувався косовертикальний доступ за Scheflan [17]. Мастектомія виконувалась з мобілізацією шкіри на рівні поверхневої фасції з її збереженням, що запобігає ушкодженню підшкірного судинного сплетіння та міжреберних перфорантів і забезпечує адекватне кровопостачання шкіри залози. Великий грудний м’яз перетинався по нижньому контуру, в зоні його прикріплення до грудної стінки. Медіальна межа перетинання встановлювалась на рівні САК (3-тя година праворуч та 9-та година ліворуч) (рис. 1), що запобігало тиску м’яза на імплантат з його деформацією та зміщенням догори і латерально.
Це також допомагало правильно сформувати медіальний контур реконструйованої залози. Субмамарна складка зберігалась та укріплювалась, якщо її вихідне положення було оптимальним, або переміщалась з її реконструкцією при необхідності її корекції. Залежно від анатомічної структури грудної стінки виконувалась мобілізація малого грудного та переднього зубчастого м’язів для формування верхньолатеральної стінки кишені. Мобілізований медіальний край малого грудного м’яза зшивався з латеральним краєм великого грудного м’яза, а зубчастий м’яз в подальшому фіксувався до латеральної частини АДМ. Параметри та розмір іплантату остаточно підбирались інтраопераційно за допомогою сайзера. Форма АДМ готувалась відповідно до кривини субмамарної складки, потім матрикс фіксувався до субмамарної складки з її укріпленням на рівні поверхневої фасції до грудної стінки (рис. 2). Важливо проводити цей етап у положенні пацієнтки сидячи.
/17.jpg)
Потім вибраний імплантат уводився в сформовану кишеню під великий грудний м’яз та АДМ, і верхній край матриксу фіксувався до нижнього краю великого грудного м’яза відповідно до остаточної оптимальної геометрії кишені з урахуванням природного птозу. Це також виконувалось в положенні сидячи. Важливим було оптимальне співвідношення поверхні імплантату та кишені, тобто грудний м’яз, АДМ і шкіра повинні бути розправлені на поверхні імплантату без складок, залишкових порожнин, але і без зайвого натягу (принцип «рука в рукавичці»). Порожнина кишені імплантату завжди дренувалась вакуумними дренажами через контрапертуру. Дренаж видалявся, коли кількість виділень за добу не перевищувала 30 мл. Періопераційна антибіотикопрофілактика проводилась у всіх пацієнток — призначались цефалоспорини 2-го покоління безпосередньо перед операцією та до видалення дренажу з порожнини кишені імплантату. Активне спостереження за пацієнтками проводилось протягом 2 тижнів після операції, потім кожні три місяці протягом першого року лікування та раз на півроку в подальшому періоді у випадку відсутності ускладнень і при стабільній клінічній картині. Проводились клінічне обстеження та фотофіксація зони втручання в стандартних позиціях, анкетування пацієнток та інструментальні дослідження згідно з попереднім планом або клінічним статусом. Пацієнткам рекомендувалось носити спеціальну компресійну білизну з 2–3-го дня після операції протягом 3 місяців. Перший місяць — не менше 20 годин на добу, два подальші місяці — на менше 12 годин на добу. Перед кожним втручанням всі пацієнтки проходили докладну співбесіду з хірургом і підписували інформовану згоду з детальним описанням можливих ускладнень та правил поведінки в післяопераційному періоді, а також з дозволом використання візуальних матеріалів, отриманих в процесі лікування. З другого дня після операції для кожної пацієнтки формувався індивідуальний план реабілітаційних заходів за допомогою реабілітолога, підбиралась спеціальна компресійна білизна. Ми провели анкетування методом прямого опитування 21 (77,8 %) пацієнтки з приводу задоволення результатами операції через більше ніж два роки з моменту операції. Питання стосувались задоволеності зовнішнім виглядом оперованих молочних залоз, якості життя, наявності скарг в зоні хірургічного втручання, бажання провести корекцію. Пацієнтку просили дати загальну оцінку результату хірургічного лікування згідно з модифікованою шкалою Likert: «не задоволена», «скоріше не задоволена», «скоріше задоволена», «дуже задоволена». Робота затверджена етичним комітетом Лікарні ізраїльської онкології LISOD.
Результати
Нами було виконано 35 операцій, із них 34 одномоментні та одна відтермінована одноетапна реконструкція (рис. 3) із встановленням постійного імплантату. Метою використання АДМ при відтермінованій реконструкції була профілактика капсулярної контрактури після ад’ювантної променевої терапії.
Серед одномоментних реконструкцій лише дві були двохетапними, із встановленням експандеру (в одному випадку — через редукцію шкіри, в іншому — через сумніви щодо адекватності кровопостачання шкірного клаптя (рис. 4)), інші 33 були із встановленням імплантату на першому етапі.
Терапевтичні втручання, тобто з приводу пухлини, мали місце в 25 (73,5 %) випадках, профілактичні, тобто у пацієнток з мутаціями гену BRCA 1, — в 4 (11,8 %) випадках (рис. 5, 6), симетризуючі, тобто через бажання пацієнтки досягти максимального естетичного результату, — в 5 (14,7 %) випадках.
Двобічні мастектомії з одномоментною реконструкцією виконані у 8 пацієнток. У двох пацієнток виконана відтермінована симетризуюча операція — одна редукційна вертикальна мамопластика і одна редукційно-аугментаційна мамопластика (рис. 7).
/19.jpg)
Більшість мастектомій — 18 (52,9 %) — були сосокзберігаючими. Біопсія сигнального лімфовузла (БСЛВ) виконана у 12 (44,4 %) пацієнток, аксилярна лімфодисекція (АЛД) — у 7 (25,9 %), а у 4 (14,8 %) пацієнток внаслідок виявлення метастазу в сигнальному лімфовузлі БСЛВ перейшла в АЛД. Середня маса видаленої молочної залози становила 376,4 г (124—754 г), середній об’єм встановленого імплантату — 411 мл (245–620 мл). Наявність клітин неінвазивної карциноми у фронтальному краї з відстанню менше 2 мм від краю резекції виявлена у 2 (7,4 %) пацієнток. У однієї з них виконане розширення краю в ділянці ареоли з підтвердженням чистого краю. Іншій пацієнтці через технічну складність ререзекції проведена ад’ювантна променева терапія. Інвазивної карциноми в краях резекції в жодної пацієнтки виявлено не було. Ми використали АДМ Permacol™ в 32, а SurgiMend — в 3 операціях. У 11 (31,4 %) пацієнток в подальшому виконано ліпографтинг в ділянку реконструйованої залози, із них у 5 ліпографтинг проведено двічі. Ранні післяопераційні ускладнення (до 30 діб після втручання) спостерігались у 11 (31,4 %) випадках. Структура ускладнень подана в табл. 2.
/20_2.jpg)
Внаслідок ранніх післяопераційних ускладнень було виконано 3 ревізійні операції: у 2 випадках — з приводу часткового некрозу шкірного клаптя, з виконанням некректомії та успішним ушиванням рани в одному випадку і некректомії, заміни імпланту на експандер і ушиванням рани в іншому. Ще однією причиною ревізії стала гематома — були проведені санація та дренування порожнини кишені. Середній термін спостереження пацієнтів становив 46 місяців (6–84 місяці). Пізні ускладнення ми спостерігали в 4 випадках: в 3 випадках — інфекція та в 1 випадку — пізня серома. У 2 випадках пізньої інфекції, що виникла після проведення ад’ювантної променевої терапії, спостерігався некроз шкіри, що призвело до необхідності ревізії та видалення імплантату. В одному з випадків дефект був закритий торакодорсальним клаптем, в іншому — місцевими тканинами. Ще в одному випадку мала місце запалена серома кишені імплантату, що вилікувана дренуванням та антибіотиками. Пізня серома без ознак запалення пролікована консервативно. Капсулярну контрактуру 3-го ступеня ми виявили в 5 реконструйованих залозах (14,3 %). Всі вони пройшли ад’ювантну променеву терапію, що є основним фактором розвитку вказаного ускладнення. Ми відслідкували віддалені результати всіх оперованих пацієнток. Системний рецидив виник у 6 (22,2 %) пацієнток з медіаною в 20 (6–46) місяців. В одному випадку мало місце олігометастатичне ураження головного мозку, було проведене хірургічне видалення вогнища в спеціалізованому закладі, променева терапія та системна таргетна терапія без подальшого рецидиву хвороби. П’ять пацієнток (18,5 %) померли внаслідок прогресування основної хвороби. Одна пацієнтка (3,7 %) померла від прогресії первинної пухлини іншої локалізації. У жодної пацієнтки ми не виявили місцевого рецидиву за період спостереження. За результатами опитування 21 пацієнтки щодо загальних естетичних і функціональних результатів хірургічного лікування виявлено, що 19 (90,5 %) з них оцінили результат як «дуже задоволені», а 2 (9,5 %) — як «скоріше задоволені».
Обговорення
Перша публікація щодо використання АДМ у клінічній практиці з’явились у 1994 році [18]: йшлося про лікування опіків. А перший досвід використання цієї технології в реконструктивній хірургії молочної залози був представлений Breuing та Warren в 2005 році [19]. В Україні історія використання АДМ почалась з майстер-класу з живою хірургією за участю Майкла Шефлана (Michael Scheflan), організованого в лікарні LISOD 15 грудня 2011 року. Тоді була виконана двобічна шкірнозберігаюча мастектомія з одномоментною реконструкцією імплантатами й АДМ та подальшим ліпографтингом (рис. 8).
/20.jpg)
Ацелюлярний дермальний матрикс радикально змінив сучасну хірургію молочної залози. Ця біологічна тканина вирішувала два принципових завдання — механічне та біологічне. АДМ дозволяв технічно легко створити внутрішній конверт для імплантату значного розміру, стабілізувати імплантат в оптимальному положенні та запобігти його зміщенню як у ранньому післяопераційному періоді (латералізація), так і у віддалені терміни (птоз, або bottoming-out). Він дозволяв перетинати та мобілізувати великий грудний м’яз на будь-якому рівні, запобігаючи його тиску на імплантат, і разом з м’язом формувати конверт оптимальної конфігурації. Це дало можливість використовувати імплантати великого розміру і маси вже на першому етапі, одночасно з мастектомією. Єдиним серйозним технічним обмеженням стала якість і кровопостачання шкірного клаптя, що ставило високі вимоги до якості виконання мастектомії. Біологічне завдання вирішувалось здатністю матриксу до його біоінтеграції в тканину реципієнта. Наявність ацелюлярного каркасу призводила до його насичення фібробластами організму реципієнта та активації ангіонеогенезу вже на 7-й день після операції, а при наступних спостереженнях відзначався розвиток капілярів лімфатичної системи в зоні встановлення дермального матриксу [20, 21]. Це сприяло мінімізації запальної реакції та, як результат, значному зменшенню рівня капсулярних контрактур, навіть після променевої терапії [22, 23]. У своїх оглядах Scheflan (2014), Cook (2018), як і інші автори, вказують на виражене зменшення рівня капсулярних контрактур при використанні АДМ порівняно з методикою без використання матриксів [24, 25, 34]. Хоча, наприклад, Hallberg та ін. (2018) в своєму метааналізі зауважують, що переваги АДМ у профілактиці такого ускладнення не є дуже значними [26]. Також ефект біоінтеграції сприяв не витонченню покривних тканин, тобто шкірного клаптя над імплантатом через його гіпотрофію, а навпаки — їх потовщенню. Як наслідок — значно кращі естетичні та функціональні результати, натуральніший вигляд реконструйованих молочних залоз і значно менший рівень видимої «хвилястості» (rippling), що активно використовувалось і при ревізійних втручаннях [27]. Створення біологічного каркасу дозволяло в подальшому ефективно проводити ліпографтинг, що стало початком зовсім нового напрямку реконструктивної хірургії — біоінженерної реконструкції [28]. Великі переваги та відносна технічна простота впровадження нової технології породили певну ейфорію, навіть незважаючи на високу вартість АДМ. Проте було підраховано, що в умовах страхової медицини у високорозвинених країнах використання АДМ при одномоментній одноетапній реконструкції є навіть дешевшим, ніж класична двохетапна реконструкція [29]. Певний час одномоментну реконструкцію імплантатами та АДМ вважали ідеальною. Але накопичення досвіду показало і значний рівень ускладнень. В багатьох оглядах було продемонстровано, що рівень ранніх післяопераційних ускладнень при одноетапних реконструкціях з використанням АДМ є більшим порівняно з двохетапними реконструкціями [30] та використанням синтетичних сіток і може досягати 55,0 %, а рівень втрати імплантатів — до 40,0 % [32, 34, 38]. Хоча Hallberg та ін. (2018) в своєму метааналізі не виявили значущої різниці саме в рівні ранніх ускладнень у групах з використанням біологічного матриксу та без нього [26]. Треба підкреслити, що ця технологія ставить вищі вимоги до хірурга та потребує ретельного відбору пацієнтів, проведення технічно досконалої шкірно/сосокзберігаючої мастектомії зі збереженням дермальних судин і перфорантів, що забезпечують кровопостачання шкіри, інтраопераційного контролю життєздатності шкірних клаптів і використання оптимального АДМ, оскільки не всі матрикси є однаковими [25, 31, 32, 38, 39]. До найчастіших ускладнень реконструктивних операцій з використанням АДМ належать серома, інфекція, некроз шкірного клаптя та гематома [24, 26, 30, 33, 34, 37, 38]. Проте рівень капсулярних контрактур є нижчим, ніж при класичних реконструкціях [22–24, 33, 34]. У своїй практиці ми теж мали значний відсоток ускладнень, що пов’язано з кривою навчання та періодом засвоєння методики. Проте віддалені результати у більшості пацієнток були дуже хорошими, що корелює з даними літератури [35, 36]. Ми також спостерігали значний відсоток капсулярних контрактур. На наш погляд, це пов’язано з особливостями самого матриксу. В більшості випадків ми застосовували Permacol™, оскільки саме цей продукт був офіційно зареєстрований і доступний в Україні. Цей матрикс має дуже щільну і малоеластичну структуру, що впливає на його біоінтеграційні можливості і регенеративний ефект [40]. Більше того, Permacol™ був розроблений та використовується в основному для закриття дефектів черевної стінки, що, очевидно, ставить до нього інші вимоги, ніж у реконструктивній хірургії молочної залози. Тому використання цього продукту в хірургії молочної залози не є оптимальним. На жаль, на момент написання статті в Україні немає офіційно зареєстрованого АДМ для реконструкції молочної залози. Це значно стримує розвиток хірургічної онкомамології та впровадження нових технологій.
Висновки
Ми подали, на наш погляд, перший і поки що найбільший досвід використання АДМ у реконструктивній хірургії молочної залози в Україні. Незважаючи на певні недоліки та складність його використання — високу вартість, а через це обмежену доступність даного матеріалу, високі вимоги до технічно правильного виконання мастектомії з максимальним збереженням кровопостачання шкірних клаптів і значущий рівень ранніх післяопераційних ускладнень, особливо в період засвоєння методики, ця технологія має однозначні переваги. Це можливість відносно простіше технічно сформувати велику кишеню для імплантату, що дозволяє проводити одномоментну одноетапну реконструкцію у пацієнток з середнім і великим розміром грудей, створення тканинного матриксу для подальшого ліпографтингу, профілактика «хвилястості» (rippling) та зменшення рівня капсулярних контрактур. Permacol™ серед інших варіантів АДМ не є оптимальним через високу щільність і незначну еластичність. Реконструкції з використанням АДМ є ефективним методом відновлення молочних залоз після онкологічних операцій з хорошими естетичними результатами і дуже широко використовуються у світі. Ми сподіваємося на подальше широке впровадження цієї технології в клінічну практику в Україні.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Подяки. Автори дякують Риспаєвій Д.Е. за допомогу в підготовці та редагуванні тексту.
Інформація про внесок кожного автора: Жигулін А.В. — концепція і дизайн дослідження, збирання й обробка матеріалів, аналіз отриманих даних, написання та оформлення тексту, підбір та підготовка ілюстрацій; Федосов А.Е. — збирання й обробка матеріалів, аналіз отриманих даних, допомога в написанні та оформленні тексту; Палиця В.Я. — збирання й обробка матеріалів; Недєльчев В.С. — збирання й обробка матеріалів, даних, редагування тексту; Вінницька Д.К. — збирання й обробка матеріалів; Бернштейн Г.Б. — концепція дослідження, редагування тексту.
Список литературы
1. Федоренко З.П., Гулак Л.О., Михайлович Ю.Й. та ін. Рак в Україні (2018–2019). Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України № 21. Київ, 2020. http://www.ncru.inf.ua/publications/BULL_21/index.htm
2. Bray F., Ferlay J., Soerjomataram I. et al. Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries CA. Cancer. J. Clin. 2018. 68. 394-424. DOI: 10.3322/caac.21492.
3. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Breast Cancer. Version 3. 2020 March 6. https://www.nccn.org/
4. Cardoso F., Kyriakides І., Ohno S. et al. Early Breast Cancer: ESMO Clinical Practice Guidelines for Diagnosis, Treatment and Follow-Up. Ann. Oncol. 2019. 30. 1194-1220. DOI: 10.1093/annonc/mdz189.
5. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги «Рак молочної залози». Наказ МОЗ України від 30 червня 2015 р. № 396. http://www.dec.gov.ua/mtd/reestr.html
6. Panchal H., Matros E. Current Trends in Post-Mastectomy Breast Reconstruction. Plast. Reconstr. Surg. 2017 Nov. 140(5). 7S-13S. DOI: 10.1097/PRS.0000000000003941.
7. Cronin T.D., Gerow F.J. Augmentation mammaplasty: a new “natural feel” prosthesis. Amsterdam: In: Transactions of the Third International Congress of Plastic and Reconstructive Surgery. Excerpta Medica. 1963.
8. Freeman B.S. Subcutaneous mastectomy for benign breast lesions with immediate or delayed prosthetic replacement. Plast. Reconstr. Surg. Transplant. Bull. 1962 Dec. 30. 676-82. DOI: 10.1097/00006534-196212000-00008.
9. Snyderman R.K., Guthrie R.H. Reconstruction of the female breast following radical mastectomy. Plast. Reconstr. Surg. 1971. 47. 565-567. DOI: 10.1097/00006534-197106000-00008.
10. Gruber R.P., Kahn R.A., Lash H. et al. Breast reconstruction following mastectomy: a comparison of submuscular and subcutaneous techniques. Plast. Reconstr. Surg. 1981. 67(3). 312-317.
11. Dempsey W.C., Lathern W.O. Subpectoral implants in augmentation mammoplasty. Plast. Reconstr. Surg. 1968. 42. 515.
12. Radovan C. Breast reconstruction after mastectomy using the temporary expander. Plast. Reconstr. Surg. 1982. 69. 195-208. DOI: 10.1097/00006534-198202000-00001.
13. Toth B.A., Lappert P. Modified skin incisions for mastectomy: The need for plastic surgical input in preoperative planning. Plast. Reconstr. Surg. 1991. 87. 1048. DOI: 10.1097/00006534-199106000-00006.
14. Boháč M., Danišovič Ľ., Koller J. et al. What happens to an acellular dermal matrix after implantation in the human body? A histological and electron microscopic study. European Journal of Histochemistry. 2018. 62. 2873. DOI: 10.4081/ejh.2018.2873.
15. American Society of Plastic Surgeons. Plastic surgery statistics report. 2012. Available at https://d2wirczt3b6wjm.cloudfront.net/News/Statistics/2012/plastic-surgery-statistics-full-report-2012.pdf
16. Mylvaganam S., Conroy E., Paula R. et al. Variation in the provision and practice of implant-based breast reconstruction in the UK: Results from the iBRA national practice questionnaire. Breast. 2017 Oct. 35. 182-190. doi: 10.1016/j.breast.2017.07.016.
17. Scheflan M., Maisel Lotan A., Allweis T.M. Trans-vertical mastectomy with immediate implant-based reconstruction: a retrospective, observational study. Aesthet. Surg. J. 2019. 39(7). 733-742. DOI: 10.1093/asj/sjy181.
18. Wainwright D.J. Use of an acellular allograft dermal matrix (AlloDerm) in the management of full-thickness burns. Burns. 1995. 21(4). 243-8. DOI: 10.1016/0305-4179(95)93866-i.
19. Breuing K.H., Warren S.M. Immediate bilateral breast reconstruction with implants and inferolateral AlloDerm slings. Ann. Plast. Surg. 2005. 55(3). 232-9. DOI: 10.1097/01.sap.0000168527.52472.3c.
20. Wong A.K., Schonmeyr B., Singh P. et al. Histologic analysis of angiogenesis and lymphangiogenesis in acellular human dermis. Plast. Reconstr. Surg. 2008. 121(4). 1144-52. doi.org/10.3389/fmed.2016.00072.
21. Garcia O.Jr., Scott J.R. Analysis of acellular dermal matrix integration and revascularization following tissue expander breast reconstruction in a clinically relevant large-animal model. Plast. Reconstr. Surg. 2013. 131(5). 741e-51e. DOI: 10.1097/PRS.0b013e3182865c6d.
22. Kim I.K., Park S.O., Chang H., Jin U.S. Inhibition Mechanism of Acellular Dermal Matrix on Capsule Formation in Expander-Implant Breast Reconstruction After Postmastectomy Radiotherapy. Ann. Surg. Oncol. 2018. 25(8). 2279-2287. DOI: 10.1245/s10434-018-6549-8.
23. Leong M., Basu C.B., Hicks M.J. Further evidence that human acellular dermal matrix decreases inflammatory markers of capsule formation in implant-based breast reconstruction. Aesthet. Surg. J. 2015. 35(1). 40-7. DOI: 10.1093/asj/sju014.
24. Scheflan M., Colwell A.S. Tissue Reinforcement in Implant-based Breast Reconstruction. Plast. Reconstr. Surg. Glob. Open. 2014. 2. e192; DOI: 10.1097/GOX.0000000000000140.
25. Cook L.J., Kovacs T. Novel devices for implant-based breast reconstruction: is the use of meshes to support the lower pole justified in terms of benefits? A review of the evidence. Ecancer. 2018. 12. 796. DOI: 10.3332/ecancer.2018.796.
26. Hallberg H., Rafnsdottir S., Selvaggi S. et al. Benefits and risks with acellular dermal matrix (ADM) and mesh support in immediate breast reconstruction: a systematic review and meta-analysis. Journal of Plastic Surgery and Hand Surgery. 2018. DOI: 10.1080/2000656X.2017.1419141.
27. Nahabedian M.Y., Spear S.L. Acellular Dermal Matrix for Secondary Procedures Following Prosthetic Breast Reconstruction. Aesthetic. Surgery Journal. 2011. 31. 7 (suppl.). 38S-50S. DOI: 10.1177/1090820X11418093.
28. Maxwell G.P., Gabriel A. Bioengineered Breast: Concept, Technique, and Preliminary Results. Plast. Reconstr. Surg. 2016. 137(2). 415-21. DOI: 10.1097/01.prs.0000475750.40838.53.
29. Krishnan N.M., Chatterjee A., Rosenkranz K.M. et al. The cost effectiveness of acellular dermal matrix in expander-implant immediate breast reconstruction. J. Plast. Reconstr. Aesthet. Surg. 2014. 67(4). 468-76. DOI: 10.1016/j.bjps.2013.12.035.
30. Dikmans R.E., Negenborn V.L., Bouman M.B. et al. Two-stage implant-based breast reconstruction compared with immediate one-stage implant-based breast reconstruction augmented with an acellular dermal matrix: an open-label, phase 4, multicentre, randomised, controlled trial. Lancet Oncol. 2017. 18(2). 251-258. DOI: 10.1016/j.bjps.2017.05.001.
31. Kim J.Y.S., Mlodinow A.S. What’s New in Acellular Dermal Matrix and Soft-Tissue Support for Prosthetic Breast Reconstruction. Plast. Reconstr. Surg. 2017. 140. 30S. DOI: 10.1097/PRS.0000000000003950.
32. Aguilera-Sáez J., Roura P.B., Ferrer A.G. et al. Early complications in cases series in implant based immediat e breast reconstruct ion with a biological acellular matrix during the learning curve of this technique and using 3 different matrices: a case series of 84 breasts. International Journal of Surgery Oncology. 2018. 3. e52. DOI: 10.1097/IJ9.0000000000000052.
33. Heidemann L.N., Gunnarsson G.L., Salzberg C.A. et al. Сomplications following nipple-sparing mastectomy and immediate acellular dermal matrix Implant-based breast reconstruction — a systematic review and meta-analysis. Plast. Reconstr. Surg. Glob. Open. 2018. 6. e1625. DOI: 10.21037/gs.2017.08.06.
34. Logan E., Asaolu O., Nebo V., Kasem A. Biological and synthetic mesh use in breast reconstructive surgery: a literature review. World Journal of Surgical Oncology. 2016. 14. 121. DOI: 10.1186/s12957-016-0874-9.
35. Forsberg C.G., Kelly D.A., Wood B.C. et al. Aesthetic outcomes of acellular dermal matrix in tissue expander/implant-based breast reconstruction. Ann. Plast. Surg. 2014. 72(6). S116-20. DOI: 10.1097/SAP.0000000000000098.
36. Ibrahim A.M., Koolen P.G., Ganor O. et al. Does acellular dermal matrix really improve aesthetic outcome in tissue expander/implant-based breast reconstruction? Aesthetic. Plast. Surg. 2015. 39(3). 359-68. DOI: 10.1007/s00266-015-0484-x.
37. Ibrahim A.M., Ayeni O.A., Hughes K.B. et al. Acellular dermal matrices in breast surgery. A comprehensive review. Ann. Plast. Surg. 2013. 70. 732-738. DOI: 10.1097/SAP.0b013e31824b3d30.
38. Lohmander F., Lagergren J., Roy P.G. et al. Implant based breast reconstruction with acellular dermal matrix safety data from an open-label, multicenter, randomized, controlled trial in the setting of breast cancer treatment. Ann. Surg. 2018. DOI: 10.1097/SLA.0000000000003054.
39. Hillberg N.S., Ferdinandus P.I., Dikmans R.E.G. et al. Is single-stage implant-based breast reconstruction (SSBR) with an acellular matrix safe? Strattice™ or Meso Biomatrix® in SSBR. European Journal of Plastic Surgery. 2018. 41. 429-438. DOI: https://doi.org/10.1007/s00238-018-1415-2.
40. Cheng A., Saint-Cyr M. Comparison of Different ADM Materials in Breast Surgery. Clin. Plastic. Surg. 2012. 39. 167-175. DOI: 10.1097/GOX.0000000000001576.
/20.jpg)

/16.jpg)
/17.jpg)
/18.jpg)
/19.jpg)
/20_2.jpg)