Журнал «Практическая онкология» Том 3, №2, 2020
Вернуться к номеру
Циторедуктивная хирургия и HIPEC в лечении первичного эпителиального рака яичника III–IV стадии
Авторы: Назаров Я.С.(1), Копецкий В.И.(2), Шудрак Е.А.(2)
(1) — Национальный медицинский университет имени А.А. Богомольца, г. Киев, Украина
(2) — Национальный институт рака, г. Киев, Украина
Рубрики: Онкология
Разделы: Справочник специалиста
Версия для печати
Рак яєчника (РЯ) — найагресивніша пухлина органів жіночої статевої системи, що характеризується імплантаційним ростом, ураженням парієтальної і вісцеральної очеревини, а також органів черевної порожнини і заочеревинного простору. РЯ III–IV стадії первинно діагностується приблизно у 80 % пацієнток. Щорічно на РЯ у світі захворює понад 290 тисяч, а гине понад 180 тисяч жінок. Оперативна тактика в цієї групи пацієнток не може обмежитись класичними процедурами, такими як пангістеректомія і оментектомія, і може включати втручання на інших органах малого таза, а також органах, що виходять за межі таза, у тому числі верхніх відділів черевної порожнини, що пред’являє високі вимоги до оперативної техніки хірурга. Первинна повна циторедукція, що має на меті видалення всіх видимих пухлинних вогнищ, з подальшою ад’ювантною поліхіміотерапією є золотим стандартом лікування РЯ III–IV стадії. Гіпертермічна внутрішньочеревна хіміотерапія є перспективною додатковою опцією у лікуванні РЯ, що здатна підвищити загальну і безрецидивну виживаність у даної категорії пацієнток.
Рак яичника (РЯ) — наиболее агрессивная опухоль органов женской половой системы, характеризующаяся имплантационным ростом, поражением париетальной и висцеральной брюшины, а также органов брюшной полости и забрюшинного пространства. Ежегодно РЯ в мире заболевает свыше 290 тысяч женщин, а погибает свыше 180 тысяч. РЯ III–IV стадии первично выявляется у 80 % пациенток. Оперативная тактика у этой группы пациенток не может ограничиться классическими процедурами, такими как пангистерэктомия и оментэктомия, и может включать вмешательства на других органах малого таза, а также органах, выходящих за пределы таза, в том числе органах верхних этажей брюшной полости, что предъявляет повышенные требования к оперативной технике хирурга. Первичная полная циторедукция, подразумевающая удаление всех видимых опухолевых очагов, с последующей адъювантной полихимиотерапией является золотым стандартом лечения РЯ III–IV стадии. Гипертермическая внутрибрюшинная химиотерапия является перспективной дополнительной опцией в лечении РЯ, способной увеличить общую и безрецидивную выживаемость у данной категории пациенток.
Ovarian cancer (OC) is the most aggressive female genital cancer, which is characterized by implant growth, visceral and parietal peritoneal carcinomatosis and damage to the abdominal cavity and retroperitoneal space. Every year, more than 290,000 new cases of OC and 180,000 deaths from this pathology are registered worldwide. Stage III–IV OC is a primary diagnosis in 80 % of the patients. Classic procedures like radical hysterectomy and omentectomy are not sufficient for the recovery of such patients. Additional interventions in pelvic, extrapelvic and upper abdomen organs might be required. Such procedures demand high-skill surgeon techniques. Primary complete cytoreduction which imply complete removal of all masses followed by the adjuvant chemotherapy is the gold standard in the treatment for stage III–IV OC. Hyperthermic intraperitoneal chemotherapy is the novel option in the treatment of OC, which could increase overall and disease-free survival rate in these patients.
рак яєчника; рак яєчника III–IV стадії; циторедуктивна хірургія; циторедукція; гіпертермічна внутрішньочеревна хіміотерапія; огляд
рак яичника; рак яичника III–IV стадии; циторедуктивная хирургия; циторедукция; гипертермическая внутрибрюшинная химиотерапия; обзор
ovarian cancer; stage III–IV ovarian cancer; cytoreductive surgery; debulking; hyperthermic intraperitoneal chemotherapy; review
Введение
Материалы и методы
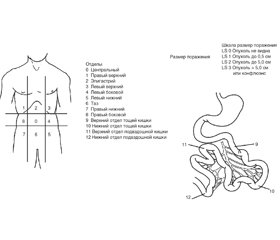
Результаты и обсуждение
Выводы
- Global Cancer Observatory: Ovarian cancer. [Internet]. Lyon. Fr. Int. Agency Res. Cancer. 2018 [cited 2019 Jun 6]; available from: https: //gco.iarc.fr/today
- Torre L.A., Bray F., Siegel R.L. et al. Global cancer statistics, 2012. CA Cancer J. Clin. 2015. 65 (2). 87-108. doi: 10.3322/caac.21262.
- Torre L.A., Siegel R.L., Ward E.M. et al. Global cancer incidence and mortality rates and trends — an update. Cancer Epidemiol. Biomarkers Prev. 2016. 25 (1). 16-27. doi: 10.1158/1055-9965.EPI-15-0578.
- Kurman R., Carcangiu M., Herrington C. WHO Classification of tumours of female reproductive organs. Lyon: IARC Press, 2014.
- Amin M., Greene F., Edge S. AJCC Staging Manual, 8th edition: Springer International Publishing. 2017. 1-1024.
- Hennessy B.T., Coleman R.L., Markman M. Ovarian cancer. Lancet. 2009 Oct 17. 374 (9698). 1371-82. doi: 10.1016/S0140-6736 (09)61338-6.
- Chan D.L., Morris D.L., Rao A., Chua T.C. Intraperitoneal chemotherapy in ovarian cancer: a review of tolerance and efficacy. Cancer Manag. Res. 2012. 4. 413-22. doi: 10.2147/CMAR.S31070.
- Eisenkop S.M., Spirtos N.M. What Are the Current Surgical Objectives, Strategies, and Technical Capabilities of Gynecologic Oncologists Treating Advanced Epithelial Ovarian Cancer? Gynecol. Oncol. 2001 Sep. 82 (3). 489-97. doi: 10.1006/gyno.2001.6312.
- Sugarbaker P.H. Cytoreductive surgery and perioperative intraperitoneal chemotherapy for the treatment of advanced primary and recurrent ovarian cancer. Curr. Opin. Obstet. Gynecol. 2009 Feb. 21 (1). 15-24. doi: 10.1097/GCO.0b013e32831f8f32.
- Sugarbaker P.H. Peritonectomy procedures. Ann. Surg. 1995. 221. 29-42. doi: 10.1097/00000658-199501000-00004.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Ovarian cancer. Version 1.2020; available from: https. //www.nccn.org/professionals/physician_gls/pdf/ovarian.pdf
- European Society of Gynaecological Oncology (ESGO) Guidelines for Ovarian Cancer Surgery. Version 2.2017; available from: http: //ebooks.esgo.org/ovarian-surgeryguidelines/mobile/index.html#p=1
- Bogani G., Ditto A., Martinelli F., Lorusso D. et al. Surgical Techniques for Diaphragmatic Resection During Cytoreduction in Advanced or Recurrent Ovarian Carcinoma: A Systematic Review and Meta-analysis. Int. J. Gynecol. Cancer. 2016. 26 (2). 371-80. doi: 10.1186/s12885-017-3311-8.
- Chang S.J., Bristow R.E. Surgical technique of en bloc pelvic resection for advanced ovarian cancer. J. Gynecol. Oncol. 2015. 26. 155. doi: 10.3802/jgo.2015.26.2.155.
- Houvenaeghel G., Gutowski M., Buttarelli M., Cuisenier J., Narducci F., Dalle C. et al. Modified posterior pelvic exenteration for ovarian cancer. Int. J. Gynecol. Cancer. 2009. 19. 968-73. doi: 10.1111/IGC.0b013e3181a7f38b.
- Jones N.L., Chen L., Chatterjee S., Tergas A.I. et al. National trends in extended procedures for ovarian cancer debulking surgery. Int. J. Gynecol. Cancer. 2018 Jan. 28 (1). 19-25. doi: 10.1097/IGC.0000000000001132.
- Son J.H. et al. Perioperative outcomes of extensive bowel resection during cytoreductive surgery in patients with advanced ovarian cancer. J. Surg. Oncol. 2019. Jun. 119 (7). 1011-1015. doi: 10.1002/jso.25403.
- Oseledchyk A., Abramian A., Kaiser C. et al. Total or subtotal colectomy in patients undergoing surgery for primary or recurrent epithelial ovarian cancer. Oncol. Res. Treat. 2014. 37 (9). 448-54. doi: 10.1159/000366249.
- Xiang L. et al. Distal pancreatectomy with splenectomy for the management of splenic hilum metastasis in cytoreductive surgery of epithelial ovarian cancer. J. Gynecol. Oncol. 2016. Nov. 27 (6). e62. doi: 10.3802/jgo.2016.27.e62.
- Walter A.C., Manahan K.J., Geisler J.P. Morbidity of partial gastrectomy in primary ovarian cancer cytoreduction. J. Gynecol. Surg. 2010. 26 (4). 243-245. doi: 10.1089/gyn.2009.0067.
- Eisenhauer E.L., Abu-Rustum N., Sonoda Y., Levine D.A., Poynor E.A., Aghajanian C. et al. The addition of extensive upper abdominal surgery to achieve optimal cytoreduction improves survival in patients with stages IIIC–IV epithelial ovarian cancer. Gynecol. Oncol. 2006. 103. 1083-90. doi: 10.1016/j.ygyno.2006.06.028.
- Gasparri M.L., Grandi G., Bolla D., Gloor B. et al. Hepatic resection during cytoreductive surgery for primary or recurrent epithelial ovarian cancer. J. Cancer. Res. Clin. Oncol. 2016. Jul. 142 (7). 1509-20. doi: 10.1007/s00432-015-2090-3.
- Costantini B., Vizzielli G., Fanfani F., D'Addessi A. et al. Urologic surgery in gynecologic oncology: a large single-institution experience. Eur. J. Surg. Oncol. 2014. Jun. 40 (6). 756-61. doi: 10.1016/j.ejso.2014.01.020.
- Harter P., Sehouli J., Lorusso D. et al. LION: Lymphadenectomy in Ovarian Neoplasms — a prospective randomized AGO study group led gynecologic cancer intergroup trial. J. Clin. Oncol. 2017. 35 (15 Suppl). 5500. doi: 10.1200/JCO.2017.35.15.
- Spiliotis J., Halkia E., Lianos E., Kalantzi N., Grivas A., Efstathiou E. et al. Cytoreductive surgery and HIPEC in recurrent epithelial ovarian cancer: a prospective randomized phase III study. Ann. Surg. Oncol. 2015. 22. 1570-5. doi: 10.1245/s10434-014-4157-9.
- Van Driel W.J., Koole S.N., Sikorska K., Schagen van Leeuwen J.H., Schreuder H.W.R., Hermans R.H.M. et al. Hyperthermic intraperitoneal chemotherapy in ovarian cancer. N. Engl. J. Med. 2018. 378. 230-40. doi: 10.1056/NEJMoa1708618.
- Valle S.J., Alzahrani N.A., Liauw W., Sugarbaker P.H. et al. Hyperthermic ntraperitoneal Chemotherapy (HIPEC) Methodology, drugs and bidirectional chemotherapy. Indian. J. Surg. Oncol. 2016. 7 (2). 152-159. doi: 10.1007/s13193-016-0498-0.
- Sugarbaker P.H., van der Speeten K. Surgical technology and pharmacology of hyperthermic perioperative chemotherapy. J. Gastrointest. Oncol. 2016. 7 (1). 29-44. doi: 10.3978/j.issn.2078-6891.2015.105.
- Wang Y., Ren F., Chen P., Liu S. et al. Effects of CytoReductive surgery plus hyperthermic IntraPEritoneal chemotherapy (HIPEC) versus CytoReductive surgery for ovarian cancer patients: A systematic review and meta-analysis. Eur. J. Surg. Oncol. 2019. 45 (3). 301-309. doi: 10.1016/j.ejso.2018.10.528.
- Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. Рак в Україні, 2018–2019. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України, № 21. ПП Поліум, 2020.

/34.jpg)
/35.jpg)
/32.jpg)
/33.jpg)