Вступ
В останніх рекомендаціях, що стосуються лікування тяжкої черепно-мозкової травми (ЧМТ) [1–9], дуже важливим компонентом терапії є керування внутрішньочерепним тиском (ВЧТ) як важлива передумова якісного відновлення мозкових функцій. Наявність можливості проведення інвазивного моніторингу ВЧТ значно спрощує клінічну ситуацію щодо його конт-ролю, але більшість лікувальних закладів України на сьогодні такої можливості не мають. Тому частина досліджень нині проводиться за відсутності такого виду моніторингу.
У рандомізованому контрольованому дослідженні, присвяченому лікуванню внутрішньочерепного тиску (BEST TRIP), поданий єдиний проспективно досліджений клінічний протокол для управління черепно-мозковою травмою без моніторингу внутрішньочерепного тиску (ICP) [10]. Серед 167 молодих пацієнтів (медіана віку — 29 років) із середнім показником бала за шкалою коми Глазго (ШКГ) 4, але з анізокорією або аномальною реакцією зіниць, у 40 % цей протокол дав результати, які несуттєво відрізнялися від результатів рандомізованих досліджень протоколу, що базується на моніторуванні ВЧТ (сприятливий 6-місячний розширений показник результатів Глазго — 39 %; смертність — 41 %). Зазвичай для лікування внутрішньочерепної гіпертензії використовують гіпертонічний сольовий розчин у низьких/помірних дозах (72 %) і маніт (57 %), гіпервентиляцію (регульований парціальний тиск вуглекислого газу 30–35 мм рт.ст.) (73 %) і вазопресорні агенти для підтримки мозкової перфузії (62 %). Незвичним було використання високих доз гіперосмолярних розчинів або барбітуратів. Частота несприятливих подій була низькою і порівнянною з групою BEST TRIP. Незважаючи на те, що цей протокол повинен давати подібні прийнятні результати за обставин, порівнянних з випробуваннями, такі впливи, як довший догоспітальний час і транспортування хворих неспеціалізованим персоналом, плюс модель відділення інтенсивної терапії (ВІТ) із застосуванням агресивної інтенсивної терапії невеликими групами інтенсивістів, які спеціалізуються на лікуванні нейротравм, що відрізняється від більшості високоресурсних моделей, підтримують обережність щодо очікування однакових результатів у різних умовах. Нарешті, підхід до титрування ВЧТ у цьому протоколі при підозрі на внутрішньочерепну гіпертензію (проти кризового управління для контрольованого ВЧТ) вимагає подальшого дослідження.
Серед відносно нових підходів до управління ВЧТ при тяжкій ЧМТ є застосування комплексного препарату L-лізину есцинат®. Експериментально й клінічно доведені такі його ефекти: ендотеліотропна й венотонічна дія, покращання венозного й лімфовідтоку, протизапальна й помірна протибольова дія, нормалізація мікроциркуляції та антиагрегантна дія.
Важливим є те, що дія препарату реалізується на рівні ендотелію капілярів (блокує активацію мембранних фосфоліпідів, нормалізує вміст АТФ в ендотеліоцитах, перешкоджає активації ендотеліоцитів і вивільненню арахідонової кислоти), судинної стінки (нормалізує тонус судини, захищає глікозаміноглікани судинної стінки, покращує еластичність і резистентність капілярів, пригнічує перекисне окислення ліпідів), у просвіті судини (пригнічує адгезію нейтрофілів, перешкоджає агрегації тромбоцитів, нормалізує реологію крові).
Отже, такі ефекти L-лізину есцинату® дозволяють розглядати його застосування як запобіжний захід для зменшення набряку головного мозку (ГМ) при якомога більш ранньому його застосуванні в комплексній інтенсивній терапії хворих на черепно-мозкову травму. Він може розглядатись як засіб запобігання розвитку мозкового набряку з наступним кращим контролем внутрішньочерепного тиску. Для оцінки ефективності й наслідків застосування L-лізину есцинату® було проведене багатоцентрове ретроспективне дослідження в клініках різних регіонів України.
Матеріали та методи
В аналіз ефективності й безпеки включено 988 пацієнтів з урахуванням усіх критеріїв включення й невключення. Пропущені дані оброблялися або не оброблялися залежно від умов.
У дослідженні проаналізовано дані 811 (82,1 %) чоловіків і 177 (17,9 %) жінок.
В аналіз включені пацієнти віком від 18 до 65 років відповідно до критеріїв включення в дослідження (медіана — 40 років). Пацієнти, включені в дослідження, мали масу від 48 до 120 кг (медіана — 78 кг). Індекс маси тіла (ІМТ) у пацієнтів був у межах від 16,46 до 40,4 кг/м2 (медіана ІМТ — 25,11 кг/м2).
Стан свідомості за ШКГ — від 4 до 10 балів, що відповідало критеріям включення в дослідження (медіана — 8 балів). Час від моменту отримання травми до надходження до ВІТ становив від 0,417 до 24 годин (медіана — 3,25 години).
При включенні пацієнта в дослідження оцінювали наявність і тяжкість ушкоджень за шкалою AIS (Abbreviated Injury Scale). Медичні карти пацієнтів з позачерепними ушкодженнями, потенційно несумісними з життям (5–6 балів за шкалою AIS), не включали в дослідження. На підставі суми балів за AIS щодо трьох найбільш уражених ділянок тіла розраховано індекс тяжкості травми ISS (Injury Severity Score).
У більшості хворих травма голови поєднувалася з ураженнями шкіри та іншими (неуточненими) травмами легкої і помірної тяжкості. У деяких хворих ЧМТ поєднувалася з життєзагрожуючими (4 бали) ушкодженнями органів шиї, грудної клітки й живота. Медіана ISS становила 17 балів, тобто більшість пацієнтів мали серйозну травму (> 16 балів, усереднений ризик летального наслідку > 10 %), причому наявність ЧМТ і порушень свідомості (≤ 8 балів за ШКГ) є незалежним фактором ризику летальності.
Одним з критеріїв невключення, згідно з протоколом дослідження, була тривалість госпіталізації, яка мала становити не менше від 2 діб. Для оцінки даного часу було взято момент смерті для померлих пацієнтів і момент виписки для тих пацієнтів, які вижили. Оскільки час виписки не реєструвався, для розрахунків було взято 12:00 дня виписки — загальноприйнятий час виписки/переведення пацієнтів.
Тривалість госпіталізації для пацієнтів, включених в аналіз, становила від 1,82 до 104,48 доби (медіана — 20,68 доби).
653 (66,1 %) пацієнтам додатково до базової терапії було призначено L-лізину есцинат®, а 335 (33,9 %) пацієнтам його не призначали. Відношення кількості пацієнтів у групах становило 1,96, що відповідає припущенням, покладеним в основу розрахунку розміру вибірки (не більше ніж 2,5). Для пацієнтів, яким призначали L-лізину есцинат®, час від моменту госпіталізації до початку його прийому становив не більше ніж 20,83 години (медіана — 2,75 години). L-лізину есцинат® призначався курсом від 2 до 8 діб (медіана — 7 діб).
Групи за статтю (р = 0,727), віком (р = 0,054), масою тіла (р = 0,465), зростом (р = 0,683) та ІМТ (р = 0,131) статистично істотно не відрізнялися.
Статистична неоднорідність була встановлена за такими параметрами: оцінками за ШКГ (р = 0,002) (середнє в групі базової терапії — 7,84, СВ (стандартне відхилення) — 1,7; у групі L-лізину есцинату® — 8,24, СВ — 1,42) і часом до моменту надходження до ВІТ (р < 0,001) (середнє в групі базової терапії — 7,07, СВ — 6,61; у групі L-лізину есцинату® — 4,79, СВ — 4,91).
Групи були однорідними за оцінками ушкоджень за AIS таких ділянок тіла, як голова (р = 0,794), груди (р = 0,786), живіт (р = 0,422) і кінцівки зі скелетом таза (р = 0,412). Групи мають статистично істотні відмінності за оцінками ушкоджень за AIS таких ділянок тіла: обличчя (р = 0,031), шия (р = 0,022), шкіра та інші ушкодження (р < 0,001).
Також групи були статистично істотно відмінними за оцінками за шкалою ISS (р < 0,001) (середнє в групі базової терапії — 19,45, СВ — 6,31 (Ме — 17); у групі L-лізину есцинату® — 19,56, СВ — 4,76 (Ме — 18)).
Загальний стан хворого оцінювався в балах за такою вербальною аналоговою шкалою: 1 — відносно задовільний; 2 — середньої тяжкості; 3 — тяжкий; 4 — украй тяжкий; 5 — термінальний. За даним показником групи були також неоднорідними (р < 0,001) (середнє арифметичне значення в групі базової терапії — 3,26, СВ — 0,57; у групі L-лізину есцинату® — 3,11, СВ — 0,37), що вимагало коригування за допомогою відповідних статистичних методів (включення в аналіз як коваріати) при порівнянні груп за змінними ефективності.
На початку лікування для встановлення правильного діагнозу пацієнтам мали робити комп’ютерну/магнітно-резонансну томографію (КТ/МРТ). Однак через певні обставини КТ/МРТ була виконана не всім пацієнтам, включеним в аналіз. Крім того, деякі показники КТ/МРТ, а саме сумарний об’єм гематом або забоїв головного мозку, були задокументовані належним чином не в усіх пацієнтів. Тому висновки, що ґрунтуються на цих неповних даних, слід сприймати з обережністю. Підсумовуючи вищенаведене, потрібно зазначити, що наведені нижче результати аналізу є неповними, можуть містити зміщення й мають лише довідковий характер для оцінки можливих тенденцій.
При проведенні КТ/МРТ оцінювали такі параметри:
— наявність гематом, їх тип, об’єм і/або розмір;
— наявність забоїв головного мозку, їх об’єм і розміри;
— наявність крововиливів у шлуночки головного мозку;
— величина поперечної дислокації (зміщення сере-динних структур);
— наявність і величина компресії базальних цистерн (БЦ).
Серед пацієнтів, у яких доступні дані КТ/МРТ при госпіталізації, гематоми виявлені в 62,4 % пацієнтів групи базової терапії і 42,3 % пацієнтів групи L-лізину есцинату® (р < 0,001). Серед пацієнтів, у яких на КТ/МРТ були виявлені гематоми, розподіл за типом гематом був таким:
— епідуральні гематоми виявлені в 30,4 % у базовій групі та 42,3 % у групі L-лізину есцинату® (р < 0,001);
— субдуральні гематоми були виявлені в 69,1 % пацієнтів групи базової терапії і 57,3 % пацієнтів групи L-лізину есцинату® (р < 0,001);
— внутрішньомозкові гематоми були виявлені в 10,3 % пацієнтів групи базової терапії і 5,5 % пацієнтів групи L-лізину есцинату® (р < 0,001).
Серед пацієнтів, для яких доступні дані КТ/МРТ при госпіталізації:
— забій головного мозку виявлено в 76,4 % пацієнтів групи базової терапії і 90,3 % пацієнтів групи L-лізину есцинату® (р < 0,001);
— крововиливи в шлуночки головного мозку було виявлено в 6,7 % пацієнтів групи базової терапії і 3,1 % пацієнтів групи L-лізину есцинату® (р < 0,001);
— наявність поперечної дислокації (зміщення серединних структур) головного мозку виявлено в 52,5 % пацієнтів групи базової терапії і 32,3 % пацієнтів групи L-лізину есцинату® (р < 0,001);
— наявність компресії базальних цистерн виявлено в 33,8 % пацієнтів групи базової терапії і 26,2 % пацієнтів групи L-лізину есцинату® (р < 0,001).
Також відмінності між групами були статистично значущими за об’ємом внутрішньочерепних гематом (p < 0,001) та об’ємом вогнищ забою головного мозку (p < 0,001) (табл. 1). Однак у зв’язку з великою кількістю пацієнтів, для яких дані були відсутні, ці висновки можуть бути зміщеними.
Групи відрізнялися (р < 0,001) за частотою проведення хірургічних втручань. Хірургічні втручання проводились у 70,7% хворих з базовою терапією і 51,3 % хворих, яким додатково було призначено L-лізину есцинат®.
Наявність статистично істотних відмінностей між групами за певними змінними вимагало коригування при порівнянні груп за змінними ефективності.
Аналіз даних проведено за допомогою стандартних засобів статистичного аналізу електронних таблиць Microsoft Excel і пакета прикладних програм SPSS 23.0.
Під час аналізу застосовані методи описової статистики (для кількісних змінних обчислені показники — n, середнє арифметичне, медіана, стандартне відхилення, мінімум і максимум, а для категоріальних — частота й частка у відсотках), графічні методи, методи інтервального оцінювання (виконана побудова довірчих інтервалів (ДІ) для середніх арифметичних, медіан або часток залежно від характеру даних). Нормальність розподілу даних перевірялася за допомогою критерію Шапіро — Уїлка при рівні значущості 0,01. Для порівняння підгруп за категоріальними змінними застосовувався критерій хі-квадрат Пірсона або точний критерій Фішера залежно від виконання передумов аналізу [11]. У разі, якщо у вихідному стані групи статистично значимо відрізнялись за параметрами, що могли вплинути на оцінку ефективності лікування (тяжкість стану, час до надання фармакотерапевтичної допомоги тощо), для порівняння груп за категоріальними змінними застосовувалась логістична регресія, у якій як коваріати в рівняння регресії вводились відповідні параметри, що могли впливати на змінну ефективності. Структура моделі логістичної регресії формувалася з використанням методу Forward Wald (покрокове введення предикторів у рівняння регресії з використанням статистики Вальда). При застосуванні логістичної регресії оцінку відмінностей між групами (групою базової терапії і групою L-лізину есцинату®) робили за значимістю й величиною співвідношення шансів (СШ), апроксимацією якого є експонента коефіцієнта рівняння регресії, а також наводилися довірчі інтервали для СШ. Для порівняння підгруп за кількісними змінними ефективності в разі вихідної неоднорідності груп використовувався коваріаційний аналіз (ANCOVA) з відповідними коваріатами. Нормальність залишків ANCOVA перевірялася за допомогою критерію Шапіро — Уїлка. У разі, якщо залишки були розподілені ненормально, виконувався ANCOVA у рангах [13]. Для порівняння груп за змінними ефективності, що за своїм характером є «часом до настання події» і були цензурованими праворуч, використовувались методи аналізу виживаності — будувались криві виживаності за методом Каплана — Меєра, оцінювались медіани виживаності в групах і використовувався логранговий критерій. У разі невиконання передумов застосування логрангового критерію і/або вихідної не-однорідності груп застосовувалася регресія Кокса. Висновки щодо переважаючої ефективності терапії в групі L-лізину есцинату® порівняно з групою базової терапії робилися за величиною й значимістю коефіцієнтів рівняння Кокса. Експонента відповідного коефіцієнта рівняння регресії Кокса трактувалась як оцінка відносного ризику, і для неї будувалися 95% довірчі інтервали.
/28.jpg)
Результати та обговорення
Головною змінною в оцінці ефективності призначення препарату була летальність у ВІТ у пацієнтів, яким призначено L-лізину есцинат®, порівняно з пацієнтами, яким цей препарат не було призначено. Результати, подані без коригування за допомогою коваріат, наведені в табл. 2 і на рис. 1.
На основі даних, наведених у табл. 2, летальність у базовій групі становила 24,2 %, а в групі L-лізину есцинату® — 10,3 %. Різниця часток у групах («не прий-мали» — «приймали») становила 13,9 % (95% ДІ: 8,93–19,21 %) (р < 0,001).
Однак у зв’язку з тим, що групи, які порівнюються, на момент включення відрізнялися за ШКГ, за часом від моменту травми до надходження у ВІТ, за шкалою AIS і, відповідно, шкалою ISS, для врахування цих відмінностей було застосовано логістичну регресію. Оскільки оцінки ISS розраховуються з використанням оцінок AIS (береться сума квадратів трьох найбільших оцінок AIS за шістьма ділянками тіла), то в модель не були включені оцінки AIS, а були включені лише оцінки ISS.
Для відбору предикторів (незалежних змінних) у модель було використано метод Forward Wald, який здійснює поступово їх відбір і включення до рівняння регресії з використанням статистики Вальда. Коефіцієнти отриманої моделі на третьому й останньому кроці її формування наведено в табл. 3.
У підсумку було виявлено, що на результат лікування пацієнта (вижив або помер) у даному дослідженні не впливає час від моменту отримання травми до надходження у ВІТ. У той же час на результат впливають інші предиктори: прийом L-лізину есцинату® (р < 0,001), оцінки стану свідомості за ШКГ (р < 0,001) та оцінки тяжкості уражень за ISS (р < 0,001). На підставі отриманих результатів логістичної регресії можна констатувати, що найбільшою мірою на результат лікування пацієнта (вижив чи помер) впливає прийом L-лізину есцинату®. Його застосування збільшує шанси на виживання пацієнта з ЧМТ у 3,3 раза (СШ = 3,311; 95% ДІ: 2,108–5,200). При цьому слід звернути увагу: незважаючи на те, що оцінки за ШКГ на момент надходження у ВІТ статистично відрізнялися, в обох групах вони були на рівні коми І, медіана в обох групах становила 8 (середнє в групі базової терапії становило 7,84, СВ (стандартне відхилення) — 1,7; у групі L-лізину есцинату® — 8,24, СВ — 1,42). За шкалою ISS ситуація аналогічна: середнє в групі базової терапії становило 19,45, СВ — 6,31 (Ме — 17), у групі L-лізину есцинату® — 19,56, СВ — 4,76 (Ме — 18), показники в обох групах знаходяться в діапазоні оцінки тяжкості політравми як стабільної. Це дозволяє рекомендувати включення до стандартної терапії L-лізину есцинату® для лікування пацієнтів з ізольованою або поєднаною ЧМТ тяжкого або середнього ступеня тяжкості.
/29_2.jpg)
Для оцінки ефективності застосування L-лізину есцинату® при лікуванні хворих з ЧМТ за тривалістю госпіталізації пацієнтів у ВІТ аналіз було проведено окремо для тих пацієнтів, які померли у ВІТ, і окремо для усіх інших. Для хворих, які не були переведені з відділення інтенсивної терапії, дані в групах практично не відрізнялися. Результати аналізу тривалості перебування пацієнтів у відділенні реанімації та інтенсивної терапії (РІТ) для тих, хто був переведений з цього відділення, методами описової статистики наведено в табл. 4 і на рис. 2.
Згідно з табл. 4, медіани тривалості перебування у РІТ для пацієнтів, які були переведені з нього, статистично істотно відрізняються (р < 0,001) на користь тих пацієнтів, які приймали L-лізину есцинат®, що підтверджує його ефективність.
Одним з параметрів, що свідчить про ефективність терапії, є відновлення ясної свідомості — збільшення оцінки за шкалою коми Глазго до 15 балів. Для цього аналізуються дві змінні:
— день відновлення ясної свідомості, тобто час, за який у пацієнта відновилася ясна свідомість;
— відновлення ясної свідомості протягом перебування в стаціонарі (відновилася/не відновилася).
Результати аналізу ефективності за відновленням ясної свідомості протягом періоду перебування в стаціонарі без коригування з використанням коваріат наведено в табл. 5 і на рис. 3.
На підставі даних, наведених у табл. 5, можна зробити висновок, що частка відновлення ясної свідомості протягом перебування в стаціонарі в групі пацієнтів, які приймали L-лізину есцинат®, становила 87,0 % (у контролі — 66,0 %) (р < 0,001). Різниця часток у групах («приймали» — «не приймали») становила 21 % (95% ДІ: 61,54–26,75 %).
Встановлено, що на відновлення ясної свідомості пацієнта в стаціонарі в даному дослідженні впливає час від моменту отримання травми до моменту надходження у ВІТ (р = 0,003), прийом L-лізину есцинату® (р < 0,001), оцінки стану свідомості за ШКГ (р < 0,001) та оцінки тяжкості уражень за ISS (р < 0,001).
Згідно з отриманими результатами логістичної регресії (табл. 6), найбільшою мірою на відновлення ясної свідомості пацієнтів протягом перебування в стаціонарі впливає прийом L-лізину есцинату®. Його прийом збільшує шанси на відновлення ясної свідомості пацієнта з ЧМТ у 3,8 раза (СШ = 3,823; 95% ДІ: 2,535–5,765).
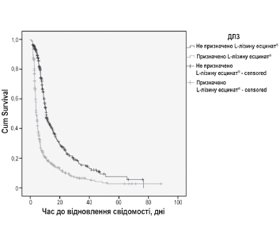
Для оцінки часу настання відновлення ясної свідомості з моменту надходження до ВІТ було взято 12:00 відповідної дати. Для тих пацієнтів, для яких ця подія не настала (цензуровані дані або ті, які вибули), було взято дату виписки або дату смерті. Результати аналізу часу настання цієї події методами описової статистики (методом Каплана — Меєра) наведено в табл. 7.
Криві виживаності наведено на рис. 4.
Для оцінки відмінностей між кривими виживаності було застосовано логранговий критерій (табл. 8).
Медіана виживаності, або, у даному випадку, медіана настання події «відновлення ясної свідомості», для пацієнтів, які не приймали L-лізину есцинат®, становить 10,84 (95% ДІ: 9,84–11,85) доби, а для пацієнтів, які приймали, — 3,99 (95% ДІ: 3,65–4,33) доби. Згідно з результатами логрангового критерію, відмінності між кривими виживаності є високозначимими (р < 0,001).
Встановлено (табл. 9), що на час до відновлення ясної свідомості впливає час від моменту отримання травми до моменту надходження у ВІТ (р < 0,001), прийом L-лізину есцинату® (р < 0,001), оцінка свідомості за ШКГ (р < 0,001) і тяжкості уражень за ISS (р < 0,001). Оскільки Exp(B) у табл. 9 фактично є оцінкою відносного ризику (ВР), то можна констатувати, що найбільшою мірою на час до відновлення ясної свідомості впливає прийом L-лізину есцинату®. Його застосування підвищує ймовірність відновлення ясної свідомості в пацієнта з ЧМТ у 2,46 раза (ВР = 2,463; 95% ДІ: 2,10–2,89).
/31.jpg)
Досить показовою була динаміка оцінок пацієнтів за шкалою коми Глазго. Стан пацієнта за ШКГ оцінювався при надходженні до ВІТ, на 2–8, 10 і 30-й дні, при переводі з ВІТ і на момент виписки. Оскілки дані ШКГ є неповними для періоду з 2-го по 30-й день через те, що деякі пацієнти були виписані, а деякі померли, неповні дані були замінені з використанням підходу переносу даних останнього візиту на наступний (Last-Observation Carried-Forward (LOCF) з урахування стану пацієнта. Для пацієнтів, які померли, неповні дані були замінені на значення «3», а для інших — на останні відомі значення.
Спостерігалися статистично значущі відмінності за динамікою оцінок ШКГ та оцінок тяжкості стану хворих у групах (рис. 5), що свідчить про ефективність застосування на додаток до стандартної терапії L-лізину есцинату®.
При аналізі ефективності за динамікою даних КТ/МРТ було встановлено, що якщо при госпіталізації 98 % пацієнтів робили КТ/МРТ, то контрольне КТ/МРТ було зроблено лише в 79,6 % пацієнтів. Тому при аналізі динаміки можливе значне зміщення результатів, що в кінцевому рахунку може призвести до неправильних висновків. У зв’язку з цим отримані результати можна вважати довідковими.
При проведенні КТ/МРТ оцінювалися такі параметри:
— наявність гематом і їх типи (епідуральна, субдуральна, внутрішньомозкова) та сукупний об’єм або розмір;
— наявність вогнищ забоїв головного мозку та їх сукупний об’єм або розмір;
— величина зміщення поперечної дислокації;
— наявність компресії базальних цистерн.
Вторинні змінні ефективності, що мають бути сформовані для оцінки динаміки:
— динаміка об’єму внутрішньочерепних гематом;
— динаміка об’єму вогнищ забою головного мозку;
— динаміка величини зміщення поперечної дислокації;
— динаміка ступеня компресії базальних цистерн.
Аналіз динаміки наявності внутрішньочерепних гематом було зроблено лише для тих пацієнтів, яким було проведено КТ/МРТ як при госпіталізації, так і конт-
рольне. Частка усунутих (ліквідованих повністю) гематом була статистично істотно більшою в групі базової терапії (р < 0,001). Це, можливо, пов’язано з тим, що при госпіталізації частка пацієнтів з гематомами була більшою в групі базової терапії, а також гематоми видалялися в деяких пацієнтів шляхом оперативного втручання незалежно від прийому L-лізину есцинату®. Тому визначити причину ліквідації гематоми не завжди було можливо.
Динаміку наявності забоїв головного мозку було визначено лише для тих пацієнтів, яким було проведено КТ/МРТ як при госпіталізації, так і контрольне, вона подана на рис. 6.
З огляду на виявлені статистично істотні відмінності (р < 0,001) між групами за наявністю вогнищ забою ГМ на момент госпіталізації (у групі L-лізину есцинату® їх було істотно більше) частка усунутих (ліквідованих повністю) вогнищ забоїв ГМ була істотно більшою в групі L-лізину есцинату® (р = 0,023). Це формально свідчить на користь переважаючої ефективності в групі L-лізину есцинату®. Однак з огляду на те, що контрольна КТ/МРТ була зроблена лише в 79,6 % пацієнтів, ці висновки мають бути обережними.
Були виявлені відмінності між групами за наявністю зміщення серединних структур як на момент госпіталізації (у групі базової терапії дислокацію було виявлено в 53,7 % хворих, у групі L-лізину есцинату® — 32,6 %, р < 0,001), так і на момент контролю (у групі базової терапії — 29 % хворих, у групі L-лізину есцинату® — 11,4 %, р < 0,001). Якщо в групі L-лізину есцинату® частка пацієнтів з поперечною дислокацією серединних структур головного мозку була істотно меншою, то частка усунутих (ліквідованих повністю) випадків дислокації (зміщення серединних структур) у групах не відрізнялась.
Серед важливих показників підвищеного ВЧТ унаслідок набряку ГМ за даними КТ і МРТ є наявність компресії базальних цистерн мозку. Аналізували тільки пацієнтів, яким було проведене повторне КТ/МРТ-досліження. Для оцінки зникнення компресії базальних цистерн було створено спеціальну змінну «ліквідація компресії БЦ» з категоріями «компресію БЦ ліквідовано» і «без змін». Результати аналізу динаміки наявності дислокації (зміщення) серединних структур наведено в табл. 10.
У групі L-лізину есцинату® частка пацієнтів з компресією базальних цистерн була істотно меншою, що опосередковано свідчило про протинабрякову ефективність досліджуваного препарату. Частка усунутих (ліквідованих повністю) випадків компресії базальних цистерн у групі L-лізину есцинату® статистично не відрізнялася від групи базової терапії.
Ефективність терапії була оцінена за даними 3-, 10-, 30-добової і загальної госпітальної летальності. Згідно з отриманими результатами логістичної регресії встановлено, що на 3-добову госпітальну летальність впливають лише вихідні (на час надходження до відділення реанімації та інтенсивної терапії) оцінки за ШКГ та ISS. Дані між групами не відрізнялися.
Для оцінки ефективності за 10-добовою госпітальною летальністю було сформовано відповідну змінну. Результати порівняльного аналізу в групах за змінною «10-добова госпітальна летальність» без коригування на неоднорідність груп за оцінками деяких змінних у вихідному стані (коваріат), які впливають на ефективність, наведено в табл. 11 і на рис. 7.
На основі отриманих даних можна зробити висновок, що 10-добова госпітальна летальність у групі L-лізину есцинату® становила 6,9 %, а в групі базової терапії — 17,3 %. Різниця часток в групах («тільки базова терапія» — «L-лізину есцинат®») становила 10,4 % (95% ДІ: 6,14–15,15 %) (р < 0,001). Найбільшою мірою на 10-добову госпітальну летальність впливає застосування L-лізину есцинату®, що збільшує пацієнту з ЧМТ шанси на виживання протягом 10 діб госпіталізації у 2,78 раза (СШ = 2,781; 95% ДІ: 1,706–4,532).
/34_2.jpg)
Дані 30-денної летальності виявилися ще більш показовими (табл. 12). 30-добова госпітальна летальність в основній групі становила 9,8 %, а в групі базової терапії — 24,2 % (р < 0,001). Різниця часток у групах («тільки базова терапія» — «L-лізину есцинат®») становила 14,4 % (95% ДІ: ,28–19,52 %). Найбільший вплив на 30-добову госпітальну летальність мало саме застосування L-лізину есцинату®, яке підвищує для пацєнтів з ЧМТ шанси вижити протягом 30 діб госпіталізації в 3,29 раза (СШ = 3,291; 95% ДІ: 2,082–5,202).
При аналізі безпеки й переносимості виявлено, що серйозних і/або непередбачуваних побічних реакцій/побічних явищ при застосуванні L-лізину есцинату® зафіксовано не було.
Висновки
1. Летальність у ВІТ на тлі прийому L-лізину есцинату® зменшувалася на 13,9 % (95% ДІ: 8,93–19,21 %) і становила 10,3 % (у контролі — 24,2 %).
2. На підставі отриманих результатів логістичної регресії можна констатувати, що найбільшою мірою на результат лікування пацієнта (вижив чи помер) впливає прийом L-лізину есцинату® (р < 0,001). Його застосування збільшує шанси на виживання пацієнта з ЧМТ у ВІТ у 3,3 раза (СШ = 3,311; 95% ДІ: 2,108–5,200). Також слід враховувати оцінки стану свідомості за ШКГ (р < 0,001) і тяжкості уражень за ISS (р < 0,001).
3. Частка відновлення ясної свідомості протягом перебування в стаціонарі в групі пацієнтів, які приймали L-лізину есцинат®, становила 87,0 % (у контролі — 66,0 %). Різниця часток у групах («прий-мали» — «не приймали») становила 21 % (95% ДІ: 61,54–26,75 %) (р < 0,001). Прийом L-лізину есцинату® збільшує шанси на відновлення ясної свідомості пацієнта з ЧМТ у 3,8 раза (СШ = 3,823; 95% ДІ: 2,535–5,765).
4. У групі L-лізину есцинату® 10-денна летальність становила 6,9 % (у контролі — 17,3 %), а 30-добова госпітальна летальність була 9,8 і 24,2 % відповідно (р < 0,001). Різниця часток на 30-ту добу в групах («тільки базова терапія» — «L-лізину есцинат®») становила 14,4 % (95% ДІ: 9,28–19,52 %). Найбільше на 30-добову госпітальну летальність впливає застосування L-лізину есцинату®, яке підвищує для пацієнтів з ЧМТ шанси вижити протягом 30 діб госпіталізації у 3,29 раза (СШ = 3,291; 95% ДІ: 2,082–5,202).
5. Дані дослідження дозволяють рекомендувати включення до стандартної терапії L-лізину есцинату® для лікування пацієнтів з ізольованою або поєднаною ЧМТ тяжкого або середнього ступеня.
Конфлікт інтересів. Не заявлений.
/29.jpg)
/30_2.jpg)
/32_2.jpg)

/28.jpg)
/29_2.jpg)
/30.jpg)
/31.jpg)
/32.jpg)
/33.jpg)
/34.jpg)
/34_2.jpg)