Архив офтальмологии Украины Том 8, №3, 2020
Вернуться к номеру
Прогресування початкової діабетичної ретинопатії: зв’язок зі станом вуглеводного обміну
Авторы: Риков С.О., Коробов К.В., Могілевський С.Ю.
Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
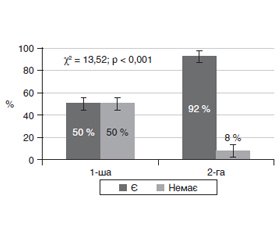
Актуальність. Розпізнавання ранніх стадій діабетичної ретинопатії (ДР) у пацієнтів із цукровим діабетом 2-го типу (ЦД2) та прогнозування їх прогресії має окреме значення та є актуальною задачею сучасної офтальмології. Мета дослідження — вивчити особливості виникнення та прогресування початкових стадій ДР і встановити зв’язок зі ступенем порушення вуглеводного обміну у пацієнтів із ЦД2. Матеріали та методи. Був обстежений 91 пацієнт (182 ока) із ЦД2. Відповідно до ETDRS системи клінічних ознак Airlie House визначали мікроаневризми (МА), мікрогеморагії (МГ), інтраретинальні мікросудинні аномалії (ІРМА), ретинальні венозні аномалії, неперфузію сітківки та зв’язок їх розвитку зі ступенем порушення вуглеводного обміну у хворих на ЦД2. Результати. У більшості пацієнтів (72,5 %) на початку дослідження ДР не було (рівень ETDRS становив 0–10 на обох очах). У решти пацієнтів (27,5 %) на одному оці рівень ETDRS був 10, а на іншому оці відмічені одиничні зміни калібру судин, розширення та звивистість вен, ІРМА або МГ, що відповідало рівню ETDRS 14/15. У цих пацієнтів давність ЦД2 була більшою (в середньому на 3 роки), а порушення вуглеводного обміну були більш вираженими. Протягом 1 року спостереження очні зміни прогресували неоднаково: за відсутності очних змін на початку дослідження прогресія була відмічена у 50 %, тоді як за їх наявності — у 92 %. Пацієнти з прогресією мали більший стаж діабету та гірші показники вуглеводного обміну. Висновки. Встановлено, що діабетичні зміни сітківки починаються з поодиноких судинних змін, за наявності яких протягом 1 року ДР розвивається у більшості випадків.
Актуальность. Распознавание ранних стадий диабетической ретинопатии (ДР) у пациентов с сахарным диабетом 2-го типа (СД2) и прогнозирование их прогрессии имеет важное значение и является актуальной задачей современной офтальмологии. Цель исследования — изучить особенности возникновения и прогрессирования начальных стадий ДР и установить связь со степенью нарушения углеводного обмена у пациентов с СД2. Материалы и методы. Был обследован 91 пациент (182 глаза) с СД2. Согласно ETDRS по системе клинических признаков Airlie House определяли микроаневризмы (МА), микрогеморрагии (МГ), интраретинальные микрососудистые аномалии (ИРМА), ретинальные венозные аномалии, неперфузию сетчатки и связь их развития со степенью нарушения углеводного обмена у больных СД2. Результаты. У большинства пациентов (72,5 %) на начало исследования ДР не было (уровень ETDRS составил 0–10 на обоих глазах). У остальных (27,5 %) на одном глазу уровень ETDRS был 10, а на другом отмечены единичные изменения калибра сосудов, расширение и извитость вен, ИРМА или МГ, что соответствовало уровню ETDRS 14/15. У этих пациентов давность СД2 была больше (в среднем на 3 года), а нарушения углеводного обмена были более выраженными. В течение 1 года наблюдения глазные изменения прогрессировали по-разному: при отсутствии ДР в начале исследования прогрессия была отмечена в 50 % случаев, тогда как при их наличии — в 92 %. Пациенты с прогрессией имели больший стаж диабета и худшие показатели углеводного обмена. Выводы. Установлено, что диабетические изменения сетчатки начинаются с одиночных сосудистых изменений, при наличии которых в течение 1 года ДР развивается в большинстве случаев.
Background. Recognizing the early stages of diabetic retinopathy (DR) in patients with type 2 diabetes mellitus (T2DM) and predicting their progression is important and is an urgent challenge of modern ophthalmology. The study aimed at investigating the peculiarities of occurrence and progression of DR initial studies and establishing its relationship with the severity of carbohydrate metabolism disorders in patients with T2DM. Materials and methods. We examined 91 patients (182 eyes) with T2DM. Based on the ETDRS system of clinical signs Airlie House, there were determined the microaneurysms (MA), microhemorrhages (MH), intraretinal microvascular anomalies (IRMA), retinal venous anomalies, retina nonperfusion, and their relationship with the severity of carbohydrate dysmetabolism in T2DM patients. Results. Most patients (72.5 %) had no retinopathy at the start of the study (ETDRS level was 0–10 in both eyes). The rest (27.5 %) had the ETDRS level 10 in one eye, while the other showed single changes in the caliber of blood vessels, dilatation, and tortuosity of the veins, IRMA or MH, which corresponded to the ETDRS level 14/15. In these patients, the duration of T2DM was longer (on average by 3 years), and the carbohydrate disorders were more pronounced. During one year of observation, eye changes progressed in different ways: in the absence of DR at the beginning of the study, progression was noted in 50.0 % of cases, while in their presence — in 92.0 %. The patients with progression had a longer history of diabetes and worse indicators of carbohydrate metabolism. Conclusions. It has been established that diabetic changes in the retina begin from a single vascular injury. With its presence within one year, DR develops in most cases.
початкова стадія діабетичної ретинопатії; цукровий діабет 2-го типу; вуглеводний обмін
начальная стадия диабетической ретинопатии; сахарный диабет 2-го типа; углеводный обмен
initial stage of diabetic retinopathy; type 2 diabetes; carbohydrate metabolism
Вступ
Матеріали та методи
Результати та обговорення
/11.jpg)
Висновки
- Ulyte A., Bähler C., Schwenkglenks M., von Wyl V., Gruebner O., Wei W. et al. Measuring diabetes guideline adherence with claims data: systematic construction of indicators and related challenges. BMJ Open. 2019 Apr 24. 9(4). Е027138. doi: 10.1136/bmjopen-2018-027138.
- Kowall B., Rathmann W., Stang A., Bongaerts B., Kuss O., Herder C. et al. Perceived risk of diabetes seriously underestimates actual diabetes risk: the KORA FF4 study. PLoS One. 2017 Jan 31. 12(1). Е0171152. doi: 10.1371/journal.pone.0171152.
- Lotfy M., Adeghate J., Kalasz H., Singh J., Adeghate E. Chronic complications of diabetes mellitus: a mini review. Curr. Diabetes Rev. 2017. 13(1). 3-10. doi: 10.2174/1573399812666151016101622.
- Khan R.M., Chua Z.J., Tan J.C., Yang Y., Liao Z., Zhao Y. From pre-diabetes to diabetes: diagnosis, treatments and translational research. Medicina. Kaunas. 2019 Aug 29. 55(9). 546. doi: 10.3390/medicina55090546.
- WHO. Global Diabetes Report [Internet]. 2020 [cited 15.07.20]. Available on www.who.int/diabetes/ru/.
- Nowak M.S., Grzybowski A. Rewie of the epidemiology of diabetic retinopathy. Modern Retina. Ophtalmology Times. 2018 June 11. Available from: https://www.modernretina.com/diabetic-retinopathy/review-epidemiology-diabetic-retinopathy.
- International Diabetes Federation and The Fred Hollows Foundation. Diabetes eye health: A guide for health care professionals. Brussel, Belgium: International Diabetic Federation [Internet]. 2015 [cited 15.07.20]. 10. Available on: https://idf.org/our-activities/care-prevention/eye-health/eye-health-guide.html# sub-content-tab-nav.
- Tronko M.D. Priority issues of diabetology in Ukraine at the present stage and ways to solve them. 2019 [Internet]. [cited 15.07.20]. Available on: http://iem.net.ua/endocrinology_task/ [in Ukranian].
- Pankiv V.I. Symposium № 156. Diabetes mellitus: definition, classification, epidemiology, risk factors. Int. J. Endocrin. 2013. 55(7). 95-104. Available on: https://cyberleninka.ru/article/n/tsukroviy-diabet-viznachennya-klasifikatsiya-epidemiologiya-faktori-riziku/viewer [in Ukraine].
- Kirsch S., Iroku-Malize T. Eye Conditions in Older Adults: Diabetic Retinopathy. FP Essent. 2016 Jun. 445. 29-37; quiz 38-9.
- Pankiv V.I. Diabetic retinopathy: a new approach to drug treatment (literature review). Int. J. Endocrin. 2014. 59(3). 93-5. Available on: http://www.mif-ua.com/archive/article/38677 [in Ukranian].
- Safi H., Safi S., Ali H.-M., Hamid A. Early detection of diabetic retinopathy. Survey of Ophthalmology. 2018 Apr. 63(5). 601-8. doi: 10.1016/j.survophthal.2018.04.003.
- Voigt M., Schmidt S., Lehmann T., Köhler B., Kloos C., Voigt U.A., Meller D. et al. Prevalence and progression rate of diabetic retinopathy in type 2 diabetes patients in correlation with the duration of diabetes. Exp. Clin. Endocrinol. Diabetes. 2018 Sep. 126(9). 570-6. doi: 10.1055/s-0043-120570.
- Lin Y., Jiang H., Liu Y., Gameiro G.R., Gregori G., Dong C., Rundek T. et al. Age-related alterations in retinal tissue perfusion and volumetric vessel density. Invest. Ophthalmol. Vis. Sci. 2019 Feb 1. 60(2). 685-93. doi: 10.1167/iovs.18-25864.
- Eleftheriou C.G., Ivanova E., Sagdullaev B.T. Of neurons and pericytes: еhe neuro-vascular approach to diabetic retinopathy. Vis. Neurosci. 2020 Aug. 37. 5. doi: 10.1017/S0952523820000048.
- Dedov I.I., Smirnova O.M. Diabetic retinopathy: current problems (the view of a diabetologist). Diabetes. Ophthalmology. 2008. 3. 4. Available on: https://cyberleninka.ru/article/n/diabeticheskaya-retinopatiya-sovremennye-problemy-vzglyad-diabetologa/viewer [in Russian].
- Fong D.S., Aiello L., Gardner T.W., King G.L., Blankenship G., Cavallerano J.D., Ferris 3rd F.L. et al. Retinopathy in diabetes. Diabetes Care. 2004 Jan. 27(1). 84-7. doi: 10.2337/diacare.27.2007.s84.
- Kashim R.M., Newton P., Ojo O. Diabetic retinopathy screening: a systematic review on patients’ non-attendance. Int. J. Environ. Res. Public Health. 2018 Jan 19. 15(1). 157. doi: 10.3390/ijerph15010157.
- Балашевич Л.І. Очні прояви діабету [рос. мовою]. СПб.: СПбМАПО, 2004. 379 с.
- Балашевич Л.І., Ізмайлов А.С. Діабетична офтальмопатія [рос. мовою]. СПб.: Человек, 2012. 396 с.
- Luc K., Schramm-Luc A., Guzik T.J., Mikolajczyk T.P. Oxidative stress and inflammatory markers in prediabetes and diabetes. J. Physiol. Pharmacol. 2019 Dec. 70(6). 111-13. doi: 10.26402/jpp.2019.6.01.
- Giri B., Dey S., Das T., Sarkar M., Banerjee J., Dash S.K. Chronic hyperglycemia mediated physiological alteration and metabolic distortion leads to organ dysfunction, infection, cancer progression and other pathophysiological consequences: an update on glucose toxicity. Biomed. Pharmacother. 2018 Nov. 107. 306-28. doi: 10.1016/j.biopha.2018.07.157.
- Eshaq R.S., Aldalati A.M.Z., Alexander J.S., Harris N.R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. 2017 Dec. 24(4). 229-41. doi: 10.1016/j.pathophys.2017.07.001.
- Hussain M., Awan F.R. Hypertension regulating angiotensin peptides in the pathobiology of cardiovascular disease. Clin. Exp. Hypertens. 2018. 40(4). 344-52. doi: 10.1080/10641963.2017. 1377218.
- Early Treatment Diabetic Retinopathy Study Research Group. Grading diabetic retinopathy from stereoscopic color fundus photographs — an extension of the modified airlie house classification: ETDRS report № 10. Ophthalmology. 2020 Apr. 127(4S). 99-119. doi: 10.1016/j.ophtha.2020.01.030.
- Khatri M., Saxena S., Kumar M., Chabbra A.K., Bhasker S.K., Akduman E.I., Pham H. et al. Resistive index of central retinal artery is a bioimaging biomarker for severity of diabetic retinopathy. Int. J. Retina Vitreous. 2019 Nov 12. 5. 38. doi: 10.1186/s40942-019-0189-4.
- Pappuru R.K., Ribeiro L., Lobo C., Alves D., Cunha-Vaz J. Microaneurysm turnover is a predictor of diabetic retinopathy progression. Br. J. Ophthalmol. 2019. 103(2). 222-26. doi: 10.1136/bjophthalmol-2018-311887.
- Schmidt-Erfurth U., Garcia-Arumi J., Gerendas B.S., Midena E., Sivaprasad S., Tadayoni R., Wolf S. et al. Guidelines for the management of retinal vein occlusion by the European society of retina specialists (EURETINA). Ophthalmologica. 2019. 242(3). 123-62. doi: 10.1159/000502041.
- Cui Y., Zhu Y., Wang J.C., Lu Y., Zeng R., Katz R., Vingopoulos F. et al. Comparison of widefield swept-source optical coherence tomography angiography with ultra-widefield color fundus photography and fluorescein angiography for detection of lesions in diabetic retinopathy. Br. J. Ophthalmol. 2020 Jun 26; bjophthalmol-2020-316245. doi: 10.1136/bjophthalmol-2020-316245.

/9.jpg)
/10.jpg)
/10_2.jpg)
/10_3.jpg)
/11_2.jpg)
/12.jpg)