Вступ
Рак молочної залози (РМЗ) є найпоширенішим онкологічним захворюванням серед жіночого населення в усьому світі. За даними Національного канцер-реєстру України, показник захворюваності у 2018 році становив 45,3, а смертності — 14,8 на 100 000 жіночого населення (без урахування даних Донецької, Луганської областей, АР Крим і м. Севастополь) [1]. Щорічно захворюваність на РМЗ збільшується, що вимагає пошуку нових тригерних факторів, які можуть робити вагомий внесок у розвиток і перебіг даного захворювання.
Одним з таких факторів є вітамін D, щодо якого більшість населення планети, включно з жінками в постменопаузі, перебуває в стійкому дефіциті. Дана епідеміологічна ситуація дає підстави для вивчення ролі вітаміну D у сценарії розвитку злоякісних пухлин різних локалізацій, а саме раку молочної залози, колоректального раку, раку передміхурової залози, меланоми й раку шкіри, раку легені, сарком м’яких тканин і кісток, раку підшлункової залози тощо.
Вітамін D — жиророзчинний вітамін, що має стероїдне походження й відіграє основну роль у підтриманні гомеостазу кальцію в організмі (класичний ефект). Вітамін D надходить до організму у вигляді двох форм — холекальциферол (D3) і ергокальциферол (D2) — з продуктами харчування рослинного і тваринного походження, однак переважна більшість вітаміну D, а саме холекальциферолу (D3), синтезується ендогенно з 7-дегідрохолестерину в шкірі під час дії ультрафіолетового випромінювання сонця. Далі в організмі відбувається гідроксилювання вітаміну D, що проходить у два послідовні етапи: перший — у печінці, де утворюється 25-гідроксивітамін (25(OH)D) — основний циркулюючий метаболіт, а другий — в нирках, де під дією ферменту 1-α-гідроксилази (CYP27B1) утворюється 1,25(OH)2D, відомий як кальцитріол, що є активною формою вітаміну D і здійснює всі ефекти через внутрішньоклітинні рецептори вітаміну D (VDR), які разом з естрогеновими, прогестероновими й андрогеновими рецепторами входять до складу ядерного сімейства регуляторів транскрипції стероїдних гормонів. На сьогодні, крім класичного ефекту, виділяють й інші (некласичні) ефекти вітаміну D. До найбільш відомих некласичних ефектів кальцитріолу належать протизапальна, антипроліферативна й проапоптозна дія вітаміну. Протизапальна дія кальцитріолу обумовлена блокуванням ферменту циклооксигенази-2, що призводить до пригнічення синтезу простагландинів. Встановлено, що VDR відповідають за експресію близько 200 генів, які впливають на диференціацію клітин, їх проліферацію та апоптоз [2–5]. Важливу роль в активації VDR відіграють ферменти — CYP27B1 (забезпечує гідроксилювання в нирках) і CYP24A1 (відповідає за руйнування як 25(ОН)D, так і 1,25(OH)), які метаболізують кальцитріол. В експериментальних дослідженнях виявлено, що під час розвитку пухлинного процесу баланс між цими ферментами порушується, що призводить до нівелювання протипухлинних ефектів, які опосередковані активацією VDR [6, 7]. Численні дослідження показали, що 1,25(OH) і його аналоги сповільнюють ріст пухлинних клітин, в основному в G0/G1 фазі клітинного циклу шляхом індукування апоптозу. Крім цього, 1,25(OH) пригнічує ангіогенез, клітинну адгезію і міграцію, а отже, зменшує експансію пухлинних клітин [8, 9].
Класичним місцем синтезу вітаміну D є нирки, проте кишечник, молочна залоза, простата також можуть експресувати 1-α-гідроксилазу (CYP27B1) і синтезувати 1,25(OH) у так званий автокринний спосіб [10]. Особливістю цього процесу є те, що гідроксилювання 25(ОН)D поза нирками не регулюється паратгормоном і фактором росту фібробластів [3, 8].
З урахуванням вищенаведених фізіологічних ефектів вітаміну D цілком очевидно, що наявність експресії VDR є передумовою протипухлинного ефекту 1,25(OH) [5, 6], а підтримання нормального рівня 25(OH)D у сироватці крові є необхідним для здійснення не лише класичних функцій вітаміну D (метаболізм мінералів в кістках), але й регуляції клітинної проліферації і диференціації. Це, у свою чергу, дозволяє припустити, що при РМЗ рівень вітаміну D, а саме його активного метаболіту 25(ОН)D, є досить показовим, оскільки відображає сумарний вміст ендогенного й екзогенного вітаміну D [3–6]. Важливо розуміти, що на концентрацію сироваткового вітаміну D впливає безліч факторів, таких як вік, індекс маси тіла (ІМТ), менструальний статус, тютюнопаління, етнічна й расова приналежність, рівень інсоляції, фізична активність, вагітність, лактація, колір шкіри, сімейний анамнез РМЗ, додаткове вживання вітаміну D у вигляді дієтичних добавок, час забору крові. Тому при визначенні впливу сироваткового рівня вітаміну D на канцерогенез РМЗ потрібно враховувати ці фактори [3, 11, 12]. Оскільки на даний час ведуться суперечки з приводу рівнів вітаміну D, які вважаються достатніми, недостатніми й дефіцитними, у даному огляді будуть розглянуті лише ті дослідження, у яких рівень < 20,0 нг/мл визначається як дефіцитний, 20,0–29,9 нг/мл — як недостатній, ≥ 30,0 нг/мл — як достатній відповідно.
З огляду на ріст захворюваності на РМЗ і поширеність дефіциту вітаміну D даний літературний огляд буде присвячений питанням зв’язку між концентрацією сироваткового вітаміну D і ризиком розвитку й прогнозом перебігу РМЗ.
Зв’язок між дефіцитом вітаміну D і ризиком розвитку РМЗ
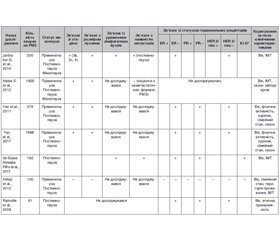
Роль вітаміну D як фактора ризику розвитку раку молочної залози до сьогодні остаточно не з’ясована. Через складність епідеміологічних і популяційних досліджень у літературі немає однозначної думки щодо зв’язку між рівнем 25-гідроксивітаміну й ризиком розвитку раку молочної залози. У табл. 1 наведено результати епідеміологічних досліджень з вивчення впливу рівня сироваткового вітаміну D на ризик виникнення РМЗ [11–17].
/22.jpg)
/23.jpg)
У багатоетнічному когортному дослідженні «випадок — контроль» Y. Kim і співавт. (2014) вивчали взаємозв’язок між сироватковим рівнем вітаміну D і ризиком розвитку РМЗ. У дослідження включено 36 458 жінок п’яти расових/етнічних груп (білі, афроамериканці, корінні гавайці, японці й латиноамериканці), з яких 707 — жінки в постменопаузі, які на момент включення в дослідження проживали на Гаваях і в Лос-Анджелесі. Використовуючи умовні моделі логістичної регресії, виявили обернено-пропорційний зв’язок між дефіцитом вітаміну D і розвитком раку молочної залози в постменопаузі лише серед білошкірих жінок, а в інших расових/етнічних групах такої залежності не виявлено. Особливе це дослідження тим, що воно показує роль дефіциту вітаміну D як фактора ризику розвитку РМЗ не лише в жінок з білою шкірою, як переважна більшість досліджень, але й у жінок інших расових/етнічних груп. Середній час між забором крові й виникненням раку молочної залози становив близько 3 років. Результати даного дослідження дають можливість припустити, що білі жінки мають більш виражений поліморфізм ядерних VDR або що світла шкіра в комбінації з частим перебуванням на сонці підвищує рівень синтезу вітаміну D3, що, у свою чергу, зменшує ризик розвитку РМЗ [14].
Р. Chen і співавт. (2013) у дослідженні «випадок — контроль» оцінювали зв’язок сироваткового рівня 25(OH)D з ризиком виникнення РМЗ у 593 пацієнток з карциномою молочної залози та 580 здорових жінок із Шанхаю (Китай). У дослідженні виявлено, що 80 % здорових жінок мали дефіцит вітаміну D (менше від 20 нг/мл), а 15,2 % — легкий дефіцит (20–30 нг/мл), і лише 4,8 % жінок мали достатній рівень вітаміну D (> 30 нг/мл), тоді як серед хворих на РМЗ дефіцит вітаміну D зафіксовано у 96,1 %, легкий дефіцит і достатній рівень 25(OH)D — у 3,2 і 0,7 % відповідно. Після проведення аналізу отриманих даних встановлено, що порівняно з пацієнтами з найнижчим рівнем сироваткового 25(OH)D жінки з найвищим рівнем вітаміну D демонстрували значне зниження ризику раку молочної залози (Q4 проти Q1: співвідношення шансів (СШ) = 0,10; 95% довірчий інтервал (ДІ): 0,06–0,15) і збільшення рівня 25(ОН)D у плазмі крові на 1 нг/мл призводило до зниження ризику виникнення РМЗ на 16 % (СШ = 0,84; 95% ДІ: 0,81–0,87; P < 0,001). Тобто жінки з нормальним або високим рівнем сироваткового вітаміну D мають нижчий ризик розвитку раку молочної залози порівняно з жінками, які мають виражений дефіцит. Усі показники оцінювались з поправкою на вік, ІМТ, прийом оральних контрацептивів, сезон року, менструальний статус, час настання менархе, сімейний анамнез раку молочної залози [12].
U. Shamsi та співавт. (2020) оцінювали зв’язок концентрації 25(OH)D у сироватці крові, вживання вітаміну D та інсоляції на ризик виникнення РМЗ у пацієнток, які звертались до двох лікарень у Карачі (Пакистан). Усього було обстежено 1195 жінок: 411 хворих на РМЗ і 784 жінки без жодних злоякісних пухлин, які становили контрольну групу. Дефіцит вітаміну D (< 20 нг/мл) зафіксовано в 67,7 % хворих на РМЗ і 56,7 % жінок контрольної групи. У дослідженні виявлено, що жінки з дефіцитом сироваткового 25(OH)D (< 20 нг/мл) мали вищий ризик РМЗ (СШ = 1,65; 95% ДІ: 1,10–2,50) порівняно з пацієнтами з достатньою кількістю вітаміну D у сироватці крові (> 30 нг/мл). У жінок, які в анамнезі приймали вітамін D за рік до включення в дослідження, зафіксовано протективний ефект щодо РМЗ (СШ = 0,32; 95% ДІ: 0,24–0,43) [18].
N. Estébanez і співавт. (2018) провели метааналіз 68 досліджень, опублікованих між 1998 і 2018 роками, які вивчали взаємозв’язок між вітаміном D і раком молочної залози. Дане дослідження виявило протективний вплив 25(OH)D у когортних дослідженнях (відносний ризик 0,85; 95% ДІ: 0,74–0,98) і дослідженнях «випадок — контроль» (СШ = 0,65; 95% ДІ: 0,56–0,76). Вітамін-D-асоційоване зниження ризику розвитку РМЗ залежно від менструального статусу зафіксовано лише в дослідженнях «випадок — контроль» у жінок в пременопаузі (СШ = 0,67; 95% ДІ: 0,49–0,92). Також не було знайдено доказів впливу споживання вітаміну D на ризик розвитку РМЗ [19].
Дослідження Alipour et al. (2014), яке включало 672 жінки, серед яких було 136 хворих на РМЗ (гістологічно 4 — карцинома in situ, 132 — інвазивна протокова). Результати рівня сироваткового вітаміну D хворих на РМЗ порівнювались із результатами жінок з доброякісними захворюваннями молочної залози й контрольною групою, яка включала здорових жінок. Дефіцит вітаміну D оцінювався з поправкою на вік, менструальний статус, час перших пологів, анамнез грудного вигодовування й сімейний анамнез раку молочної залози. У результаті різниця вмісту між доброякісними випадками й контрольною групою, а також між доброякісними та випадками раку не була статистично значущою [10].
Простежено невідповідність між результатами досліджень, що може бути свідченням неправильно підібраної групи, неврахування супутніх позаклінічних факторів, що впливають на концентрацію сироваткового вітаміну D (вік, менструальна функція, наявність/відсутність вагітностей, фізична активність, куріння, вживання алкоголю, вітамінних добавок, оральних контрацептивів), методики вимірювання 25(ОН)D, сезону, території проживання, рівня інсоляції, етнічної і расової приналежності, дизайну дослідження [18, 20]. Для об’єктивної оцінки впливу вітаміну D на розвиток РМЗ необхідно враховувати шляхи метаболізму основних форм вітаміну D в організмі. Так, холекальциферол (D3) синтезується переважно в результаті УФ-опромінення шкіри й частково надходить з продуктами харчування. У свою чергу ергокальциферол (D2) надходить в організм лише з продуктами харчування або у вигляді добавок [14]. Тому при оцінці рівня вітаміну D як фактора ризику раку молочної залози необхідно при виборі груп пацієнтів звертати увагу на колір шкіри, рівень інсоляції, чутливість шкіри до неї, характер харчування, вживання дієтичних добавок, оскільки саме ці фактори визначають метаболізм основних двох форм вітаміну D і можуть істотно вплинути на гетерогенність досліджень.
Зв’язок між концентрацією сироваткового вітаміну D і характеристиками пухлини
Оскільки остаточної думки щодо ролі вітаміну D як фактора ризику розвитку раку молочної залози у літературі так і не було сформовано, дослідники акцентували увагу на оцінці вітаміну D як фактора прогнозу в жінок, які страждають від РМЗ. Так, за останні 20 років література містить чималу кількість праць, що оцінюють кореляційний зв’язок між рівнем сироваткового вітаміну D і факторами прогнозу перебігу РМЗ, такими як розмір пухлини, ураження лімфатичних вузлів, стадія, молекулярний тип пухлини тощо. Однак серед наукових публікацій спостерігається дисоціація, оскільки наявні дослідження, що підтверджують цей зв’язок, а є і такі, що спростовують.
У перехресному дослідженні G. Janbabai та спів–авт. (2016) за участю 200 пацієнток з раком молочної залози дефіцит 25(OH)D (< 20 нг/мл) зафіксовано в 122 (61 %) хворих. Було показано, що низький рівень сироваткового вітаміну D корелює з несприятливими клініко-патологічними прогностичними факторами, такими як пізня стадія (ІІІВ, ІІІС і ІV), великий розмір пухлини, ураження лімфатичних вузлів (4–9 лімфатичних вузлів або понад 9), незалежно від менструального статусу на момент постановки діагнозу. У даному дослідженні також було оцінено зв’язок між факторами прогнозу перебігу РМЗ і менструальним статусом. Отже, було виявлено, що взаємозв’язок між дефіцитом вітаміну D і стадією захворювання й ураженням лімфатичних вузлів існує лише в пацієнток у постменопаузі. Щодо рецепторів стероїдних гормонів і статусу HER2/neu, найнижчий рівень вітаміну D спостерігається при ER- і HER2/neu-негативних пухлинах, у жінок у пременопаузі — 19,7 і 19,85 % відповідно [21].
У когортному дослідженні S. Hatse і співавт. (2012), яке включало 1800 пацієнтів з первинним інвазивним неметастатичним РМЗ, дефіцит 25(OH)D (< 20 нг/мл) зафіксовано в 583 (32,4 %) хворих, аналогічно до попереднього дослідження було виявлено негативну кореляцію рівня сироваткового вітаміну D з розміром пухлини. Інші характеристики пухлини (ураження лімфатичних вузлів, статус гормональних рецепторів і НЕR2/neu) не корелювали із сироватковим рівнем вітаміну D. Важливою особливістю цього дослідження є те, що до нього були включені жінки з мульти- й уніфокальними пухлинами молочної залози, у яких також оцінювався статус вітаміну D. З метою визначення кореляції між рівнем 25(ОН)D у сироватці крові й розміром пухлини було перевірено ефект взаємодії між кількістю пухлинних вогнищ і їх розміром. Цей ефект виявився несуттєвим, оскільки рівень сироваткового вітаміну D був однаковим для пацієнтів з уніфокальними й мультифокальними пухлинами. Крім того, встановлено, що у хворих сироватковий рівень 25(ОН)D > 30 нг/мл асоціюється з кращими показниками загальної виживаності незалежно від менструального статусу, а в пацієнток у постменопаузі високий рівень вітаміну D (> 30 нг/мл) покращує показники специфічної виживаності й тривалість інтервалу без ознак захворювання [22].
У дослідженні «випадок — контроль» S. Yao та спів–авт. (2011) взяли участь 579 хворих на РМЗ і 574 здорові жінки, які відповідали дослідній групі за віком і часом забору крові для дослідження. Усіх хворих розподілено за менструальним статусом при визначенні рівня сироваткового вітаміну D. У досліджені не було встановлено залежності між гістологічним типом пухлини й рівнем 25(ОН)D у жінок як пременопаузального, так і постменопаузального періодів. Однак при визначенні залежності між вітаміном D і молекулярним підтипом пухлини в жінок незалежно від менструального статусу визначався найнижчий рівень сироваткового 25(ОН)D при тричі негативному РМЗ, причому в пацієнток, які перебувають у пременопаузі, цей рівень виявився найнижчим (17,5 нг/мл), на відміну від хворих на люмінальний A РМЗ (24,5 нг/мл). Негативна кореляція простежувалась між рівнем 25(ОН)D і розміром пухлини, а саме: найнижчий рівень серед жінок у пременопаузі визначався при ІІІВ, ІІІС і ІV стадіях, у пацієнтів, що перебувають у постменопаузі, — при ІІІА стадії. Також було простежено тенденцію, що в жінок в пременопаузі з інвазивним раком молочної залози та ЕR-негативним був більш низький рівень сироваткового вітаміну D порівняно з хворими з ЕR-позитивним раком. Серед хворих на неінвазивний РМЗ найвищий рівень сироваткового вітаміну D мають пацієнти в пременопаузі (28,9 нг/мл) [23].
У 2017 р. S. Yao і співавт. опублікували результати дослідження, присвяченого асоціації вітаміну D з клінічними, морфологічними й молекулярними характеристиками пухлини. Це був когортний аналіз, який включав 1666 жінок з люмінальними й нелюмінальними підтипами пухлин РМЗ, розподілених залежно від менструального статусу. У результаті визначення рівня сироваткового вітаміну D було встановлено зв’язок між стадією і ступенем диференціювання пухлини та сироватковим рівнем 25(ОН)D. Залежність між сироватковим вітаміном D і молекулярними варіантами пухлини була аналогічною з попереднім дослідженням — найнижчий рівень спостерігався при тричі негативному раку в жінок у пременопаузі (18,7 нг/мл) [20, 23].
Дослідження В. de Sousa Almeida-Filho і співавт. (2017) серед 192 бразильських жінок у постменопаузі, хворих на РМЗ, показали негативну кореляцію вітаміну D з гістологічним типом, ступенем диференціювання пухлини, стадією, статусом реґіонарних лімфатичних вузлів, гормональним статусом пухлини (ER, PR), експресією HER2/neu та індексом проліферації пухлини (Ki-67). Серед молекулярних підтипів найвищий рівень сироваткового вітаміну D спостерігався при люмінальному А та В типах, найнижчий — при тричі негативному. Також досліджувався показник Кі-67, високі значення якого корелювали з низьким рівнем 25(ОН)D [24].
У дослідженні S. Imtiaz і співавт. (2012), яке включало 100 жінок, було встановлено, що в жодної пацієнтки з РМЗ не було оптимального рівня сироваткового вітаміну D. Найнижчий рівень 25(ОН)D спостерігався в пацієнток з ІІІ і ІV стадією захворювання. Суттєвої залежності між молекулярним підтипом РМЗ і концентрацією вітаміну D не було виявлено, оскільки всі пацієнти мали дефіцит, тому статистично важливу різницю простежити було неможливо. Також в дослідженні було виявлено, що в пацієнтів у постменопаузі дефіцит вітаміну D більш виражений порівняно з пацієнтами в пременопаузі, що може бути пов’язано з остеопенією або остеопорозом і в подальшому може бути фактором ризику виникнення та/або перебігу РМЗ [25].
У дослідженні L. Peppone та співавт. (2012) було встановлено, що найнижчий рівень вітаміну D мають жінки з тричі негативним раком молочної залози, при цьому більшість хворих на РМЗ мали дефіцит вітаміну D [26]. Дослідження С. Rainville і співавт. (2009) також показує зв’язок дефіциту вітаміну D з тричі негативним раком молочної залози. У це дослідження було включено 91 пацієнтку з РМЗ, серед яких було 15 пацієнток із тричі негативним молекулярним підтипом. У результаті було встановлено, що 54 (59 %) пацієнтки з 91 мали знижений рівень сироваткового вітаміну D, а саме < 32 нг/мл, а 13 (87 %) з 15 випадків тричі негативного РМЗ мали найнижчі показники серед усієї групи (< 23 нг/мл) [27].
Результати вищенаведених досліджень систематизовані в табл. 2.
Вплив статусу рецепторів вітаміну D на розвиток і перебіг раку молочної залози
Після отримання даних про вплив вітаміну D на розвиток і прогноз перебігу злоякісних пухлин цілком логічним кроком була оцінка статусу VDR, оскільки саме їх експресія впливає на виконання всіх властивих вітаміну D функцій.
У дослідженні The Malmö Diet and Cancer Study L. Huss і співавт. (2019) показали статистично значущий взаємозв’язок між відсутністю експресії VDR клітинами пухлини й наявністю несприятливих прогностичних факторів. Так, було обстежено 17 035 жінок, у яких протягом 1996–2007 років був встановлений діагноз РМЗ, виняток становили жінки з карциномою in situ, наявністю віддалених метастазів, двостороннім ураженням молочних залоз. У результаті під час фарбування клітин пухлин і прилеглих тканин було виявлено, що VDR експресуються в ядрі, на поверхні ядерної мембрани, в цитоплазмі й на поверхні клітинної мембрани переважно клітин пухлини, а в прилеглих тканинах експресія практично відсутня. Через складність інтерпретації великого масиву даних у подальшому оцінювалась лише експресія VDR у цитоплазмі та ядрі пухлинних клітин, які позначались як позитивні й негативні. У результаті було виявлено, що найбільша кількість негативних VDR у ядрах спостерігається при тричі негативних пухлинах, а найменша — при люмінальних А та В типах. Аналогічна ситуація була при розподілі експресії VDR у цитоплазмі, що також встановило статистично значиму асоціацію з експресією HER2/neu, оскільки жодна пухлина в групі з низькою цитоплазматичною експресією не була HER2/neu позитивною [28].
У своєму дослідженні J. Al-Azhri та співавт. (2017) показали таку ж залежність між рівнем експресії VDR і молекулярним типом РМЗ. Їх дослідження включало 1188 хворих на РМЗ, серед яких було визначено, що найнижчий рівень ядерних VDR мають тричі негативні карциноми. Окрім цього, дослідження встановило статистично значущу залежність між високим показником Кі-67 і низьким рівнем експресії VDR саме в жінок, старших від 50 років [29].
На особливу увагу заслуговує дослідження N. Lopes і співавт. (2010), що порівнювало рівні експресії VDR у пацієнток з інвазивним раком молочної залози, карциномою in situ, доброякісними новоутвореннями. Було встановлено, що найвищий рівень експресії VDR мали жінки з доброякісними новоутвореннями, а в пухлинних клітинах поряд з низькою експресією VDR спостерігається високий рівень ферменту, що метаболізує вітамін D, а саме CYP24A1 [30].
У дослідженні А. Zati Zehni та співавт. (2019) було доведено статистично значущу кореляцію між гістологічним типом пухлини, стадією, ураженням лімфатичних вузлів і рівнем експресії VDR. Було з’ясовано, що високодиференційовані пухлини, розмір пухлини до 2 см (Т1), відсутність ураження лімфатичних вузлів (N0) найбільш часто асоціюються з більшою кількістю позитивних ядерних VDR. Особливістю цього дослідження було те, що такий зв’язок оцінювали в пацієнтів з уні- та мультифокальними пухлинами. У результаті зв’язок, який був описаний вище, був простежений лише в пацієнтів з уніфокальними пухлинами. На противагу цьому пацієнти з мультифокальними пухлинами, у яких була висока експресія VDR, мали гірший прогноз і в подальшому — більшу частоту розвитку рецидиву [31].
Отже, у вищеперерахованих дослідженнях можна простежити відсутність збігу результатів, але всі вони показують, що наявність експресії VDR у клітині пухлини пов’язана з більш сприятливим прогнозом перебігу РМЗ.
Вплив концентрації сироваткового вітаміну D на лікування раку молочної залози
Питання впливу вітаміну D на ефективність лікування раку молочної залози вкладається в поняття метаболізму кальцитріолу й виконання ним його типових функцій. Оскільки кальцитріол пригнічує експресію гена, що кодує ароматазу (CYP19A1) — фермент, який бере безпосередню участь в синтезі естрогену з попередників андрогенів, і супресує ERα ядерний рецептор, що відповідає за експресію естрогену, особливо виражений зв’язок між рівнем сироваткового вітаміну D і його метаболітів можна простежити серед гормон-залежних форм РМЗ. Численні дослідження показали, що експресія ароматази при РМЗ вища, ніж у нормальній тканині молочної залози, що пояснює естроген-залежний ріст пухлини. Крім цього, кальцитріол відіграє важливу роль в експресії ароматази в кістках шляхом активування остеобластів [2, 32, 33].
Як відомо, яєчники є основним джерелом естрогену в організмі жінки пременопаузального періоду. Однак після менопаузи позагонадним місцем синтезу естрогенів є молочна залоза й жирова тканина [32, 33].
Дослідження V. Aruna та співавт. (2019) на зразках пухлинних тканин раку молочної залози показали, що поєднана дія інгібіторів ароматази (ІА) і кальцитріолу сприяє кращому терапевтичному ефекту в естроген-чутливих пухлинах. Оскільки інгібітори ароматази знижують рівень естрогенів не тільки в пухлині, але й в усьому організмі, це має негативне значення для кісток, які для свого гомеостазу вимагають наявності достатньої кількості естрогену. Отже, одночасний прийом ІА з кальцитріолом запобігає остеопорозу, оскільки він знижує експресію ароматази в молочній залозі при одночасному підвищенні в кістках. Також це дослідження показало, що кальцитріол інгібує експресію ERα ядерного рецептора в ракових клітинах [33].
Дослідження J. Qamar і співавт. (2010) показало, що прийом вітаміну D3 у дозі 50 000 МО разом з ІА в ад’ювантному режимі запобігає розвитку артралгій, викликаних ІА. У даному дослідженні взяли участь 60 пацієнток із РМЗ на старті прийому летрозолу. Вимірювання сироваткового рівня вітаміну D було здійснено до початку прийому, через 4, 10 і 16 тижнів. На старті всі пацієнтки демонстрували дефіцитний рівень 25(OH)D (< 20 нг/мл). Однак після 12 тижнів прийому летрозолу в комбінації з добавками вітаміну D3 рівень 25(OH)D у більшості жінок становив > 66 нг/мл, що супроводжувалось відсутністю скарг на артралгії [34].
D. Prieto-Alhambra та співавт. (2011) у своєму дослідженні за участі 290 жінок, які починали приймати ІА, встановили рівень сироваткового вітаміну D, який може запобігти розвитку артралгій на фоні прийому ІА. Був призначений щоденний прийом вітаміну D3 у дозі 800 МО пацієнтам з нормальним рівнем вітаміну D і додатково 16 000 МО — пацієнтам з вихідним рівнем 25(OH)D < 30 нг/мл. Було з’ясовано, що вживання протягом 3 місяців вітаміну D у дозі 800 МО хворими без вихідного дефіциту і 16 000 МО — з вихідним дефіцитом вітаміну D запобігало виникненню артралгій [35].
Оскільки метаболізм кальцію відіграє важливу роль у пацієнтів з метастазами РМЗ у кістки, питання впливу кальцитріолу на перебіг захворювання залишається відкритим. Основним препаратом вибору для таких пацієнтів залишаються бісфосфонати, прийом яких супроводжується гіпокальціємією і вторинним гіпопаратиреозом [36, 37].
Дослідження, проведені серед таких пацієнток, показали двозначний ефект. E. Amir і співавт. (2009) продемонстрували, що щоденний прийом 400 МО холекальциферолу серед 46 пацієнтів з метастазами РМЗ не запобігає порушенню метаболізму кальцію і такої дози недостатньо для уникнення розвитку вторинного гіпопаратиреозу. При цьому показник сироваткового вітаміну D у більшості пацієнтів перебував на субоптимальному рівні (< 30 нг/мл) [36].
Ретроспективне дослідження М. Tanaka та співавт. (2018) показало позитивний вплив одночасного прийому бісфосфонатів і препаратів вітаміну D після прийому ІА в ад’ювантному режимі. Так, у дослідження було включено 96 пацієнток, серед яких 46 — жінки в постменопаузі з ER-позитивним РМЗ, які після прийому ІА мали знижену щільність кісткової тканини (за даними денситометрії, Т-критерій становив менше за 2,5), а інша частина — пацієнтки з первинним постменопаузальним остеопорозом. Усім жінкам кожного місяця вводили бісфосфонати й вітамін D. У результаті моніторинг протягом 24 місяців показав, що така комбінація призводить до підвищення кісткової щільності в обох групах за результатами денситометрії [38].
Дослідження А. Charehbili та співавт. (2016) показали, що рівень сироваткового вітаміну D у хворих на РМЗ, які отримували неоад’ювантну хіміотерапію, був значно нижчим порівняно з вихідним (< 30 нг/мл), а в пацієнтів з вищим рівнем сироваткового вітаміну D терапевтичний ефект проведеної хіміотерапії був значно кращим [39]. Таке дослідження дає підстави для вибору рівня сироваткового вітаміну D як індикаторного показника моніторингу стану пацієнтів протягом лікування як у неоад’ювантному, так і в ад’ювантному режимах.
Враховуючи результати наведених досліджень, можна простежити вагомий вплив вітаміну D на терапевтичний ефект хіміо- та гормонотерапії, а також терапії бісфосфонатами при РМЗ.
Взаємозв’язок між концентрацією вітаміну D і виживаністю хворих
У дослідженні S. Hatse та співавт. (2012), яке згадувалось вище, простежувався також зв’язок між рівнем сироваткового вітаміну D і смертністю від РМЗ. Середній період спостереження за пацієнтами становив 4,7 року, протягом яких відбулись 64 смерті від РМЗ. У результаті була підтверджена обернена кореляція між сироватковим рівнем 25(ОН)D і ризиком смерті, що статистично не залежала від менструального статусу [22].
Проспективне когортне дослідження H. Maalmi та співавт. (2014) показало, що рівень сироваткового вітаміну > 75 нмоль/л (> 30 нг/мл) корелює зі зниженням смертності від раку молочної залози [40].
Дослідження P.J. Goodwin і співавт. (2009) серед 512 хворих на ранній РМЗ показало, що при медіані спостереження 11,6 року померло 106 (20,7 %) жінок, а 116 (22,7 %) мали віддалений рецидив. Зв’язок між рівнем вітаміну D і безрецидивною виживаністю був скоригований за такими показниками: вік, стадія захворювання, ураження лімфатичних вузлів, статус рецепторів естрогену, гормонотерапія і хіміотерапія. У результаті було встановлено, що низький рівень сироваткового вітаміну D корелює з підвищеним рівнем рецидиву [41].
Дослідження S. Mohr і співавт. (2014) і S. Thanasitthichai та співавт. (2019) [7, 42] показують зв’язок між тривалішою безрецидивною виживаністю хворих на РМЗ і високим рівнем 25(ОН)D у сироватці крові. На особливу увагу заслуговує когортне дослідження S. Thanasitthichai та співавт. (2019), проведене в Таїланді, де 303 хворих на РМЗ (вік від 24 до 78 років) підлягали спостереженню протягом 7 років. У результаті було встановлено, що група пацієнток з низьким рівнем сироваткового вітаміну D на момент постановки діагнозу (< 16 нг/мл) статистично мала найбільший ризик смертності, ніж група з високою концентрацією 25(ОН)D (> 16 нг/мл) у сироватці крові [42].
Дослідження S.T. Lim і співавт. (2015) серед 469 жінок Кореї, хворих на рак молочної залози, показало, що пацієнти з несприятливими факторами прогнозу перебігу захворювання й старшого віку, але з достатнім рівнем сироваткового вітаміну D мали кращий прогноз РМЗ і виживаність (період спостереження становив 85,8 ± 31,0 міс.) порівняно з групою, яка мала сприятливий прогноз перебігу, але стійкий дефіцит вітаміну D [43].
Результати досліджень А. Ismail і співавт. (2018) і А. Vrieling і співавт. (2014) показують аналогічні результати впливу дефіциту вітаміну D на виживаність хворих із РМЗ [44, 45].
Обговорення
Проблема зв’язку дефіциту вітаміну D і раку молочної залози — це актуальне питання, яке залишається значною мірою невирішеним остаточно в усіх аспектах (ризик виникнення, фактори прогнозу, ефективність лікування, виживаність). У даному літературному огляді, що включав дослідження, які розрізнялися за дизайном і вибіркою, була зроблена спроба систематизувати результати, отримані впродовж останніх років з даної теми. Неоднорідність таких досліджень є виправданою, оскільки створити популяційне дослідження, що змогло б стати універсальним на всіх континентах планети, практично неможливо, адже кожна територія проживання зі своїми кліматичними характеристиками, включно з інсоляцією, етнічними й расовими особливостями характеризується різними показниками сироваткового вітаміну D, який прийнято розцінювати як достатній, і це автоматично не може вирівняти результати досліджень і зробити їх шаблоном для всього населення планети. Дефіцит або недостатній рівень 25(OH)D у сироватці крові, що супроводжує розвиток раку молочної залози, не може бути остаточно визнаним фактором ризику даного захворювання, оскільки література нараховує чималу кількість досліджень, які спростовують цю гіпотезу. Основними характеристиками таких досліджень, що можуть ставити під сумнів правильність та об’єктивність результатів, є несвоєчасний забір крові, сезон, що визначає інсоляцію і характер харчування, вихідний рівень вітаміну D, неврахування інших позаклінічних факторів (вік, менструальна функція, наявність/відсутність вагітностей, фізична активність, куріння, вживання алкоголю, вітамінних добавок, оральних контрацептивів, сімейний анамнез РМЗ), кількість жінок, включених у дослідження, їх етнічна й расова приналежність, правильно підібрана група контролю, дизайн дослідження, тривалість спостереження. Коригування всіх цих факторів з дефіцитом вітаміну D і ризиком розвитку раку молочної залози не завжди є можливим, а, отже, і відсутність однозначності результатів цих досліджень є цілком очікуваним явищем.
Щодо розбіжностей кореляційного зв’язку між низьким/дефіцитним рівнем вітаміну D і факторами прогнозу перебігу РМЗ, то, можливо, мають місце ті ж причини в комбінації з тяжкістю тривалого моніторингу за пацієнтами.
На особливу увагу заслуговують дослідження, спрямовані на оцінку статусу рецепторів вітаміну D у клітинах пухлини. Результати досліджень однозначно вказують на зв’язок малої кількості/відсутності VDR із гіршими прогностичними факторами раку молочної залози і його молекулярними варіантами. Це, у свою чергу, може бути розглянуто як терапевтична мішень супресорного впливу для лікування таких підтипів РМЗ, що не мають своєї прикладної точки, — тричі негативний РМЗ.
Що стосується лікування, то вплив рівня сироваткового вітаміну D пояснюється кращим кумулятивним ефектом при одночасному застосуванні інгібіторів ароматази з препаратами кальцитріолу при гормон-залежному РМЗ. Також дослідження показують, що при метастазах РМЗ у кістки вживання вітамінних добавок у комбінації з бісфосфонатами сприяє підвищенню кісткової щільності, що, у свою чергу, робить вагомий внесок у ліквідацію остеопорозу й артралгій у пацієнток переважно постменопаузального періоду.
Незважаючи на суперечливі результати досліджень, більшість з них все ж показує зв’язок недостатнього рівня вітаміну D з ризиком розвитку РМЗ, його прогностичними факторами, виживаністю й результатами лікування. Тому обраний вектор наукових пошуків є раціональним як щодо ліквідації пандемії дефіциту вітаміну D серед населення планети, так і щодо запобігання поширеності РМЗ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 20.01.2021
Рецензовано/Revised 01.02.2021
Прийнято до друку/Accepted 03.02.2021

/22.jpg)
/23.jpg)
/26.jpg)