Введение
Известно, что болезнь Паркинсона (БП) и рассеянный склероз являются распространенными прогрессирующими патологиями центральной нервной системы (ЦНС), развитие которых приводит к инвалидизации пациентов [1, 2]. Факты встречаемости рассеянного склероза не только у молодых, но и у лиц старше 45 лет, а также преимущественного выявления БП у пожилых людей указывают на связь этих заболеваний с возрастом. Нарушения функционального состояния ЦНС при БП и рассеянном склерозе характеризуются двигательными, эмоциональными, вегетативными и когнитивными проявлениями [1, 2]. Важную роль в развитии таких нарушений нервной системы играет оксидативный стресс. Так, по данным авторов, свободные радикалы и активные формы кислорода повреждают дофаминергические нейроны черной субстанции головного мозга и миелин нервных окончаний [3, 4]. Нами показана сопряженность развития оксидативного стресса в головном мозге и выраженных изменений двигательной, эмоциональной и исследовательской активности животных с экспериментальными моделями паркинсонизма и демиелинизации [5–7].
Использование медикаментозных средств по-прежнему является основным методом лечения пациентов разного возраста с БП и рассеянным склерозом. Вместе с тем длительное применение лекарственных препаратов часто сопровождается значительными побочными метаболическими эффектами [4, 8]. Поэтому представляется важным поиск средств с антиоксидантными свойствами, которые способны одновременно улучшить нарушенное функциональное состояние ЦНС при этих патологиях. Одним из таких средств может быть гормон эпифиза мелатонин, который регулирует биоритмы организма, проявляет антиоксидантные, антиапоптотические, антивоспалительные, иммуномодулирующие и нейротрофические свойства [9, 10]. Важно, что с возрастом при БП/паркинсонизме и рассеянном склерозе содержание мелатонина в циркуляции снижается [10–12]. Нами показано выраженное антиоксидантное, нейропротекторное и ремиелинизирующее действие экзогенного мелатонина у взрослых животных с экспериментальными моделями паркинсонизма и демиелинизации [7, 13]. В то же время у стареющих животных с такими патологиями ЦНС эффекты мелатонина остаются недостаточно исследованными.
Цель — исследовать влияние мелатонина на поведение, факторы оксидативного стресса и антиоксидантной защиты головного мозга стареющих мышей с экспериментальными моделями паркинсонизма и демиелинизации.
Материалы и методы
Животные. Исследования проводили на мышах — самках линии 129/Sv (генотип Н-2b) в возрасте 15–16 мес. (стареющие) из питомника ГУ «Институт генетической и регенеративной медицины НАМН Украины». По нашим данным, мыши линии 129/Sv разного возраста чувствительны к повреждающим эффектам нейротоксинов разной природы [5, 6]. Животных содержали в стандартных условиях вивария при фиксированном режиме освещения 12 : 12. Для получения биологического материала (головной мозг) мышей декапитировали в утреннее время суток под эфирным наркозом. Все экспериментальные исследования проводили согласно закону Украины «О защите животных от жестокого поведения» и «Европейской конвенции по защите позвоночных животных, которые используются с экспериментальной и другой научной целью» (Страсбург, 1986).
Модели. Экспериментальную модель паркинсонизма воспроизводили у стареющих мышей путем подкожного (в область шеи) одноразового введения селективного для дофаминергических нейронов черной субстанции головного мозга нейротоксина 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МФТП) (Sigma, США) в дозе 30 мг/кг [5]. Нами показано, что у стареющих мышей через 18 дней после введения МФТП развиваются морфофункциональные изменения ЦНС [5]. Экспериментальную модель демиелинизации индуцировали у стареющих мышей с помощью ежедневного в течение трех недель приема с пищей (0,2 % от суточного корма) нейротоксина купризона (бис(циклогексанон)-оксалдигидразон) (Sigma, США) [4, 6]. По нашим данным, подобный прием купризона позволяет получить у стареющих мышей линии 129/Sv не только демиелинизирующий, но и нейротоксический эффект [6, 7].
Мелатонин (Sigma, США) вводили стареющим животным внутрибрюшинно, ежедневно в 18:00, из расчета 1 мг/кг: мышам с экспериментальной моделью паркинсонизма — с 7-го до 18-го дня после одноразовой инъекции МФТП; мышам с экспериментальной моделью демиелинизации — с 8-го до 21-го дня купризоновой диеты. Выбор указанных сроков начала введения мелатонина при изучаемых патологиях связан с выявлением уже в этих периодах действия используемых нейротоксинов признаков структурных и функциональных изменений в нервной системе, а также нарушений метаболизма нейромедиаторов [6, 14].
Экспериментальные группы. Стареющих мышей с моделью паркинсонизма разделили на следующие группы (в каждой по 10 животных): интактные животные; мыши контрольной группы, которым вводили МФТП и растворитель мелатонина (0,9% раствор хлорида натрия); мыши, которым вводили МФТП и мелатонин. Стареющих мышей с моделью демиелинизации разделили на такие группы (по 10 особей в группе): интактные, которые находились на обычном рационе вивария; контрольные мыши, получавшие купризон и инъекции растворителя мелатонина; мыши, получавшие купризон и инъекции мелатонина.
На 18-й день после инъекции МФТП и на 21-й день купризоновой диеты, а также одновременно у интактных мышей проводили поведенческие тесты. На следующий день (соответственно 19-й и 22-й день эксперимента) всех мышей декапитировали и извлекали головной мозг для проведения биохимических исследований.
Показатели оксидативного стресса и антиоксидантной защиты. Содержание малонового диальдегида (МДА) в головном мозге определяли по интенсивности цвета триметинового комплекса, образующегося между тиобарбитуровой кислотой и МДА [15]. Активность антиоксидантных ферментов измеряли в супернатанте гомогенатов головного мозга мышей спектрофотометрическим методом (спектрофотометр μQuant, Bio-Tek, США), как нами было описано ранее [5]. Активность супероксиддисмутазы (СОД) определяли по способности фермента угнетать реакцию аутоокисления адреналина (Fluka, Германия) в адренохром при рН 10,2 и выражали в условных единицах из расчета на 1 мг белка за 1 мин. Активность каталазы оценивали по кинетике разрушения Н2О2 (Riedel-deHaën, Германия) и выражали в микромолях утилизованной Н2О2 на 1 мг белка за 1 мин. Активность глутатионпероксидазы (ГП) и глутатионредуктазы (ГР) измеряли по уменьшению никотинамидадениндинуклеотидфосфата (NADPH) в соединенной глутатионредуктазной реакции с добавлением в реактивную смесь соответствующих реагентов (Sigma, США) и выражали в наномолях окисленного NADPH на 1 мг белка за 1 мин. Содержание белка в головном мозге измеряли по методу Лоури.
Поведение у мышей с моделью паркинсонизма исследовали в тестах «открытое поле», на ригидность и в ротарод-тесте, а с купризоновой моделью демиелинизации — в тесте «открытое поле» и ротарод-тесте [16, 17]. Тест «открытое поле» дает возможность оценить у животных горизонтальную двигательную (количество пересеченных квадратов), вертикальную двигательную (количество вертикальных стоек), эмоциональную (число фекальных болюсов) и исследовательскую (количество заглядываний в норки — норковый рефлекс) активность. Длительность тестирования мышей 3 мин. Ротарод-тест позволяет оценить координацию, чувство равновесия и мышечный тонус мышей. Скорость оборотов барабана в установке изменяли последовательно с 10 оборотов в 1 мин (об/мин) (3 V, 300 mA) до 20 об/мин (5 V, 300 mA). Данные представляли в виде суммарного времени (секунды) удержания на валу при 10 и 20 об/мин. Ригидность у животных изучали по изменению длины тела (миллиметры) и походки. Для оценки походки стопы мышей обрабатывали нетоксическими растворами краски разного цвета и по отпечаткам измеряли длину шага, длину и ширину стопы (миллиметры).
Статистическую обработку результатов проводили с помощью t-критерия Стьюдента. Для статистического анализа использовали программу Statistica 7.0 (StatSoft Inc., США).
Результаты
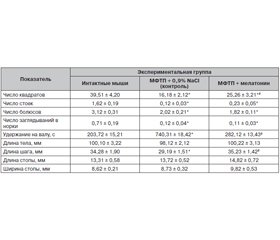
Поведение, факторы оксидативного стресса и антиоксидантной защиты головного мозга стареющих мышей с МФТП-моделью паркинсонизма и их изменения после введения мелатонина. Установлено, что у мышей под влиянием МФТП число квадратов, вертикальных стоек, болюсов, заглядываний в норки, длина шага уменьшались, тогда как время удержания на валу значительно увеличивалось по сравнению с интактными животными (табл. 1). После инъекций мелатонина число квадратов было существенно больше, чем у мышей контрольной группы, однако меньше, чем у интактных животных (табл. 1). Под влиянием экзогенного мелатонина время удержания на валу и длина шага достигали значений показателей интактной группы животных.
/45.jpg)
Содержание МДА в головном мозге стареющих мышей повышалось после введения МФТП, тогда как активность СОД и каталазы снижалась (табл. 2). Инъекции мелатонина привели к существенному снижению содержания МДА, а также повышению активности СОД и каталазы. При этом значения МДА и каталазы соответствуют таковым в интактной группе животных.
Следовательно, под влиянием экзогенного мелатонина у стареющих мышей с МФТП-моделью паркинсонизма наблюдались положительные изменения показателей поведения и баланса факторов оксидативного стресса и антиоксидантной защиты головного мозга.
Поведение, факторы оксидативного стресса и антиоксидантной защиты головного мозга стареющих мышей с купризоновой моделью демиелинизации и их изменения после введения мелатонина. Установлено, что у стареющих мышей с купризоновой диетой число квадратов, стоек, болюсов, заглядываний в норки, а также время удержания на валу меньше, чем у мышей интактной группы (табл. 3). После инъекций мелатонина число квадратов, стоек и болюсов повышалось по сравнению с группой контроля и при этом не отличалось от значений у интактных животных (кроме числа стоек).
Содержание МДА в головном мозге стареющих мышей с купризоновой диетой выше, чем в интактной группе, тогда как активность каталазы и ГП меньше (табл. 4). После введения мелатонина наблюдалось снижение содержания МДА и повышение активности ГП до значений, регистрируемых у интактных животных. В группе мышей с экзогенным мелатонином активность СОД превышала таковую у интактных животных.
Итак, после инъекций мелатонина у стареющих мышей с купризоновой диетой улучшение поведенческих реакций сочеталось со снижением содержания МДА в головном мозге и повышением активности антиоксидантных ферментов.
Обсуждение
Влияние мелатонина на поведение и проявления оксидативного стресса в головном мозге стареющих мышей с МФТП-моделью паркинсонизма. Уменьшение у стареющих мышей под влиянием МФТП двигательной, эмоциональной, исследовательской активности и появление признаков мышечной ригидности может быть связано с повреждением нейротоксином структуры нейронов черной субстанции и других отделов головного мозга [5, 18, 19]. При этом одним из факторов повреждающего влияния МФТП на нервные клетки является МДА, который образуется в результате пероксидации полиненасыщенных жирных кислот и способен вступать в реакцию с нуклеиновыми кислотами, фосфолипидами и аминокислотами [3]. В проведенном эксперименте нами установлено повышение содержания МДА в головном мозге стареющих опытных мышей и, наоборот, снижение активности СОД и каталазы.
В то же время под влиянием мелатонина у стареющих мышей с МФТП-моделью паркинсонизма наблюдается повышение двигательной активности и уменьшение проявлений мышечной ригидности. Мы не исключаем того, что у таких мышей могут происходить положительные изменения структуры нервных клеток. Так, по данным литературы и нашего исследования, у взрослых животных, которым одновременно с нейротоксинами (включая МФТП) вводили мелатонин, улучшение поведенческих реакций сочеталось с повышением числа неповрежденных нейронов в черной субстанции и других отделах головного мозга [13, 20, 21].
Антиоксидантный и антивоспалительный эффекты экзогенного мелатонина — возможные механизмы положительного влияния гормона на функциональное состояние ЦНС у стареющих мышей с МФТП-моделью паркинсонизма. Известно, что при патологических состояниях ЦНС мелатонин действует как прямой и непрямой антиоксидант, влияя в последнем случае на генетический аппарат синтеза антиоксидантных ферментов в клетке [12, 20]. В нашей работе установлено не только снижение содержания МДА в головном мозге таких мышей, но и повышение активности некоторых антиоксидантных ферментов. Авторами показано, что клетки микроглии/макрофаги головного мозга, активированные МФТП, синтезируют провоспалительные цитокины (фактор некроза опухоли альфа, интерлейкин-1β, интерферон-γ) с повреждающим эффектом на нервные клетки [22]. В то же время, по нашим данным, под влиянием экзогенного мелатонина содержание активных макрофагов в головном мозге животных с моделью паркинсонизма существенно снижается [21].
Влияние мелатонина на поведение и проявления оксидативного стресса в головном мозге стареющих мышей с купризоновой моделью демиелинизации.
Нами установлено, что у стареющих мышей с купризоновой диетой двигательная, эмоциональная, исследовательская активность и мышечный тонус уменьшаются. Напротив, введение мелатонина таким мышам приводит к улучшению поведенческих реакций, большинство показателей которых не отличались от таковых в интактной группе. Известно о влиянии мелатонина на дифференцировку нейральных стволовых клеток и синтез нейротрофических факторов в головном мозге мышей с купризоновой моделью демиелинизации [10]. Нами ранее показано, что положительные изменения поведения у стареющих мышей, получавших купризон одновременно с мелатонином, могут быть связаны с усилением нейрогенеза в головном мозге и восстановлением структуры нейронов ЦНС [7].
По мнению авторов, нейропротекторный эффект мелатонина у взрослых животных с демиелинизирующей патологией в значительной степени связан c его антиоксидантными, антивоспалительными и антиапоптотическими свойствами [23]. В данной работе нами установлен антиоксидантный эффект мелатонина и у стареющих мышей с экспериментальной моделью демиелинизации, который характеризовался не только снижением повышенного содержания МДА в головном мозге, но и ростом сниженной активности некоторых антиоксидантных ферментов. Необходимо отметить усиливающий эффект мелатонина на антиоксидантную защиту всего головного мозга, а не только мозжечка, как было ранее установлено [7]. Это важный факт, поскольку купризон оказывает токсическое влияние на нервные клетки многих структур головного мозга, включая мозжечок, кору, гиппокамп и т.д. [4, 6, 7].
В положительном эффекте мелатонина на поведение стареющих мышей с купризоновой диетой важны также его антивоспалительные свойства. Так, нами ранее показано снижение количества активных макрофагов и Т-клеток в головном мозге стареющих мышей, получавших купризон и одновременно инъекции мелатонина [7].
Таким образом, мелатонин оказался эффективным средством, улучшающим функционирование ЦНС стареющих мышей с экспериментальными моделями паркинсонизма и демиелинизации. Общей чертой действия мелатонина при изученных экспериментально-индуцированных патологиях является положительное изменение баланса факторов оксидативного стресса и антиоксидантной защиты головного мозга. При этом эффект гормона на поведение мышей и проявления оксидативного стресса в головном мозге наблюдается в случае его применения уже в ранние сроки действия нейротоксинов.
Выводы
1. У стареющих животных с МФТП-моделью паркинсонизма и токсической купризоновой моделью демиелинизации нарушения функционального состояния ЦНС, оцененные по поведенческим реакциям, сопряжены с повышением в головном мозге содержания МДА и снижением активности антиоксидантных ферментов.
2. Положительное влияние мелатонина на поведение мышей с экспериментально-индуцированными моделями патологии ЦНС в значительной степени опосредовано антиоксидантным эффектом гормона в головном мозге.
3. Мелатонин можно рассматривать как перспективное патогенетическое средство в терапии функциональных расстройств ЦНС при паркинсонизме и демиелинизирующей патологии в стареющем организме.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Информация о финансировании: исследования выполнены по бюджетной теме № 0119U000087 при финансовой поддержке НАМН Украины.
Получено/Received 01.02.2021
Рецензировано/Revised 15.02.2021
Принято в печать/Accepted 19.02.2021
Список литературы
1. Karaban I.N., Karaban N.V., Karasevych N.V. The ways of neuroprotection in Parkinson’s disease. International neurogical journal. 2011. № 6 (44). P. 95-99.
2. Міщенко Е.С., Шульга О.Д., Бобрик Н.В., Шульга Л.А. Розсіяний склероз: глобальні перспективи. Український медичний часопис. 2014. № 3 (101). С. 84-87.
3. Guo J.-D., Zhao X., Li Y., Li G.-R., Liu X-L. Damage to dopaminergic neurons by oxidative stress in Parkinson’s disease (Review). Int. J. of molecular medicine. 2018. Vol. 41. P. 1817-1825. doi: 10.3892/ijmm.2018.3406.
4. Praet J., Guglielmetti C., Berneman Z. Cellular and molecular neuropathology of the cuprizone mouse model: Clinical relevance for multiple sclerosis. J. Neubiorev. 2014. Vol. 47. P. 485-505. doi.org/10.1016/j.neubiorev.2014.10.004.
5. Labunets I.F., Utko N.A., Savosko S.I., Panteleymonova T.N., Butenko G.M. Changes in nigral neuronal structure, indices of antioxidant protection of the brain and behavior in mice of different age with MPTP parkinsonism model. International neurogical journal. 2020. № 3 (16). P. 7-15. doi: 10.22141/2224-0713.16.3.2020.203444.
6. Labunets I.F. Possibilities and prospects of the application of the in vivo and in vitro toxic cuprizone model for demyelination in experimental and clinical neurology (literature review and own research results). Ukrainian Neurological Journal. 2018. № 2. P. 63-68. doi: 10.30978/UNZ2018263.
7. Лабунец И.Ф., Родниченко А.Е. Эффекты мелатонина у молодых и стареющих мышей с токсической купризоновой моделью демиелинизации. Успехи геронтол. 2019. № 3 (32). С. 338-346. PMID: 31512419.
8. Gutierrer-Valdez A.L., Anaya-Martinez V., Ordonez-Librado J.L., Garcia-Ruiz R., Torres-Esquivel C., Moreno-Rivera M. еt al. Effect of chronic L-Dopa or melatonin treatments after dopamine deafferentation in rats: dyskinesia, motor performance, and cytological analysis. ISRN Neurology. 2012. ID 360379. doi: 10.5402/2012/360379.
9. Manchester L.C., Coto-Montes A., Boga J.A. Melatonin: an ancient molecule that makes oxygen metabolically tolerable. J. Pineal. Res. 2015. № 4 (59). P. 403-419. doi: 10.1111/jpi.12267.
10. Sarlak G., Jenwitheesuk А., Chetsawang B., Govitrapong P. Effects of melatonin on nervous system aging: neurogenesis and neurodegeneration. J. Pharmacol. Sci. 2013. Vol. 123. P. 9-24. PMID: 23985544.
11. Wurtman R. Multiple sclerosis, melatonin and neurobehavio-ral diseases. Front. Endocrinol. 2017. 23 October 2017. doi:10.3389/fendo.2017.00280.
12. Cardinali D.Р. Melatonin: clinical perspectives in neurodegeneration. Front. Endocrinol. 2019. 10. doi: 3389/fendo.2019.00480.
13. Labunets I.F., Chaikovsky Yu.B., Savosko S.I., Butenko G.M., Sagach V.F., Kop’yak B.S. Effects of melatonin on the behavioral indices and structural characteristics of cerebral and spinal neurons of rats with experimental hemiparkinsonism. Neurophysiology. 2018. № 1 (50). P. 11-22. doi: 10.1007/s11062-018-9712-8.
14. Muthian G., Mackey V., Prasad K., Chariton C. Curcumin and an antioxidant formulation protect C57Bl/6j mice from MPTP-induced Parkinson’s disease like changes:potential neuroprotection for neurodegeneration. Journal of Parkinsonism and Restless legs syndrome. 2018. Vol. 8. Р. 49-59. doi: 10.2147/JPRLS.S151452.
15. Uchtyama M., Mihara M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal. Biochem. 1978. № 1 (86). P. 271-278. doi: 10.1016/0003-2697(78)90342-1.
16. Amikishieva A.V. Behavioral phenothyping: up-to date me-thods and equipment. Vestnik VOGiS. 2009. № 3 (13). Р. 529-542.
17. Fernagut P.O., Diguet E., Labattu B., Tison F. A simple method to measure stride length as an index of nigrostrial dysfunction in mice. J. Neurosci. Methods. 2002. № 2 (113). Р. 123-130. doi: 10.1016/s0165-0270(01)00485-x.
18. Guo L., Xiong H., Kim J., Wu Y., Laichandani R.R., Cui Y. Dynamic rewiring of neural circuits in the motor cortex in mouse models of Parkinson’s disease. Nat. Neurosci. 2015. № 9 (18). P. 1299-1309. doi: 10.1038/nn.4082.
19. Mathai A., Ma Y., Pare J.-F., Villalba R.M., Wichmann Th., Smith Y. Reduced cortical innervation of the subthalamic nucleus in MPTP-treated parkinsonian monkeys. Brain. 2015. Vol. 138. P. 946-962. doi: 10.1093/brain/awv018.
20. Chen D., Zhang T., Lee T.H. Cellular mechanisms of melatonin: insight from neurodegenerative diseases. Biomolecules. 2020. 10. 1158. doi: 10.3390/biom 10081158.
21. Labunets I.F. Neuroprotective еffects of the pineal hormone melatonin in animals with experimental model of neurodegenerative pathology. Conceptual options for the development of medical science and education. Baltija Bublishing. 2020. P. 355-370. doi: 10.30525/978-9934-588-44-01/18.
22. Meredith G.E., Rademacher D.J. MPTP mouse models of Parkinson’s disease: an update. J. Parkinsons Dis. 2011. № 1. P. 19-33. doi: 10.3233/JPD-2011-11023.
23. Vakilzadeh G., Khodagholi F., Ghadin T. The effect of melatonin on behavioral, molecular, and histopathological changes in cuprizone model of demyelination. Mol. Neurobiol. 2016. № 7 (57). P. 4675-4684. doi: 10.1007/s12035-015-9404-y.

/45.jpg)
/46.jpg)