Актуальність
Ішемічний інсульт має складний патогенез, що складається з послідовного каскаду реакцій у мозку, які, на додаток до ішемії, відповідальні за подальше пошкодження мозкової тканини й уповільнюють розвиток компенсаторних і регенеративних механізмів. Одним з ключових патологічних механізмів, спровокованих ішемією тканин, є експоненціальний спалах виробництва агресивних кисневих радикалів, що відіграють самостійну роль у розвитку некрозу й апоптозу нейрональних структур. Каскад патологічних реакцій не тільки чинить пряму пошкоджуючу дію на клітинні мембрани й органели (мітохондрії, комплекс Гольджі, ядро тощо), але й формує вторинні ефекти за рахунок ураження ендотелію капілярів — збільшення проникності судинної стінки, драматичне зростання тканинного набряку й поглиблення ішемії.
Ці процеси достатньо вивчені, і численні спроби якимсь чином переривати патологічний каскад тривають декілька десятиліть. Першою перспективною молекулою, яка продемонструвала в доклінічних дослідженнях потенціал скавенджера (прибиральника, поглинача) надлишкових агресивних перекисів, стала MCI-186, що під назвою «едаравон» увійшла у 2001 році в клінічну практику, в основному в ситуації ішемічного інсульту й травматичного ушкодження мозку. Згодом препарат був схвалений FDA для лікування хвороби моторного нейрона.
Позитивні клінічні ефекти едаравону були підтверджені в численних спостережних і рандомізованих дослідженнях, і він отримав поширення в Японії, Китаї, Індії та низці країн Сходу, увійшовши в національні клінічні настанови й стандарти (рівень доказовості В), але повільно набуває визнання в європейській і американській неврологічній практиці.
Метою даного дослідження є встановлення клінічних ефектів застосування едаравону (Ксаврон) як супутньої терапії гострого періоду ішемічного інсульту (СТІКс) у режимі реальної клінічної практики.
Матеріали та методи
Дослідження було заплановане як мультицентрове, із залученням досвідчених інсультних центрів на добровільній основі. Був розроблений і оприлюднений [1, 4] протокол дослідження, положення якого прийняті виконавцями. Протокол максимально враховував повсякденну практику лікарів-неврологів, і його положення ґрунтувались на клінічних оцінках перебігу й наслідків інсульту, як безпосередніх, так і віддалених. Це особливий момент: уперше у вітчизняній практиці застосована оцінка функціонального стану пацієнтів за шкалою mRS (модифікована шкала Ренкіна) на 90-й день від початку захворювання. Цей інструмент, як кінцева точка оцінки результату будь-якого типу лікування, є загальновизнаним у світовій інсультній практиці: як так званий shift-аналіз (порівняння зміщення розподілу результату за 6 балами шкали функціональних можливостей пацієнтів при порівнянні моменту виписки зі стаціонару і часової точки 90-го дня від початку симптомів інсульту) [2], так і визначення відсотка хворих, у яких оцінка за mRS за тримісячний період змінилась на 1 бал або більше.
Останній показник набуває все більше прихильності в дослідженнях з оцінки впливу тих чи інших втручань у гострому періоді хвороби: безпосередній результат може й не бути надто очевидним (7–9 днів стаціонарного спостереження), але більш стрімке відновлення в 3-місячний період може свідчити про збереження потенціалу важливих репаративних механізмів — те, що зазвичай вкладається в поняття нейропротекції або цитопротекції.
Статистичне опрацювання отриманих результатів проводилось незалежною групою фахівців (м. Львів), без втручання співавторів дослідження. Матеріал обраховувався стандартними статистичними методами з перевіркою за необхідними критеріями, включно з критеріями однорідності.
Методологія застосування Ксаврону як супутньої терапії гострого періоду ішемічного інсульту була стандартною — як прописано в затвердженій інструкції до препарату: внутрішньовенне введення по 30 мг препарату двічі на добу. Початок введення — протягом першої доби від надходження пацієнта в інсультне відділення. Тривалість введення (інструкція рекомендує тривалість 10–14 діб) обмежувалась часом перебування у відділенні й моментом виписки, коли, на думку лікуючого лікаря, настав момент достатньої клінічної стабілізації і був можливий перехід до ранньої реабілітації. Тривалість введення в середньому становила 7–9 діб.
Результати
Усього було отримано 1000 анкет оцінки й спостереження за пацієнтами: 570 випадків з використанням Ксаврону в курсі лікування і 430 випадків зі стандартною, конвекційною терапією (контрольна група).
У табл. 1 подано порівняння за основними клініко-демографічними параметрами двох груп дослідження.
Необхідно звернути увагу, що, попри відсутність формальних вимог у протоколі дослідження щодо принципів рандомізації пацієнтів (віднесення їх у дослідну групу чи групу контролю), базові клініко-демографічні параметри в обох групах дуже близькі.
У групі активного лікування був дещо більший відсоток чоловіків і середній вік пацієнтів був незначно меншим. Розподіл за часом надходження до лікарні дуже близький, хоча в дослідній групі 59,7 % надійшли в межах до 6 годин, у той час як у контрольній — 46,9 % (p < 0,001). Натомість кількість хворих, госпіталізованих після 24 годин від початку симптомів, була відносно вищою в контрольній групі (14,7 % проти 6,9 %; p < 0,001).
Рівень свідомості при надходженні в лікарню є важливим показником тяжкості ураження мозку (розмір ураження, локалізація, набрякова реакція тканини всередині черепа тощо). Частка пролікованих пацієнтів, які мали ясну свідомість, була абсолютно однаковою в обох групах. Але більш пізнє надходження до лікарні частини пацієнтів контрольної групи позначилося на тому, що більша частка хворих у ній мала оцінку рівня свідомості «кома» (5,6 % проти 2,8 %; p = 0,0256). Незважаючи на це, усереднена оцінка стану свідомості за шкалою коми Глазго (ШКГ) практично ідентична.
Найважливішим показником коректності порівняння груп є розподіл пацієнтів за тяжкістю інсульту (за оцінкою шкали NIHSS). У контрольній групі було вірогідно більше пацієнтів з легким інсультом при надходженні (21,6 % проти 15,8 %; p = 0,02). А в дослідній групі було дещо більше випадків тяжкого інсульту (14,9 % проти 12 %; p = 0,186). У результаті усереднений показник демонструє, що група активного лікування характеризується більш тяжким ушкодженням, ніж контрольна (11,67 ± 0,26 проти 10,93 ± 0,29; p < 0,0000).
Цей результат треба мати на увазі при інтерпретації кінцевих даних дослідження: дослідну групу в цілому становили більш тяжкі хворі.
Рутинна клінічна практика передбачає і проведення при сприятливих обставинах тромболітичної терапії. Частка таких хворих була невисокою в обох групах (4,4 % в основній і 6,98 % у контрольній), але показники відбивають реальну ситуацію у вітчизняній інсультній допомозі і, більше того, підтверджують, що участь у дослідженні брали найбільш кваліфіковані центри й фахівці.
Не менш важливим для інтерпретації результатів є клінічний показник розподілу пацієнтів за локалізацією інсульту й наявністю афазії як одного з найбільш інвалідизуючих симптомів. Табл. 1 демонструє ідентичність такого розподілу в обох групах. На додаток до цього середній ліжко-день був однаковим, а його невелике стандартне відхилення підтверджує рівномірність лікувальних стратегій у центрах — учасниках дослідження.
У табл. 2 наведені основні результати — показники перебігу стаціонарного періоду лікування й кінцеві дані щодо оцінки функціонального стану пацієнтів при виписці й на 90-й день від початку хвороби.
Згідно з прийнятим протоколом розглядались певні параметри перебігу інсульту під час госпіталізації, які, на наш погляд, є важливими, у тому числі з точки зору прогнозування наслідків.
Зазвичай у більшості пацієнтів порушена свідомість відновлюється протягом перших 3–5 діб. Одночасно можна спостерігати певне покращання неврологічного дефіциту. Але один з варіантів негативного перебігу найгострішої фази інсульту — тимчасове погіршення стану свідомості й поглиблення неврологічного дефіциту, що зумовлено передусім розвитком набряку мозку. Ця реакція передбачувана, але вона призводить до додаткового зниження тканинного кровотоку, особливо в зонах ішемічної гіпоперфузії.
Загалом частка пацієнтів, у яких спостерігався позитивний сценарій перебігу в перші 3–5 діб, становила в групі із супутнім лікуванням (Ксаврон) 86,5 %, що вірогідно вище, ніж у пацієнтів групи контролю — 57 % (p < 0,001). Це може свідчити про вірогідний протективний ефект відносно розвитку набряку мозку при застосуванні досліджуваного препарату.
У пацієнтів, у яких спостерігалось погіршення свідомості й неврологічного дефіциту (37 осіб (8,6 %) у групі контролю і 31 особа (5,4 %) в основній групі; р = 0,049), у середньому такі прояви припадали на 3-тю добу спостереження — 3,00 ± 0,06 у групі активного лікування і 3,07 ± 0,09 у контрольній групі (р = 0,55). Така близькість показників в обох групах підкреслює закономірність феномена, а не його випадковий характер.
Погіршення стану свідомості в групі лікування досягало рівня 9,74 ± 0,14 бала (при вихідному рівні 13,46 ± 0,09 бала) і 10,63 ± 0,19 бала — в контрольній (при вихідному рівні при надходженні 13,51 ± 0,11 бала), р < 0,001. Більш глибоке погіршення стану свідомості в групі додаткового лікування можна пояснити вірогідно тяжчим у середньому початковим неврологічним дефіцитом у цих хворих (табл. 1).
Але тривалість такого погіршення стану була вірогідно меншою в групі лікування порівняно з контролем (2,83 ± 0,16 доби проти 3,67 ± 0,12 доби; p < 0,001).
Цей ефект, вірогідно пов’язаний з уведенням додаткового препарату, підтверджується порівнянням часу клінічної стабілізації (доба), що визначався на думку лікуючого лікаря: 3,89 ± 0,14 у групі активного лікування проти 5,33 ± 0,18; p < 0,001.
Паралельна оцінка феномену тимчасового погіршення стану в межах 2–5 діб за оцінками шкали NIHSS — 33 пацієнти (7,7 %) у групі контролю і 27 пацієнтів (4,7 %) (при порівнянні за критерієм хі-квадрат, р = 0,053) — продемонструвала таку ж тенденцію: погіршення дефіциту сягало середньої оцінки 16,38 ± 0,34 бала (при початковій середній оцінці в основній групі 11,67 ± 0,26 бала) і 17,91 ± 0,42 бала (початкова оцінка в контрольній групі 10,93 ± 0,29 бала). Глибина погіршення була вірогідно більшою в пацієнтів контрольної групи (р = 0,01). Але більш наочним показником стала тривалість такого погіршення дефіциту — 3,41 ± 0,16 доби при додатковому лікуванні проти 4,78 ± 0,17 доби в групі стандартного ведення пацієнтів. Різниця вірогідна (p < 0,001) і свідчить про спроможність досліджуваної методики лікування скорочувати тривалість тимчасового погіршення стану й сприяти швидшому відновленню функцій загалом.
Два важливих клінічних показники характеризують перебіг гострого періоду інсульту: різноманітні соматичні ускладнення — від інфекційної патології легеневої і сечовидільної систем до серцево-судинних порушень, декомпенсації діабету, трофічних ушкоджень шкіри тощо, і геморагічна трансформація (доведена як за клінічними ознаками, так і при нейровізуалізації, а в окремих випадках — при постмортальному морфологічному дослідженні).
Сукупність соматичних ускладнень перебігу захворювання виявилась вірогідно нижчою — майже вдвічі в групі прийому Ксаврону: 47 пацієнтів (8,42 %) проти 63 (17,12 %); p < 0,001. Гіпотетичні механізми, через які реалізується такий ефект, невідомі, але можна припустити, що за рахунок зменшення спалаху агресивних перекисних радикалів нівелюється системна реакція організму на мозкову катастрофу, а отже, зменшується ризик декомпенсації функцій відповідних органів і систем.
Значно складніше пояснити феномен зменшення частоти геморагічних трансформацій на тлі прийому Ксаврону. Він відзначений і в інших дослідженнях як у пацієнтів з конвенційним веденням, так і в умовах застосування тромболізису й механічної тромбекстракції. У нашому випадку в основній групі відмічена більше ніж двократна редукція частоти геморагічної трансформації (9 випадків (1,84 %) порівняно з 22 випадками (5,67 %) у контрольній групі пацієнтів; р = 0,0012).
Отже, щодо абсолютної більшості показників, які характеризують перебіг гострого періоду інсульту, виявляється позитивний вплив супутньої терапії Ксавроном. Його можна сприймати як помірний, не радикальний, але за відсутності можливості виконати такі методи лікування, ефективність яких доведена, як тромболітична терапія чи механічне видалення тромбу при ураженні великої судини (зазвичай при часових обмеженнях або обмеженні доступу до ендоваскулярних втручань), будь-який підхід, що зменшує негативні впливи складних каскадних механізмів інсульту на наслідки, кінцевий результат, слід вважати доцільним.
Як указувалось вище, оцінка кінцевого результату й наслідків інсульту проводилась у два моменти часу — при виписці пацієнтів зі стаціонару й через 3 місяці від початку симптомів.
Перша оцінка, прийнята у вітчизняній практиці, може вважатись доволі суб’єктивною: при виписці лікар визначає, чи була позитивною динаміка протягом часу лікування і чи пацієнт може переходити до іншого етапу — реабілітації. У разі відсутності ознак позитивної динаміки, при стійкому стані дефіциту робиться висновок «виписаний без змін», хоча це не означає можливості подальшого покращання стану.
В основній групі дослідження 93,7 % пацієнтів виписані з покращанням стану. У контрольній групі такий висновок зроблено для 81 % пацієнтів (вірогідність різниці p < 0,001). Вердикт «без змін» винесено в першій групі в 5,4 % випадків, у той час як серед пацієнтів групи контролю ця частка була майже втричі вищою — 17 % (p < 0,001). Смертність під час госпіталізації в основній групі становила 0,7 %, а в конт-рольній — 2 % (різниця статистично невірогідна: р = 0,0713). Такий результат слід розглядати як наявність позитивної тенденції.
Безумовно, такий показник загальної оцінки якості надання стаціонарної допомоги при інсульті, як «можливість пройти 10 метрів самостійно» (взятий з переліку оцінки якості європейського реєстру RES-Q), не може розглядатись як універсальна кількісна характеристика функціонального стану хворого на момент виписки. Він скоріше характеризує загальний рівень надання допомоги в центрах, що брали участь у дослідженні. І в основній групі (64,3 %), і в групі контролю (62,1 %) частка таких пацієнтів була однаковою і доволі високою. Загалом це дуже непоганий результат. Слід також мати на увазі, що за 9 (у середньому) днів лікування не варто очікувати суттєвого відновлення функції при практично будь-якому втручанні.
Це підтверджує і однакова усереднена оцінка загального функціонального стану пацієнтів за mRS: у контрольній групі при виписці вона становила 2,77 ± 0,22 бала і була дещо нижчою в основній групі дослідження — 2,66 ± 0,06 бала (р = 0,62). Цим лише підтверджується загальна позитивна тенденція до відновлення в усій когорті з 1000 хворих.
Хоча за оцінкою індексу Бартел, що є більш композитною щодо функціональних спроможностей пацієнтів і точніше описує їх можливості, середньогруповий вимір був вірогідно вищим у групі активного лікування: 78,82 ± 1,05 бала проти 69,22 ± 1,12 бала; p < 0,001. На нашу думку, це доволі показово й логічно відповідає сукупності всіх тих позитивних клінічних тенденцій, що описані вище для характеристики перебігу стаціонарного періоду лікування й спостереження.
На додаток і для пояснення такого результату наведемо фінальну оцінку неврологічного дефіциту в пацієнтів на момент виписки за шкалою NIHSS, за якою пацієнти оцінювались при надходженні до інсультних підрозділів. У середньому в основній групі бал оцінки (6,34 ± 0,22) знизився більше, ніж у контрольній групі (7,46 ± 0,27; p < 0,001). І це при тому, що при надходженні в основній групі, як зазначалось вище (табл. 1), тяжкість інсульту була більшою, ніж у контрольній. Така динаміка не може бути випадковою і при всіх інших рівноцінних показниках, на наш погляд, відображає вплив додаткового лікування препаратом Ксаврон.
Але момент виписки не може вважатись закінченням процесу відновлення, тому у світі прийнято оцінювати результати пізніше, у термін 3 місяці після початку захворювання, коли повноцінно реалізується потенціал нейровідновлення: збережені в гострому періоді ділянки мозку, передусім пенумбри, що на момент перших 10–21 дня ще знаходяться в стані діашизу, поступово включаються в роботу ансамблю мозкових функцій. У нашому дослідженні первинною кінцевою точкою теж обрано результат відновлення, оцінений на 90-й день захворювання за шкалою mRS.
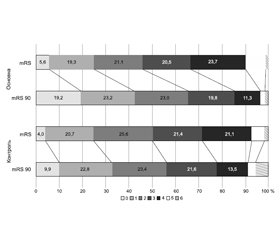
Зазвичай таку оцінку порівняно з вихідними даними (оцінка за mRS при виписці пацієнтів) проводять у графічній формі — порівнюють розподіл пацієнтів за балами шкали від 0 (немає симптомів взагалі) до 6 балів (смерть пацієнта). На рис. 1 продемонстровано порівняння такого розподілу у двох моментах часу в основній і контрольній групах.
/25.jpg)
Найбільша динаміка при порівнянні між конт-рольною та основною групами спостерігається в 0-му рівні шкали mRS. Однак у цілому за шкалою mRS за результатами shift-аналізу з використанням тесту Кохрана — Мантеля — Хензеля не було виявлено вірогідної різниці між контрольною та основною групами (р = 0,91), а загальне співвідношення шансів становило 1,01 (ДІ = 0,84–1,22). При цьому порівняння між контрольною та основною групами за рівнями за результатами обрахунку хі-квадрата Пірсона також не виявило вірогідної різниці за жодним рівнем mRS. Тому для подальшого аналізу шкалу mRS було поділено на два рівні — 0–1 (повне одужання) і 2–6 (наявність неврологічних розладів різного ступеня). І аналіз проводився за цими рівнями [2].
Якщо на момент виписки частка хворих, які мали значну позитивну динаміку й можуть бути віднесені до категорії «практично здорові» (оцінка 0–1 бал), була очевидно однаковою (24,7 % у контролі та 24,9 % в основній групі), то на 90-й день ця частка змінилась на користь основної групи (32,7 % у контролі і 42,4 % в основній групі, р = 0,0018).
Такий же результат був і при оцінці сукупності часток, оцінених у межах 0–2 бали (включно з особами з мінімальним неврологічним дефіцитом, що дозволяє їм виконувати основні побутові функції і самообслуговування, бути самостійними, не потребувати особливого догляду й асистування): через 90 днів частка хворих з таким діапазоном у контрольній групі становила 56,1 %, а в групі активного лікування — 65,4 % (р = 0,0029).
Наочно співвідношення кількості хворих з повним відновленням і середньою і тяжкою інвалідизацією, що залишається на 90-й день від розвитку інсульту, показано на рис. 2.
За результатами тесту Кохрана — Мантеля — Хензеля було виявлено вірогідність різниці між контрольною та основною групами (р = 0,024), а загальне співвідношення шансів становило 1,26 (ДІ = 1,03–1,53). Також встановлено вірогідність різниці за дихотомічною шкалою mRS на 90-й день між контрольною та основною групами за результатами обрахунку хі-квадрата Пірсона (р = 0,002).
Для визначення можливого впливу на результат лікування початкових значень шкали NIHSS було проведено shift-аналіз з розподілом шкали NIHSS на групи тяжкості при надходженні — 0–5 (легка), 6–12 (середня) і 13–25 (тяжка).
За результатами тесту Кохрана — Мантеля — Хензеля було виявлено вірогідність різниці між контрольною та основною групами (р < 0,001), а загальне співвідношення шансів становило 1,93 (ДІ = 1,42–2,62). При цьому за результатами тесту Бреслоу — Дея встановлено гомогенність співвідношення шансів за групами тяжкості (р = 0,85), а отже, зміни є незалежними від ступеня тяжкості за шкалою NIHSS. Зведені дані за кожним ступенем тяжкості за NIHSS наведені в табл. 3, різниця відображена графічно на рис. 3.
У додаткових матеріалах до цього фінального звіту наведені зведені таблиці аналізу відношення mRS на 90-й день захворювання при порівнянні не тільки між групами (за U-критерієм Манна — Уїтні, п. 2; p < 0,001), але й за деякими іншими факторами можливого впливу на результат, а саме — за статтю й тяжкістю інсульту, оціненою на момент надходження до лікарні.
В основній групі різниця досягнутого результату між чоловіками й жінками виявляється вірогідною (U-критерій, р = 0,006, п. 3) на користь кращого відновлення в чоловіків, але в контрольній групі такий ефект відсутній, хоча при порівнянні з відповідною статтю основної групи обидві статі вірогідно демонструють менший потенціал відновлення.
/27.jpg)
Як вказувалось вище (табл. 3, рис. 3), за тестом Кохрана — Мантеля — Хензеля є чітка різниця у відношеннях шансів на краще відновлення між групами на користь дії досліджуваного препарату для хворих з легким і середнім за тяжкістю інсультом, а також спостерігається односпрямована тенденція для пацієнтів з тяжким інсультом, хоч і не підтверджена статистично. При використанні іншого критерію — Краскела — Уолліса й апостеріорного тесту Дана (п. 4 додаткових матеріалів) підтверджується різниця між темпами відновлення в пацієнтів з різною тяжкістю інсульту, і можна помітити, що в усіх підгрупах тяжкості середні значення менші в основній групі порівняно з конт-ролем. Також різні статистичні підходи демонструють вірогідну відмінність між основною і контрольною групами за досягнутим результатом.
/26_2.jpg)
Одночасно був проведений аналіз кореляційних зв’язків первинної кінцевої точки (mRS на 90-й день) з іншими показниками. При порівнянні з mRS на момент виписки в основній групі демонструється сильний позитивний вірогідний зв’язок: R = 0,78; p < 0,001. Це виглядає логічно, тому що показники є взаємопов’язаними. У контрольній групі теж спостерігається сильний позитивний вірогідний кореляційний зв’язок — R = 0,67; p < 0,001, але він слабший, імовірно, за рахунок більшої неоднорідності потенціалу відновлення — відсутності, як в основній групі, фактора прийому Ксаврону.
Між mRS на 90-й день і віком існує слабкий позитивний вірогідний кореляційний зв’язок в основній групі: R = 0,17; p < 0,001. Це теж виглядає доволі закономірним: чим більший вік пацієнтів, тим більший остаточний бал функціональної оцінки — менший потенціал відновлення. Так, саме в цій групі спостерігається слабкий позитивний вірогідний кореляційний зв’язок з початком введення Ксаврону від моменту госпіталізації: R = 0,16; p < 0,001 — чим раніше починається введення препарату, тим менший кінцевий бал за mRS. Але також виявлений слабкий позитивний вірогідний кореляційний зв’язок (R = 0,16; p < 0,001) між mRS на 90-й день і тривалістю курсу введення препарату. Це здається трохи дивним, але пояснення може полягати в тому, що триваліший курс був у більш тяжких пацієнтів, госпіталізація яких була об’єктивно довшою (зазвичай на кілька днів).
/28.jpg)
Оскільки показник mRs на 90-й день визначається за кількісною шкалою (де різницю видно лише по середніх), то для прогнозування можна запропонувати регресію (як приклад наведемо дві таблиці з коефіцієнтами). Обидві моделі вірогідні.
На основі таких моделей можна коментувати результат у тому сенсі, що наявність в основній групі фактора прийому Ксаврону зменшує результуючий показник mRS на 90-й день на 0,79 бала, а кожен бал за NIHSS збільшує результуючий показник на 0,11 бала. У чоловіків цей показник буде меншим ще на 0,11 бала. Таким чином можна спрогнозувати вірогідний показник для конкретного пацієнта (табл. 4, 5).
В обох випадках рівняння вірогідні й описують вплив фактора статі й віку на кінцевий результат. Більший вплив має фактор статі, на що вказувалось вище (п. 3 додаткових матеріалів). У будь-якому випадку це демонструє, що матеріали, отримані під час дослідження, дозволяють не тільки робити (за обсягом, якістю тощо) висновки про корисність застосування Ксаврону як додаткової терапії ішемічного інсульту, але й прогнозувати позитивний результат за допомогою математичних процедур і моделювання.
/28_2.jpg)
І ще один важливий результат, методологія якого стає в останні роки досить популярною в дослідженнях впливу будь-якого втручання на перебіг і наслідки лікування інсульту. Ідеться про порівняння в основній і контрольній групах частки пацієнтів, у яких оцінка за mRS на 90-й день змінилась порівняно з оцінкою на момент виписки на 1 або більше бал. Тобто це частка пацієнтів з найбільшою динамікою відновлення функціонального стану. Якщо під впливом втручання в основній групі така частка більше, ніж у контролі, це означає додаткове підтвердження дієвості такого втручання. Показник підсилює значення результату, отриманого за первинною кінцевою точкою дослідження.
У нашому випадку така очевидна позитивна динаміка в групі контролю була виявлена в 136 пацієнтів (34,8 %), а в основній групі — у 345 випадках (62,6 %). Хі-квадрат Пірсона за оцінкою різниці становив 69,78 (df = 1), p < 0,001 (п. 5 додаткових матеріалів). Отже, це ще одне підтвердження вірогідного позитивного ефекту додаткової терапії Ксавроном ішемічного інсульту.
Обговорення
На одному з перших круглих столів, що відбулися в рамках щорічного 7-го Конгресу Європейської інсультної організації (ESOC-2021) 1 вересня 2021 року, провідні фахівці з інсультної медицини (професори Philip M. Bath, Kennedy Lees, Велика Британія, Werner Hacke, Німеччина, Charlotte Cordonnier, Франція, і Else Charlotte Sandset, Норвегія) обговорювали прогрес за останні 30 років у питанні лікування інсульту. Окрім прийняття концепції пенумбри, «часового вікна», невідкладної нейровізуалізації, лікування в спеціально пристосованих інсультних відділеннях, тромболізису й тромбекстракції було відмічено необхідність переглянути з нових позицій і питання нейропротекції (чи цитопротекції), що залишаються вельми важливими для захисту мозку, розтягнення часу існування пенумбри (а не стрімкого переходу її до необоротного ішемічного ураження тканини мозку) з метою надати можливості виконати, зокрема, певні втручання чи взагалі зберегти хоч якусь частину мозку від загибелі.
Одночасно наголошувалось, що очікувати якихось грандіозних, всеохоплюючих та інтернаціональних досліджень з того чи іншого питання марно через складність організації та проведення, величезні витрати, і до того ж сила такого дослідження поступається потенціалу сукупності менших випробувань на національному чи регіональному рівні, дані яких, проте, за подібністю методології проведення можуть бути об’єднані в метааналіз і надати більш вірогідний результат.
Ініціюючи проведення дослідження СТІКс, ми керувались подібними міркуваннями: це мультицентрове дослідження за узгодженим протоколом, що максимально наближений до поточної клінічної практики й містить стандартні, прийняті у світі критерії оцінки результатів. Дослідження планувалось як суто клінічне, за принципами «випадок — контроль», і первинною кінцевою точкою якості результату було обрано оцінку функціонального стану пацієнта через 90 днів від початку захворювання за модифікованою шкалою Ренкіна.
Додатковим параметром була частка пацієнтів у кожній з досліджуваних груп (основна та контроль), у яких оцінка за mRS зменшилась від моменту виписки до 90-го дня на 1 бал чи більше, що є загальноприйнятим критерієм у подібного роду випробуваннях (вплив фармакологічного препарату чи іншої методики лікування на наслідки захворювання).
У результаті при дихотомічному аналізі розподілу оцінки за mRS на 90-й день захворювання виявлена перевага на користь застосування додаткової терапії Ксавроном у діапазоні 0–1 бал (практичне одужання): 32,7 % у контролі і 42,4 % в основній групі, р = 0,0018. Більше того, такий саме результат досягнутий при аналізі діапазону 0–2 (одужання чи мінімальний дефіцит, що дозволяє повноцінно виконувати процедури самообслуговування, бути незалежним у повсякденному житті): частка хворих у контрольній групі в цьому діапазоні становила 56,1 %, а в групі активного лікування — 65,4 % (р = 0,0029).
Результат підтверджується і за вторинною точкою оцінки: очевидна позитивна динаміка (зменшення оцінки за mRS на 1 бал чи більше) в групі контролю була виявлена в 136 пацієнтів (34,8 %), а в основній групі — у 345 випадках (62,6 %). Хі-квадрат Пірсона по оцінці різниці становив 69,78 (df = 1), p < 0,001.
Але найбільш цікавим, з нашої точки зору, було продемонструвати, за рахунок яких змін упродовж перебігу госпітального періоду отриманий кінцевий результат і чи не був він випадковим математичним феноменом.
Дослідження показало, що у вірогідно меншої кількості пацієнтів у групі активного лікування виникало погіршення стану свідомості й неврологічного дефіциту в гострому періоді інсульту, а тривалість такого погіршення була вірогідно коротшою. Хворі раніше стабілізувались у соматичному й неврологічному сенсі, у них виникало вірогідно менше соматичних ускладнень перебігу, а частота клінічно значущих геморагічних трансформацій була більше ніж удвічі меншою. І хоча в основній групі пацієнти мали в середньому більш тяжкий за дефіцитом інсульт, динаміка відновлення переважала порівняно з контрольною групою. Вплив на механізми інтими, що розвиваються в гострому періоді хвороби (агресивні кисневі радикали, захист інтими ендотелію, зменшення набряку мозкової тканини тощо) [5], у кінцевому результаті дав загальний позитивний клінічний наслідок.
Наші дані доволі близькі до результатів інших подібних досліджень, проаналізованих в останньому метааналізі С. Chen et al. 2021 року [3], у якому об’єднані матеріали 4 доволі великих сучасних спостережень, проведених за схожими методичними підходами.
Тому ми впевнені, що отримані нами результати будуть з довірою сприйняті національною неврологічною спільнотою і допоможуть обґрунтувати доцільність застосування Ксаврону як додаткової терапії гострого ішемічного інсульту.
Додатковий матеріал статистичної оцінки результатів дослідження СТІКс (матеріали надані незалежною групою статистичного аналізу)
1. Згідно з обрахунком критерію Шапіро — Уїлка з метою перевірки на нормальність розподілу в більшості варіаційних рядів встановлено негаусівський розподіл.
Проте в більшості випадків за медіаною не видно різниці поміж групами — при такому об’ємі вибірок медіани однакові.
Таблиці сформовані з указуванням медіани з квартилями й середніх значень. Перевірка за t-критерієм — для дискретних даних, і при такому об’ємі статистично можна пробувати, також дублюється наявність різниць.
Гетерогенність встановлюють за допомогою тесту на гомогенність співвідношення шансів odds ratio heterogeneity (homogeneity) — у даному випадку тест Бреслоу — Дея. Умовно кажучи, його можна порівняти з тестом Левене на рівність дисперсії при ANOVA, однак у даному випадку ми перевіряємо рівність (гомогенність) співвідношення шансів (ODD Ratio) у стратифікованих шкалах (підгрупах).
Отримано/Received 19.08.2021
Рецензовано/Revised 06.09.2021
Прийнято до друку/Accepted 13.09.2021
/26.jpg)

/23.jpg)
/24.jpg)
/25.jpg)
/27.jpg)
/26_2.jpg)
/28.jpg)
/28_2.jpg)
/30.jpg)
/31.jpg)