Вступ
У структурі гострих порушень мозкового кровообігу провідне місце займають ішемічні інсульти [1, 2]. Вони спричиняють розвиток інфарктів, тобто вогнищевого ураження речовини мозку, характеризуються загибеллю усіх тканинних елементів — нейронів та клітин нейроглії. Інфаркти можуть виникати в різних відділах мозку. За даними патоморфологічного дослідження, найчастіше (75 %) вони виявляються в басейні середньої мозкової артерії та дуже рідко (5 %) — у басейні передньої мозкової артерії [3]. За даними секційних розтинів, частота інфарктів у каротидному басейні в 4 рази перевищує таку в басейні артерій задньої циркуляції. За даними клініко-неврологічних досліджень, частота півкульних інфарктів у каротидній системі значно (за деякими статистичними дослідженнями, у 5–6 разів) перевищує частоту інфарктів у вертебробазилярній системі [4]. Доволі велика частота множинних інфарктів (18–20 %), розташованих у різних відділах головного мозку, що кровопостачаються каротидною і вертебробазилярною системами.
В Україні у 2019 році зареєстровані 127 тис. мозкових інсультів, 70 % із них — ішемічні. Порівняно з 2012 роком (111 615 випадків) показник захворюваності на мозковий інсульт зріс і різко контрастує з показниками західноєвропейських країн [5].
З огляду на наведені дані для глибшого розуміння неврологічної клініки каротидних інфарктів та ідентифікації вогнища ураження важливе значення має знання особливостей кровопостачання їх судинних територій.
Як відомо, головний мозок забезпечують кров’ю дві парні магістральні артерії голови — внутрішні сонні (ВСА) та хребтові (ХА). Дві третини всієї кількості крові постачають у мозок внутрішні сонні артерії, одну третину — хребтові артерії. Перші утворюють передню каротидну систему, другі — задню вертебробазилярну систему [6].
Внутрішні сонні артерії входять у порожнину черепа крізь внутрішній отвір сонного каналу скроневої кістки, вступають у кавернозний синус (sinus cavernosus), де утворюють S-подібний вигин. Ця частина ВСА отримала назву сифона, або кавернозної частини. Після виходу із кавернозної частини ВСА «проколює» тверду мозкову оболонку, робить новий вигин випуклістю вперед, тут від неї відходить перша гілка — очна артерія (a.ophthalmica). Латерально від перехрестя зорових нервів ВСА розділяється на дві кінцеві гілки: передню (ПМА) і середню мозкові артерії (СМА). Вони забезпечують кровопостачання більшої частини головного мозку [7, 8].
Передня мозкова артерія васкуляризує передній відділ лобної частки і внутрішню поверхню півкулі до тім’яно-потиличної борозни. Термінальні гілки її досягають випуклої поверхні півкуль мозку в ділянці верхньої частини центральних, першої та другої лобних звивин, де утворюють анастомози з гілками середньої мозкової артерії, а в ділянці клина (cuneus) — із гілками задньої мозкової артерії (ЗМА).
Від СМА (a.cerebri media) у центральній борозні відходить від 6 до 8 стріарних гілок (аa.striataе), які васкуляризують глибокі відділи півкуль великого мозку (підкіркові ядра, більшу частину внутрішньої капсули). Необхідно зазначити, що в підкірковій ділянці анастомозів артерій немає зовсім, унаслідок чого за умови ураження однієї з артерій у ділянці її кровопостачання настають необоротні зміни тканини мозку. У подальшому СМА розділяється на кінцеві гілки, які кровопостачають значну частину кори лобної, тім’яної і скроневої часток [9].
Отже, у передній каротидній системі розрізняють три групи артерій, які мають різні структурні та функціональні характеристики:
— магістральні, або регіонарні, судини — це внутрішні сонні артерії в екстра- та інтракраніальному відділах;
— великі за діаметром внутрішньомозкові артерії — передня і середня мозкові артерії, які є гілками внутрішньої сонної артерії; обидві передні мозкові артерії з’єднує передня сполучна артерія, а середні та задні мозкові артерії — задня сполучна артерія;
— дрібні за діаметром глибокі перфорантні артерії, та поверхневі перфорантні артерії м’якої мозкової оболонки, які здебільшого є кінцевими гілками.
Унаслідок з’єднання між собою каротидних і вертебробазилярних басейнів на нижній поверхні півкуль великого мозку утворюється замкнена система — артеріальне (вілізієве) коло великого мозку.
Наявність у передньому каротидному басейні артерій різного калібру з відмінною будовою й не-однаковими зонами кровопостачання в разі розвитку гострих ішемічних порушень мозкового кровообігу (ГПМК) визначають локалізацію вогнища ураження, його розміри та клінічний перебіг передньоциркулярних інфарктів.
Патологічні процеси, що спричиняють їх ураження і розвиток ішемічних інсультів, різні. Атеросклеротичні бляшки, які є джерелом тромбоемболії, здебільшого уражають великі (дугу аорти) та середні за діаметром артерії в місцях їх поділу (біфуркація сонної артерії), звивистості (сифон сонної артерії) або злиття. Натомість мало страждає від атеросклерозу ВСА дистальніше від аорти й до сифона, а також основні мозкові артерії дистальніше від вілізієвого кола. Тому оклюзія СМА виникає частіше внаслідок емболії, ніж локального тромбозу на місці атеросклеротичної бляшки. Кардіогенні та артеріо-артеріальні емболи рідко сягають дрібних глибоких перфорантних артерій. Патологічні зміни цих артерій здебільшого спричиняють процеси, що зумовлюють облітерацію просвіту судин внаслідок плазморагій, фібриноїдного некрозу, мікрогіалінозу та склеротичних змін судинних стінок [6].
Патогенетична класифікація інфаркту характеризує механізми розвитку ГПМК, локалізацію вогнища ураження, його розміри [10]. Згідно з цією класифікацією виділяють такі форми інфаркту мозку передньої циркуляції:
— територіальний інфаркт, зумовлений тромботичною або тромбоемболічною закупоркою русла артерій великого і середнього калібру (макроангіопатії), неврологічна симптоматика відповідає ураженню основних судинних басейнів; у разі закупорки ВСА всередині черепа або закупорки русла передньої або середньої мозкової артерії виникає тотальний інфаркт;
— інфаркт у кінцевих гілках великих артерій мозку або в межових зонах — територіях, васкуляризованих дистальними артеріями малого калібру із сусідніх судинних басейнів; виділяють два типи межових зон, тобто територій із функціональними анастомозами між системами двох різних мозкових артерій (наприклад, між ПМА і СМА, ЗМА і СМА); друга зона — це поверхневі кіркові артерії та глибокі гілки СМА, що досягають кіркових гілок артерій, але не анастомозують із ними, їх ураження зумовлює розвиток малих кортикальних інфарктів;
— лакунарні інфаркти у ділянці внутрішньої капсули або в білій речовині півкуль великого мозку (семіовальному центрі, променистому пучку) зумовлені патологією дрібних за діаметром пенетрувальних артерій і локальними порушеннями кровотоку в ділянці мікроангіопатій у разі артеріальної гіпертензії та цукрового діабету.
Точність і вірогідність діагнозу півкульного інфаркту, що ґрунтується на певній території артеріального кровопостачання, не підлягає сумніву, оскільки спостерігається тісний зв’язок вонищевих неврологічних симптомів із басейном русла ураженої артерії. Нейровізуалізаційне обстеження пацієнта дозволяє точно верифікувати топографію півкульного інфаркту й відповідну йому артеріальну територію, залучену до патологічного процесу.
З огляду на наведені дані проведення клініко-радіологічного аналізу каротидних інфарктів у гострому періоді ішемічного інсульту дозволить визначати вихідний рівень неврологічного дефіциту, локалізацію та розмір вогнища ураження, тобто визначити форму інфаркту мозку, ідентифікувати ділянку артеріального ураження, що має важливе значення для оцінки клінічної ситуації, визначення плану та послідовності термінових лікувальних заходів.
Мета дослідження — дослідити клініко-неврологічні та нейровізуалізаційні особливості лакунарних і нелакунарних каротидних інфарктів у гострому періоді ішемічного інсульту й оцінити їх короткострокові наслідки.
Матеріали та методи
Проведене комплексне клініко-неврологічне й нейровізуалізаційне обстеження 540 хворих з ішемічним інсультом, госпіталізованих у неврологічні відділення клінік м. Києва через 6–24 год після появи перших симптомів, із них 247 (45,7 %) чоловіків і 293 (54,3 %) жінки, віком від 24 до 88 років (середній вік — 69,4 ± 12,1 року) із підтвердженим за допомогою МРТ діагнозом гострого каротидного інфаркту в передньоциркулярному басейні.
Клініко-неврологічне обстеження включало вивчення чинників ризику та темпу розвитку інсульту, оцінку загального стану пацієнта, соматичне обстеження.
Ступінь порушення неврологічних функцій оцінювали на момент госпіталізації пацієнта та в динаміці за шкалою NIHSS (National Institute of Health Stroke Sсale), порушення повсякденної життєдіяльності — за модифікованою шкалою Ренкіна (мШР), ступінь соціальної дезадаптації пацієнта — за індексом Бартел (ІБ). Обсяг і відновлення неврологічних функцій визначали на 21-шу добу курації хворих. Критерієм сприятливого наслідку вважали досягнення на тлі терапії показника мШР 0–2 бали, несприятливого — 4–5 балів, фатальні наслідки — 6 балів. Ступінь дезадаптації пацієнта визначали згідно з ІБ: мінімальний — ≥ 95 балів, помірний — 94–75 балів, середній — 74–50, тяжкий — < 50 балів. Функціональний стан магістральних артерій голови в екстракраніальному відділі та інтракраніальних артерій досліджували за допомогою транскраніальної допплерографії і триплексного допплерівського сканування. Локалізацію та розмір інфарктного вогнища верифікували за допомогою МРТ-дослідження головного мозку, що виконували в стандартних Т1-, Т2-режимах і дифузійно-зваженому режимі. Використовували також мультидетекторну спіральну комп’ютерну (МСК) томографію. Розмір вогнища інфаркту визначали за формулою [11]:
V = 0,52 × A × D × C,
де V — об’єм вогнища ураження; A, B, C — його діаметри, 0,52 — коефіцієнт для підрахунку неправильного еліпсоїда.
Особливості та закономірності відновлення втрачених неврологічних функцій оцінювали з урахуванням позитивної динаміки показників клінічних шкал інсульту. Первинною кінцевою точкою оцінки короткострокових наслідків інсульту були функціональні показники: повне відновлення неврологічних функцій (одужання): мШР = 0–2 бали, ІБ ≥ 95 балів; помірне функціональне відновлення: мШР ≤ 2 балів, ІБ ≥ 80 балів; втрата працездатності: мШР > 2 бали, ІБ < 80 балів.
Статистичну обробку отриманих даних та елементи статистичного аналізу проводили за допомогою непараметричних тестів та програм статистичного аналізу Microsoft Office Excel 2007, програми SPSS Statistics 17.0 та Stata 10. Порівняння динаміки неврологічного дефіциту проведене за допомогою критерію Вілкоксона. Статистично вірогідною вважали різницю при р < 0,05.
Результати та обговорення
За результатами комплексного клініко-нейровізуалізаційного обстеження 540 хворих з ішемічним інсультом різних анатомічних територій передньоциркулярного басейну в 155 (28,7 %) пацієнтів діагностували інфаркти кори та білої речовини лобної та значної частини тім’яної й скроневої часток мозку, у 385 (71,3 %) — інфаркти глибоких відділів півкуль головного мозку, тобто інфаркти підкірково-капсулярної ділянки мозку. Доволі висока була частота множинних інфарктів — у 66 (12,2 %) хворих вогнища були в різних відділах головного мозку, що кровопостачаються каротидною й вертебробазилярною системами: півкулі мозочка, таламус, ділянки потиличних часток головного мозку.
Між хворими з інфарктами кори й білої речовини лобної та значної частини тім’яної й скроневої часток мозку, а також пацієнтами з інфарктами глибоких відділів головного мозку не виявлено статистично значущої різниці за основними демографічними параметрами та васкулярними чинниками ризику (табл. 1).
На підставі даних неврологічної клініки, за результатами рентгенрадіологічних, ультразвукових і лабораторних методів обстеження з урахуванням критеріїв TOAST (Trial of ORG 10172 in Acute Stroke Treatment) [12] виділені чотири патогенетичні підтипи каротидних ішемічних інсультів: атеротромботичний (n = 277), кардіоемболічний (n = 125), лакунарний (n = 120), остаточно невизначений (n = 18) (табл. 2).
/44.jpg)
Атеротромботичний підтип ішемічного інсульту діагностований у 277 (51,3 %) хворих. Цей підтип інсульту здебільшого зумовлювався атеросклеротичним процесом великих, середніх і глибоких гілок ПМА і СМА, що викликало їх стеноз, закупорку, тромбоз, тобто макроангіопатіями. Більшість випадків такого підтипу ішемічного інсульту виникала під час сну або відразу після нього. Клінічна картина в пацієнтів характеризувалася поступовим, протягом кількох годин, іноді 2–3 діб, посиленням вогнищевих неврологічних симптомів. Приблизно в 1/3 випадків захворювання розвивалося гостро, апоплектиформно, з одномоментним розвитком неврологічної симптоматики.
Кардіоемболічний підтип інсульту визначений у 125 (23,1 %) хворих. Він здебільшого виникав раптово, без будь-яких провісників, зазвичай під час фізичної активності. Характерною була наявність помірної або значної загальномозкової симптоматики. До його розвитку здебільшого призводила постійна або пароксизмальна фібриляція передсердь, миготлива аритмія, гіпокінезія після перенесеного інфаркту міокарда. Кардіогенні та артеріо-артеріальні емболи частіше зумовлювали оклюзію СМА або її гілок, ніж локальний тромбоз на місці атеросклеротичної бляшки.
Лакунарні інфаркти діагностовані у 120 (22,2 %) хворих, хоча не завжди виявляються. Вони були обумовлені первинним ураженням перфорантних (проникних) артерій, характеризуються розвитком дрібних вогнищ некрозу. У процесі організації з них формувалися невеликі за розміром (0,5–1 см) порожнини круглої або неправильної форми — лакуни. До розвитку лакунарних інфарктів призводять мікроангіопатії, які супроводжують артеріальну гіпертензію й спричиняють облітерацію дрібних пенетрувальних артерій: плазморагія з розвитком фібриноїдного некрозу, вираженого мікрогіалінозу артерій і склеротичних змін стінок судин [13, 14]. Цукровий діабет у 2,3 раза збільшує ризик розвитку лакунарних інфарктів [15]. Лакунарні інфаркти не є наслідком кардіальної або артеріо-артеріальної емболії.
Остаточно невизначений підтип інфаркту діагностовано у 18 (3,3 %) хворих. Такі ішемічні порушення мозкового кровотоку здебільшого були проявами судинної мозкової недостатності, зриву реакцій авторегуляції мозкового кровообігу.
Отже, найчастіше передньоциркулярні інфаркти спричиняли макроангіопатії, кардіоемболічні механізми та мікроангіопатії.
З урахуванням критеріїв TOAST та патогенетичних механізмів передньоциркуляні інфаркти розподілені на лакунарні (n = 120) та нелакунарні (n = 420).
Клініко-нейровізуалізаційні особливості каротидних інфарктів у гострий період ішемічного інсульту
Клініко-неврологічний та радіологічний аналіз особливостей каротидних інфарктів у 540 хворих із гострим ішемічним інсультом показав, що частота виникнення вогнища інфаркту, його розміри в пацієнтів з інсультом з урахуванням анатомічних територій передньоциркулярного басейну були неоднаковими. Найчастіше інфарктні вогнища виявляли в ділянці глибоких відділів півкуль головного мозку (підкіркові ядра, коліно, передні відділи заднього і частково переднього стегна внутрішньої капсули) — 385 (71,3 %) пацієнтів. Значно рідше — у 155 (28,7 %) пацієнтів — у ділянках кори і білої речовини головного мозку в руслі васкуляризації ПМА і СМА, тобто в лобній частці та значній частині тім’яної й скроневої часток головного мозку. Безумовно, така локалізація гострого порушення мозкового кровообігу визначала розміри інфаркту та особливості неврологічної клініки.
Інфаркти кори й білої речовини головного мозку в руслі васкуляризації передньої та середньої мозкових артерій
Васкуляризація кори й білої речовини лобної та значної частини тім’яної й скроневої часток півкуль головного мозку є комплексною і здійснюється артеріальними гілками із двох басейнів: передньої мозкової артерії, яка відходить від ВСА і кровопостачає передній відділ лобної частки і внутрішню поверхню півкуль до тім’яно-потиличної борозни, а термінальні гілки її досягають випуклої поверхні півкуль мозку в ділянці верхньої і другої лобної звивин, де утворюють анастомози з гілками СМА; середньої мозкової артерії, кінцеві гілки якої васкуляризують значну частину кори лобної, тім’яної та скроневої часток головного мозку [7].
Проведений клініко-неврологічний і нейровізуалізаційний аналіз 155 хворих з ішемічним інсультом у руслі васкуляризації кіркових гілок ПМА і СМА передньоциркулярного басейну показав, що гостре ПМК спричиняло розвиток у 89 (57,4 %) пацієнтів малих кортикальних інфарктів і в 65 (41,9 %) — лакунарні інфаркти; в 1 хворого (0,7 %) з оклюзією проксимального відділу ПМА діагностували тотальний інфаркт.
Тотальний інфаркт у басейні русла ПМА в пацієнта зумовлював парез ноги на протилежному від вогнища ураження боці, значне підвищення тонусу м’язів ноги, гіперрефлексію глибоких рефлексів, порушення поверхневої та глибокої чутливості на нозі, розлади пам’яті, емоцій, появу хапального феномену.
Малі кортикальні інфаркти — це обмежені інфаркти, які здебільшого виникають унаслідок оклюзії кінцевих гілок дрібного калібру ПМА, СМА або в межових зонах — територіях васкуляризації дистальними артеріями малого калібру цих судинних басейнів. Вони характеризуються симптомами ураження моторики, поверхневої та/або глибокої чутливості в одній кінцівці.
Закупорка гілок ПМА зумовлювала монопарез стопи, інколи спостерігалися затримка або нетримання сечі. Виявлялися рефлекси орального автоматизму, хапальний феномен; патологічні стопні згинальні рефлекси Россолімо, Бехтерева, Жуковського. Виникали зміни психічного статусу, зниження пам’яті, критики.
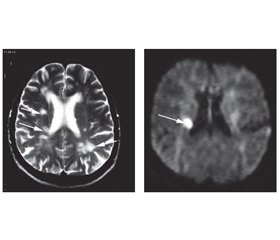
Для ілюстрації наводимо МРТ головного мозку хворого Г., 55 років, із кортикальним інфарктом у басейні лівої ПМА (рис. 1).
Якщо малі кортикальні інфаркти локалізувалися в басейні кіркових гілок СМА, то залежно від локалізації вогнища ураження в ділянках кори лобної, тім’яної або скроневої часток головного мозку спостерігалися рухові розлади, порушення чутливості переважно в руці, а також сенсомоторна афазія, аграфія, алексія, акалькулія – за умови лівопівкульної локалізації інфаркту. У разі правопівкульної локалізації вогнища виникали анозогнозія, розлади схеми тіла.
Ілюстрацією такої локалізації вогнища ураження може служити МРТ головного мозку хворого С., 60 років, із малим кортикальним інфарктом у басейні правої СМА (рис. 2).
За нашими спостереженнями, частота та локалізація малих кортикальних інфарктів, верифікованих методом нейровізуалізації, була різною: 45 (50,6 %) —
у лівій півкулі головного мозку, 38 (42,7 %) — у правій, у 6 (6,7 %) пацієнтів верифікували бігемісферну локалізацію вогнищ інфаркту.
Для ілюстрації бігемісферного малого кортикального інфаркту наводимо мультидетекторну спіральну комп’ютерну томограму хворого М., 68 років (рис. 3).
Інфаркти глибоких відділів головного мозку
Глибокі відділи головного мозку охоплюють базальні ядра, коліно, передні відділи заднього і частково переднього стегна внутрішньої капсули, тобто значну частину підкірково-капсулярної ділянки мозку, васкуляризація яких здійснюється середньою мозковою артерією — найбільшою гілкою ВСА. Від проксимальної частини стовбура СМА відходить майже під прямим кутом група тонких судин — від 6 до 8 гілок стріарних артерій [16], які живлять кров’ю глибокі відділи півкуль головного мозку.
Ішемічні інфаркти глибоких відділів мозку в каротидному басейні в більшості випадків були пов’язані з тромботичними або емболічними наслідками атеросклерозу артерій великого й середнього калібру (макроангіопатії), ураженням внутрішньочерепних судин дрібного калібру (мікроангіопатії), а також з кардіоемболією.
Закупорка ВСА всередині черепа (1 випадок), а також оклюзія головного стовбура СМА до відходження від неї глибоких гілок (13 хворих) зумовлювала тотальний (варіант територіального) інфаркт. Захворювання розвивалося гостро, апоплектиформно і, як правило, супроводжувалося тяжким клінічним перебігом, розладами свідомості, геміплегією, геміанестезією, геміанопсією. У разі лівопівкульної локалізації вогнища виникали розлади мовлення, за умови правопівкульних інфарктів — апрактоагностичний синдром. Спостерігалися виражені загальномозкові симптоми, психомоторне збудження, вторинний дислокаційний стовбуровий синдром.
Для ілюстрації наводимо МРТ головного мозку хворого П., 75 років, із тотальним інфарктом у басейні правої ВСА (рис. 4).
Оклюзія головного стовбура СМА до відходження від неї глибоких гілок зумовлювала розвиток тотального інфаркту, що супроводжувався геміплегією, геміанестезією, геміанопсією на протилежному щодо вогнища ураження боці. Спостерігалися парез погляду, у разі лівопівкульної локалізації вогнища — розлади мовлення (моторна або тотальна афазія), а за правопівкульних інфарктів — агнозія, апраксія.
Для ілюстрації наводимо МРТ головного мозку та магнітно-резонансну ангіографію (МРА) хворого К., 24 років, з оклюзією лівої СМА (рис. 5).
Закупорка русла артерій в басейні глибоких гілок СМА великого або середнього калібру зумовлювала розвиток територіальних інфарктів, верифікованих нами у 185 хворих, а також інфарктів середнього розміру (131 пацієнт).
Для ілюстрації наводимо МРТ головного мозку хворого З., 74 років, із територіальним інфарктом правої лобно-скроневої ділянки (рис. 6).
Інфаркт у басейні глибоких гілок СМА зумовлював розвиток спастичної геміплегії, парез мімічних м’язів лиця та язика за центральним типом, інколи розлади чутливості на боці, протилежному вогнищу. Ураження лівої півкулі призводило до моторної афазії. Вогнище інфарктів у глибоких відділах головного мозку частіше верифікується у лівій півкулі — 219 (56,9 %) пацієнтів, дещо менше — 166 (43,1 %) хворих — у правій півкулі головного мозку. Ліва ВСА уражається частіше від правої, оскільки ліва загальна сонна артерія починається безпосередньо від дуги аорти, а права — від безіменної артерії, тому емболи частіше зумовлюють оклюзію лівої СМА та її гілок і рідше — правої.
Лакунарні інфаркти (55 (14,3 %) пацієнтів) верифікували в ділянках семіовального центру (променистого пучка), суміжних із внутрішньою капсулою, у ділянці задньої третини заднього стегна внутрішньої капсули (рис. 7).
У неврологічному статусі хворих із лакунарними інфарктами внаслідок ураження пірамідних шляхів найчастіше виявляється повний моторний синдром: парез мімічних м’язів за центральним типом, руки і ноги з одного боку, або частковий, коли уражається нижня частина лиця й рука, або рука й нога. Порушення чутливості, геміанопсія, мовленнєві розлади, агнозія, апраксія не характерні.
Друге місце за частотою серед каротидних синдромів лакунарного ураження після чисто рухового синдрому займав сенсомоторний лакунарний інсульт. Вогнища ішемії локалізувалися у задньому стегні внутрішньої капсули, променистому пучку (вінчику).
Виявлялися також множинні дрібні вогнища лакунарних інфарктів у білій речовині лобної, тім’яно- скроневої часток півкуль головного мозку, які зумовлювали формування судинної лейкоенцефалопатії.
Об’єм вогнищ каротидних інфарктів визначався локалізацією і калібром інфарктзалежної артерії та в середньому становив: лакунарні інфаркти — 4,6 ± 0,3 мм3; малі кортикальні інфаркти — 1,69 ± 0,70 см3; середнього розміру інфаркти — 3,3 ± 0,9 см3; територіальні інфаркти — 13,8 ± 2,3 см3; тотальні інфаркти — від 40,7 ± 12,5 см3 до 162,3 ± 75,1 см3.
З огляду на наведений аналіз клініко-нейровізуалізаційних даних каротидних інфарктів важливою була оцінка фонового неврологічного дефіциту пацієнтів після перенесеного інфаркту з локалізацією вогнища на території різних анатомічних ділянок передньоциркулярного басейну (табл. 3).
Як свідчать дані табл. 3, фоновий неврологічний дефіцит у хворих з інфарктами білої речовини лобної та значної частини тім’яної й скроневої часток головного мозку в середньому за шкалою NIHSS відповідав порушенням неврологічних функцій середнього ступеня тяжкості. Порушення життєдіяльності та ступінь дезадаптації за показниками двох шкал — мШР та ІБ були в межах від середньої (за показниками шкали ІБ) до помірної тяжкості (за показниками мШР) інвалідизації.
Фоновий неврологічний дефіцит у пацієнтів з інфарктами глибоких відділів головного мозку, тобто з ураженням значної частини підкірково-капсулярних утворень, у середньому за показниками трьох шкал — NIHSS, мШР та ІБ свідчив про тяжку інвалідизацію, фатальні наслідки.
Отже, оцінку вихідного рівня неврологічного статусу та базових показників сучасних шкал інсультів NIHSS, мШР та ІБ слід вважати важливим предиктором функціональних результатів і прогнозу пацієнта після перенесеного передньоциркулярного інфаркту.
Програма лікування пацієнтів досліджуваних груп передбачала застосування заходів невідкладної допомоги, моніторинг і корекцію функцій респіраторної й серцево-судинної системи, порушень водно-електролітного обміну, регуляцію метаболізму глюкози, нормалізацію температури тіла та стандартну диференційовану терапію. Хворим із гострим середньотяжким і тяжким ішемічним інсультом призначали внутрішньовенну форму кверцетину (Корвітин). Застосування препарату зумовлювало такі терапевтичні ефекти: стабілізацію клітинних мембран; антиоксидантну дію; протизапальний ефект; поліпшувало мікроциркуляцію; запобігало внутрішньосудинному тромбоутворенню. Крім медикаментозної терапії пацієнтам призначали комплекс реабілітаційних заходів.
Аналіз наслідків передньоциркулярних інфарктів, проведений нами без диференціації ураженої території та локалізації вогнища, показав, що 21-денний курс лікування завершили 526 (97,4 %) пацієнтів із 540 обстежених; 14 (2,6 %) хворих померли впродовж перших 14 діб спостереження (ранній період смерті). На 21-шу добу повне функціональне неврологічне відновлення досягнуто в 193 (35,7 %) пацієнтів, серед них 120 (22,2 %) обстежених перенесли лакунарний інфаркт та 73 (13,5 %) — нелакунарний; помірне відновлення неврологічних функцій досягнуто у 210 (38,9 %) хворих; у інших 127 (23,5 %) зберігалась інвалідизація. Причини ранньої смерті пацієнтів були різними: закупорка ВСА всередині черепа (1 випадок) та оклюзія головного стовбура СМА до відходження від неї глибоких гілок (11 хворих) зумовлювала тотальний (варіант територіального) інфаркт; причиною фатальних наслідків ще у 2 пацієнтів були тромбоемболія легеневої артерії (ТЕЛА) та перенесений супутній інфаркт міокарда (ІМ). У пацієнтів із вогнищами інфаркту в ділянці глибоких відділів головного мозку (підкірково-капсулярні) повне функціональне відновлення неврологічних функцій настало у 86 (22,3 %) хворих, із яких 55 перенесли лакунарний інфаркт і 31 — невеликі за розміром нелакунарні інфаркти в басейні глибоких гілок СМА дрібного калібру; помірне відновлення неврологічних функцій досягнуте в 163 (42,3 %) пацієнтів; втрата працездатності утримувалася у 127 (33,0 %) хворих та фатальні наслідки протягом перших 14 діб виникли у 12 (3,1 %) хворих із тотальним інфарктом та у 2 (0,5 %) випадках від супутніх ускладнень: ТЕЛА та ІМ.
Отже, наслідки передньоциркулярних інфарктів визначалися локалізацією ураженої артеріальної території, калібром інфарктзалежної території, розміром інфарктного вогнища.
Разом з тим отримані нами загалом кращі результати лікування в гострому періоді інсульту (порівняно із середньоміськими показниками) зумовлені додатковим включенням до схеми лікування всіх пацієнтів препарату Корвітин.
Висновки
Каротидні інфаркти виникають на різних рівнях системи кровообігу передньоциркулярного басейну. Найчастіше вогнища інфаркту виявляли в ділянці глибоких відділів головного мозку (підкіркові ядра, коліно, передні відділи заднього й частково переднього стегна внутрішньої капсули, семіовальний центр) — 385 (71,3 %) хворих; значно рідше — у 155 (28,7 %) пацієнтів — верифікували інфаркти в ділянках кори й білої речовини лобної частки та значної частини тім’яної й скроневої часток півкуль мозку.
Згідно з патогенетичним механізмом розвитку гострого ішемічного інсульту, локалізацією інфарктзалежної артерії та вогнища ураження, його розміром виявляли такі форми каротидного інфаркту мозку:
— територіальний (тотальний) інфаркт, зумовлений тромботичною або тромбоемболічною оклюзією ВСА, головного стовбура СМА і великого русла ПМА; інфаркти середнього розміру виникали при ураженні глибоких гілок СМА;
— малі кортикальні інфаркти, які здебільшого виникали внаслідок оклюзії кінцевих гілок дрібного калібру СМА, ПМА або в межових зонах кіркових гілок ПМА і СМА;
— лакунарні інфаркти локалізувалися в білій речовині півкуль мозку, глибоких відділах його півкуль, зокрема в семіовальному центрі, внутрішній капсулі, та обумовлені первинним ураженням перфорантних артерій (мікроангіопатії) на тлі артеріальної гіпертензії, часто ускладненої цукровим діабетом.
Неврологічна клініка каротидного ішемічного інсульту визначалася локалізацією вогнища ураження та його розміром. Вихідний рівень неврологічного дефіциту в пацієнтів з інфарктами кори в ділянках білої речовини лобної частки та значної частини тім’яної й скроневої часток півкуль мозку за шкалою NIHSS відповідав інсульту середньої тяжкості, ступінь дезадаптації також середній; у хворих з інфарктами глибоких відділів півкуль головного мозку фоновий неврологічний дефіцит відповідав тяжкому інсульту, ступінь дезадаптації також був тяжким.
Наслідки каротидних інфарктів визначали локалізація ураженої артеріальної території, калібр інфаркт-залежної артерії, розмір інфарктного вогнища та вид медикаментозної терапії.
Конфлікт інтересів. Не заявлений.
Отримано/Received 01.09.2021
Рецензовано/Revised 10.09.2021
Прийнято до друку/Accepted 14.09.2021
/45.jpg)
/48.jpg)

/44.jpg)
/46.jpg)
/47.jpg)
/48_2.jpg)
/49.jpg)