Сон виконує багато функцій в організмі людини, серед яких синхронізація організму з оточуючим середовищем, збереження енергії, синтез і накопичення білка й глікогену, консолідація пам’яті, видалення накопичених протягом дня в міжклітинному просторі головного мозку метаболітів [1]. Порушення нічного сну можуть виникати в будь-якому віці, але найчастіше — в людей похилого віку [2, 3]. Серед усіх порушень сну найчастіше зустрічається інсомнія. Інсомнія — це найпоширеніше порушення сну, що може розвинутися як при соматичному або психічному захворюванні, так і на тлі відносного благополуччя [1, 2]. Інсомнія — клінічний синдром, що поєднує кілька видів порушень сну. Інсомнія може призводити до розвитку серцево-судинних [3, 4], нейродегенеративних захворювань, когнітивних порушень [5], значно знижує якість життя й працездатність людини [2, 6]. Розроблено рекомендації щодо визначення інсомнії, які увійшли до Міжнародної класифікації розладів сну 3-го перегляду [7, 8].
Виділяють клінічні форми інсомнії: хронічна, гостра або ідіопатична (неуточнена). Гостра інсомнія триває менше за 3 місяці й зазвичай пов’язана з гострою стресовою подією. У цьому випадку лікар повинен купірувати її за допомогою снодійних препаратів [9]. Хронічна інсомнія триває понад 3 місяці й зазвичай вимагає проведення когнітивно-поведінкової терапії, а снодійні розглядаються як додатковий інструмент [1]. Ідіопатична інсомнія існує в пацієнта все життя й погано піддається терапії. Ці форми інсомнії вимагають особливої уваги фахівців, які мають доступ до всієї лінійки психофармакотерапії, а також працюють у тандемі з психологами [1].
Порушення нічного сну є поширеною проблемою в сучасному світі. Поширеність хронічної інсомнії в загальній популяції населення становить близько 10 %, а оборотні порушення сну виявляються набагато частіше (у 30–35 % осіб у загальній популяції). Хронічна інсомнія в 1,5 раза частіше зустрічається в жінок, ніж у чоловіків. Більш схильні до цього розладу особи з низьким соціально-економічним статусом, які не працюють або працюють за змінним графіком [10].
Виділяють 4 групи факторів, що впливають на формування інсомнії: біологічні, психологічні, соціальні, поведінкові [11].
До біологічних належать: зниження активності гальмівних систем, особливо гамма-аміномасляної кислоти (ГАМК), десинхронізація електроенцефалограми (ЕЕГ), підвищений тонус симпатичної нервової системи, підвищення рівнів катехоламінів, кортизолу, частоти серцевих скорочень і варіабельності серцевого ритму, посилення метаболізму [12].
Психологічні фактори включають підвищену емоційність, тривожність, іпохондричність, психологічну травму, афективні, депресивні розлади [9].
До соціальних факторів належать: змінна й нічна робота, низький соціоекономічний статус, сімейний анамнез інсомнії [11, 12].
На формування інсомнії впливають поведінкові розлади у вигляді порушень правил гігієни сну, куріння, зловживання алкоголем, сидячого способу життя [9]. Провокувати інсомнію можуть загострення хронічних захворювань, травма, стрес, переїзд до іншої країни, тривалий переліт, висока напруга, епідемії, стихійні лиха, психологічна травма тощо [11, 12].
Підтримують інсомнію дисбаланс гальмівних і активуючих систем, переважання тонусу симпатичної нервової системи, кіркова гіперактивація, безсистемне застосування снодійних, транквілізаторів, зловживання кавою, тютюном, алкоголем, перегляд телевізійних передач, некомфортні умови для сну, надлишок освітленості [11, 13].
Існують і інші причини інсомнії. Так, інсомнія є частим супутником психічних розладів, депресії і генералізованого тривожного розладу [1].
Гострі порушення сну можуть виникати при тирео-токсикозі, гастроезофагеальній рефлюксній хворобі.
Інсомнія часто виникає на тлі прийому лікарських засобів, особливо при самолікуванні або необґрунтованому призначенні препаратів. Найчастіше вона набуває хронічної форми на фоні прийому β-адреноблокаторів (за рахунок пригнічення ендогенного мелатоніну), селективних інгібіторів зворотного захоплення серотоніну (флуоксетин, пароксетин, циталопрам — за рахунок зміни співвідношення гальмівних і активуючих нейромедіаторів), ніфедипіну, стимуляторів, особливо кофеїну і його похідних тощо [14].
Виділяють первинну й вторинну інсомнії. Остання може виникати при синдромі неспокійних ніг, синдромі обструктивного апное сну та ін. [15, 16].
У даний час отримані переконливі докази того, що інсомнія може мати спадковий характер. В осіб зі спадкоємністю першого ступеня інсомнія розвивається з частотою від 35 до 55 % випадків, що набагато більше, ніж у загальній популяції. Ці асоціації виявляються сильнішими при наслідуванні по материнській лінії [17].
У патофізіології інсомнії основну роль відіграють порушення у вигляді підвищеного збудження в когнітивно-емоційній, поведінковій сферах, а також у вегетативній або центральній нервовій системі [18]. Це проявляється збільшенням частоти серцевих скорочень і варіабельності серцевого ритму, посиленням метаболізму протягом доби, підвищенням температури тіла, рівня секреції адренокортикотропного гормону й кортизолу (основних медіаторів реакції на стрес), особливо у вечірній час, збільшенням високочастотної електроенцефалографічної активності, що свідчить про підвищену активність симпатичної нервової системи й гіперактивацію гіпоталамо-гіпофізарно-надниркової системи під час сну й неспання. Передбачається, що фізіологічна дисрегуляція цих систем і є основною причиною розвитку інсомнії [19].
Є кілька базових моделей патогенезу інсомнії. У клінічній практиці найчастіше спираються на модель «трьох П», яку запропонував А. Шпільман у 1987 р. Згідно з цією моделлю існує 3 види факторів, що викликають інсомнію. Сприятливі фактори створюють ґрунт, на якому поступово розвивається інсомнія. Провокуючі фактори спричиняють гострий стрес, у рамках якого інсомнія дебютує. Підтримуючі фактори не дають пацієнтові відреагувати на стрес, і за рахунок цього інсомнія переходить у хронічну форму. Уявляючи сукупність «трьох П» у конкретного пацієнта, можна намагатися індивідуалізувати терапію і прогнозувати її результат [12, 18]. Діагностика інсомній базується на анамнестичних даних щодо якості й тривалості сну з боку пацієнта і його родичів. Розроблено клінічні критерії для визначення інсомній [8, 13]. Для діагностики інсомній використовують опитувальники й шкали сонливості (Епворта, Стендфордська, Каролінська та ін.). У клінічній практиці найбільш поширеним є опитувальник Епворта. Найбільш ефективним інструментом для діагностики є метод полісомнографії (ПСГ), що дозволяє якісно й кількісно оцінити порушення сну [17].
Виділяють два підходи до лікування інсомнії [11, 19]. Перший — неспецифічний, застосовується при будь-якому виді інсомнії, особливо при хронічній. Це психотерапія, і вона має три напрямки: навчання пацієнта правилам гігієни сну; поведінкова терапія: створення відповідних умов для настання сну; когнітивна терапія: зміна уявлень про власний сон. Психотерапія інсомнії також ефективна, як і фармакотерапія. Але остання є більш специфічною в лікуванні інсомній.
Спить людина або не спить, залежить від балансу активності гальмівних і активуючих систем у головному мозку. Призначаючи снодійні, ми змінюємо цей баланс таким чином, щоб людині було легко розслабитись і заснути. Основні групи препаратів для лікування інсомній: похідні бензодіазепіну й фенобарбітал, інші ліганди ГАМК (Z-група), антидепресанти із седативною дією, що застосовуються для лікування первинної і вторинної інсомнії (тразодон, амітриптилін, міансерин і міртазапін, агомелатин) та ін. [8, 13].
Найбільш ефективними серед снодійних засобів вважаються похідні бензодіазепінів [20]. Похідні бензодіазепінів (феназепам, клоназепам, гідазепам та ін.) збільшують спорідненість гамма-аміномасляної кислоти до рецептора, підвищують гальмівний постсинаптичний потенціал, знижують збудливість нейрона. Їх снодійний ефект реалізується через α1-субодиницю рецепторного комплексу ГАМК. Вони мають анксіолітичний, амнестичний, міорелаксуючий ефекти; з огляду на останній вони протипоказані при синдромі апное сну. Більшість бензодіазепінів дають відразу декілька перелічених ефектів і відрізняються тривалим, до 12 год і більше, періодом напіввиведення. Через свою низьку вибірковість і тривалу дію бензодіазепіни викликають побічні ефекти: погіршення пам’яті, денну сонливість, нестійкість. При тривалому застосуванні вони можуть спричинити звикання, що формується через зниження чутливості ГАМК-рецепторного комплексу. Щоб запобігти цьому, бензодіазепіни слід застосовувати не більше ніж 3–4 тижні.
До снодійних засобів належать блокатори центральних Н-рецепторів доксиламін, дифенілгідрамін, адаптогени (препарати мелатоніну) та інші ліганди ГАМК (Z-група). Низка молекул не мають бензодіазепінового компонента у своїй структурі, але здатні зв’язуватися з рецепторним комплексом ГАМК, виявляють високий афінітет до α1-субодиниці й тому більш безпечні; характеризуються відносно коротким (від 1 до 5 год) періодом напіввиведення. Ці молекули — зопіклон, золпідем і залеплон — широко застосовуються в клінічній практиці.
До цієї групи препаратів належить Левана® IC (виробництва «ІнтерХім», Україна). Препарат є частковим (неповним) селективним агоністом ГАМК-А-рецепторного комплексу. Має виражену снодійну, анксіолітичну, помірну міорелаксуючу й протисудомну дію; посилює ефект снодійних, наркотичних і нейролептичних препаратів, етилового спирту. Особливістю снодійної дії препарату є здатність збільшувати тривалість не тільки повільнохвильового, але й парадоксального сну при незмінній кількості його епізодів, що робить снодійний ефект препарату більш фізіологічним. Препарат швидко всмоктується з шлунково-кишкового тракту, біодоступність становить близько 80 %, Т1/2 — 10–14 год (препарат може бути віднесений до засобів середньої тривалості дії). Виділяється ренальним і біліарним шляхами у вигляді активного метаболіту — 3-оксипохідного.
З наукової точки зору цікаво було вивчити ефективність і безпеку препарату Левана® IC у лікуванні первинних інсомній і порівняти його з препаратом Імован®, що має достатню доказову базу. Імован® — снодійний препарат із групи циклопіролонів. Має снодійну, седативну, транквілізуючу, протисудомну й міорелаксуючу дії. Ці властивості пов’язані з його дією на рецептори центральної нервової системи, що належать до макромолекулярного комплексу ГАМК, модулюючи відкриття каналів для іонів хлору. Звикання до снодійної дії препарату відсутнє протягом тривалого періоду лікування, аж до 17 тижнів. Імован® швидко всмоктується. Значення Cmax у плазмі крові досягаються в межах 1,5–2 год і становлять приблизно 30 і 60 нг/мл після прийому всередину 3,75 і 7,5 мг відповідно. Абсорбція препарату не залежить від статі, а також прийому їжі.
Мета дослідження: аналіз ефективності й безпеки препарату Левана® IC порівняно з препаратом Імован® у лікуванні інсомнії.
Завдання дослідження:
— оцінити вплив препарату Левана® IC порівняно з препаратом Імован® на динаміку вираженості інсомнії в процесі лікування за анкетою бальної оцінки суб’єктивних характеристик сну і за даними опитувальника денної сонливості Епворта (Epworth sleepiness scale);
— оцінити вплив препарату Левана® IC порівняно з препаратом Імован® на динаміку показників психо-емоційного стану в процесі лікування за даними шкали тривожності Спілбергера — Ханіна (State-Trait Anxiety Inventory — STAI);
— оцінити вплив препарату Левана® IC порівняно з препаратом Імован® на показники структури сну за даними полісомнографії;
— оцінити безпеку препарату Левана® IC.
Матеріали та методи
Методи та дизайн дослідження
— Клінічне обстеження хворих, що містить збір анамнезу життя і захворювання; визначення демографічних (вік, стать) і антропометричних (маса тіла) даних, попередній і поточний прийом ліків; об’єктивне обстеження (аускультація серця і легенів, пальпація і перкусія живота, огляд шкіри і слизових), вимірювання артеріального тиску, частоти серцевих скорочень і температури тіла.
— Психодіагностичне обстеження з використанням анкети бальної оцінки суб’єктивних характеристик сну, опитувальника денної сонливості Епворта і шкали тривожності Спілбергера — Ханіна.
— Полісомнографічне дослідження за допомогою комп’ютерного енцефалографа «Нейрон-Спектр 4/ВПМ» з програмним забезпеченням «Нейрон-Спектр ПСГ». Побудова гіпнограми з використанням епохи 30 с, розрахунок стадій і фаз сну за Міжнародною класифікацією Rechtshaffen and Kales (1968) [21].
— Лабораторні дослідження за такими показниками: загальний аналіз крові (гемоглобін, еритроцити, гематокрит, лейкоцити, швидкість осідання еритроцитів); загальний аналіз сечі (рН, питома вага, білок, цукор, лейкоцити, еритроцити, епітеліальні клітини, циліндри).
— Статистична обробка даних проводилась за допомогою програм Excel і SPSS, розраховувались середні значення показників (M) і стандартна помилка середнього значення (m), вірогідність відмінностей визначалась за допомогою непараметричного критерію Манна — Уїтні — Вілкоксона при рівні значимості р ≤ 0,05.
Тривалість дослідження для кожного пацієнта становила 18–20 днів, з них: 3–5 днів скринінг, 14 днів лікування, 1 день після закінчення прийому ліків — заключний візит. Під час дослідження було 4 візити: візит 1 — скринінг, візит 2 — рандомізація і 1-й день лікування, візит 3 — на 7-й день терапії, візит 4 — на 15-й день від початку терапії.
Критерії включення:
— чоловіки і жінки віком від 18 до 40 років;
— пацієнти з наявністю первинної хронічної інсомнії неорганічної етіології;
— наявність скарг на розлад сну, що полягає в труднощах засинання, або в нічних пробудженнях, або в поганій якості сну;
— розлад сну відзначається не менше від трьох разів на тиждень;
— вираженість інсомнії за анкетою бальної оцінки суб’єктивних характеристик сну 11–18 балів;
— негативний тест на вагітність для жінок репродуктивного віку, а також згода на застосування адекватних засобів контрацепції в період дослідження;
— інформована письмова згода пацієнта на участь в дослідженні.
Критерії виключення:
— відома з анамнезу індивідуальна чутливість до компонентів досліджуваних препаратів;
— вагітність, лактація;
— розлади сну, пов’язані із змінним режимом роботи;
— наявність органічної судинної патології;
— шизофренія, епілепсія, афективні розлади, депресія та інші клінічно значущі психічні порушення;
— тяжка хронічна дихальна недостатність в анамнезі,
— синдром зупинки дихання уві сні (апное);
— спінальна й мозочкова атаксія;
— печінкова і/або ниркова недостатність в анамнезі;
— глаукома, у тому числі в анамнезі пацієнта або в сімейному анамнезі;
— міастенія;
— аденома і/або гіперплазія простати (симптоми затримки сечі) в анамнезі;
— верифіковані злоякісні новоутворення;
— алкоголізм або наркоманія в анамнезі;
— вроджена галактоземія, синдром порушення абсорбції глюкози й галактози, лактазна недостатність в анамнезі;
— лікування нейролептиками, антидепресантами, анксіолітиками, седативними або снодійними засобами протягом 4 тижнів, що передували скринінгу;
— будь-які інші супутні соматичні або психічні захворювання, наявність яких, на думку дослідника, може перешкоджати участі пацієнта в дослідженні або вплинути на результати дослідження;
— діяльність, що вимагає підвищеної уваги й швидкої рухової і психічної реакції (наприклад, водіння транспорту);
— одночасна участь в будь-якому іншому клінічному дослідженні.
Результати та обговорення
Було обстежено в динаміці 60 хворих (20 чоловіків і 40 жінок) віком від 18 до 40 років (середній вік 34,47 ± 1,41 року). Хворі мали клінічні ознаки вегетосудинної дистонії. У всіх обстежених визначені клінічні симптоми первинної хронічної інсомнії. Порушення сну тривали від 3 до 12 місяців (середній показник — 5,13 ± 0,27 місяця). Методом простої рандомізації всі хворі були поділені на 2 групи (основна група і група порівняння) по 30 хворих у кожній. Пацієнти основної групи отримували препарат Левана® IC по 0,5 мг (1 таблетка) 1 раз на добу за 30 хвилин до сну. У разі недостатньої ефективності доза препарату збільшувалась до 1,0 мг (2 таблетки по 0,5 мг) 1 раз на добу за 30 хв до сну. У 5 пацієнтів на 2-й день терапії доза препарату Левана® IC була збільшена до 1,0 мг на ніч. Пацієнти групи порівняння отримували препарат Імован® по 7,5 мг (1 таблетка) 1 раз на добу за 30 хв до сну. Курс лікування для всіх хворих становив 14 днів. Пацієнти додержувались рекомендацій з гігієни сну (лягати спати й вставати в один і той же час; виключити денний сон, особливо в другій половині дня; не вживати на ніч чай або каву; зменшити стресові ситуації, розумове навантаження, особливо у вечірні години; організувати фізичне навантаження не пізніше ніж за 2 години до сну; регулярно використовувати водні процедури перед сном).
Анкета бальної оцінки суб’єктивних характеристик сну була запропонована О.М. Вейном [22]. Оціночна шкала включає наступні показники: тривалість часу засинання (від «миттєво» — 5 балів до «дуже довго» — 1 бал); тривалість сну (від «дуже довга» — 5 балів до «дуже коротка» — 1 бал); кількість нічних пробуджень (від «ні» — 5 балів до «дуже часто» — 1 бал); кількість сновидінь (від «ні» — 5 балів до «дуже часто» — 1 бал); якість сну (від «відмінно» — 5 балів до «дуже погано» — 1 бал); якість ранкового пробудження (від «відмінно» — 5 балів до «дуже погано» — 1 бал). Сумарний результат за всіма оцінками менше за 19 балів відповідає інсомнії; 19–21 бал — граничний стан; понад 22 бали — показник норми, максимальна сумарна оцінка — 30 балів.
У табл. 1 наведені дані сумарних показників оцінки суб’єктивних характеристик сну в пацієнтів обох груп спостереження в динаміці.
Як видно з табл. 1, в обох групах спостереження за три дні до початку лікування показники опитувальника суб’єктивної оцінки сну мали низькі значення, які відповідали рівню інсомнії, вірогідних міжгрупових відмінностей не визначено. З перших днів лікування в обох групах хворих спостерігалось нівелювання симптомів інсомнії. В основній групі в більшості пацієнтів на 3-й день прийому препарату Левана® IC сумарний бал за суб’єктивною оцінкою показників сну досяг 22 балів, що відповідало нижній межі норми. У більшості пацієнтів групи порівняння, які приймали препарат Імован®, оцінка 22 бали була зафіксована тільки на 8-й день лікування. До кінця лікування в обох групах простежувалась позитивна динаміка, що проявлялась редукцією симптомів інсомнії.
/25.jpg)
Ми провели більш детальний аналіз суб’єктивних характеристик нічного сну. У пацієнтів основної групи на тлі прийому препарату Левана® IC уже на 2-й день терапії визначались вірогідно вищі показники за шкалами «тривалість часу засинання» (р = 0,04) і «кількість нічних пробуджень» (р = 0,01). На 3-й день лікування під впливом препарату Левана® IC в обстежених пацієнтів поряд з вірогідно вищими показниками за шкалами «тривалість часу засинання» і «кількість нічних пробуджень» простежується ще й вірогідне підвищення показників за шкалами «якість сну» (р = 0,01) і «якість ранкового пробудження» (р = 0,02). На 5-й день лікування в обстежених нами хворих з’являються вірогідні розбіжності між показниками тривалості нічного сну з перевищенням у хворих основної групи. Починаючи з 5-го дня і до кінця курсу лікування в пацієнтів основної групи на тлі прийому препарату Левана® IC простежується статистично значиме стійке перевищення значень таких показників, як тривалість часу засинання, тривалість сну, якість нічного сну і якість ранкового пробудження. Порівняння значень показників кількості нічних пробуджень довело нестійкість вірогідних розбіжностей між групами пацієнтів упродовж курсу лікування. А такий показник суб’єктивної оцінки нічного сну, як кількість сновидінь, взагалі не мав вірогідних відмінностей у групах спостереження впродовж всього курсу лікування.
У пацієнтів основної групи на 15-й день спостереження сумарний бал за суб’єктивною оцінкою нічного сну був вірогідно вищим.
Для оцінки вираженості денної сонливості в процесі лікування використовувався опитувальник Епворта. Опитувальник заповнювався пацієнтом протягом трьох днів до початку лікування, а потім на 2–15-й дні лікування. Пацієнту пропонували оцінити можливість задрімати або навіть заснути в різних ситуаціях і оцінити ймовірність цього в балах (0 — ніколи, 1 — низька, 2 — помірна, 3 — висока): читання сидячи; перегляд телепередач; пасивна участь у громадських заходах (сидячи у театрі, на зборах); поїздка пасажиром у машині (якщо поїздка триває щонайменше годину); відпочинок лежачи після обіду, коли дозволяє ситуація; сидячи або розмовляючи з будь-ким; сидячи спокійно після їди (без вживання алкоголю); за кермом автомобіля, який зупинився на кілька хвилин під час руху. Сума показників за даними опитувальника Епворта характеризувала сонливість як: слабку (1–8 балів), помірну (9–16 балів), значну (17–24 бали).
У табл. 2 надані сумарні показники денної сонливості опитувальника Епворта в пацієнтів обох груп спостереження в динаміці.
Як видно з табл. 2, до початку лікування в усіх обстежених пацієнтів діагностовано денну сонливість помірної вираженості. На тлі проведення курсу лікування у всіх пацієнтів зменшувалась вираженість денної сон-ливості. Під впливом препарату Левана® IC отримано статистично значимі більш низькі показники денної сонливості з перших днів лікування й до кінця курсу терапії. Так, у пацієнтів основної групи вже на 2-й день терапії помірно виражена денна сонливість перейшла в категорію слабкої сонливості, що зберігалась до кінця лікування. Під впливом препарату Імован® денна сонливість вираженого ступеня зберігалася ще й на 2-й день терапії і почала послаблюватись на 3-й день терапії. Отже, під впливом препарату Левана® IC визначені більш швидкі темпи нівелювання симптомів денної сонливості.
/26.jpg)
Враховуючи високу коморбідність порушень сну й тривожної симптоматики, ми провели обстеження пацієнтів обох груп спостереження за допомогою шкали тривожності Спілбергера — Ханіна до і після курсу лікування. Шкала діагностики самооцінки Ч.Д. Спілбергера була адаптована Ю.Л. Ханіним для кількісної оцінки рівня особистісної тривожності як стійкої характеристики людини й ситуативної тривожності як стану в конкретний момент часу. Рівень особистісної тривожності в обстежених хворих був дещо підвищений, а саме: в основній групі він відповідав оцінці 47,3 ± 6,7 бала, а в групі порівняння — 46,9 ± 5,1 бала, вірогідних міжгрупових відмінностей не визначено. За шкалою ситуативної тривожності до початку лікування також отримані дещо підвищені оцінки, у хворих основної групи — 49,3 ± 4,7 бала, а у хворих групи порівняння — 48,7 ± 5,4 бала, ці дані також вірогідно не відрізнялись. У хворих, які під час лікування приймали препарат Левана® IC, рівень ситуативної тривожності знизився до 44,8 ± 4,4 бала, а в пацієнтів групи порівняння — до 45,5 ± 5,0 бала, але дані зміни не досягли статистично значимих відмінностей.
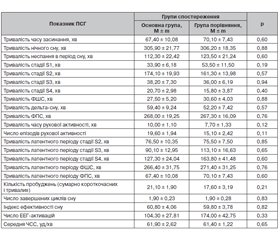
Проведення полісомнографічного дослідження в динаміці дозволило виявити об’єктивні зміни в структурі нічного сну в пацієнтів в обох групах спостереження. Ми проаналізували міжгрупові розбіжності таких показників сну, як тривалість часу засинання; тривалість нічного сну; тривалість неспання в період сну; тривалість фази повільнохвильового сну (ФПС) у цілому, а також окремо тривалість стадії S1, тривалість стадії S2, тривалість стадії S3, тривалість стадії S4, тривалість дельта-сну (сумарно стадії S3 і S4); тривалість фази швидкого сну (ФШС); тривалість часу рухової активності; число епізодів рухової активності; тривалість латентного періоду стадії S2; тривалість латентного періоду стадії S3; тривалість латентного періоду стадії S4; тривалість латентного періоду ФШС; тривалість латентного періоду ФПС; кількість пробуджень (сумарно короткочасних і тривалих); число завершених циклів сну; індекс ефективності сну; число електроенцефалографічних патернів спонтанної реакції активації (ЕЕГ-активації) і середню частоту серцевих скорочень (ЧСС). У табл. 3 наведені дані пацієнтів обох груп спостереження до лікування.
Як видно з табл. 3, у пацієнтів в обох групах спостерігались подовження часу засинання, низька тривалість нічного сну, дефіцит повільнохвильового сну в цілому і передусім дельта-сну, подовження латентності фази швидкого сну, зменшення числа його епізодів і їх тривалості, що призводить до порушення циклічності сну. Подовження періодів нічного неспання, часті нічні пробудження сприяли зменшенню ефективності сну. Ми не аналізували окремо випадки короткочасних (здебільшого не усвідомлюваних) і довготривалих (понад 3 хв) пробуджень, бо вони мають спільний механізм формування, а їх тривалість відображалась у показниках тривалості нічного неспання. Також були відмічені часті патерни спонтанних ЕЕГ-активацій, що перешкоджали поглибленню нічного сну, переходу до стадій поверхневого чи дрімотного сну або пробудження. Стан вегетативного забезпечення оцінювали за показником середньої ЧСС. Результати аналізу показали, що до початку лікування показники сну за даними ПСГ в обох групах спостереження вірогідно не відрізнялись. Далі ми провели аналіз показників ПСГ в обох групах спостереження після проведення 14-денного курсу лікування інсомнії. У табл. 4 наведені дані пацієнтів обох груп спостереження після лікування.
/27.jpg)
Як видно з табл. 4, за більшістю показників у пацієнтів основної групи визначено статистично значиме переважання порівняно з групою контролю. Основні статистично підтверджені переваги, що обумовлювались впливом препарату Левана® IC, такі: скорочення часу засинання, зменшення тривалості часу неспання в період сну, зменшення тривалості латентних періодів стадій фази повільнохвильового сну й фази швидкого сну, зменшення тривалості дрімотного стану впродовж ночі, збільшення тривалості дельта-сну й тривалості ФШС, зменшення числа ЕЕГ-активацій, нормалізація циклічної структури сну й збільшення числа завершених циклів сну, також визначено вірогідне зменшення числа епізодів рухової активності й кількості нічних пробуджень, що значно покращило ефективність нічного сну. За такими показниками, як загальна тривалість нічного сну, тривалість ФПС взагалі і стадії S2 зокрема, тривалість часу рухової активності й середня ЧСС, вірогідні відмінності після лікування не визначені.
Проведено аналіз показників ПСГ-дослідження в основній групі до і після лікування препаратом Левана® IC. Дані наведені в табл. 5.
Після проведеного лікування інсомнії препаратом Левана® IC практично за всіма обраними показниками нічного сну (табл. 5) отриманий статистично значимий позитивний результат, що проявлявся в нормалізації процесу засинання, збільшенні тривалості нічного сну, збільшенні тривалості глибоких стадій ФПС і скороченні стадій дрімотного стану, збільшенні тривалості ФШС, відновленні циклічності сну і його ефективності. Відсутність вірогідних відмінностей визначена тільки щодо показника середньої ЧСС, який зберігав достатньо стабільні значення в межах норми.
/28.jpg)
/29.jpg)
Аналогічно були проаналізовані дані ПСГ-дослідження в пацієнтів групи порівняння до і після лікування препаратом Імован®. Під впливом препарату Імован® також відбувається редукція багатьох об’єктивних показників інсомнії. Визначено, що значно покращувався процес засинання, збільшувалась тривалість нічного сну, збільшувалась тривалість ФПС і її глибоких стадій, збільшувалась тривалість ФШС, зменшувалась тривалість латентних періодів фаз і стадій сну, покращувалась ефективність сну. Відсутність вірогідних відмінностей визначена щодо таких показників, як тривалість стадії S1, тривалість часу рухової активності і число епізодів рухової активності, кількість нічних пробуджень, число ЕЕГ-активацій, число завершених циклів сну і середня ЧСС.
Слід відзначити, що впродовж усього терміну спостереження за пацієнтами обох груп побічних ефектів, які вимагали відміни призначених препаратів, не зареєстровано. Показники клінічних аналізів крові й сечі впродовж лікування не мали клінічно значущих відхилень. Показники температури, ЧСС і артеріального тиску, які вимірювались під час візитів, зберігались у межах норми.
Висновки
1. Проведене дослідження за більшістю показників суб’єктивної і об’єктивної оцінки статистично підтвердило швидку й виражену клінічну ефективність препарату Левана® IC порівняно з препаратом Імован® у лікуванні інсомнії.
2. Доведено, що під впливом препарату Левана® IC на 3-й день терапії в більшості пацієнтів сумарний бал за суб’єктивною оцінкою показників сну досяг 22, що відповідало нижній межі норми. Також починаючи з 2-го дня терапії спостерігалось зменшення інтенсивності денної сонливості.
3. Показано, що покращення якості нічного сну приводило до зменшення рівня ситуативної тривожності в обох групах спостереження з деяким переважанням в групі, у якій проводилось лікування препаратом Левана® IC.
4. За даними ПСГ-дослідження встановлено, що на тлі терапії препаратом Левана® IC простежувалась нормалізація процесу засинання, збільшення тривалості нічного сну, збільшення тривалості глибоких стадій фази повільного сну й зменшення стадій дрімотного стану, збільшення тривалості фаз швидкого сну, відновлення циклічності сну і його ефективності.
Конфлікт інтересів. Не заявлений.
Отримано/Received 16.11.2021
Рецензовано/Revised 02.12.2021
Прийнято до друку/Accepted 13.12.2021

/25.jpg)
/26.jpg)
/27.jpg)
/28.jpg)
/29.jpg)