Вступ
Реканалізаційна терапія є золотим стандартом лікування гострого ішемічного інсульту. З моменту його схвалення до використання внутрішньовенний тромболізис із застосуванням рекомбінантного тканинного активатора плазміногену (rtPA) є рутинною системною терапією для окремих випадків інсульту, і протягом останніх п’яти років він разом із тромб-ектомією є терапією першого вибору при оклюзії великих судин передніх ділянок мозку [1, 2]. Проте, незважаючи на високі показники ефективності реканалізації, деякі пацієнти не отримують переваги від жодного з вищезазначених методів при їх застосуванні окремо або в комбінації. Пацієнти, яким вводили rtPA, все ще демонструють вірогідно більшу частоту виникнення симптоматичних внутрішньочерепних кровотеч у перші 24 години після лікування порівняно з пацієнтами, у яких не проводився тромболізис [3], і навіть успішна реканалізація закупорених судин не призводить до ефективної реперфузії майже в половині випадків [4, 5]. Більше того, рання реканалізація, яка є передумовою хорошого результату, все ще може призвести до невдалої реперфузії або реперфузійної травми. Незважаючи на позитивні результати клінічних досліджень, реканалізація є невдалою принаймні у 20 % пацієнтів, а неефективна реканалізація зустрічається майже у 60 % пацієнтів [6]. У більшості з цих пацієнтів не відзначається клінічного покращення [7, 8]. Спроби досягти належної нейропротекції у цих пацієнтів теж поки що не мали вірогідного клінічного успіху [9, 10]. Оскільки ней-розапалення відіграє важливу роль при ішемічному інсульті, що призводить до нейротоксичності та порушення гематоенцефалічного бар’єра і до більш високого ризику розвитку геморагічної трансформації в ішемізованій тканині, особливо після лікування rtPA, препарат, який може впливати на ці механізми, може бути корисним у пацієнтів із гострим інсультом після неефективної реканалізації [9–11].
Церебролізин, нейропептидний препарат з доведеною нейротрофічною та нейропротекторною дією in vitro, ще має отримати підтвердження ефективності у клінічних умовах гострого інсульту. Хоча кілька досліджень продемонстрували позитивний клінічний ефект і співвідношення користь — ризик [12], метааналіз семи рандомізованих клінічних досліджень продемонстрував докази середньої якості, що Церебролізин має незначний вплив або зовсім не має позитивного впливу на запобігання смерті від усіх причин при гострому ішемічному інсульті та потенційно збільшує частоту нелетальних серйозних побічних явищ, тоді як загальна кількість серйозних побічних явищ подібна до плацебо [13]. Однак перше клінічне випробування, у якому досліджували комбінацію Церебролізину з тромболітичною терапією з використанням rtPA, продемонструвало хороший профіль безпеки препарату, а також сприятливий вплив на неврологічний результат (оцінювали за шкалою інсульту Національного інституту охорони здоров’я) порівняно з випадками, коли застосовували тільки rtPA [14]. Крім того, нещодавній метааналіз дев’яти досліджень з ішемічним інсультом продемонстрував статистично вірогідний вплив Церебролізину на покращення функціонального результату, що визначався за допомогою mRS на 90-й день після інсульту у підгрупі пацієнтів із інсультом помірного та тяжкого ступеня [12]. Для підтвердження попередніх висновків ми провели проспективне дослідження, у якому порівняли клінічний результат та частоту геморагічних ускладнень у групі пацієнтів із гострим інсультом після неефективної реканалізації, які отримували Церебролізин, порівняно з групою пацієнтів із відповідним інсультом, які отримували лише стандартну терапію.
Матеріали та методи
У дане проспективне відкрите дослідження ми включили пацієнтів віком старше 18 років із діагнозом «гострий ішемічний інсульт» та початковим показником за шкалою інсульту Національного інституту охорони здоров’я (NIHSS) > 8, які не мали протипоказань для реканалізації. Реканалізаційну терапію проводили відповідно до міжнародних та національних рекомендацій. Усі пацієнти, якщо у них не було протипоказань, отримували внутрішньовенну тромболітичну терапію (альтеплаза 0,9 мг/кг, максимальна доза 90 мг, 10 % препарату введено в/в болюсно, а решта — в/в протягом 60 хв), з наступною тромбектомією, якщо оклюзію великих судин було підтверджено ангіографією. Усі пацієнти проходили лікування у відділенні інтенсивної терапії Університетської лікарні Загреба під наглядом фахівців з інтервенційної неврології та неврологів, що спеціалізуються на лікуванні інсульту. Пацієнти були набрані з січня 2018 року по січень 2019 року та спостерігалися щонайменше 12 місяців. Дослідження було схвалено комітетом з етики Університетської лікарні Загреба до початку набору пацієнтів, і кожен пацієнт або його законний представник підписали інформовану згоду на участь у дослідженні. Після реканалізації та не пізніше 24 год після появи симптомів пацієнти були розподілені в досліджувану або контрольну групи послідовно у співвідношенні 1 : 1. Критеріями включення були діагноз гострого ішемічного інсульту з початковим показником NIHSS > 8 і показання до тромболітичної терапії, тромбектомії або обох цих втручань, а також неефективна рання реканалізація. Неефективна реканалізація визначалася або критеріями нейровізуалізації, або клінічним погіршенням. Критеріями нейровізуалізації для відсутності реканалізації були TICI 2a або менше на контрольній ангіографії або зона інфаркту, що відповідає оклюзованій артерії, на контрольній комп’ютерній томографії. Клінічними критеріями неефективної реканалізації були відсутність покращення показника NIHSS або його погіршення більше ніж на 2 бали протягом перших 12 годин після реканалізації. Досліджувана група отримувала Церебролізин внутрішньовенно (30 мл/добу в/в протягом 60 хв) протягом мінімум 14 і максимум 21 дня, починаючи не пізніше 24 год після появи симптомів. Критеріями виключення були показник за модифікованою шкалою Ренкіна (mRS) > 2, ниркова або печінкова недостатність, гострі інфекції, вагітність, відома алергія на досліджуваний препарат або участь в іншому клінічному дослідженні. Лікування та догляд за пацієнтами в дослідженні проводилися відповідно до стандартних протоколів лікування інсульту. Проаналізовано та порівняно вік пацієнтів, стать, тяжкість інсульту, застосування реканалізаційної терапії та етіологію інсульту. Ефективність лікування Церебролізином оцінювали за допомогою NIHSS на 7-й день після розвитку інсульту та mRS під час виписки, а також через 3 та 12 місяців після інсульту. Оцінку проводив незалежний експерт, навчений роботі зі шкалами оцінки інсульту. Безпека оцінювалася шляхом ретельного моніторингу клінічного статусу, побічних явищ та рутинних лабораторних тестів. Нейровізуалізація включала безконтрастну комп’ютерну томографію головного мозку для всіх пацієнтів не пізніше ніж через 24 години після реканалізації, КТ або МРТ головного мозку на 7-й день після надходження у відділення та контрольну КТ або МРТ головного мозку через 6–12 місяців після інсульту.
Основною метою дослідження була оцінка клінічної ефективності Церебролізину як додаткової терапії у пацієнтів із помірним або тяжким інсультом після неефективної реканалізації. Як вторинну мету нашого дослідження ми розглядали швидкість геморагічної трансформації після реканалізації, яка була визначена або як симптомна внутрішньомозкова гематома (sICH), або як безсимптомна внутрішньомозкова гематома (aICH), представлена як геморагічна трансформація, продемонстрована за допомогою нейровізуалізації (комп’ютерної томографії головного мозку), що проводилася через 24 години та на 7-й день після появи симптомів.
Статистичний аналіз
Результати обох груп порівнювали та аналізували за допомогою відповідних методів описової статистики. Статистичний аналіз проводили за допомогою IBM SPSS Statistics 25. Для визначення нормального розподілу даних використовувався тест Колмогорова — Смирнова. Відмінності в розподілі категоріальних змінних визначали за допомогою тесту хі-квадрат. Для аналізу відмінностей кількісних змінних використовували параметричний (незалежний t-критерій) та непараметричний (критерій Манна — Уїтні) статистичні методи. Рівень статистичної вірогідності встановлено як p < 0,05, двосторонній.
Результати
У дослідження були включені дві групи пацієнтів, які порівнювали між собою. Після проведення реканалізації група 1 (дослідна) на додаток до стандартного лікування отримувала в/в Церебролізин, а група 2 (контрольна) — тільки стандартне лікування. Групу Церебролізину становили 23 пацієнти (середній вік 76,0 ± 9,8 року, 9 жінок), а контрольну — 21 пацієнт (середній вік 72,7 ± 10,6 року, 11 жінок). Між групами не було статистично вірогідної різниці за статтю та віком (p = 0,378 і p = 0,296 відповідно), а також за базовими характеристиками. Методи лікування також були ідентичними: 1 пацієнту у кожній групі проводилася лише тромбектомія; лише тромболізис проводився 15 пацієнтам у групі Церебролізину та 16 пацієнтам у контрольній групі; тромболізис із подальшою тромбектомією проводили у 7 пацієнтів групи Церебролізину та у 4 пацієнтів конт-рольної групи. У всіх пацієнтів, включених у дослідження, інсульт локалізувався у басейні передніх мозкових артерій. Крім того, у всіх пацієнтів була досліджена етіологія інсульту (табл. 1). Не було статистично вірогідної різниці між групами щодо швидкості реканалізації, яку вимірювали за шкалою тромболізису при інфаркті головного мозку (шкала TICI).
/11.jpg)
Порівняння між групами середнього значення показника за шкалою NIHSS у три моменти часу — вихідний рівень NIHSS, а також NIHSS через 24 години та 7 днів після інсульту — наведено в табл. 2. Не було статистично вірогідної різниці між двома групами щодо показника за NIHSS на початку дослідження та в будь-який момент часу, хоча в групі Церебролізину продемонстрована тенденція до кращого показника за NIHSS на 7-й день із медіаною 6 порівняно з 9 у конт-рольній групі.
Етіологія інсульту дещо відрізнялася між групами — більша кількість кардіоемболічних інсультів була у групі Церебролізину, тоді як у контрольній групі було більше інсультів, спричинених атеросклерозом великих артерій, а також інсультів унаслідок оклюзії дрібних артерій (лакунарних інсультів). Однак ця різниця не була статистично вірогідною.
Що стосується дотримання режиму лікування в групі Церебролізину, то всі пацієнти, крім одного (летальний кінець на 3-й день), отримували від 14 до 21 інфузії Церебролізину відповідно до протоколу дослідження. Загалом 10 пацієнтів отримали необхідний мінімум длинное тире с пробелами 14 інфузій, а 12 пацієнтів отримали від 15 до 21 інфузії.
/12.jpg)
У табл. 3 наведене порівняння показників за шкалою mRS у пацієнтів двох груп в три моменти часу — ранній показник за mRS на момент виписки (від 14 до 28 днів після появи симптомів), mRS через 90 днів і mRS через 12 місяців спостереження. Хоча не було виявлено жодної статистично вірогідної різниці між двома групами за шкалою mRS у будь-який момент часу, група Церебролізину продемонструвала явну описову перевагу над контрольною групою з різницею в середньому значенні mRS за 12 місяців (група Церебролізину — 2; контрольна група — 4), що означає наявність чіткої тенденції до кращого результату через 12 місяців після інсульту. Ці результати також підтверджуються, якщо ми згідно з mRS подамо результат як хороший, поганий і летальний (табл. 4, рис. 1). Встановлено чітку тенденцію щодо переваги Церебролізину над контрольною групою через 12 місяців після інсульту, хоча різниця не була статистично вірогідною. На цей момент 70 % пацієнтів у групі Церебролізину мали хороший функціональний результат із балом mRS 0–3 порівняно з лише 48 % пацієнтів у контрольній групі.
/12_2.jpg)
Що стосується смертності після 90 днів спостереження, в одного пацієнта (4 %) в групі Церебролізину та у 4 (19 %) у контрольній групі був летальний результат. На момент 12-місячного терміну від моменту розвитку інсульту померли 3 пацієнти (13 %) у групі Церебролізину проти 9 пацієнтів (43 %) у контрольній групі, що свідчить про вірогідне зниження рівня смертності на користь пацієнтів, які отримували Церебролізин (p = 0,033).
/13.jpg)
У кожній групі в 1 пацієнта протягом 24 годин після реканалізації на основі контрольної КТ та погіршення клінічного статусу (про що свідчить підвищення показника за NIHSS більше ніж на 2 бали) було діагностовано внутрішньомозкову гематому великого розміру. У групі Церебролізину це був пацієнт 78 років, з миготливою аритмією, серцевою недостатністю та початковим показником за NIHSS = 9, який отримував варфарин та мав МНВ 1,1. Йому було проведено тромболізис, церебральна ангіографія не показала оклюзії великої судини. Тромбектомія не проводилася. Протягом 7 годин після тромболізису клінічний статус пацієнта погіршився із збільшенням показника за NIHSS до 13, а КТ продемонструвала наявність внутрішньомозкової гематоми в басейні лівої середньої мозкової артерії. Він отримував стандартну терапію, включаючи Церебролізин, протягом 12 годин від початку симптомів інсульту. Хворий помер на третю добу після надходження в стаціонар. У контрольній групі пацієнтом, який мав летальний результат (mRS 6 через 90 днів), був 67-річний чоловік із некомпенсованою артеріальною гіпертензією та цукровим діабетом, початковим показником за NIHSS = 10 та гострою оклюзією лівої середньої мозкової артерії, підтвердженою методами нейровізуалізації. Через 3 години після появи симптомів пацієнту було проведено тромболізис, а через 4,5 години — тромбектомію. Результат реканалізації через 35 хв був ідеальним (TICI 3), однак через 5 год після тромбектомії стан пацієнта раптово погіршився, а на КТ виявлено велику внутрішньочерепну гематому у лівій півкулі, що відповідає визначенню реперфузійної травми. Можливість хірургічного втручання з приводу гематоми у кожного з цих пацієнтів обговорювалася з нейрохірургом, але його застосування було відхилено через глибоку локалізацію гематоми.
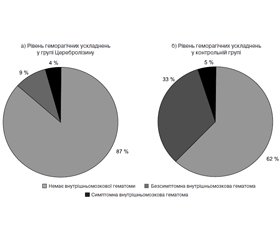
У 2 пацієнтів у групі Церебролізину та у 7 пацієнтів у контрольній групі на 7-му добу після появи симптомів за допомогою нейровізуалізації виявлено безсимптомний внутрішньомозковий крововилив (рис. 2). Ця різниця досягла граничної статистичної вірогідності (р = 0,055).
Нарешті, щодо безпеки препарату, жодних побічних явищ, у тому числі негативного впливу Церебролізину та стандартного лікування згідно з протоколом на лабораторні, клінічні показники та дані нейровізуалізації не було зафіксовано.
Обговорення
Ефективність Церебролізину
У нашому дослідженні ми спостерігали чітку тенденцію до кращого довгострокового результату через 12 місяців після розвитку інсульту, про що свідчить бал за mRS: сприятливий результат у групі Церебролізину мали 70 % пацієнтів проти лише 48 % у контрольній групі. Це, безсумнівно, чудовий результат, беручи до уваги відносно невелику кількість пацієнтів у нашому дослідженні, і він узгоджується з більшістю раніше опублікованих досліджень та оглядів із застосування Церебролізину [12–16]. Однак функціональний результат у наших пацієнтів, виражений показником mRS, не показав статистично вірогідної різниці між групами через 90 днів. Цей факт також може свідчити про те, що на кінцевий результат у довгостроковому спостереженні вплинули деякі інші фактори, або може бути пов’язаний з відносно невеликою кількістю пацієнтів у нашому дослідженні. Крім того, у наше дослідження ми включили пацієнтів із помірним та тяжким інсультом [17, 18], що також могло сприяти невірогідним результатам, оскільки попередні дослідження продемонстрували, що ефект лікування у пацієнтів із інсультом був більш вираженим у разі більш тяжкого ступеня захворювання (NIHSS > 12) [12, 14].
Важливо, що тривале спостереження продемонструвало вірогідний позитивний вплив на показник виживання пацієнтів. Цей висновок узгоджується з метааналізом 9 досліджень Церебролізину при гострому інсульті [12], але контрастує з результатами іншого метааналізу 7 досліджень Церебролізину, які розглядали саме смерть від усіх причин протягом 90 днів після інсульту [13]. Дані нашого дослідження щодо смерті від усіх причин за один рік свідчать про протилежне. Беручи до уваги відмінності в етіології інсульту між групами, ми, однак, не можемо виключити, що супутні захворювання, пов’язані з конкретними типами інсульту (які можуть спричинити смерть, не пов’язану із самим інсультом), могли вплинути на сприятливий результат смертності в нашому дослідженні. Тому, незважаючи на те, що різниця в етіології інсульту не досягла статистичної вірогідності між нашими групами пацієнтів, у майбутніх дослідженнях слід уникати гетерогенності груп.
Пізній і довготривалий позитивний ефект Церебролізину в нашій когорті пацієнтів може бути пов’язаний з його нейротрофічними та нейропластичними ефектами, такими як стимуляція нейрогенезу та олігодендрогенезу, що потенційно може викликати посилення довгострокового функціонального відновлення [19].
Геморагічна трансформація та реперфузійне пошкодження після реканалізації можуть бути одним із найгірших ускладнень після успішної реканалізації, що безпосередньо впливає на результат пацієнта. Симптоматична внутрішньочерепна кровотеча виникає приблизно у 4–6 % пацієнтів після будь-якої реканалізаційної терапії, а летальний клінічний результат реєструється у понад 40 % цих випадків [20, 21].
Повідомляється, що навіть безсимптомний внутрішньомозковий крововилив, який часто виявляють лише за допомогою контрольної нейровізуалізації, проведеної пізніше, погіршує довгострокові результати. Деякі нещодавні дослідження вказали на негативний вплив на кінцевий результат навіть безсимптомної внутрішньомозкової гематоми після тромбектомії [20]. Як ми чітко показали в нашому дослідженні, у пацієнтів, які отримували Церебролізин, рівень геморагічних ускладнень був вірогідно нижчим. Частота симптомної внутрішньомозкової гематоми була однаковою (4,3 проти 4,8 %) в обох групах, і гематома виникала через кілька годин після тромболітичної терапії, до введення першої дози Церебролізину. Навпаки, безсимптомна внутрішньомозкова гематома зустрічалася частіше в контрольній групі (38 проти 13 % у групі Церебролізину). Зменшення кількості aICH також може пояснити позитивну тенденцію щодо функціонального результату (mRS) через 12 місяців після інсульту та статистично вірогідне зниження смертності в групі Церебролізину. Нарешті, ми також можемо припустити, що в групі Церебролізину геморагічна трансформація була менш вираженою, а результат був кращим, незважаючи на вищий ризик геморагічної трансформації та гіршого результату через більшу частоту пацієнтів з кардіоемболічним інсультом [22].
Залишається з’ясувати, чи мають гострі геморагічні ускладнення тромболітичної терапії та уповільнена геморагічна трансформація внаслідок реперфузійного синдрому однаковий патофізіологічний механізм. Цілком ймовірно, що вони мають принаймні деякі спільні патофізіологічні механізми, такі як підвищення проникності гематоенцефалічного бар’єра, наявність
постішемічного некрозу стінок кровоносних судин, а також тривала ішемія [20]. Таким чином, мультимодальні нейропротекторні/нейротрофічні засоби, такі як Церебролізин, можуть зменшити наслідки реперфузійного синдрому. Їх вплив на зменшення нейрозапалення, сприяння життєздатності нейронних клітин і нейрогенезу, а також стабілізуючий ефект на гематоенцефалічний бар’єр свідчать про те, що такі препарати також мають нейропротекторну дію, коли не відбувається реканалізація.
Безпека Церебролізину
Однією з цілей нашого дослідження було підтвердження безпеки Церебролізину при призначенні його пацієнтам із помірним та тяжким інсультом. У нашій дослідницькій групі ми не зареєстрували жодної побічної дії, пов’язаної з досліджуваним препаратом Церебролізин. Це відповідає раніше опублікованим результатам, у тому числі даним метааналізу дев’яти рандомізованих досліджень Bornstein та співавт., опублікованого аналізу профілю безпеки від Thome і Doppler, а також опублікованого огляду від Ziganshina [12, 13, 23, 24].
Сильні та слабкі сторони дослідження
Наше дослідження, безумовно, має кілька недоліків. Воно було розроблене як незасліплене пілотне дослідження для надання попередніх даних для формування гіпотези. Більше того, наше дослідження не має достатньої потужності для оцінки первинного результату ефективності через невелику кількість пацієнтів. Крім того, у нашому аналізі ми не змогли контролювати фактори ризику розвитку внутрішньомозкового крововиливу після інсульту, такі як неконтрольована гіпертензія, погані колатералі та/або наявність мікрокровотеч [18, 19], через малу кількість пацієнтів.
Якщо говорити про сильні сторони, наскільки нам відомо, це перше проспективне дослідження, яке оцінювало ефекти нейропротекторного препарату у пацієнтів із гострим інсультом помірного та тяжкого ступеня після неефективної реканалізації на основі клінічної оцінки та швидкості геморагічної трансформації після реканалізаційної терапії протягом 12 місяців. Це надає попередні докази того, що додаткове нейропротекторне лікування Церебролізином може сприяти кращому довгостроковому клінічному результату та зниженню смертності.
Висновки
Ідея нейропротекції досліджувалася протягом багатьох років, і in vitro вивчено великий список нейропротекторних препаратів. Однак, оскільки очевидний клінічний успіх не був продемонстрований, нейропротекція все ще залишається клінічною проблемою. Церебролізин як мультимодальний нейропротекторний і нейровідновлювальний засіб вже продемонстрував деякі багатообіцяючі ефекти у пацієнтів із інсультом щодо функціонального результату. У нашому дослідженні Церебролізин як додаткова терапія для пацієнтів із інсультом помірного та тяжкого ступеня виявився ефективним у запобіганні геморагічній трансформації після неефективної реканалізації та продемонстрував явне зниження смертності в досліджуваній групі пацієнтів. Одним із питань, що залишилися для майбутніх досліджень, є встановлення того, чи знаходяться ці два ефекти у причинно-наслідковому зв’язку.
Оригінал статті доступний за посиланням:
https://doi.org/10.1016/j.clineuro.2021.106767
Список литературы
1. Powers W.J., Rabinstein A.A., Ackerson T. Guidelines for the early management of patients with acute ischaemic stroke: 2019 update to the 2018 Guidelines for the early management of acute ischaemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2019. 50(12). e344-e41.
2. Steiner T., Al Shahi Salman R., Ntaios G. The European Stroke Organisation (ESO) guidelines. Int. J. Stroke. 2014. 9(7).
3. Bhaskar S., Stanwell P., Cordato D., Attia J., Levi C. Reperfusion therapy in acute ischemic stroke: dawn of a new era? BMC Neurol. 2018. 18. 8.
4. Tsivgoulis G., Saqqur M., Sharma V.K. et al.; CLOTBUST-PRO investigators. Timing of recanalisation and functional recovery in acute ischaemic stroke. J. Stroke. 2020. 22(1). 130-140.
5. Lee S.H., Kim B.J., Han M.-K. et al. Futile reperfusion and predicted therapeutic benefits after successful endovascular treatment according to initial stroke severity. BMC Neurol. 2019. 19. 11.
6. Gomis M., Davalos A. Recanalization and reperfusion therapies of acute ischemic stroke: what have we learned, what are the major research questions, and where are we headed? Front. Neurol. 2014. 5. 226.
7. Goda T., Oyama N., Kitano T. et al. Factors associated with unsuccessful recanalisation in mechanical thrombectomy for acute ischaemic stroke. Cereb. Dis. Extra. 2019. 9. 107-113.
8. Nie X., Pu Y., Zhang Z., Liu X., Duan W., Liu L. Futile recanalization after endovascular therapy in acute ischemic stroke. BioMed. Res. Int. 2018. 2018. 1-5.
9. Auriel E., Bornstein N. Neuroprotection in acute ischaemic stroke — current status. J. Cell. Mol. Med. 2010. 14(9). 2200-2202.
10. Patel R.A.G., McMullen P.W. Neuroprotection in the treatment of acute ischaemic stroke. Prog. Cardiovasc. Dis. 2017. 59(6). 542-548.
11. Guan X., Wang Y., Kai G. et al. Cerebrolysin ameliorates focal cerebral ischemia injury through neuroinflammatory inhibition via CREB/PGC-1a pathway. Front. Pharmacol. 2019. 10(1245). 01-16. https://doi.org/10.3389/fphar.2019.01245.
12. Bornstein N.M., Guekht A., Vester J., Heiss W.D., Gusev E., Homberg V., Rahlfs V., Bajenaru O., Popescu B.O., Muresanu D. Safety and efficacy of Cerebrolysin in early post-stroke recovery: a meta-analysis of nine randomized clinical trials. Neurol. Sci. 2018. 39. 629-640.
13. Ziganshina L.E., Abakumova T., Vernay L. Cerebrolysin for acute Stroke (Review). Cochrane Library. 2017. Issue 4. Art No: CD007026.
14. Lang W., Stadler C.H., Poljakovic Z., Fleet D.; Lyse Study Group. A prospective, randomized, placebo-controlled, double-blind trial about safety and efficacy of combined treatment with alteplase (rt-PA) and Cerebrolysin in acute ischaemic hemispheric stroke. Int. J. Stroke. 2013. 8(2). 95-104.
15. Hong Z., Moessler H., Bornstein N., Brainin M., Heiss W.D.; CASTA-Investigators. A double-blind, placebo-controlled, randomi-zed trial to evaluate the safety and efficacy of Cerebrolysin in patients with acute ischaemic stroke in Asia — CASTA. Int. J. Stroke. 2009. 4(5). 406-412.
16. Heiss W.D., Brainin M., Bornstein N.M., Tuomilehto J., Hong Z. Cerebrolysin in patients with acute ischaemic stroke in Asia: results of a double blind, placebo-controlled randomized trial. Stroke. 2012. 43(3). 630-636.
17. Gharagozli K., Harandi A.A., Houshmand S. et al. Efficacy and safety of Cerebrolysine treatment in early recovery after acute ishemic stroke: a randomized, placebo-controlled, double-blinded, multicenter clinical trial. J. Med Life. 2017. 10(3). 153-160.
18. Muchada M., Rubiera M., Rodriguez-Luna D., Pagola J., Flores A., Kallas J., Sanjuan E., Meler P., Alvarez-Sabin J., Ribo M., Molina C.A. Baseline National Institutes of Health Stroke Scale — adjusted time window for intravenous tissue-type plasminogen activator in acute ischemic stroke. Stroke. 2014. 45(4). 1059-1063.
19. De Graba T.J., Hallenbeck J.M., Pettigrew K.D., Dutka A.J., Kelly B.J. Progression in acute stroke: value of the initial NIH stroke scale score on patient stratification in future trials. Stroke. 1999. 30(6). 1208-1212.
20. Zhang L., Chopp M., Meier D.H., Winter S. et al. Sonic hedgehog signaling pathway mediates Cerebrolysin — improved neurological function after stroke. Stroke. 2013. 44. 1965-1972.
21. Nawabi J., Kniep H., Schon G. et al. Hemorrhage after endovascular recanalization in acute stroke: lesion extent, collaterals and degree of ischemic water uptake mediate tissue vulnerability. Front. Neurol. 2019. 10. 569.
22. Gauberti M., Lapergue B., Martinez de Lizarrondo S., Vi-vien D., Richard S., Bracard S., Piotin M., Gory B. Ischaemia-reperfusion injury after endovascular thrombectomy for ischaemic stroke. Stroke. 2018. 49. 3071-3074.
23. Paciaroni M., Agnelli G., Corea F., Ageno W. et al. Early haemorrhagic transformation of brain infarction: rate, predictive factors, and influence on clinical outcome. Results of a Prospective Multicenter Study. Stroke. 2008. 39(8). 2249-2256.
24. Thome J., Doppler E. Safety profile of Cerebrolysin: clinical experience from dementia and stroke trials. Drugs Today. 2012. 48(Suppl. A). 63-69.
/13.jpg)

/11.jpg)
/12.jpg)
/12_2.jpg)
/13_2.jpg)