За даними Всесвітньої організації охорони здоров’я, близько 50 % населення земної кулі в якийсь момент свого життя страждають на нервово-психічні розлади [1]. Результати дослідження Psychological Disorders in Primary Care демонструють, що найбільш частими психічними розладами в загальномедичній практиці є депресія і тривожні розлади [2]. Поширеність депресивних розладів у населення економічно розвинених країн Європи і США досягає 10 % [4], хоча б один епізод тривожних розладів реєструється у 12–27 % населення Європи [5], а в осіб із соматичною патологією вони зустрічаються в 2–3 рази частіше, ніж у загальній популяції [6].
У великій кількості досліджень, систематичних оглядах і метааналізах наводяться узгоджені дані про те, що тривога і депресія є незалежними факторами ризику розвитку хронічного нейропатичного болю [3]. Так, у масштабному мультинаціональному дослідженні A. Tsang et al. [7], у яке також була включена і Україна, хронічний біль протягом останніх 12 місяців відзначали 19,7 % пацієнтів з тривогою або депресією.
Низка дослідників стверджують, що будь-який хронічний больовий синдром супроводжується депресією тією чи іншою мірою. Депресивні синдроми у пацієнтів із хронічним болем є варіабельними, і їх частота коливається в межах 10–100 % [8, 9]. При цьому частота вираженої депресії істотно нижча і становить у пацієнтів з хронічним болем 1,5–54 % [10].
У великомасштабному дослідженні Н. Breivik et al. [11], проведеному в 15 європейських країнах та Ізраїлі, повідомляється, що у 21 % пацієнтів, які відчувають хронічний біль, була діагностована депресія. У великому епідеміологічному дослідженні L. Aguera et al. [12] оцінювали больові розлади та депресивну симптоматику у 3189 пацієнтів з недиференційованим хронічним болем [20]. Були розглянуті скарги на біль у шиї та спині (71,6 %), головний біль (64,7 %), біль у суглобах та кінцівках (61,3 та 58,5 % відповідно). Симптоми депресії виявлялися у чотирьох з п’яти пацієнтів. Серед них кожен другий пацієнт відповідав критеріям вираженої депресії, а кожен п’ятий — критеріям дистимії.
Поширеність тривожних розладів у пацієнтів з хронічним болем у спині оцінюється приблизно в 17–30 % [13]. Зокрема, за даними L. Manchikanti et al. [14], кожен п’ятий пацієнт з хронічним болем у спині страждає від генералізованого тривожного розладу. На змішаній вибірці пацієнтів з больовими синдромами (головний біль напруження, цервікалгія, біль у спині) було продемонстровано, що тривожні розлади при вищевказаних больових синдромах зустрічаються в 3,13–6,91 раза частіше, ніж у загальній популяції [15].
Депресія поширена серед осіб похилого віку і пов’язана з високим ризиком інвалідизації та підвищеною смертністю. Дані про поширеність депресії серед літніх хворих варіюють від 15 до 27 % [26], при цьому у пацієнтів, які мають будь-яке соматичне захворювання, цей показник може збільшуватися до 42 % [27]. Соціальні наслідки депресії похилого віку досить тяжкі: поряд з різким зниженням якості життя вона супроводжується зростанням захворюваності і смертності в цій віковій групі хворих [28].
Таким чином, існує безумовний зв’язок між болем, депресією і тривогою.
Депресія, тривога та хронічний біль: від патогенезу до патогенетичного лікування
Поєднання депресії, тривоги і хронічного больового синдрому пояснюється їх патогенетичними механізмами [20, 21]. Переважну роль у патогенезі депресії відіграє дефіцит норадреналіну і серотоніну. Більшість норадренергічних нейронів локалізуються в ділянці мозкового стовбура — у блакитній плямі. Норадренергічні шляхи широко представлені в головному мозку і беруть участь у формуванні багатьох функцій. Проєкції в префронтальну кору модулюють настрій і увагу; в лімбічну ділянку — психомоторну активність і стомлюваність. Більшість серотонінергічних нейронів локалізується в ядрах шва стовбура мозку. Серотонінергічні проєкції у фронтальну кору регулюють настрій. Проєкції в базальні ганглії беруть участь у контролі рухів, формуванні обсесивно-компульсивної поведінки. Проєкції в лімбічну систему формують тривогу і паніку, у гіпоталамус — регулюють апетит і харчову поведінку, у центри сну мозкового стовбура — повільнохвильовий сон.
Низхідні норадренергічні та серотонінергічні шляхи є частиною антиноцицептивних (протибольових) систем і активно включені в контроль болю. При недостатності низхідних протибольових систем закономірно знижується поріг больової чутливості, створюються умови для неконтрольованого проходження больових імпульсів. Особливого значення при цьому набуває феномен центральної сенситизації, який характеризується тим, що після припинення впливу серії периферичних больових стимулів залишається певний рівень збудження в центральних сенсорних нейронах заднього рогу, і цей стан підтримується низьким рівнем ноцицептивної стимуляції. Тому надходження в задній ріг спинного мозку навіть слабких або небольових стимулів сприймається як біль.
Слід зазначити, що моноамінові системи знаходяться в стані постійного взаємовпливу. Наприклад, норадренергічні шляхи можуть як активувати, так і гальмувати вивільнення серотоніну. Як виявилося, норадренергічні шляхи стовбура від блакитної плями до серотонінергічних нейронів шва (аксонодендритична взаємодія) активують вивільнення серотоніну, а норадренергічні шляхи до кори головного мозку, взаємодіючи з терміналями серотонінергічних аксонів (аксоноаксональна взаємодія), навпаки, гальмують вивільнення серотоніну.
На основі уявлень про функції моноамінів була сформульована «класична» моноамінова теорія депресії, згідно з якою головну роль в її патогенезі відіграє зниження рівня моноамінів у синапатичній щілині (переважно серотоніну і норадреналіну).
Таким чином, наявність загальних механізмів формування хронічного болю, депресії і тривоги дозволяє розглядати їх як стани, тісно пов’язані між собою і патогенетично, і клінічно [17, 18], а також пояснює доцільність застосування антидепресантів — селективних інгібіторів зворотного захвату серотоніну і норадреналіну, що впливають на загальний патогенез цих захворювань [16].
Дулоксетин — потужний інгібітор зворотного захвату серотоніну і норадреналіну. Особливість механізму дії дулоксетину полягає в тому, що препарат має приблизно однаковий афінітет (спорідненість) до зв’язування транспортних субодиниць, що здійснюють зворотний захват серотоніну і норадреналіну, справляючи тим самим збалансовану дію щодо обох моноамінів.
Механізм дії дулоксетину при лікуванні депресії полягає в пригніченні зворотного захвату серотоніну і норадреналіну, у результаті чого підвищується серотонінергічна і норадренергічна нейротрансмісія в центральній нервовій системі. Завдяки підвищенню рівня серотоніну і норадреналіну в ЦНС також підвищується функціональна активність низхідної системи пригнічення болю і поріг больової чутливості, що забезпечує знеболюючу дію препарату [24, 25].
Безпека дулоксетину порівняно з трициклічними антидепресантами обумовлена відсутністю фармакологічно значущого впливу на мускаринові, гістамінергічні, дофамінергічні та холінергічні рецептори в ЦНС [22].
Фармакокінетика дулоксетину лінійна і залежить від дози. Максимальна концентрація в плазмі досягається через 6 годин, після прийому їжі — через 10 годин, що може мати клінічне значення [11].
Дулоксетин метаболізується за участю ферментів CPY2D6 і CYP1A2. Препарат є помірним інгібітором цитохрому CPY2D6, але в дозі до 60 мг не впливає на метаболізм препаратів за участю ізоферменту CPP1A2. Тому застосування дулоксетину практично не обмежує використання інших лікарських засобів. Метаболіти препарату неактивні і на 70 % виводяться із сечею. Вік і стать мало впливають на фармакокінетику препарату, з огляду на це не потрібна корекція дозування залежно від цих показників [25].
Таким чином, дулоксетин має необхідний механізм дії для лікування депресії, тривоги і хронічного болю, сприятливий профіль безпеки, практично не має міжлікарських взаємодій. Це, у свою чергу, відіграє істотну роль при лікуванні пацієнтів, які мають супутні захворювання та приймають інші ліки.
Місце дулоксетину в рекомендаціях Національної служби охорони здоров’я Британії щодо лікування депресії
Для успішного лікування помірної та тяжкої депресії Національна служба охорони здоров’я Британії рекомендує застосування антидепресантів. Важлива роль також відводиться використанню психотерапевтичних методик (включаючи когнітивно-поведінкову терапію) і соціальним втручанням [19].
Вибір антидепресанту повинен являти собою спільний процес прийняття рішення лікарем і пацієнтом. Обговорення повинно включати: попередній досвід лікування депресії, ефективність і переносимість раніше призначених антидепресантів, будь-які індивідуальні переваги і пріоритети з урахуванням можливих побічних ефектів і симптомів відміни, потенційні побічні ефекти/взаємодії з іншими лікарськими засобами, супутні захворювання, для жінок — наявність вагітності та годування груддю.
При початковій терапії депресії вибір препарату здійснюється на користь селективних інгібіторів зворотного захвату серотоніну (СІЗЗС) або антидепресанту, на який пацієнт відповідав раніше, — сертраліну, флуоксетину, есциталопраму, циталопраму, пароксетину. При неефективності або непереносимості даної терапії слід вибрати інший СІЗЗС або міртазапін. При відсутності ефекту і поганій переносимості цього лікування вибирають антидепресант з іншого фармакологічного класу — венлафаксин [19].
У разі відсутності ефекту від лікування слід вибрати антидепресант із іншого фармакологічного класу або розглянути стратегію комбінованого лікування: антидепресант + літій, антидепресант + нейролептик (арипіпразол, оланзапін, кветіапін, рисперидон), СІЗЗС + міртазапін або венлафаксин + міртазапін. Незважаючи на те, що міртазапін широко використовується на практиці, нещодавно опублікований кокрейнівський огляд (2019) показує, що доповнення лікування міртазапіном не дає клінічно значущої переваги у зменшенні симптомів депресії.
Для лікування діабетичного периферичного нейропатичного болю з уніполярною депресією або без неї, а також для лікування стресового нетримання сечі середнього та тяжкого ступеня, згідно з рекомендаціями NICE-2020, препаратом першої лінії є дулоксетин [19]. Крім того, дулоксетин є засобом першої лінії терапії при лікуванні депресії у пацієнтів із супутніми кардіо-васкулярними захворюваннями як препарат, що має низький кардіоваскулярний ризик [19].
У рекомендаціях Німецького товариства неврологів, виданих у 2019 році, дулоксетин, прегабалін, габапентин і амітриптилін є препаратами першої лінії в лікуванні нейропатичного болю [37]. Також дулоксетин схвалений для лікування депресії та генералізованого тривожного розладу [37].
Дулоксетин включений в алгоритм лікування хронічного болю в нижній частині спини (ХБНЧС) в рекомендаціях Американської колегії лікарів [43]. У рекомендаціях Міжнародного товариства з вивчення остеоартриту (OARSI) 2019 р. [45] дулоксетин розглядається як терапія першої лінії у пацієнтів з остеоартритом (ОА) колінного суглоба, з поширеним хронічним больовим синдромом і депресивними порушеннями.
Ефективність дулоксетину в лікуванні пацієнтів літнього віку: дулоксетин порівняно з СІЗЗС
Важливою віхою в лікуванні депресії у літніх пацієнтів стала поява нового класу антидепресантів — СІЗЗС, серед яких найкращу ефективність і безпеку має дулоксетин [29].
У кількох плацебо-контрольованих дослідженнях і дослідженнях з активним контролем доведена ефективність і безпека дулоксетину в лікуванні афективних і соматичних симптомів депресії у літніх пацієнтів [30–32]. В інших дослідженнях оцінювався вплив дулоксетину на симптоми депресії та хронічного болю у пацієнтів літнього віку, у тому числі при супутній кардіоваскулярній патології.
Дослідження J. Raskin et al. [33] — 8-тижневе плацебо-контрольоване дослідження ефективності дулоксетину у 311 пацієнтів віком старше 65 років із депресією і хронічним болем у спині [33]. Усі пацієнти випадковим чином були розподілені на 2 групи: групу 1 (n = 207), яка отримувала дулоксетин 60 мг/день, і групу 2 (n = 104), яка приймала плацебо в тій же дозі.
Головною кінцевою точкою в даному дослідженні була оцінка когнітивних функцій, яка ґрунтувалася на результатах тестів: вербального заучування і відтворення, заміни цифрових символів — для оцінки уваги, на викреслювання двох цифр — зорової уваги, цифро-літерний тест — пам’яті і виконавчої функції. За результатами 4 тестів складалася комплексна когнітивна оцінка (від 0 до 51). Іншими показниками ефективності була геріатрична шкала депресії GDS, шкала Гамільтона HAMD-17, а також візуальна аналогова шкала болю (VAS), що складається з шести питань, які відображають різні характеристики больового синдрому [33].
Результати дослідження показали, що дулоксетин значно перевершує плацебо за комплексним когнітивним показником (p < 0,02]. Перевага дулоксетину над плацебо виявлена в тестах на вербальне заучування і відтворення (p = 0,003 для заучування; p = 0,02 для відстроченого відтворення).
При оцінці симптомів депресії дулоксетин виявився значно ефективнішим за плацебо за загальним балом GDS (–4,07 проти –1,34), загальним балом HAMD-17 (–6,49 проти –3,72) на 8-му тижні лікування. Різниця в ефективності була більш помітною серед пацієнтів з початково високим рівнем депресивної симптоматики. У групі дулоксетину спостерігався значно вищий відсоток респондерів, які відповіли на лікування (37,3 % порівняно з 18,6 % у групі плацебо) та пацієнтів, які досягли ремісії (27,4 % порівняно з 14,7 % у групі плацебо).
Дулоксетин значно покращив показники візуальної аналогової шкали для болю в спині і часу болю під час неспання порівняно з плацебо. Значно менше пацієнтів, які отримували дулоксетин, вийшли з дослідження через відсутність ефективності (2,9 проти 9,6 %). Випадки припинення прийому препарату через небажані явища були аналогічними для дулоксетину та плацебо (9,7 проти 8,7 %).
Автори дослідження дійшли висновку, що дулоксетин покращує когнітивні функції, знижує рівень депресії і болю. Препарат був безпечний і добре переносився у літніх пацієнтів з депресією.
У метааналізі J.C. Nelson et al. [34] ефективність і безпека дулоксетину оцінювалися при лікуванні великого депресивного розладу і пов’язаних з ним больових симптомів, у пацієнтів віком 55 років і старше на підставі 2 рандомізованих плацебо-контрольованих досліджень. Дулоксетин у дозі 40–120 мг/день отримували 119 пацієнтів, плацебо — 90 хворих. Основним показником ефективності лікування депресії була зміна загального бала HAMD-17, больові симптоми оцінювали за допомогою VAS.
Дулоксетин виявився значно ефективнішим за плацебо за середнім балом HAMD-17, а також за відсотком респондерів, які відповіли на лікування (52,8 % порівняно з 28,0 % у групі плацебо) та відсотком пацієнтів, які досягли ремісії (44,1 % порівняно з 16,1 % у групі плацебо). Також він виявився значно ефективнішим за плацебо щодо загальної вираженості больових відчуттів (p = 0,039), болю в спині (p = 0,004) і відсотка болю в період неспання (p = 0,015). Частота небажаних явищ була вищою у групі прийому дулоксетину (21,0 %), ніж плацебо (6,7 %), однак у більшості випадків вони не вимагали відміни терапії.
М.М. Wohlreich et al. [35] було проведено 52-тижневе відкрите дослідження, у яке був включений 101 пацієнт старше за 65 років з великим депресивним розладом. Усі вони отримували дулоксетин від 40 мг 2 р/день до 60 мг 2 р/день. Показники ефективності включали шкалу CGI-S, шкалу Гамільтона HAMD-17, шкалу депресії Бека II (BDI-II), шкалу глобального враження пацієнта від поліпшення (PGI-I) і шкалу працездатності Шихана (SDS).
За шкалами депресії спостерігалося значне поліпшення на 6, 28 і 52-му тижні при прийомі дулоксетину: частка респондерів, які відповіли на лікування, становила 62,9; 84,9 і 89,4 % відповідно; частка пацієнтів, які досягли ремісії, — 41,4; 69,8 і 72,3 % відповідно. Середня зміна бала за CGI-S у пацієнтів віком 65 років і старше була порівнянна з такою у молодшій віковій групі (18–64 роки) (рис. 1). Також у кінці лікування в групі пацієнтів з артеріальною гіпертензією відзначалося зниження систолічного і діастолічного тиску порівняно з вихідним рівнем на 3,1 і 0,8 мм рт.ст. відповідно (рис. 2), що свідчить про безпечність застосування дулоксетину в цій групі пацієнтів.
Таким чином, у даному дослідженні дулоксетин був ефективним, безпечним препаратом для довгострокової терапії депресії у пацієнтів віком 65 років і старше, у тому числі у хворих на АГ.
У багатоцентровому проспективному обсерваційному дослідженні A. Kuga et al. [36] проводилося порівняння ефективності та безпеки дулоксетину із СІЗЗС у японських пацієнтів з тяжким депресивним розладом і пов’язаними з ним болісними фізичними симптомами. У ньому взяли участь 523 пацієнти старше від 65 років, які були рандомізовані на 2 групи: 1-ша група (n = 273) отримувала дулоксетин, 2-га (n = 250) — СІЗЗС (есциталопрам, пароксетин, сертралін або флувоксамін) протягом 12 тижнів.
Пацієнти обох груп мали аналогічні вихідні характеристики. Оцінка результатів лікування проводилася з використанням короткого опитувальника оцінки болю BPI-SF, 17-бальної шкали депресії Гамільтона HAMD-17, шкали якості життя Euro-5D, шкали самооцінки соціальної адаптації SASS, шкали глобальної оцінки функціонування і шкали працездатності Шихана.
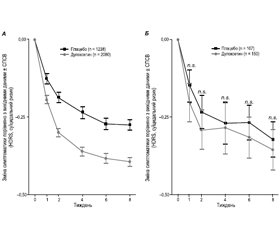
Результати дослідження показали, що ефективність дулоксетину була вищою порівняно з СІЗЗС у групі пацієнтів з першим депресивним епізодом практично за всіма показниками, особливо за середніми показниками болю за BPI-SF через 8 та 12 тижнів лікування (рис. 3А), а також за показниками HAMD-17, EQ-5D, шкалою глобальної оцінки функціонування і шкалою працездатності Шихана через 12 тижнів.
Не спостерігалося чіткої різниці між групами лікування пацієнтів, які зазнали 2 і більше епізоди депресії: відзначалося поліпшення за всіма показниками (рис. 3Б). У цілому в обох групах лікування пацієнти з першим епізодом мали кращі результати порівняно з пацієнтами, які мали 2 і більше депресивних епізоди.
При оцінюванні середнього показника болю за шкалою BPI-SF > 6 встановлено, що кращі результати в зменшенні болю і поліпшенні працездатності були досягнуті в групі пацієнтів, які отримували дулоксетин (рис. 4Б), порівняно з пацієнтами, які застосовували СІЗЗС. У підгрупі пацієнтів із середніми показниками болю за BPI-SF ≤ 6 також спостерігалося поліпшення за всіма показниками, однак чіткої різниці між групами не спостерігалося (рис. 4А).
У групі пацієнтів з вихідними сумарними балами за HAMD-17 > 18 пацієнти, які отримували дулоксетин, демонстрували більш значне поліпшення порівняно з пацієнтами, які застосовували СІЗЗС (рис. 5Б). У цій же групі пацієнтів також відзначалося поліпшення середніх показників болю за BPI-SF через 8 тижнів і здатності працювати через 12 тижнів порівняно з пацієнтами із групи СІЗЗС.
У групі пацієнтів, які мали вихідні сумарні бали за HAMD-17 ≤ 18, виявлено аналогічне за всіма показниками поліпшення в групі дулоксетину і СІЗЗС (рис. 5А). Єдина різниця, що спостерігалася між групами лікування, полягала в поліпшенні працездатності через 12 тижнів і якості життя за шкалою EQ-5D у пацієнтів з групи СІЗЗС.
Крім того, дослідження показало, що в підгрупі пацієнтів віком 65 років і старше лікування дулоксетином призводить до більш значного поліпшення за більшістю показників депресії, болю і якості життя порівняно з лікуванням СІЗЗС, тоді як у віці < 65 років така різниця не виявлена.
Автори дослідження дійшли висновку, що застосування антидепресантів для лікування пацієнтів з тяжкими депресивними епізодами забезпечує оптимальні результати терапії. При цьому дулоксетин більш ефективний порівняно із СІЗЗС для певних підгруп пацієнтів, а саме для тих, у кого виник перший депресивний епізод, хто початково має більш високу тяжкість болю, вік ≥ 65 років.
Дулоксетин — ефективне вирішення проблеми нейропатичного болю
Цілями терапії нейропатичного болю є досягнення його зменшення на ≥ 30 %, поліпшення якості сну і якості життя, збереження соціальної активності, підтримання працездатності і поліпшення функціональної активності.
Дулоксетин є препаратом першої лінії для лікування нейропатичного болю. Це зазначено в рекомендаціях NICE-2020, згідно з якими дулоксетин — перший вибір для лікування діабетичного периферичного нейропатичного болю з уніполярною депресією або без неї [19]. Це узгоджується з рекомендаціями Німецького товариства неврологів — 2019, у яких дулоксетин, прегабалін, габапентин і амітриптилін є препаратами першої лінії в лікуванні нейропатичного болю [37].
Повідомляється, що у пацієнтів з діабетичною нейропатією, що супроводжується болем, дулоксетин ефективний у дозах 60–120 мг на день. Збільшення дози дулоксетину з 60 до 120 мг на день не показало переваг у знеболювальному ефекті [37]. У рандомізованому плацебо-контрольованому сліпому подвійному дослідженні D.K. Kajdasz et al. [38] ефективність дулоксетину не відрізнялася від ефективності амітриптиліну і прегабаліну у пацієнтів з болючою діабетичною нейропатією. Прийом прегабаліну призвів до поліпшення тривалості сну, прийом дулоксетину — до поліпшення повсякденної активності.
У кокрейнівському огляді, що включав 8 досліджень і 2728 пацієнтів з діабетичним нейропатичним болем, була показана ефективність дулоксетину в добовій дозі 60 мг навіть при короткостроковій терапії протягом 12 тижнів, що проявлялося зменшенням вираженості болю на 50 % і більше [40]. При цьому побічні явища вірогідно не відрізнялися від таких у групі плацебо, не спостерігалося серйозних небажаних реакцій [40]. В іншому багатоцентровому 6-місячному порівняльному проспективному дослідженні ефективності дулоксетину, габапентину і прегабаліну більш висока ефективність при купіруванні больового синдрому, згідно з коротким опитувальником оцінки болю BPI, була виявлена у дулоксетину, як і вірогідне зменшення при його прийомі вираженості тривоги і депресії згідно з госпітальною шкалою тривоги і депресії HADS [41].
Аналіз даних 4 багатоцентрових подвійних сліпих рандомізованих плацебо-контрольованих досліджень із застосування дулоксетину для лікування хронічного болю в нижній частині спини у 1295 пацієнтів у добовій дозі 60 мг протягом 12–14 тижнів показав найбільшу ефективність цього препарату у вигляді більшої кількості пацієнтів, у яких спостерігалося зниження болю на 30 % і більше на момент завершення лікування щодо вихідного рівня — 59,7 % порівняно з 47,8 % у групі плацебо. Також відзначалося більше зниження ступеня вираженості болю — на 50 % і більше у 48,6 % пацієнтів, що перевершувало групу плацебо (35,1 %) [42].
Важливо зауважити, що предикторами найбільшої ефективності дулоксетину, на думку дослідників, були рання відповідь на терапію — у перші 2 тижні від її початку (поліпшення не менше ніж на 15 % згідно з опитувальником BPI), застосування в добовій дозі 60 мг і наявність болю в декількох ділянках [42].
У метааналізі 9 РКД [44] ефективності і безпеки дулоксетину в терапії пацієнтів з ХБНЧС було продемонстровано не тільки його вплив на вираженість болю, але й істотне поліпшення функціональної складової, повсякденної активності, емоційного фону і якості життя, причому не було виявлено статистично значущої різниці в серйозних небажаних явищах дулоксетину порівняно з групою плацебо.
У метааналізі 3 РКД [46] за участю 1011 пацієнтів було продемонстровано статистично значущий вплив дулоксетину на рівень і частоту виникнення болю при ОА, поліпшення функціональної активності, а також відсутність значущих небажаних або побічних явищ порівняно з плацебо через 10–13 тижнів терапії. В іншому рандомізованому подвійному сліпому плацебо-контрольованому дослідженні [47] пацієнтів з ОА колінних суглобів показано вірогідне зменшення болю, скутості, функціональної недостатності і поліпшення якості життя на тлі прийому дулоксетину протягом 14 тижнів.
Рекомендована доза для стартової терапії нейропатичного болю становить 30 мг уранці, через 7–14 днів її збільшують до цільової дози 60 мг (але не більше ніж 120 мг/день). Перед початком лікування всім пацієнтам слід зробити ЕКГ, проводити лабораторну діагностику показників крові, біохімічних показників печінки і нирок у процесі лікування [39].
Протипоказанням для призначення дулоксетину є порушення функції печінки і нирок тяжкого ступеня, а також неконтрольована артеріальна гіпертензія. Дулоксетин не слід поєднувати із СІЗЗС, інгібіторами моноаміноксидази і препаратами звіробою. Інгібітори CYP1A2 (ципрофлоксацин) можуть призводити до підвищення концентрації дулоксетину. У курців деградація дулоксетину прискорюється через індукцію CPY1A2, що супроводжується зниженням його концентрації в плазмі крові. Тому для таких пацієнтів варто розглянути збільшення дози до 120 мг. Дулоксетин інгібує розпад метопрололу і, отже, може подвоїти його концентрацію, а також збільшити ризик кровотечі при одночасному застосуванні антикоагулянтів (особливо варфарину) [37].
Дулоксетин у лікуванні великого депресивного розладу: досвід клінічного застосування
У метааналізі А. Lisinski et al. [48] оцінювалася ефективність дулоксетину на підставі результатів 13 плацебо-контрольованих досліджень, у яких взяли участь 3575 пацієнтів з тяжкою депресією. Крім того, ефективність застосування дулоксетину порівнювали з ефективністю СІЗЗС, отриманою у 28 плацебо-конт-рольованих дослідженнях. Оцінка депресії здійснювалася за допомогою шкали депресії Гамільтона HDRS-17 sum.
Вихідний показник депресії за шкалою HDRS-17 sum у становив становив 21,3 бала для обох груп. При лікуванні величина ефекту дулоксетину вже на 1-му тижні мала значну перевагу над плацебо за такими параметрами, як пригнічений настрій, почуття провини, схильність до суїциду, збудження і тривога (рис. 6).
При аналізі пацієнтів, які мали суїцидальні думки, було виявлено, що дія дулоксетину особливо виражена для осіб старше 25 років порівняно з особами 18–24 років (рис. 7).
Висновки
— Поширеність депресивних і тривожних розладів особливо велика у пацієнтів із хронічним нейропатичним болем. Це пояснюється спільністю патогенезу даних захворювань, в основі яких лежить дефіцит серотоніну і норадреналіну.
— Механізм дії дулоксетину при лікуванні депресії полягає в пригніченні зворотного захвату серотоніну і норадреналіну, у результаті чого підвищується серотонінергічна і норадренергічна нейротрансмісія в центральній нервовій системі. Завдяки підвищенню рівня серотоніну і норадреналіну в ЦНС також підвищується функціональна активність низхідної системи пригнічення болю і поріг больової чутливості, що забезпечує знеболювальну дію препарату.
— Для лікування діабетичного периферичного ней-ропатичного болю з уніполярною депресією або без неї, згідно з рекомендаціями NICE-2020, препаратом першої лінії є дулоксетин. Крім того, він є препаратом першої лінії терапії при лікуванні депресії у пацієнтів із супутніми кардіоваскулярними захворюваннями, тому що має низький кардіоваскулярний ризик.
— У рекомендаціях Німецького товариства неврологів дулоксетин поряд з прегабаліном, габапентином і амітриптиліном є препаратом першої лінії в лікуванні нейропатичного болю, депресії і генералізованого тривожного розладу.
— Дулоксетин включений в алгоритм лікування хронічного болю в нижній частині спини в рекомендаціях Американської колегії лікарів. У рекомендаціях Міжнародного товариства з вивчення остеоартриту OARSI він розглядається як терапія першої лінії у пацієнтів з ОА колінного суглоба, з поширеним хронічним больовим синдромом і депресивними порушеннями.
— Дулоксетин більш ефективний порівняно з СІЗЗС для пацієнтів похилого віку, які мають депресію, особливо для тих, у кого виник перший депресивний епізод, хто початково має більш високу тяжкість болю, вік ≥ 65 років.
— Результати численних досліджень демонструють ефективність і безпеку дулоксетину для лікування ней-ропатичного болю. Його застосування забезпечує зменшення болю, поліпшення функціональної і повсякденної активності, емоційного фону і якості життя.
— Ефективність дулоксетину при лікуванні великого депресивного розладу значно перевершує плацебо і порівнянна з ефективністю СІЗЗС.
Список литературы
1. Cross-national comparisons of the prevalence and correlates of mental disorders. WHO International Consortium in Psychiatric Epidemiology. Bull. World Health Organ. 2000. 4(78). 413-426.
2. Kessler R.C., McGonagle K.A., Zhao S. et al. Lifetime and 12-Month Prevalence of DSM-III-R Psychiatric Disorders in the United States. Arch. Gen. Psych. 1994. 51. 8-19.
3. Katon W.J. Epidemiology and treatment of depression in patients with chronic medical illness. Dialogues Clin. Neurosci. 2011. 13(1). 7-23.
4. Ustin T., Sartorius N. Preventive Services Task Forse: Guide to Clinical Preventive Services. Washington, DC: US. Department of Health and Human Services, 1999.
5. Dhillon S., Scott L.J., Ploster G.L. Escitalopram: a review of its use in the management of anxiety disorders. CNS Drugs. 2006. 20. 9. 763-790.
6. Fink P., Steen Hansen M., Sondergaard L. Somatoform disorders among first-time referrals to a neurology service. Psychosomatics. 2005. 6(46). 540-548.
7. Tsang A., Von Korff M., Lee S. et al. Common Chronic Pain Conditions in Developed and Developing Countries: Gender and Age Differences and Comorbidity With Depression-Anxiety Disorders. J. Pain. 2008. 9(10). 883-891.
8. Verma S., Gallagher R.H. Evaluating and treating co-morbid pain and depression. Int. Rev. Psychiatry. 2000. 12(2).103-15.
9. Pappagallo M. The neurological Basis of pain. McGraw-Hill MPD, 2005. 527-44.
10. Fishbain D.A., Сutler R., Rossomoff H.L. et al. Chronic pain assotiated depression. A review. Clin. J. Pain. 1997. 13. 116-37.
11. Breivik Н., Collett B., Ventafridda V., Cohen R., Gallacher D. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment. Eur. J. Pain. 2006. 10(4). 287-333.
12. Aguera L., Failde I., Cervilla J.A. et al. Medically unexplained pain complaints are associated with underlying unrecognized mood di-sorders in primary care. BMC Fam Pract. 2010. 11. 17.
13. Asmundson G. Understanding the cooccurrence of anxiety di-sorders and chronic pain: state-of-the-art. Depress. Anxiety. 2009. 26. 888-901.
14. Manchikanti L., Pampati V., Beyer C. Evaluation of psychological status in chronic low back pain: comparison with general population. Pain Physician. 2002. 5(2). 149-55.
15. McWilliams L., Cox B., Enns M. Mood and anxiety disorders associated with chronic pain: an examination in a nationally representative sample. Pain. 2003. 106(1–2). 127-33.
16. NICE. 2014. Anxiety disorders. Quality standard [QS53]. https://www.nice.org.uk/guidance/qs53/chapter/Quality-statement-3-Pharmacological-treatment
17. Barkin R.L. The role of venlafaxine and duloxetine in the treatment of depression with decremental changes in somatic symptoms of pain, chronic pain, and the pharmacokinetics and clinical considerations of duloxetine pharmacotherapy. Am. J. Ther. 2005. 12. 5. 431-438.
18. Magni G. The use of antidepressants in the treatment of chro-nic pain. A review of the current evidence. Drugs. 1991. 42. 5. 730-748.
19. Pharmacological Treatment of Unipolar Depression. Approved by Drug and Therapeutics Committee: November 2020.
20. Goldstein D.G., Lu Y., Detke M.J. et al. Duloxetine in the treatment of depression. J. Clin. Psychopharmacol. 2004. 24(4). 389-99.
21. Вознесенская Т.Г., Вейн А.М. Хроническая боль и депрессия. Психиатрия и психофармакология. 2000. 1. 4-7.
22. Bymaster F.P., Dreshfield-Ahmad L.J., Threlkeld P.G. et al. Comparative affinity of duloxetine and venlafaxine for serotonin and norepinephrine transporters in vitro and in vivo, human serotonin receptor subtypes, and other neuronal receptors. Neuropsychopharmacology. 2001. 25. 871-880.
23. Wong D.T., Bymaster F.P. Dual serotonin and noradrenaline uptake inhibitor class of antidepressants — potential for greater efficacy or just hype. Progress in Drug Research. 2002. 58. 169-222.
24. de Tommaso M., Sardaro M., Vecchio E. et al. Central sensitisation phenomena in primary headaches: overview of a preventive therapeutic approach. CNS Neurol Dis Drug Targets. 2008. 7. 6. 524-535.
25. Инструкция по применению препарата дулоксетин. https://www.vidal.ru/drugs/molecule/1441
26. Blazer D., Hughes D.C., George L.K. The epidemiology of depression in an elderly community population. Gerontologist. 1987. 27. 281-287.
27. Nelson J.C. Treatment of major depression, in Geriatric Psycho-pharmacology. Ed. by Nelson J.C. New York, Marcel Dekker, 1998. 61-97.
28. Bruce M.L., Seeman T.E., Merrill S.S. et al. The impact of depressive symptomatology on physical disability: MacArthur Studies of Successful Aging. Am. J. Public Health. 1994. 84. 1796-1799.
29. Hunziker M.E., Suehs B.T., Bettinger T.L. et al. Duloxetine hydrochloride: a new dualacting medication for the treatment of major depressive disorder. Clin. Ther. 2005. 27. 1126-43.
30. Perahia D.G., Pritchett Y.L., Kajdasz D.K. et al. A rando-mized, double-blind comparison of duloxetine and venlafaxine in the treatment of patients with major depressive disorder. J. Psychiatr. Res. 2008. 42. 22-34.
31. Nemeroff C.B., Schatzberg A.F., Goldstein D.J. et al. Dulo-xetine for the treatment of major depressive disorder. Psychopharmacol Bull. 2002. 36. 106-32.
32. Nelson J.C., Lu Pritchett Y., Martynov O. et al. The safety and tolerability of duloxetine compared with paroxetine and placebo: a pooled analysis of 4 clinical trials. Prim. Care Companion J. Clin. Psychiatry. 2006. 8. 212-19.
33. Raskin J., Wiltse C.G., Siegal A. et al. Efficacy of duloxetine on cognition, depression, and pain in elderly patients with major depressive disorder: an 8-week, double-blind, placebo-controlled trial. Am. J. Psychiatry. 2007. 164. 900-9.
34. Nelson J.C, Wohlreich M.M., Mallinckrodt C.H. et al. Dulo-xetine for the treatment of major depressive disorder in older patients. Am. J. Geriatr. Psychiatry. 2005. 13. 227-35.
35. Wohlreich M.M., Mallinckrodt C.H., Watkin J.G. et al. Duloxetine for the long-term treatment of major depressive disorder in patients aged 65 and older: an open-label study. BMC Geriatr. 2004. 4. 11.
36. Kuga A., Tsuji T., Hayashi S., Fujikoshi S., Tokuoka H., Yoshikawa A., Escobar R., Tanaka K., Azekawa T. An observational study of duloxetine versus SSRI monotherapy in Japanese patients with major depressive disorder: subgroup analyses of treatment effectiveness for pain, depressive symptoms, and quality of life. Neuropsychiatr. Dis. Treat. 2017. 13. 2115-2124.
37. Schlereth T. Guideline «diagnosis and non-interventional therapy of neuropathic pain» of the German Society of Neurology (deutsche Gesellschaft für Neurologie). Neurological Research and Practice. 2020. 2. 16.
38. Kajdasz D. K. et al. Duloxetine for the management of diabetic peripheral neuropathic pain: Evidence-based findings from post hoc analysis of three multicenter, randomized, double-blind, placebo-controlled, parallelgroup studies. Clinical Therapeutics. 2008. 29(suppl.). 2536-2546.
39. Lindner V., Deuschl G. Antidepressants and anticonvulsive agents. Practical utility profile in pain therapy. Schmerz. 2004. 18(1). 53-60.
40. Lunn M.P.T., Hughes R.A.C., Wiffen P.J. Duloxetine for treating painful neuropathy, chronic pain or fibramyalgia. Cochrane Database of Systematic Reviews. 2014. 1. 3. DOI: 10.1002/14651858.CD007115.pub3.
41. Enomoto H., Yasuda H., Nishiyori A. et al. Duloxetine in patients with diabetic peripheral neuropathic pain in Japan: a rando-mized, double blind, noninferiority comparative study with pregabalin. J. of Pain Researche. 2018. 11. 1857-1868.
42. Alev L., Fujikoshi S., Yoshikawa A. et al. Duloxetine 60 mg for chronic low back pain: post hoc responder analysis of double-blind, placebo-controlled trials. J. of Pain Research. 2017. 10. 1723-1731.
43. Qaseem A., Wilt T.J., McLean R.M., Forciea M.A. Clinical Guidelines Committee of the American College of Physicians. Noninvasive treatments for acute, subacute, and chronic low back pain: a clinical practice guideline from the american college of physicians. Annals of Internal Medicine. 2017. 166(7). 514-530.
44. Weng C., Xu J., Wang Q. et al. Efficacy and safety of duloxetine in osteoarthritis or chronic low back pain: a systematic review and meta-analysis. Osteoarthritis Cartilage. 2020. 28(6). 721-734.
45. Bruyère O., Honvo G., Veronese N. et al. An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Seminars in Arthritis and Rheumatism. 2019. 49(3). 337-350.
46. Wang Z.Y., Shi S.Y., Li S.J. et al. Efficacy and safety of duloxetine on osteoarthritis knee pain: a meta-analysis of randomized controlled trials. Pain Medicine. 2015. 16(7). 1373-1385.
47. Uchio Y., Enomoto H., Alev L. et al. A randomized, double-blind, placebo-controlled Phase III trial of duloxetine in Japanese patientswith knee pain due to osteoarthritis. J. of Pain Research. 2018. 11. 809-821.
48. Lisinski A., Hieronymus F., Näslund J., Nilsson S., Eriksson E. Item-based analysis of the effects of duloxetine in depression: a patient-level post hoc study. Neuropsychopharmacology. 2020. 45(3). 553-560.

/74.jpg)
/75.jpg)
/75_2.jpg)
/76.jpg)
/77.jpg)
/78.jpg)