1. Вступ
Інсульт є основною причиною інвалідності дорослих у всьому світі, в тому числі в Кореї [1]. Хоча показники смертності від інсульту в Кореї демонструють значне зниження, кількість пацієнтів з інвалідністю внаслідок інсульту зростає [2]. Останні досягнення в діагностиці, лікуванні та реабілітації значно вплинули на клінічні та функціональні результати у пацієнтів після інсульту [3]. Але незважаючи на те, що ці досягнення забезпечують клінічні переваги, у багатьох людей, які перенесли інсульт, все ще мають місце виражені рухові порушення [4]. Нейропластичність є основним принципом відновлення рухової функції після інсульту, а стратегії підвищення нейропластичності — золотий стандарт реабілітації після інсульту [5]. Підгостра стадія інсульту, що характеризується більш високою ней-ропластичністю, є критичним періодом для терапії, оскільки на цій стадії мозок найбільш сприйнятливий до модифікації, якої він зазнає під час проведення реабілітаційних заходів [6, 7].
Повідомляється, що деякі лікарські засоби покращують рухове відновлення після інсульту в поєднанні з реабілітаційними стратегіями, такими як тренування з метою виконання певних завдань [8]. Хоча є певні докази того, що фармакологічні препарати можуть сприяти відновленню моторики після інсульту, необхідне проведення добре контрольованих більш крупних досліджень, щоб підтвердити, що конкретні ліки можуть покращити рухове відновлення після інсульту [9]. У той час як у багатьох дослідженнях вивчали вплив стратегій реабілітації та фармакологічних підходів на відновлення моторики у пацієнтів із інсультом і помірними та тяжкими руховими порушеннями, лише кілька досліджень були зосереджені на вивченні ситуації у пацієнтів із інсультом і руховими порушеннями тяжкого ступеня [10]. Церебролізин (EVER Neuro Pharma GmbH, Австрія), нейропептидний препарат із низькомолекулярних нейропептидів (< 10 кДа) і вільних амінокислот, має нейропротекторні та нейровідновлювальні властивості, зменшуючи ексайтотоксичність, пригнічуючи утворення вільних радикалів, активуючи мікроглію і апоптоз, проявляючи нейротрофічну дію, сприяючи проростанню нейронів, покращуючи виживання клітин і стимулюючи нейрогенез [11, 12]. Метааналізи показали позитивний вплив Церебролізину на ранній глобальний неврологічний дефіцит та сприятливий профіль безпеки при лікуванні гострого ішемічного інсульту [13, 14]. Крім того, у нашому попередньому дослідженні ми виявили вплив Церебролізину на моторну функцію пацієнтів у підгострій стадії ішемічного інсульту [15]. Відзначалося вірогідне покращення рухової функції у підгрупі пацієнтів із початково тяжкими руховими порушеннями (шкала оцінки Фугла — Меєра (FMA) < 50); однак розмір вибірки в нашому попередньому дослідженні був недостатньо великим.
Тому ми провели дослідження з більшою кількістю учасників, щоб уточнити ефективність Церебролізину в поєднанні з відновною терапією щодо додаткового відновлення моторики під час підгострої фази інсульту у пацієнтів із руховими порушеннями тяжкого ступеня. Крім того, ми досліджували вплив Церебролізину на нейропластичність за допомогою функціональної нейровізуалізації [2].
2. Матеріали та методи
2.1. Дизайн дослідження
Для оцінки впливу Церебролізину на покращення рухової функції та пластичності рухової ділянки мозку у пацієнтів із підгострим інсультом і тяжкими руховими порушеннями (FMA < 50) ми проаналізували дані двох досліджень фази IV (NCT01996761 та NCT02768571) [16]. Пацієнти 18–80 років були включені у вищезазначені дослідження протягом перших 7 діб після інсульту, якщо у них уперше виникла кортикальна та/або підкіркова одностороння ішемія мозку, підтверджена комп’ютерною томографією або магнітно-резонансною томографією (МРТ) головного мозку, та вони перебували на стаціонарному лікуванні. Критеріями виключення були прогресуючий або нестабільний інсульт, наявне активне серйозне неврологічне захворювання або серйозне психіатричне захворювання, тяжке зловживання алкоголем або наркотиками в анамнезі протягом останніх 3 років, прогресуюче захворювання печінки, нирок, серця або легенів, термінальна стадія будь-якого захворювання із прогнозом виживання < 1 року, вагітність або лактація чи будь-який стан, при якому протипоказаний Церебролізин, включаючи алергію на нього. Критерії включення та виключення для другого дослідження (NCT02768571) були такими ж, як і для першого (NCT02768571) [15], за винятком показника оцінки рухових порушень за загальною шкалою FMA (FMA-T) на 7-й день після розвитку інсульту, який коливався від 0 до 49 [17]. У всіх пацієнтів до моменту включення їх у дослідження було отримано письмову інформовану згоду, а протоколи дослідження були затверджені інституційною ревізійною радою кожного медичного центру, де проводилися вищезазначені дослідження.
Кожне з двох клінічних досліджень було проспективним багатоцентровим рандомізованим подвійним сліпим плацебо-контрольованим у паралельних групах. Скринінг був проведений протягом 7 днів після виникнення інсульту. Були задокументовані демографічні дані, історія хвороби, дані фізикального огляду та лабораторних обстежень. Включені в дослідження пацієнти були рандомізовані для отримання 21-денного курсу лікування (8–28-ма доба) Церебролізином або плацебо, які надавалися як доповнення до стандартної реабілітаційної терапії. Церебролізин призначали один раз на добу в дозі 30 мл, розведеній фізіологічним розчином (загальний інфузійний розчин 100 мл), шляхом внутрішньовенної інфузії протягом 30 хв. Пацієнти контрольної групи замість Церебролізину отримували щодня 100 мл фізіологічного розчину. Крім того, усім пацієнтам проводилися реабілітаційні заходи за стандартизованою програмою, яка складалася з двох годин фізіотерапії та однієї години трудової терапії щодня по буднях (понеділок — п’ятниця). За потреби проводилися додаткові сеанси мовленнєвої або когнітивної реабілітації. Стандартизована програма реабілітації виконувалася відповідно до клінічних рекомендацій з реабілітації після інсульту в Кореї [18]. Після базової оцінки (день 8; T0) ефективність та безпеку оцінювали відразу після лікування (день 29; T1), а також через 3 місяці (день 90; T2) після розвитку інсульту. Зміни нейропластичності рухових структур нервової системи оцінювали за допомогою дифузійно-тензорного сканування (DTI) та функціональної магнітно-резонансної томографії у стані спокою (rs-fMRI) в моменти часу T0 та T2.
2.2. Рандомізація та засліплення
Лікування було призначено відповідно до попередньо визначеного плану рандомізації. Спеціальний код рандомізації було підготовлено з використанням програмного пакета SAS® (план процесу) у певному робочому середовищі. Використовували блок розміром 4; призначення лікування у співвідношенні 1 : 1 було стратифіковане кожним клінічним центром. Розмір блоків не був відкритим для центрів. Кожен центр отримував ліки для послідовності повних блоків, щоб в кожному центрі лікування було збалансованим. Пацієнти, медичні працівники, оцінювачі даних, оцінювачі результатів і спонсор були засліплені щодо розподілу лікування. Статист, відповідальний за рандомізацію, і особа, відповідальна за підготовку досліджуваного препарату, не були засліплені.
2.3. Оцінка функцій
Базову оцінку показників проводили в момент T0 за допомогою шкали інсульту Національного інституту здоров’я (NIHSS) для визначення тяжкості інсульту [19] та Корейської короткої шкали оцінки психічного стану (K-MMSE) з метою оцінки когнітивних функцій [20]. Оцінку рухових функцій проводили засліплені спостерігачі на початку (T0), відразу після лікування, тобто на 29-й день (T1), а також під час спостереження та через 3 місяці (T2) після розвитку інсульту за допомогою FMA. Ми використовували загальну шкалу FMA (FMA-T), а також окремо шкали FMA для оцінки верхніх кінцівок (FMA-UL) і нижніх кінцівок (FMA-LL).
Крім того, цілісність кортикоспінального тракту (CST) у момент T0 оцінювали шляхом вимірювання реакції ураженої моторної кори на транскраніальну магнітну стимуляцію (TMS); зокрема, вимірювали рухові викликані потенціали (MEP) першого паретичного дорсального міжкісткового (FDI) м’яза в спокої, як описано раніше [21, 22]. MEP оцінювали за допомогою одноразової магнітної стимуляції при 120% інтенсивності rMT над іпсіураженою M1 за допомогою 70-мм котушки.
Для реєстрації та моніторингу активності конт-ралатерального м’яза була використана система електроміографії/викликаних потенціалів Synergy (Medelec, Kingswood, Bristol, UK). Одноімпульсна TMS була використана щодо іпсіураженої М1 за допомогою стимулятора Magstim BiStim2 (Magstim, Spring Gardens, Wales, UK). Котушку тримали тангенціально щодо шкіри голови, рукоятка була спрямована назад і вбік під кутом 45° від серединної сагітальної лінії. Пацієнти були розподілені відповідно до наявності MEP на уражених FDI-м’язах на групу «відповідь MEP», яка включала всіх пацієнтів, у яких були виявлені MEP в ураженому FDI-м’язі, і групу «без відповіді MEP», до якої входили пацієнти, у яких не виявлялися будь-які MEP з амплітудою від піку до піку > 50 μV в ураженому FDI-м’язі відповідно до трьох послідовних розрядів з максимальним виходом стимулятора. MEP був надійним інструментом для прогнозування відновлення функції руху у пацієнтів із інсультом [23, 24].
2.4. Оцінка даних нейровізуалізації
Ураження, спричинені інсультом, у кожного пацієнта були вручну намальовані засліпленим спостерігачем на дифузійно-зважених зображеннях за допомогою FSLview 4.0.1 (частина програмного забезпечення FSL версії 5.0.9). Кожний об’єм ураження був приведений до стандартизованого простору Монреальського неврологічного інституту (MNI) з використанням матриці трансформації, отриманої з кожної нормалізації DTI. Результати були візуалізовані за допомогою MRIcroGL (McCausland Center for Brain Imaging, University of South Carolina, http://www.cabiatl.com/mricrogl, доступ 7 березня 2020 р.). Для порівняння груп, якщо інсультні ураження були у лівій півкулі, вони були перевернуті, щоб накласти їх на праву півкулю.
Пластичність рухових структур нервової системи оцінювали на основі даних DTI та rs-fMRI. Дані візуалізації були отримані за допомогою МР-сканера 3T Philips ACHIEVA® (Philips Medical Systems, Best, The Netherlands). Усім пацієнтам під час проведення цих досліджень було рекомендовано тримати очі закритими, не думаючи ні про що конкретно, і залишатися нерухомими під час сканування. Щодо даних DTI було отримано 46 зображень усього мозку. Набір даних містив 45 зображень з дифузійним зважуванням (значення b = 1000 с/мм2), нанесених уздовж 45 напрямків дифузії, і 1 зображення без дифузійного зважування. Параметри збору даних: 60 аксіальних зрізів, товщина зрізу = 2,25 мм, відсутність зазора, розмір матриці = = 112 × 112, час повторення = 8770 мс, час ехо-сигналу = 60 мс і поле зору = 220 × 220 мм. Щодо даних rs-fMRI було отримано 100 зображень всього мозку. Параметри збору даних: 35 аксіальних зрізів, товщина зрізу = 4 мм, відсутність зазора, розмір матриці = 128 × 128, час повторення = 3000 мс, час ехо-сигналу = 35 мс і поле зору = 220 × 220 мм.
2.4.1. Аналіз даних, отриманих за допомогою дифузійно-тензорного сканування
Дані DTI кожного пацієнта були попередньо оброблені за допомогою Diffusion Toolbox FMRIB з пакета програм FSL версії 5.0.9 (FMRIB Software Library, FMRIB, Oxford, UK, http://www.fmrib.ox.ac.uk/fsl, доступ 15 червня 2019 р.). Вихрові струми та рух голови були виправлені, а зображення мозку вирізані. Алгоритм DTIfit був використаний для підгонки тензорної моделі та для розрахунку карт фракційної анізотропії (FA) для вихрових струмів і даних, скоригованих за рухом голови. Карти FA були зареєстровані нелінійно до стандартного простору MNI (зображення стандартного простору FMRIB58_FA) за допомогою реєстраційного алгоритму методу просторової статистики на основі трактів (TBSS). У той же час уражені ділянки були замасковані. Інсультні ураження під час реєстрації не враховувалися. Викривлені карти FA були проконтрольовані візуально.
Для отримання регіон-специфічних значень FA використовували шаблон CST, отриманий із даних DTI у здорових осіб, та атлас білої речовини Університету Джона Хопкінса (JHUICBM-DTI-81) [25], наданий FSL. Були досліджені такі вертикальні, поздовжні, латеральні та цілісні шляхи білої речовини: кортикоспінальний тракт, верхній променевий вінець (SCR), верхній поздовжній пучок (SLF), уся півкуля (WHT) і мозолисте тіло. Мозолисте тіло складається з коліна (GCC), тіла (BCC) і валика (SCC). Кожен регіон був бінаризований і замаскований над деформованою картою FA. Значення FA для регіону було отримано шляхом усереднення значень FA в межах кожного регіону. Пропорційні значення FA (уражена/неуражена півкуля) були розраховані для CST, SCR, SLF та WHT.
Просторова статистика на основі тракту (TBSS) була розрахована за допомогою Diffusion Toolbox FMRIB з пакета програм FSL версії 5.0.9 (FMRIB Software Library, FMRIB, Oxford, UK, http://www.fmrib.ox.ac.uk/fsl, доступ 15 червня 2019 р.). Для нелінійної регресії використовувалися різні функції (tbss_1_preproc, tbss_2_reg, tbss_3_postreg і tbss_4_prestats). Для порівняння відносних воксельних значень FA між ураженими та неураженими півкулями була використана функція tbss_sym.
2.4.2. Аналіз даних функціональної магнітно-резонансної томографії в стані спокою
Попередню обробку даних rs-fMRI проводили за допомогою пакета SPM12 (Welcome Trust Centre for Neuroimaging, University College London, London, UK, http://www.fil.ion.ucl.ac.uk/spm, доступ 23 травня 2019 р.). Попередня обробка складалася з кількох кроків: синхронізація зрізу та корекція руху голови, реєстрація до структурних зображень, просторова нормалізація в шаблоні в просторі атласу MNI та просторове згладжування з використанням повної ширини 6 мм на половині максимуму гаусового ядра. Кілька джерел неприйнятних параметрів було видалено за допомогою лінійної регресії дев’яти неприйнятних параметрів, включаючи параметри руху голови та тимчасові параметри глобальних сигналів, сигналів білої речовини та шлуночків. Для видалення постійних зміщень і лінійних трендів була виконана смугова фільтрація між 0,009 і 0,08 Гц. Регресія неприйнятних параметрів та смугова фільтрація були оброблені за допомогою MATLAB (Mathworks, Natick, MA, USA).
Мережа складається з набору вузлів і ребер між парами вузлів. У цьому дослідженні регіони інтересу (ROI) були отримані з попередніх метааналізів [26]. Ми використали результати «рухи в уражених верхніх кінцівках» проти результатів «у стані спокою» у пацієнтів з інсультом. Двадцять чотири ROI були визначені як сфери діаметром 10 мм навколо попередньо визначених координат MNI. Уражені вокселі були замасковані. Край мережі був розрахований за допомогою кореляції Пірсона між середніми параметрами часу кожного з 24 регіонів.
Ефективність — це показник того, наскільки ефективно відбувається обмін інформацією. Міра обернено пропорційна довжині шляху. Для довідки: довжина шляху — це мінімальна кількість ребер, яку необхідно пройти, щоб перейти від одного вузла до іншого. Ефективність мережі визначається так [27]:
де n — кількість вузлів, а dw — найкоротша зважена довжина шляху між вузлом i та вузлом j.
2.5. Статистичний аналіз
Повний набір аналізів (FAS) визначався як популяція пацієнтів, які пройшли функціональну оцінку принаймні на початку (T0) і відразу після лікування (T1). Відсутні дані були підраховані методом останнього перенесеного спостереження (LOCF). Популяція безпеки включала всіх пацієнтів, які отримали хоча б одну дозу досліджуваного препарату. SPSS, версія 24.0 (SPSS, Chicago, IL, USA) була використана для статистичного аналізу. Тест нормальності Шапіро — Вілка використовувався для визначення того, чи показали оцінювані значення нормальний розподіл; було виявлено, що всі оціночні значення мають нормальний розподіл (p > 0,05 за тестом нормальності Шапіро — Вілка). Основним результатом цього дослідження була модель FMA-T від T0 до T2. Щоб перевірити ефективність Церебролізину в усі моменти часу (T0, T1 і T2), ми використали дисперсійний аналіз (ANOVA), фактором, що відображав зміни в одного пацієнта, був час, а фактором, що відображав зміни між пацієнтами (Церебролізин проти плацебо), була група. Для аналізу вірогідних змін між часовими моментами всередині груп використовували парний t-критерій. Крім того, для аналізу зміни рухової функції між двома групами використовувався незалежний t-критерій. Для корекції множинних порівнянь була використана поправка Бонфероні. Вплив Церебролізину або плацебо на FMA в T2 та покращення FMA від вихідного рівня аналізували за допомогою простої лінійної регресії з однією незалежною змінною за групою. Цей аналіз проводили для оцінки моделі покращення рухових функцій в Т2 у кожній групі.
Для аналізу зображень використовувався аналіз за протоколом (PP), який завершив подальшу оцінку в Т2. Тест нормальності Шапіро — Вілка використовувався, щоб визначити, чи отримані дані зображення з нормального розподілу; було виявлено, що всі значення мають нормальний розподіл (p > 0,05 за тестом нормальності Шапіро — Вілка). ANOVA з повторюваними вимірюваннями був використаний для дослідження ефектів взаємодії групи та часу, вимірювання зображення для дослідження пластичності рухової мережі в обох групах. Для аналізу значущих змін від Т1 до Т2 у показниках візуалізації учасників у групах був проведений парний t-тест. Значення p < 0,05 вважалися статистично вірогідними.
3. Результати
3.1. Учасники дослідження
Усього було обстежено 174 пацієнти з інсультом. 54 пацієнти були виключені, оскільки вони не відповідали критеріям наявності тяжких рухових порушень (30 пацієнтів) або відмовилися від участі у дослідженні (24 пацієнти). Таким чином, було рандомізовано 122 пацієнти, але 3 із них (група Церебролізину — n = 1, плацебо — n = 2) перед уведенням досліджуваного препарату відкликали свою згоду на участь у дослідженні. Із 119 пацієнтів, які отримали лікування, 9 пацієнтів вибули з дослідження, тому що в них виникли небажані явища (n = 5) або вони відкликали свою згоду на участь (n = 4). Таким чином, повний набір даних для аналізу (FAS) надали 110 пацієнтів (n = 59 у групі Церебролізину, n = 51 у групі плацебо), які завершили 3-тижневий курс застосування Церебролізину або плацебо та у яких оцінювали функціональні дані принаймні на початку (T0) й одразу після лікування (T1; день 29) (рис. 1). У структурі FAS були 40 пацієнтів з першого дослідного набору даних (Церебролізин — n = 21, плацебо — n = 19) і 70 пацієнтів із другого набору даних (Церебролізин — n = 38, плацебо — n = 32).
/14.jpg)
У 10 пацієнтів із тих, у кого провели оцінку даних у Т2 (день 90; n = 102), результати структурної МРТ і DTI не були включені до аналізу, тому що з цими особами перервався зв’язок перед виконанням контрольної МРТ (n = 5), через рух пацієнта під час виконання МРТ були отримані неякісні зображення (n = 2), через помилку протоколу сканування (n = 1), через наявність комбінованого ураження мозку в результаті хронічної ішемії мозку (n = 1) та невдачу просторової нормалізації для попередньої обробки МРТ (n = 1). З них rs-fMRI не можна було використовувати в 11 пацієнтів через відсутність даних про непереносимість даного методу (n = 7) та виконання сканування з використанням седації (n = 4). У підсумку, для проведення аналізу результатів були включені дані DTI 92 осіб (Церебролізин — n = 50, плацебо — n = 42) і дані rs-fMRI 81 особи (Церебролізин — n = 43, плацебо — n = 38) (рис. 1).
/15.jpg)
/15_2.jpg)
У табл. 1 узагальнено характеристики 110 пацієнтів, включених до FAS. Не було суттєвих відмінностей у демографічних та клінічних характеристиках між двома групами, включаючи початкову тяжкість інсульту, виміряну за NIHSS, рухові порушення та об’єм ураження. Карти ураження продемонстрували подібну картину в обох групах (рис. 2).
3.2. Результати оцінки рухової функції
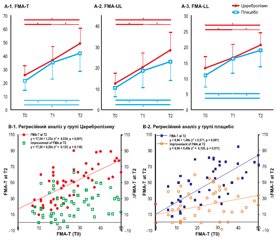
На рис. 3 наведена зміна рухової функції у пацієнтів кожної групи. У кожній групі спостерігалося вірогідне покращення за FMA-T (p < 0,05) з часом, а багаторазові вимірювання ANOVA за FMA-T (F2,l07 = 3,202, p = 0,0415, рис. 3 (A-1)) продемонстрували вірогідну ефективність взаємодії між часом і типом втручання. Покращення показників, які відзначалися в період від T0 до T1 і від T0 до T2, не продемонструвало вірогідних відмінностей між групами, однак покращення в період від T1 до T2 було вірогідно більш вираженим у групі Церебролізину, ніж у групі плацебо (p < 0,05 і d = 0,47 за Коеном; табл. 2).
/16_2.jpg)
В обох групах відбувалося вірогідне покращення з часом показників за FMA-UL та FMA-LL (p < 0,05). Повторні вимірювання ANOVA продемонстрували ефективність взаємодії між часом і типом втручання як на верхніх (FMA-UL), так і на нижніх (FMA-LL) кінцівках (F2,107 = 2,635, p = 0,076, і F2,107 = 2,825, p = 0,064, рис. 3 (A-2, A-3)). Зміна показників за FMA-UL від T1 до T2 була вірогідно більш вираженою в групі Церебролізину, ніж у групі плацебо (p < 0,05 і d = 0,44 за Коеном; табл. 2).
Проста лінійна регресія продемонструвала вірогідний зв’язок між балами за FMA в T0 і T2 як у групі Церебролізину (r2 = 0,534, p < 0,001), так і в групі плацебо (r2 = 0,571, p < 0,001) (рис. 3 (B-1)). З точки зору покращення від T0 до T2, вірогідний зв’язок з показником за FMA в T0 спостерігався лише в групі плацебо (r2 = 0,125, p = 0,011, рис. 3 (B-2)), а не в групі Церебролізину. Ці результати свідчать про несподіване покращення рухової функції в Т2 у пацієнтів, які отримували Церебролізин, порівняно з групою плацебо.
Стосовно оцінок показників як верхніх, так і нижніх кінцівок проста лінійна регресія продемонструвала вірогідний зв’язок між T0 і T2 як для Церебролізину (UL: r2 = 0,504, p < 0,001; LL: r2 = 0,428, p < 0,001), так і для плацебо (UL: r2 = 0,571, p < 0,001; LL: r2 = 0,527, p < 0,001). З точки зору покращення в період з T0 до T2, вірогідний зв’язок з FMA-UL в T0 спостерігався в групі плацебо (r2 = 0,101, p = 0,023), але не в групі Церебролізину. Ці результати означають, що в групі Церебролізину спостерігався відмінний результат щодо покращення рухової функції верхніх кінцівок у Т2.
У дослідженні MEP 20 (33,9 %) із 59 пацієнтів продемонстрували позитивну відповідь MEP в T1 у групі Церебролізину та 14 (27,5 %) з 51 пацієнта — у групі плацебо. Показники відповіді MEP були вірогідно більшими в Т2 в обох групах (р < 0,05) — 42,4 % (25 із 59 пацієнтів) у групі Церебролізину та 35,3 % (18 із 52 пацієнтів) у групі плацебо. Проте не було вірогідної різниці між групами Церебролізину і плацебо у частоті відповіді МЕП у Т1 та Т2.
3.3. Результати оцінки даних нейровізуалізації
У табл. 3 наведено результати аналізу даних DTI. Не було вірогідної різниці у значеннях FA в T0 між двома групами. У кожній групі в період з T0 до T2 спостерігалося вірогідне зниження пропорційних значень FA CST, SCR, SLF та WHT (p < 0,05). Однак ANOVA з повторними вимірюваннями продемонстрував вірогідну взаємодію між часом і типом втручання, що вимірюється пропорційними значеннями FA для CST, SCR, SLF і WHT (p < 0,05). Ці значення були більшою мірою знижені в групі плацебо порівняно з групою Церебролізину. Значення FA мозолистого тіла демонстрували однакові тенденції зі змінами основних вертикальних і поздовжніх шляхів білої речовини в кожній групі. Значення FA вірогідно зменшилися в кожній групі в період з T0 до T2 (p < 0,05). Однак ANOVA з повторними вимірюваннями продемонстрував вірогідну взаємодію між часом і типом втручання, що оцінювалося за значеннями FA для GCC, BCC та SCC (p < 0,05). Ці значення FA були знижені більшою мірою в групі плацебо порівняно з групою Церебролізину.
На рис. 4 наведені результати TBSS для осьової, фронтальної та сагітальної проєкції у кожній групі. Зміни воксельних значень FA від T0 до T2 продемонстрували різні закономірності між групами Церебролізину та плацебо. У групі Церебролізину ділянки білої речовини, де спостерігалося вірогідне зниження FA, були меншими, ніж у групі плацебо (р < 41,05). Зокрема, відмінності були помітні у внутрішній капсулі в осьовій проєкції, CST у фронтальній проєкції та в мозолистому тілі в сагітальній проєкції. Ці результати TBSS узгоджувалися з аналізами FA на основі DTI.
/18.jpg)
Аналіз даних rs-fMRI не встановив вірогідної різниці в досліджуваних зв’язках в T0 між двома групами. У групі Церебролізину не було вірогідних змін від T0 до T2 в іпсіуражених, контрауражених або міжпівкульних зв’язках та ефектах; однак у період від T0 до T2 у групі плацебо спостерігалося вірогідне зниження в іпсіуражених зв’язках та ефектах (p < 0,05) порівняно з початковим рівнем. Крім того, ANOVA з повторними вимірюваннями показав значну взаємодію між часом і типом втручання, що вимірюється в іпсіуражених зв’язках (р < 0,05, табл. 3). Ці результати свідчать про те, що рухові структури ураженої півкулі були краще збережені в групі Церебролізину, ніж у групі плацебо.
3.4. Оцінка безпеки
З усіх пацієнтів, якім проводилося лікування досліджуваним препаратом (n = 119), загалом 92,4 % отримали 21 інфузію (Церебролізин — 96,7 %, плацебо — 87,9 %). Хоча 5 пацієнтів у групі Церебролізину (8,1 %) і 5 у групі плацебо (8,3 %) мали побічні ефекти, жоден з них не був пов’язаний з досліджуваним препаратом. Під час періоду застосування досліджуваного лікування з групи Церебролізину вибув 1 пацієнт через прогресування інсульту та з групи плацебо вибули 4 пацієнти через геморагічну трансформацію інфаркту мозку (1), рухову слабкість (1), прогресування інсульту (1) та рецидив інсульту (1). Усі 5 пацієнтів одужали протягом періоду дослідження. У період спостереження 4 пацієнти з групи Церебролізину вибули через рецидив інсульту (1), ректальний крововилив (1) та пневмонію (2). Двоє з цих пацієнтів одужали протягом періоду дослідження, у 1 пацієнта з рецидивом інсульту спостерігалося загострення неврологічних симптомів, а 1 пацієнт із аспіраційною пневмонією помер. Один пацієнт з групи плацебо вибув із спостереження через рецидив інсульту, який регресував протягом періоду дослідження. Життєві та лабораторні показники у пацієнтів в двох групах були подібними, і не спостерігалося їх клінічно вірогідних змін під час дослідження.
4. Обговорення
Це дослідження показало, що поєднання традиційної реабілітаційної терапії з використанням Церебролізину протягом 3 тижнів надає додаткові переваги в плані відновлення моторики у пацієнтів з тяжкими руховими порушеннями порівняно з проведенням лише традиційної відновлювальної терапії.
Можливим ефектом, завдяки якому Церебролізин сприяє відновленню моторики, може бути збереження рухових структур нервової системи у пацієнтів з інсультом. Задля сприяння відновленню рухової функції уражених кінцівок були використані нові терапевтичні стратегії, включаючи неінвазивну стимуляцію мозку та роботизовану терапію як додаткові методи лікування, що доповнюють звичайні стратегії реабілітації, такі як тренування виконання конкретного завдання, електроміографічний біологічний зворотний зв’язок, функціональна електрична стимуляція та рухова терапія, викликана обмеженням; однак відновлення функції руху у деяких осіб, які перенесли інсульт, все ще не є задовільним [28]. Крім того, не було чітких доказів того, що нові терапевтичні стратегії, яким приділялася увага у великих багатоцентрових дослідженнях, мають переваги над загальноприйнятою реабілітацією після інсульту [29]. З метою підвищення відновлення рухової функції після інсульту розробляються нові терапевтичні стратегії, спрямовані на сприяння нейропластичності [30]. Також було проведено багато досліджень ефективності фармакотерапії, оскільки препарати, які призначаються пацієнтам з інсультом, можуть впливати на нейропластичність [10]. На сьогодні у пацієнтів з інсультом широко використовуються селективні інгібітори зворотного захвату серотоніну (СІЗЗС) завдяки їх здатності сприяти нейропластичності та підвищувати рухове відновлення [31]. Вважається, що СІЗЗС надають ці ефекти шляхом модуляції гальмівних шляхів, тим самим посилюючи реорганізацію та відновлюючи збуджувально-гальмівний контроль. У пацієнтів з інсультом ці гальмівно-модулюючі ефекти можуть відігравати ключову роль у пластичності нейронних ланцюгів, індукованій навчанням [31].
У кількох дослідженнях агоністів дофаміну повідомлялося, що вони сприяють відновленню моторики після інсульту [10]. Потенційними механізмами опосередкованого дофаміном поліпшення рухового відновлення є посилення збудження при умовному навчанні та посилення глутамінергічної передачі, що модулює синаптичну ефективність [32]. Тим не менш, у пацієнтів з інсультом і тяжкими руховими порушеннями клінічні ефекти фармакотерапії є обмеженими, оскільки поточні стратегії моторної реабілітації зосереджені на реорганізації збережених рухових структур нервової системи після інсульту [33]. У пацієнтів з інсультом і тяжкими руховими порушеннями рухові структури є відносно більш ураженими та меншою мірою збереженими, ніж в осіб з легкими руховими порушеннями. Для сприяння руховому відновленню необхідні нові лікарські засоби з нейропротекторною та нейротрофічною дією. Церебролізин (EVER Neuro Pharma GmbH, Unterach am Attersee, Austria, розчин для інфузій, 30 мл) є унікальним нейропептидним препаратом із низькомолекулярних нейропептидів (< 10 кДа) і вільних амінокислот, що має нейропротекторні та нейровідновні властивості [11, 12]. Повідомлялося, що Церебролізин посилює нейропротекторну дію, захищаючи від ексайтотоксичності та окисного стресу, а також модулюючи запальну відповідь [34]. Крім того, Церебролізин може посилювати нейрогенез і нейровідновлення через активність нейротрофічного фактора і сигнальних шляхів [35]. Метааналіз дев’яти рандомізованих досліджень показав, що Церебролізин продемонстрував сприятливий вплив як на неврологічний дефіцит, так і на функціональні результати, навіть якщо його застосування було розпочато протягом 3 днів після виникнення інсульту [13]. У нещодавно надрукованій оглядовій статті продемонстровано, що Церебролізин може відігравати важливу роль у лікуванні багатьох неврологічних захворювань, таких як інсульт, нейродегенеративні порушення та черепно-мозкова травма, хоча для уточнення ефектів Церебролізину необхідні більш надійні клінічні дані [35]. На основі досліджень на тваринах і людях було висунуто гіпотезу, що фаза підгострого інсульту є періодом підвищеної пластичності, у якому відбувається нервова реорганізація, що свідчить про існування критичного періоду для відновлення моторики [36]. У зв’язку з цим застосування Церебролізину в поєднанні з реабілітацією під час підгострої фази може бути ефективним для сприяння руховому відновленню у пацієнтів з інсультом і тяжкими руховими порушеннями.
У цьому дослідженні спостерігалася вірогідна різниця в моделях відновлення моторики між групами Церебролізину та плацебо. Після 21-денного курсу лікування покращення рухової функції спостерігалося переважно у верхніх, а не в нижніх кінцівках. Незважаючи на те, що під час 21-денного курсу лікування ступінь рухового відновлення в обох групах була схожою, у групі Церебролізину з моменту завершення 21-денного лікування до 3 місяців після виникнення інсульту спостерігалося вірогідно більш виражене рухове відновлення, ніж у групі плацебо. Ці пізні ефекти Церебролізину можуть бути пов’язані з характеристиками учасників, які на початковому етапі мали виражені рухові порушення. На відміну від пацієнтів з інсультом і легкими руховими порушеннями, у пацієнтів з інсультом і тяжкими руховими порушеннями відновлення рухової функції продовжується від 30 до 90 діб [37]. Крім того, функціональне відновлення стосується покращення сенсорної та моторної функції нервової системи у пацієнтів з інсультом, і у подальшому може відбуватися відновлення, що ґрунтується на перерозподілі між пов’язаними кортикальними ділянками з метою формування нових структурних та функціональних ланцюгів [38]. Після закінчення гострого періоду інсульту в головному мозку пацієнтів протягом кількох тижнів відбуваються спонтанні репарації [33]. У даному дослідженні Церебролізин застосовували протягом цього періоду як найважливішого терапевтичного часового вікна для функціонального відновлення [39]. Найбільш вираженим пре-диктором результату відновлення рухової функції через 3 місяці у пацієнтів з інсультом є стан рухової функції в гострій фазі. Крім того, відомо, що рухове відновлення корелює з руховою функцією в гострій фазі [40, 41]. Результати простого регресійного аналізу показали, що в групі Церебролізину поліпшення рухової функції, виміряне за допомогою FMA-T і FMA-UL, не залежало від тяжкості ураження цієї функції на початку інсульту. Відповідно у пацієнтів з інсультом і тяжкими руховими порушеннями спостерігалося більш виражене покращення відновлення рухової функції в групі Церебролізину, ніж у групі плацебо.
Пластичність рухових структур нервової системи досліджували з використанням функціональної нейровізуалізації за допомогою DTI та rs-fMRI для визначення впливу Церебролізину на нейропластичність. Аналіз DTI продемонстрував вірогідну взаємодію між типом втручання та часом щодо цілісності більшості вертикальних, поздовжніх та латеральних трактів білої речовини. Більшість трактів білої речовини продемонстрували краще збереження цілісності в групі використання Церебролізину, ніж у групі плацебо, що вимірювалося змінами значень FA. Крім того, результати TBSS на основі аналізу DTI продемонстрували менш виражене порушення цілісності білої речовини в групі Церебролізину, ніж у групі плацебо. Карти FA з DTI часто використовуються для дослідження ступеня пошкодження білої речовини та відновлення цілісності білої речовини після інсульту, оскільки ці карти є дуже чутливими до мікроструктурних змін [42, 43]. Значення FA пошкодженого тракту зменшується від гострої до хронічної стадії інсульту внаслідок валерової дегенерації [44, 45]. За допомогою TBSS, методики, яка поєднує переваги як воксельного, так і трактографічного аналізу [46], продемонстровано, що Церебролізин захищає шляхи білої речовини під час фази підгострого інсульту. Аналіз rs-fMRI показав вірогідну взаємодію між типом втручання та часом в іпсіураженому функціональному зв’язку, з її збереженням до 90-ї доби лише в групі Церебролізину. Ці результати свідчать про те, що відновлення рухової функції відбувалося за рахунок збереження рухової мережі, яка була більш вираженою в групі Церебролізину, ніж у групі плацебо.
Це дослідження має деякі обмеження. По-перше, у п’яти лікарнях, які брали участь у цьому дослідженні, не було стандартизованої програми навчання для всіх фізіотерапевтів та ерготерапевтів. Щоб мінімізувати цю упередженість, у кожному закладі було проведено збалансований розподіл груп, і всі установи забезпечили проведення стандартної програми реабілітації відповідно до клінічних рекомендацій, які використовуються в Кореї. Крім того, протягом періоду дослідження не вимірювався фактичний обсяг реабілітаційних заходів у кожного учасника. Оскільки не було різниці в частоті побічних ефектів між двома групами, можна сказати, що загальний стан пацієнтів обох груп був схожим. Однак ця недостатньо чітка інформація є одним із обмежень даного дослідження.
У нещодавно проведеному метааналізі [47] повідомлялося, що застосування флуоксетину не продемонструвало вірогідного впливу на відновлення моторики у пацієнтів з інсультом, хоча деякі дослідження показали, що флуоксетин може суттєво підвищити рухове відновлення у верхніх і нижніх кінцівках у пацієнтів з інсультом. Недавнє дослідження на мишачій фототромботичній моделі показало, що комбінація флуоксетину з фізичною реабілітацією була ефективною для відновлення моторики у мишей після інсульту [48]. Тому будуть корисними майбутні дослідження, у яких флуоксетин буде поєднуватися з різними видами та обсягами реабілітаційної терапії для відновлення моторики у пацієнтів з інсультом. Загалом склалося надто позитивне враження від застосування фармакотерапії в реабілітації після інсульту; однак немає остаточної підтримки її використання в рутинній клінічній практиці. При призначенні Церебролізину пацієнтам з інсультом слід враховувати деякі фактори, такі як тяжкість рухових порушень [15] та поєднання його використання з реабілітацією [49].
5. Висновки
Ми продемонстрували, що Церебролізин позитивно впливає на пластичність рухових структур нервової системи та на відновлення моторики у пацієнтів із руховими порушеннями тяжкого ступеня внаслідок інсульту. Лікування Церебролізином у підгострій фазі інсульту може мати важливе значення для післяінсультної реабілітації, оскільки традиційні стратегії реабілітації мають обмежену здатність сприяти відновленню рухової функції у пацієнтів із тяжкими моторними розладами внаслідок інсульту [28]. Прийом Церебролізину протягом 3 тижнів у поєднанні з відновлювальною терапією у підгострій фазі інсульту був безпечним і добре переносився. Результати нашого дослідження свідчать про те, що Церебролізин слід розглядати як доповнення до традиційної терапії для покращення рухового відновлення у пацієнтів із ішемічним інсультом і тяжкими руховими порушеннями.
Список литературы
1. Mukherjee D., Pati C.G. Epidemiology and the Global Burden of Stroke. World Neurosurg. 2011. 76. S85-S90.
2. Chang W.H., Sohn M.K., Lee J., Kim D.Y., Lee S.-G., Shin Y.-I., Oh G.-J., Lee Y.-S., Joo M.C., Han E.Y., et al. Predictors of functional level and quality of life at 6 months after a first-ever stroke: The KOSCO study. J. Neurol. 2016. 263. 1166-1177.
3. Fortinsky R.H., Grangar C.V., Seltzer G.B. The Use of Functional Assessment in Understanding Home Care Needs. Med. Care. 1981. 19. 489-497.
4. Braddom R.L. Physical Medicine and Rehabilitation. 3rd ed. Elsevier Saunders: Edinburgh, Scotland, 2007.
5. Tallabs F.A., Hammond-Tooke G.D. Theta Priming of 1-Hz rTMS in Healthy Volunteers: Effects on motor inhibition. J. Clin. Neurophysiol. 2013. 30. 79-85.
6. Counsell C., Dennis M., McDowall M., Warlow C. Predicting outcome after acute and subacute stroke: Development and validation of new prognostic models. Stroke. 2002. 33. 1041-1047.
7. Cramer S.C. Repairing the human brain after stroke. II. Resto-rative therapies. Ann. Neurol. 2008. 63. 549-560.
8. Liepert J. Update on pharmacotherapy for stroke and traumatic brain injury recovery during rehabilitation. Curr. Opin. Neurol. 2016. 29. 700-705.
9. Winstein C.J., Stein J., Arena R., Bates B., Cherney L.R., Cramer S.C., DeRuyter F., Eng J.J., Fisher B., Harvey R.L., et al. Guidelines for Adult Stroke Rehabilitation and Recovery: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2016. 47. e98-e169.
10. Viale L., Catoira N.P., Di Girolamo G., Gonzalez C.D. Pharmacotherapy and motor recovery after stroke. Expert Rev. Neurother. 2017. 18. 65-82.
11. Akai F., Hiruma S., Sato T., Iwamoto N., Fujimoto M., Ioku M., Hashimoto S. Neurotrophic factor-like effect of FPF1070 on septal cholinergic neurons after transections of fimbria-fornix in the rat brain. Histol. Histopathol. 1992. 7. 213-221.
12. Wronski R., Kronawetter S., Hutter-Paier B., Crailsheim K., Windisch M. A brain derived peptide preparation reduces the translation dependent loss of a cytoskeletal protein in primary cultured chi-cken neurons. Adv. Dement. Res. 2000. 59. 263-272.
13. Bornstein N.M., Guekht A., Vester J., Heiss W.-D., Gusev E., Homberg V., Rahlfs V.W., Bajenaru O., Popescu B.O., Muresanu D. Safety and efficacy of Cerebrolysin in early post-stroke recovery: A meta-analysis of nine randomized clinical trials. Neurol. Sci. 2018. 39. 629-640.
14. Ziganshina L.E., Abakumova T., Vernay L. Cerebrolysin for acute ischaemic stroke. Cochrane Database Syst. Rev. 2017. 4. CD007026.
15. Chang W.H., Park C.-H., Kim D.Y., Shin Y.-I., Ko M.-H., Lee A., Jang S.Y., Kim Y.-H. Cerebrolysin combined with rehabilitation promotes motor recovery in patients with severe motor impairment after stroke. BMC Neurol. 2016. 16. 1-11.
16. Fugl-Meyer A.R. Post-stroke hemiplegia assessment of physical properties. Scand. J. Rehabil. Med. Suppl. 1980. 7. 85-93.
17. Fugl-Meyer A.R., Jaasko L., Leyman I., Olsson S., Steglind S. The post-stroke hemiplegic patient. 1. А method for evalua-tion of physical performance. Scand. J. Rehabil. Med. 1975. 7. 13-31.
18. Kim Y.-H., Han T.R., Jung H.Y., Chun M.H., Lee J., Kim D.Y., Paik N.-J., Park S.-W., Kim M.-W., Pyun S.-B., et al. Clinical Practice Guideline for Stroke Rehabilitation in Korea. Brain Neurorehabilit. 2009. 2. 1-38.
19. Oh M.S., Yu K.-H., Lee J.-H., Jung S., Ko I.-S., Shin J.-H., Cho S.-J., Choi H.-C., Kim H.H., Lee B.-C. Validity and Reliability of a Korean Version of the National Institutes of Health Stroke Scale. J. Clin. Neurol. 2012. 8. 177-183.
20. Kang Y., Na D.L., Hahn S. A validity study on the Korean Mini-Mental State Examination (K-MMSE) in dementia patients. J. Korean Neurol. Assoc. 1997. 15. 300-308.
21. Groppa S., Oliviero A., Eisen A., Quartarone A., Cohen L., Mall V., Kaelin-Lang A., Mima T., Rossi S., Thickbroom G., et al. A practical guide to diagnostic transcranial magnetic stimulation: Report of an IFCN committee. Clin. Neurophysiol. 2012. 123. 858-882.
22. Kim Y.-H., Chang W.H., Bang O.Y., Kim S.T., Park Y.H., Lee P.K.W. Long-term effects of rTMS on motor recovery in patients after subacute stroke. J. Rehabil. Med. 2010. 42. 758-764.
23. Bembenek J.P., Kurczych K., Karlinski M., Czlonkowska A. The prognostic value of motor-evoked potentials in motor recovery and functional outcome after stroke — A systematic review of the literature. Diet Exerc. Cogn. Funct. Neurol. Dis. 2012. 27. 79-84.
24. Chang W.H., Park E., Lee J., Lee A., Kim Y.-H. Association between Brain-Derived Neurotrophic Factor Genotype and Upper Extremity Motor Outcome after Stroke. Stroke. 2017. 48. 1457-1462.
25. Mori S., Oishi K., Jiang H., Jiang L., Li X., Akhter K., Hua K., Faria A.V., Mahmood A., Woods R., et al. Stereotaxic white matter atlas based on diffusion tensor imaging in an ICBM template. Neuroimage. 2008. 40. 570-582.
26. Rehme A.K., Eickhoff S.B., Rottschy C., Fink G.R., Grefkes C. Activation likelihood estimation meta-analysis of motor-related neural activity after stroke. Neuroimage. 2012. 59. 2771-2782.
27. Latora V., Marchiori M. Efficient Behavior of Small-World Networks. Phys. Rev. Lett. 2001. 87. 198701.
28. Langhorne P., Bernhardt J., Kwakkel G. Stroke rehabilitation. Lancet. 2011. 377. 1693-1702.
29. Stinear C.M., Lang C.E., Zeiler S., Byblow W.D. Advances and challenges in stroke rehabilitation. Lancet Neurol. 2020. 19. 348-360.
30. Di Filippo M., Tozzi A., Costa C., Belcastro V., Tantucci M., Picconi B., Calabresi P. Plasticity and repair in the post-ischemic brain. Neuropharmacology. 2008. 55. 353-362.
31. Pinto C.B., Velez F.G.S., Lopes F., Piza P.V.D.T., DiPietro L., Wang Q.M., Mazwi N.L., Camargo E.C., Black-Schaffer R., Fregni F. SSRI and Motor Recovery in Stroke: Reestablishment of Inhibitory Neural Network Tonus. Front. Neurosci. 2017. 11. 637.
32. Ford G.A., Bhakta B.B., Cozens A., Hartley S., Holloway I., Meads D., Pearn J., Ruddock S., Sackley C.M., Saloniki E.-C., et al. Safety and efficacy of co-careldopa as an add-on therapy to occupational and physical therapy in patients after stroke (DARS): A randomised, double-blind, placebo-controlled trial. Lancet Neurol. 2019. 18. 530-538.
33. Cramer S.C. Drugs to Enhance Motor Recovery After Stroke. Stroke. 2015. 46. 2998-3005.
34. Kang D.H., Choi B.Y., Lee S.H., Kho A.R., Jeong J.H., Hong D.K., Kang B.S., Park M.K., Song H.K., Choi H.C., et al. Effects of Cerebrolysin on Hippocampal Neuronal Death After Pilocarpine-Induced Seizure. Front. Neurosci. 2020. 14. 568813.
35. Fiani B., Covarrubias C., Wong A., Doan T., Reardon T., Nikolaidis D., Sarno E. Cerebrolysin for stroke, neurodegeneration, and traumatic brain injury: Review of the literature and outcomes. Neurol. Sci. 2021. 42. 1345-1353.
36. Stroemer R.P., Kent T.A., Hulsebosch C.E. Enhanced Neocortical Neural Sprouting, Synaptogenesis, and Behavioral Recovery Withd-Amphetamine Therapy after Neocortical Infarction in Rats. Stroke. 1998. 29. 2381-2395.
37. Duncan P., Goldstein L.B., Matchar D., Divine G.W., Feussner J. Measurement of motor recovery after stroke. Outcome assessment and sample size requirements. Stroke. 1992. 23. 1084-1089.
38. Murphy T.H., Corbett D. Plasticity during stroke recovery: From synapse to behaviour. Nat. Rev. Neurosci. 2009. 10. 861-872.
39. Adams H.P., Jr., Nudo R.J. Management of patients with stroke: Is it time to expand treatment options? Ann. Neurol. 2013. 74. 4-10.
40. Byblow W.D., Stinear C.M., Barber P.A., Petoe M.A., Ackerley S.J. Proportional recovery after stroke depends on corticomotor integrity. Ann. Neurol. 2015. 78. 848-859.
41. Smith M.-C., Byblow W.D., Barber P.A., Stinear C.M. Proportional Recovery from Lower Limb Motor Impairment after Stroke. Stroke. 2017. 48. 1400-1403.
42. Alexander A.L., Lee J.E., Lazar M., Field A.S. Diffusion tensor imaging of the brain. Neurotherapeutics. 2007. 4. 316-329.
43. Feldman H.M., Yeatman J.D., Lee E.S., Barde L.H., Gaman-Bean S. Diffusion tensor imaging: A review for pediatric re-searchers and clinicians. J. Dev. Behav. Pediatrics. 2010. 31. 346.
44. Werring D.J., Toosy A.T., Clark C.A., Parker G., Barker G., Miller D.H., Thompson A.J. Diffusion tensor imaging can detect and quantify corticospinal tract degeneration after stroke. J. Neurol. Neurosurg. Psychiatry. 2000. 69. 269-272.
45. Thomalla G., Glauche V., Weiller C., Rother J. Time course of wallerian degeneration after ischaemic stroke revealed by diffusion tensor imaging. J. Neurol. Neurosurg. Psychiatry. 2005. 76. 266-268.
46. Smith S.M., Jenkinson M., Johansen-Berg H., Rueckert D., Nichols T.E., Mackay C., Watkins K.E., Ciccarelli O., Cader M.Z., Matthews P.M., et al. Tract-based spatial statistics: Voxelwise analysis of multi-subject diffusion data. NeuroImage. 2006. 31. 1487-1505.
47. Mead G.E., Legg L., Tilney R., Hsieh C.F., Wu S., Lundstrom E., Rudberg A.S., Kutlubaev M., Dennis M.S., Soleimani B., et al. Fluoxetine for stroke recovery: Meta-analysis of randomized controlled trials. Int. J. Stroke. 2020. 15. 365-376.
48. Karamyan V.T., Alamri F.F., Al Shoyaib A., Syeara N., Paul A., Jayaraman S., Karamyan S.T., Arumugam T.V. Delayed atomoxetine or fluoxetine treatment coupled with limited voluntary running promotes motor recovery in mice after ischemic stroke. Neural. Regen. Res. 2021. 16. 1244-1251.
49. Kim J.S., Kim B.J. Why Are CASTA and CARS Results Different? Analysis of CASTA Data from Korea and Hong Kong. J. Stroke. 2016. 18. 233-235.
Оригінал статті надрукований в
J. Pers. Med. 2021. 11. 545.
https:// doi.org/10.3390/jpm11060545
/13.jpg)

/14.jpg)
/15.jpg)
/15_2.jpg)
/16.jpg)
/16_2.jpg)
/18.jpg)
/17.jpg)